头孢曲松钠杂质Ceftriaxone impurities
罗氏芬Rocephin(头孢曲松钠)说明书

核准日期核准日期::2006年11月26日修改日期修改日期::2007年3月13日2007年11月9日 2009年11月16日注射用头孢曲松钠说明书注射用头孢曲松钠说明书请仔细阅读说明书并在医师指导下使用请仔细阅读说明书并在医师指导下使用 警示:本品不能加入哈特曼氏以及林格氏等含有钙的溶液中使用。
本品与含钙剂或含钙产品合并用药有可能导致致死性结局的不良事件。
【药品名称】通用名称:注射用头孢曲松钠商品名称:罗氏芬® Rocephin ®英文名称:Ceftriaxone Sodium for Injection汉语拼音:Zhusheyong Toubaoqusongna【成份】化学名称:(6R,7R )-7-[[(2-氨基-4-噻唑基)(甲氧亚氨基)乙酰]氨基]-8-氧代-3-[[(1,2,5,6-四氢-2-甲基-5,6-二氧代-1,2,4-三嗪-3-基)硫代]甲基]-5-硫代-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸二钠盐三倍半水合物。
化学结构式:分子式:C 18H 16N 8Na 2O 7S 3·31/2H 2O分子量:661.59辅料名称:本品不含其他辅料【性状】本品为白色或类白色结晶性粉末;无臭。
【适应症】对罗氏芬® 敏感的致病菌引起的感染,如:脓毒血症,脑膜炎,播散性莱姆病(早、晚期),腹部感染(腹膜炎、胆道及胃肠道感染),骨、关节、软组织、皮肤及伤口感染,免疫机制低下病人之感染,肾脏及泌尿道感染,呼吸道感染,尤其是肺炎、耳鼻喉感染,生殖系统感染,包括淋病,术前预防感染。
【规格】按CH18N8O7S3计算181.0 g0.5 g0.25 g【用法用量】标准剂量成人及12岁以上儿童:罗氏芬® 的通常剂量是1~2克,每日一次(每24小时)。
危重病例或由中度敏感菌引起之感染,剂量可增至4克,每日一次。
新生儿、婴儿及12岁以下儿童建议按以下剂量每日使用一次。
头孢类药物一、二、三、四代特点和种类

一、二、三、四代头孢菌素(头孢菌素类(Cephalosporins)是以冠头孢菌培养得到的天然头孢菌素C作为原料,经半合成改造其侧链而得到的一类抗生素。
头孢菌素类抗生素是从头孢菌素的母核7-氨基头孢烷酸(7-ACA)接上不同侧链而制成的半合成抗生素。
本类抗生素具有抗菌谱广、杀菌力强、对胃酸及对β-内酰胺酶稳定,过敏反应少,(与青霉素仅有部分交叉过敏现象)等优点。
笫一代头孢菌素第一代头孢菌素是60年代初开始上市的。
从抗菌性能来说,对第一代头孢菌素敏感的菌主要有β-溶血性链球菌和其他链球菌、包括肺炎链球菌(但肠球菌耐药),葡萄球菌(包括产酶菌株)、流感嗜血杆菌、大肠杆菌、克雷伯杆菌、奇异变形杆菌、沙门菌、志贺菌等。
不同品种的头孢菌素可以有各自的抗菌特点,如头孢噻吩对革兰阳性菌的抗菌作用较优,而头孢唑林则对某些革兰阴性菌有一定作用。
但是,第一代头孢菌素对革兰阴性菌的β-内酰胺酶的抵抗力较弱,因此,革兰阴性菌对本代抗生素较易耐药。
第一代头孢菌素对吲哚阳性变形杆菌、枸橼酸杆菌、产气杆菌、假单胞菌、沙雷杆菌、拟杆菌、粪链球菌(头孢硫脒除外)等微生物无效。
本代抗生素中常用品种有头孢唑林、头孢氨苄、头孢拉定、头孢羟氨苄、头孢克罗等。
其中除头孢唑林只能供注射外,其他的均可用于口服,也称口服头孢。
头孢噻吩、头孢噻啶、头孢来星、头孢乙腈、头孢匹林等均已少用或不用。
头孢噻吩钠(先锋霉素Ⅰ) Cefalothin Sodium (Cephalothin, Cefalotin)别名:先锋霉素Ⅰ、头孢金素、头孢菌素Ⅰ、噻孢霉素、西保力新、头孢霉素钠。
头孢噻啶 Cefaloridine(Ceporin,Keflodin)别名:先锋霉素Ⅱ、头孢利素、头孢娄利定、头孢菌素Ⅱ、西孢娄里丁、先锋芦里丁、吡噻孢霉素。
头孢来星(Cephaloglycin)别名:先锋霉素Ⅲ、头孢甘酸。
头孢氨苄 Cefalexin(Ceporex,Keflex)别名:头孢菌素Ⅳ、先锋霉素Ⅳ、头孢力新、苯甘孢霉素、西保力、头孢立新。
注射用头孢曲松钠

商品名:罗氏芬®/Rocephin®通用名:注射用头孢曲松钠曾用名:头孢三嗪英文名:Ceftriaxone Sodium for Injection汉语拼音:Zhusheyong Toubaoqusongna【理化特性】处方药:凭医师处方销售、购买和使用!本品主要成分为:头孢曲松钠其化学名为:[6R-[6α,7β(Z)]]-3-[[1,2,5,6-四氢-2-甲基-5,6-二氧代-1,2,4三嗪-3-基]硫代甲基]-7-[[(2-氨基-4-噻唑基)(甲氧亚氨基)乙酰基]氨基]-8-氧代-5-硫杂-1-氧杂双环[4.2.0]辛-2-烯-2-羧酸,二钠盐三倍半水合物.结构式:分子式:C18H16N8Na2O7S3·31/2H2O分子量:661.59【性状】本品为白色或类白色结晶性粉末。
【药理毒性】头孢曲松通过抑制细胞壁的合成而产生杀菌活性。
头孢曲松在体外对许多革兰阴性菌及革兰阳性菌发挥杀菌作用,并对革兰阳性菌及革兰阴性菌的大多数β-内酰胺酶(青霉素酶及头孢菌素酶)具有很高的稳定性,头孢曲松在体外试验及临床感染(见适应症)中通常对以下致病菌发挥抗菌作用。
内酰胺酶所致。
**这些种类中的一些分离菌的耐药,是由于产生广谱的,质粒传递的β-内酰胺酶所致。
注:以上细菌的许多菌株对其他多种抗生素耐药,如:氨基-和酰脲-青霉素,老一代的头孢菌素和氨基糖甙抗菌素等,但对头孢曲松敏感。
梅毒螺旋体在体外和动物试验中对头孢曲松敏感,临床调查显示,一期和二期梅注:产β-内酰胺酶的类杆菌属的某些菌种(值得注意的是:脆弱类杆菌)对头孢曲松耐药,难辨梭状芽胞杆菌对头孢曲松耐药。
细菌对头孢曲松的敏感性可根据国家临床实验室标准委员会(NCCLS)所推荐试验的标准化技术,通过纸片扩散试验或者通过琼脂或肉汤稀释试验进行测定。
国家临床实验室标准委员会对头孢曲松作出以下鉴定。
性,故应以头孢曲松纸片进行药敏试验。
如国家临床实验室标准委员会所推荐的标准不是常规使用,DIN、ICS和其他组织发布的十分标准化的药物敏感判定标准也可取而代之。
头孢曲松钠的亚晶型分类及对产品质量的影响

·
1036 ·
药学学报 Acta Pharmaceutica Sinica 2014, 49 (7): 1034−1038
多次进行粉末 X 射线衍射测定, 上述区别明显且重 现性良好。 提示不同亚型样品的衍射特征峰的区别反 映出了晶体在精细结构上的细微差异。 实验中发现, 5 批罗氏芬全部为Ⅱ亚型样品。 2 不同亚型头孢曲松钠的晶体形态 采用扫描电镜技术, 得到了 3 个亚型样品的扫描
薛
晶等: 头孢曲松钠的亚晶型分类及对产品质量的影响
·
1035 ·
仿制药品与原研产品的质量差异是否与其结晶过程 有关尚无较系统的研究。 本文从分析头孢曲松钠晶体 精细结构的细微差异入手 , 引入“亚晶型”的理念 , 探讨了国产头孢曲松钠与原研产品在晶型方面的差 异 , 分析了这种差异对头孢曲松钠多种理化特性的 影响, 为提高头孢曲松钠仿制品的质量明确了方向。
Subtype classification of ceftinfluence on the quality of product
XUE Jing1, JIA Yan-hua2, LI Jin1, YIN Li-hui1, HU Chang-qin1*
(1. National Institutes for Food and Drug Control, Beijing 100050, China; 2. Department of Pharmacy, The First Affiliated Hospital of PLA General Hospital, Beijing 100048, China)
头孢曲松钠 (ceftriaxone sodium) 为国家基本药 物, 是瑞士 Roche 公司在 20 世纪 80 年代推出的第三 代头孢菌素, 其以抗菌谱广、杀菌力强、半衰期长、 耐酸、耐酶、毒副作用相对较小等优点而广泛应用于 临床[1]。 国产头孢曲松钠在“七五”期间研发成功, 目 前国内有头孢曲松钠原料生产企业近四十家 , 注射
头孢曲松钠MSDS安全技术说明书

剧烈刺激:对眼睛,皮肤,胃肠道和呼吸道有剧烈刺激。
慢性危害:导致超敏,重复感染,抗生素相关伪膜性结肠炎,结石。
接触使治疗效果恶化:易过敏,酒精中毒或新近饮酒,敏感症,有出血性疾病史,肝肾功能损伤,胆囊疾病,胃肠道疾病,尤其溃疡性结肠炎,局限性肠炎,抗生素相关性肠炎。
安全数据表(MSDS)
标识
中文名:头孢曲松钠
英文名:CEFTRIAXONE SODIUM
组成:纯物质
化学名:5-Thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid, 7-[[(2-amino-4-thiazolyl)(methoxyimino)acetyl]-amino]-8-oxo-3-[[(1,2,5,6-tetrahydro-2-methyl-5,6-dioxo-1,2,4-triazin-3-yl)thio]
手部防护:戴化学防护手套
眼睛防护:安全护目镜
皮肤防护:穿防护服
暴露限:短时间接触容许浓度(STEL,Short Term Exposure Limit),0.06 mg/m3。
泄漏处置
关闭所有电器和其它易燃装置。疏散人员。穿戴全套呼吸器、橡胶靴及厚实的橡胶手套。人工收集泄漏残留,将其装入袋中待处理。避免扬尘。
避免接触的条件:
潮湿,光,热,点燃
危险的燃烧/分解产物:
加热分解形成COx, NOx, SOx, Na/Na2Ox有毒气体和其它不完全降解产物。未发生危险的聚合反应。
毒 理 学 资 料
LD50>10 g/kg(大鼠经口服)
半衰期:5.8-8.7小时。蛋白结合率:95%
未被美国国家毒理学规划处(NTP),国际癌症研究协会(LARC),美国职业安全与卫生监察局(OSHA)列为致癌物质。
头孢曲松钠Ceftriaxone Sodium --USP38

Ceftriaxone Sodium(sef'' trye ax' one soe' dee um).C18H16N8Na2O7S3·3½H2O 661.605-Thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylicacid,7-[[(2-amino-4-thiazolyl)(methoxyimino)acetyl]amino]-8-oxo-3-[[(1,2,5,6-tetrahydro-2-methyl-5-,6-dioxo-1,2,4-triazin-3-yl)thio]methyl]-, disodium salt, [6R-[6,7(Z)]]-, hydrate, (2:7);(6R,7R)-7-[2-(2-Amino-4-thiazolyl)glyoxylamido]-8-oxo-3-[[(1,2,5,6-tetrahydro-2-methyl-5,6-dioxo-as-t riazin-3-yl)thio]methyl]-5-thia-1-azabicyclo[4.2.0]-oct-2-ene-2-carboxylic acid, 72-(Z)-(O-methyloxime), disodium salt, hemiseptahydrate [104376-79-6].Anhydrous 598.56DEFINITIONCeftriaxone Sodium contains the equivalent of NLT 795 µg/mg of ceftriaxone (C18H18N8O7S3), calculated on the anhydrous basis.IDENTIFICATION• A. Infrared Absorption 197K• B. The retention time of the major peak of the Sample solution corresponds to that of the Standard solution, as obtained in the Assay.• C. Identification Tests—General, Sodium 191ASSAY•ProcedureSolution A: 9 g/L of monobasic potassium phosphate in waterSolution B: 24 g/L of disodium hydrogen phosphate, dodecahydrate in waterSolution C: 20 g/L of citric acid in water. Adjust with 10 N sodium hydroxide to a pH of 5.0 prior to final dilution.Buffer: Combine 389 mL of Solution A and 611 mL of Solution B. Adjust with 10 N sodium hydroxide or phosphoric acid to a pH of 7.0.Mobile phase: Dissolve 2.0 g of tetradecylammonium bromide and 2.0 g of tetraheptylammonium bromide in a mixture of 440 mL of water, 55 mL of Buffer, 5.0 mL of Solution C, and 500 mL of acetonitrile.System suitability solution: 50 µg/mL of USP Ceftriaxone Sodium RS and 50 µg/mL of USP Ceftriaxone Sodium E-Isomer RS in Mobile phaseStandard solution: 0.3 mg/mL of USP Ceftriaxone Sodium RS in Mobile phaseSample solution: 0.3 mg/mL of Ceftriaxone Sodium in Mobile phaseChromatographic system(See Chromatography 621, System Suitability.)Mode: LCDetector: UV 254 nmColumn: 4.6-mm ×25-cm; 5-µm packing L1Flow rate: 1.5 mL/minInjection volume: 20 µLSystem suitabilitySamples: System suitability solution and Standard solution[Note—The relative retention times for ceftriaxone and ceftriaxone E-isomer are 1.0 and 1.4, respectively. ]Suitability requirementsResolution: NLT 3.0 between the ceftriaxone and ceftriaxone E-isomer peaks, System suitability solutionTailing factor: NMT 2, Standard solutionRelative standard deviation: NMT 0.7%, Standard solutionAnalysisSamples: Standard solution and Sample solutionCalculate the quantity, in µg/mg of ceftriaxone (C18H18N8O7S3) in the portion of Ceftriaxone Sodium taken:Result = (rU/rS) ×(CS/CU) ×PrU = = peak response of ceftriaxone from the Sample solutionrS = = peak response of ceftriaxone from the Standard solutionCS = = concentration of USP Ceftriaxone Sodium RS in the Standard solution (mg/mL)CU = = concentration of Ceftriaxone Sodium in the Sample solution (mg/mL)P = = potency of ceftriaxone in USP Ceftriaxone Sodium RS (µg/mg)Acceptance crite ria: NLT 795 µg/mg on the anhydrous basisIMPURITIES•Organic ImpuritiesSolution A, Solution B, Solution C, Buffer, Mobile phase, System suitability solution, Sample solution, and Chromatographic system: Proceed as directed in the Assay.Standard s olution: 3 µg/mL of USP Ceftriaxone Sodium RS in Mobile phaseSystem suitabilitySamples: Standard solution and System suitability solution[Note—The relative retention times for ceftriaxone and ceftriaxone E-isomer are listed in Table 1. ] Suitability requirementsResolution: NLT 3.0 between the ceftriaxone E-isomer and ceftriaxone peaks, System suitability solutionSignal-to-noise ratio: NLT 10, Standard solutionAnalysisSamples: Standard solution and Sample solutionCalculate the percentage of each individual impurity in the portion of Ceftriaxone Sodium taken: Result = (rU/rS) ×(CS/CU) P ×F ×100rU = = peak response of each individual impurity from the Sample solutionrS = = peak response of ceftriaxone from the Standard solutionCS = = concentration of USP Ceftriaxone Sodium RS in the Standard solution (mg/mL)CU = = concentration of Ceftriaxone Sodium in the Sample solution (mg/mL)P = = potency of ceftriaxone in USP Ceftriaxone Sodium RS (µg/mg)F = = conversion factor, 0.001 mg/µgAcceptance criteria: See Table 1. Disregard any peak below 0.1%.SPECIFIC TESTS•Crystallinity 695: Meets the requirements•pH 《791 》Sample solution: 100 mg/mL Acceptance criteria: 6.0–8.0•Water Determination, Method I 921: 8.0%–11.0%•Sterility Tests 71: Where the label states that it is sterile, it meets the requirements when tested asdirected in Test for Sterility of the Product to Be Examined, Membrane Filtration.•Bacterial Endotoxins Test 85: Where the label states that it is sterile or must be subjected to further processing during the preparation of injectable dosage forms, it contains NMT 0.20 USP Endotoxin Unit/mg of ceftriaxone.ADDITIONAL REQUIREMENTS•Packaging and Storage: Preserve in tight containers.•Labeling: Where it is intended for use in preparing injectable dosage forms, the label states that it is sterile or must be subjected to further processing during the preparation of injectable dosage forms. •USP Reference Standards 11USP Ceftriaxone Sodium RSUSP Ceftriaxone Sodium E-Isomer RS(6R,7R)-7-[(E)-2-(2-Aminothiazol-4-yl)-2-(methoxyimino)acetamido]-3-{[(6-hydroxy-2-methyl-5-oxo-2, 5-dihydro-1,2,4-triazin-3-yl)thio]methyl}-8-oxo-5-thia-1-azabicyclo[4.2.0]oct-2-ene-2-carboxylic acid, disodium salt.C18H16N8Na2O7S3 598.53USP Endotoxin RSAuxiliary Information—Please check for your question in the FAQs before contacting USP.。
罗氏芬Rocephin(头孢曲松钠)说明书

核准日期核准日期::2006年11月26日修改日期修改日期::2007年3月13日2007年11月9日 2009年11月16日注射用头孢曲松钠说明书注射用头孢曲松钠说明书请仔细阅读说明书并在医师指导下使用请仔细阅读说明书并在医师指导下使用 警示:本品不能加入哈特曼氏以及林格氏等含有钙的溶液中使用。
本品与含钙剂或含钙产品合并用药有可能导致致死性结局的不良事件。
【药品名称】通用名称:注射用头孢曲松钠商品名称:罗氏芬® Rocephin ®英文名称:Ceftriaxone Sodium for Injection汉语拼音:Zhusheyong Toubaoqusongna【成份】化学名称:(6R,7R )-7-[[(2-氨基-4-噻唑基)(甲氧亚氨基)乙酰]氨基]-8-氧代-3-[[(1,2,5,6-四氢-2-甲基-5,6-二氧代-1,2,4-三嗪-3-基)硫代]甲基]-5-硫代-1-氮杂双环[4.2.0]辛-2-烯-2-羧酸二钠盐三倍半水合物。
化学结构式:分子式:C 18H 16N 8Na 2O 7S 3·31/2H 2O分子量:661.59辅料名称:本品不含其他辅料【性状】本品为白色或类白色结晶性粉末;无臭。
【适应症】对罗氏芬® 敏感的致病菌引起的感染,如:脓毒血症,脑膜炎,播散性莱姆病(早、晚期),腹部感染(腹膜炎、胆道及胃肠道感染),骨、关节、软组织、皮肤及伤口感染,免疫机制低下病人之感染,肾脏及泌尿道感染,呼吸道感染,尤其是肺炎、耳鼻喉感染,生殖系统感染,包括淋病,术前预防感染。
【规格】按CH18N8O7S3计算181.0 g0.5 g0.25 g【用法用量】标准剂量成人及12岁以上儿童:罗氏芬® 的通常剂量是1~2克,每日一次(每24小时)。
危重病例或由中度敏感菌引起之感染,剂量可增至4克,每日一次。
新生儿、婴儿及12岁以下儿童建议按以下剂量每日使用一次。
头孢曲松EP杂质汇总
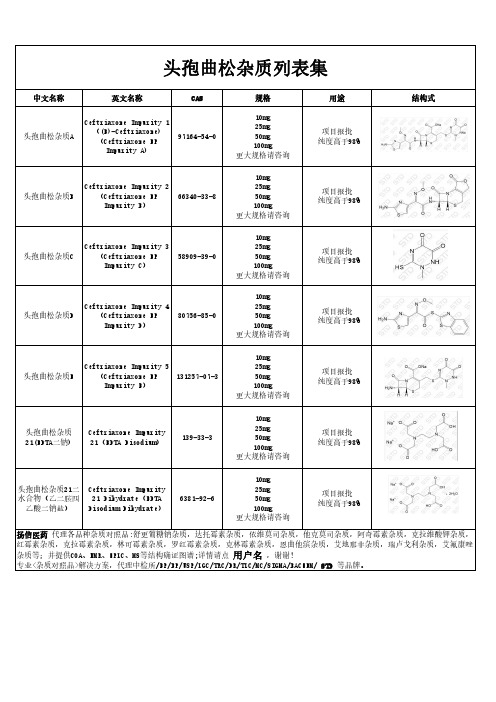
中文名称
英文名称
CAS
头孢曲松杂质A
ห้องสมุดไป่ตู้
Ceftriaxone Impurity 1 ((E)-Ceftriaxone) (Ceftriaxone EP Impurity A)
97164-54-0
规格
10mg 25mg 50mg 100mg 更大规格请咨询
用途
项目报批 纯度高于98%
结构式
专业<杂质对照品>解决方案,代理中检所/EP/BP/USP/LGC/TRC/DR/TLC/MC/SIGMA/BACHEM/ STD 等品牌。
139-33-3
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
头孢曲松杂质21二 Ceftriaxone Impurity 水合物(乙二胺四 21 Dihydrate(EDTA
乙酸二钠盐) Disodium Dihydrate)
6381-92-6
10mg 25mg 50mg 100mg 更大规格请咨询
Ceftriaxone Impurity 5
头孢曲松杂质E
(Ceftriaxone EP 131257-07-3
Impurity E)
10mg 25mg 50mg 100mg 更大规格请咨询
项目报批 纯度高于98%
头孢曲松杂质 21(EDTA二钠)
Ceftriaxone Impurity 21(EDTA Disodium)
Ceftriaxone Impurity 2
头孢曲松杂质B
(Ceftriaxone EP
66340-33-8
Impurity B)
10mg 25mg 50mg 100mg 更大规格请咨询
