(完整版)晶体的配位数,密度,距离空间利用率计算
金属及各类晶体配位数计算图总结
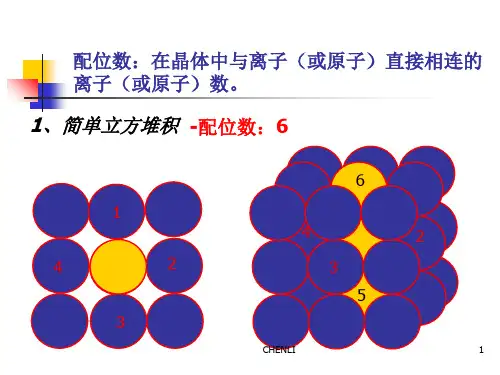
密堆积特点:结合能低,晶体结构稳定;配位数最大为12。
CHENLI
19
(1)六角密积 (Be,Mg,Cd,Zn)
AB
第一层:每个球与6个球相切,有6个空隙, 如编号1,2,3,4,5,6。
第二层:占据1,3,5空位中心。
第三层:在第一层球的正上方形成ABABAB······
排列方式。
CHENLI
20
配位数的确定
高考备考
CHENLI
16
Cl-按面心立方堆积的配位数是12。怎么都 是配位数一会儿是6,一会儿又是12,这怎 么理解?
氯离子按面心立方堆积是没错,但那不是真
正的配位数,因为氯离子是同号离子,是相互斥
的;
同理,钠离子也是按面心立方堆积的,这两
种离子形成的面心立方堆积都产生八面体空穴,
彼此进入对方八面体空穴中就对了,此时异号离
层的垂直方向为三次象转轴。
既是立方体的空间对角线。
原胞当中包含一个粒子,是
布拉菲格子。
CHENLI
7
CHENLI
8
3.典型结构的配位数
(1)六角密积和立方密积的配位数都是十二。即晶体中最
大配位数为十二。
(2)当晶体不是由全同的粒子组成时,相应的配位数要发
生变化—减小。由于晶体的对称性和周期性的特点,以
当0.73r 0.41时,两种球的化排钠列型为 R
o
R Cl - 1 .81 A
rNa 0.52
o
rNa 0 .95 A
RCl CHENLI
13
配位数和半径之比的关系
配位数
r/R
12
1
8
1~0.73
6
0.73~0.41
有关晶体的计算

Ca2+:4 F-: 8
碱土金属卤化 物、碱金属氧 化物。
3、边长(晶胞参数)和半径关系
(1)简单立方晶胞参数:边长a
球半径r 与晶胞边长 a 的关系:
a
a
a
a
a=2r
-
3、边长(晶胞参数)和半径关系
(2)体心立方晶胞参数:边长a 球半径r 与晶胞边长 a 的关系:
a
a
a
a
b 3a b 4r
看底面
a 2r
a
2
-
2rsin60
3、边长(晶胞参数)和半径关系 (6)金刚石型
在面心立方基础上,再插入4个球,分别占据8个小立 方体中4个互不相
邻的体心,若1号小体心有球, 则3、6、8号小体心 也有球
8
7
5
6
每个新插入的球,与它所在 小立方 体的顶点4个球相切
4
3
1
2
-
3、边长(晶胞参数)和半径关系 (7)氯化钠型晶胞参数a与离子半径的关系:
2 A3六方晶胞 Zn Cd 内部
6
a=2r
8
12
12
-
各类型离子晶体晶胞的比较
晶体 晶胞 类型 类型
晶胞结构 示意图
距离最近 每个晶 配位数 且相等的 胞含有
相反离子 离子数
实例
NaCl 型
AB CsCl 型
Na+:6 Na+:6 Cl-: 6 Cl-: 6
Cs+:8 Cs+:8 Cl-: 8 Cl-: 8
体积,NA,知道3个可求另一个,因此可能围绕密度出现4种题型。 在晶胞体积中,还可以考察晶胞边长与微粒半径的关系。
-
金属及各类晶体配位数计算图总结
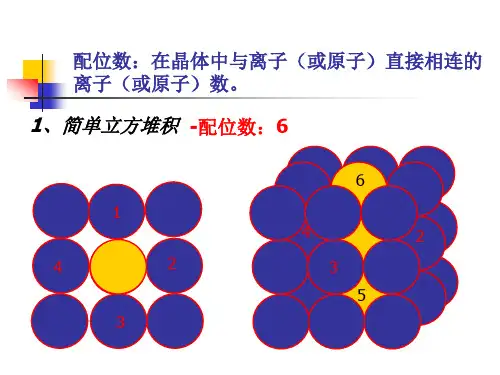
(1)堆积形式
如图所示,为ABAB…组合
(2)堆积特点
层的垂直方向为6度象转轴。
六角晶系中的 c 轴。它是
一种复式格子。原胞当中
含有两个粒子。
2.立方密堆积(立方密积)
(1)堆积形式
如图所示:ABCABC…组合
(2)堆积特点
层的垂直方向为三次象转轴。
既是立方体的空间对角线。 原胞当中包含一个粒子,是 布拉菲格子。
3(层状结构)、2(链状结构)。
4.氯化铯型结构的配位数
如图所示,大球 ( 半径为 R) 中心为立方体顶角,小 球(半径为r)位于立方体的中心。 如果大球相切,则
立方体的边长为:
空间对角线的长度为: ak
a 2R
Cs
3a 2 3 R
RCl - 1.81 A rC s 1.69 A
3.典型结构的配位数 (1)六角密积和立方密积的配位数都是十二。即晶体中最
大配位数为十二。
(2)当晶体不是由全同的粒子组成时,相应的配位数要发
生变化 —减小。由于晶体的对称性和周期性的特点,以
及粒子在结合成晶体时,是朝着结合能最小、最稳固的
方向发展。因此,相应的配位数只能取:
8(CsCl 型结构 ) 、 6(NaCl 型结构 ) 、 4( 金刚石型结构 ) 、
我们在提到配位数时应当分 析其所处环境。
1、在晶体学中配位数与晶胞类型有关; 2、离子晶体中指一个离子周围最近的异 电性离子的数目; 3、配位化学中,化合物中性原子周围的 配位原子的数目。
一、晶胞密堆积、配位数
1.配位数 一个粒子周围最近邻的粒子数称为配位数。 它可以描述晶体中粒子排列的紧密程度,粒子排列越紧密,
晶体空间利用率计算

V球 空间利用率= 100% V晶胞 4 3 r 3 3 100% =52% 8r
1个晶胞中平均含有1个原子 4 3 V =(2r)3=8r3 V球= r 晶胞 3
2、体心立方堆积 a b a
b a a 2 2 2 2 (4r ) a b 3a
2 2 2
4 a r 3
【堆积方式及性质小结】
堆积方式 晶胞类型 空间利 配位数 用率 简单立方 简单立方 体心立方 体心立方 六方堆积 六方 52% 68% 74% 74% 6 8 12 实例
Po Na、K、Fe
Cu、Ag、Au Mg、Zn、Ti
面心立方 面心立方
12
空间利用率= 4 3 2 r 3 100% 3 a
4 3 2 r 3 100% 4 3 ( r) 3
3 100% 68% 8
3、六方最密堆积 hs
s 2r 3r 2 3r
2
s
V球 100% 空间利用率= V晶胞
4 3 V球 2 r 2r 3 2 6 2 V晶胞 s 2h 2 3r 2 r 8 2r 3 3
【例题1】现有甲、乙、丙、丁四种晶胞,可推 1:1 知甲晶体中与的粒子个数比为——————;乙 DC2 或C2D 晶体 的化学式为—————— ————;丙晶体的 化学式为EF或FE ;丁晶体的化学式为XY Z —————— ———。
2
B
A
Z D C F E X
甲乙丙Fra bibliotek丁Y
甲
乙
丙
【例题2】上图甲、乙、丙三种结构单元中,金属 1:2:3 原子个数比为—————————。 乙晶胞中所含金属原子数为8×1/8+6×1/2=4 晶胞中所含金属原子数为12×1/6+2×1/2+3=6
晶胞的有关计算

M Z NA V
注意:单位的换算
V-晶胞体积 M-相对分子质量 Z-晶胞中粒子数 NA-阿伏伽德罗常数
例3、金晶体的晶胞是面心立方晶胞,金原子的 直径为d,用NA表示阿伏加德罗常数,M表示金 的摩尔质量。
(1)一个晶胞的体积是多少?
2d
(2)金晶体的密度是多少?
各面对角线上的三个球两两相切
a
(1)设晶胞边长为a,则有a2+a2=(2d)2,即a= 2d
___ pm(列出计算式即可)。(已知D是S,E是Zn) 2 3 4 97 1010
2 NA
(5)空间利用率的计算
空间利用率:指构成晶体的微粒在整个晶体空间中所
占有的体积百分比。
空间利用率
=
球体积 晶胞体积 100%
例5:计算体心立方晶胞中金属原子的空间利用率。
2 4 r3 2 4 ( 3 a)3
祝同学们: 祝学同习学进们步:!金榜题金名榜!题名!
再 见 再见
÷(565.76×10-10cm)3=
g•cm-3。
(6)晶胞有两个基本要素:①原子坐标参数,表示
晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,
其中原子坐标参数A为(0,0,0);B为( ,0, );
C为 ( , ,0 )。则D原子的坐标参数为
(4)原子坐标参数的确定
。 ( 1 ,1,1) 44 4
练习1:
原子D与E所形成化合物晶体的 晶胞如图所示。
① 在该晶胞中,E的配位数为__4____。
② 原子坐标参数可表示晶胞内部各原子的相对位置。 右图晶胞中,原子坐标参数a为(0,0,0);b为( ,0, )
C为( , ,0 )。则d原子的坐标参数为(__0__,___,__)。
有关晶体的计算

Na +:4 Cl -: 4 Cs +:1 Cl -:1
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn 2+ :4 Zn 2+ :4 Zn 2+ :4 ZnS、AgI、 S2- : 4 S2- : 4 S2- :4 BeO
AB 2 CaF2 型
Ca 2+ :8 Ca 2+ :8 Ca 2+ :4 F-: 4 F-: 4 F-: 8
相切
A
14
3、边长(晶胞参数)和半径关系 (8)氟化钙型晶胞参数a与离子半径的关
系: 实际上与金刚石型相同
3a ? 4(r? ? r? )
A
15
3、边长(晶胞参数)和半径关系
(9)CsCl的晶体结构及晶胞构示意图
---Cs+ ---Cl-
Cs+的配位数为:8
Cl-的配位数为:8
A
16
练习:2017全国三卷(5)MgO具有NaCl型结构(如图),其 中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO
A
2
1、晶体中的微粒数、化学式 B
A
3
1、晶体中的微粒数、化学式 B
A
4
2、配位数
原子的 完全占有
边长的半 空间占有
晶胞类型 代表
配位数
位置 的原子数
径的关系 率
Po 顶点
1
简单立方
6
a=2r
Li Na 顶 点 、
2
8
A2体心立方 K Fe 体心
Cu Ag 顶 点 、
4
12
A1面心立方 Au Pt 面心
常见晶体模型及晶胞计算
找铜型的晶胞
面心立方最密堆积的空间占有率 =74%
金属晶体的四种堆积模型对比
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
小结:高考常见题型 (一) 晶胞中微粒个数的计算, 求化学式
(二) 确定配位数
(三) 晶体的密度及微粒间距离 的计算
(1)长方体(立方体):
N=N顶角×1/8 + N棱上×1/4 + N面上×1/2 + N体内
(2)非长方体(非立方体):
视具体情况分析。
分子晶体 干冰晶体结构 ——晶胞为面心立方体
8个CO2分子位于立方体顶点 6个CO2分子位于立方体面心 在每个CO2周围等距离且相距最近 的CO2共有 12 个。 在每个小立方体中平均分摊到的CO2 分子数为:(8×1/8 + 6×1/2) = 4 个
(2)晶胞的边长为acm,求NaCl晶 体的密度。
ρ=
M / NA×晶胞所含粒子数 晶胞的体积
=
58.5 / NA×4 a3
(3)若NaCl晶体的密度为ρg/cm3,则 NaCl晶体中Na+与 Na+间的最短距离是多少?
CsCl的晶体结构——晶胞为体心立方体
(1)每个Cs+( Cl-)周围等距
且紧邻的Cl- (Cs+)有 8 个, Cs+( Cl-)的配位数为 8 。
常见晶体模型及晶胞计算
晶胞 描述晶体结构的基本单元
晶胞一般是平行六面体,整块晶体可看作是数量巨大的 晶胞“无隙并置”而成。
三种典型立方晶体结构
简单立方
体心立方
面心立方
晶胞中微粒的计算方法——均摊法
常见晶体模型及晶胞计算
练习
-的距离为 a cm,该晶体密度为
(1)设NaCl晶胞的边长为acm,则
示晶为胞中Na+和Cl-的最近距离(( 即小)立
方体的边长)为 a/2 cm,则晶胞中 同种离子的最近距离为 a/2 cm。
(2)晶胞的边长为acm,求NaCl晶 体的密度。
ρ=
M / NA×晶胞所含粒子数 晶胞的体积
镁型[六方密堆积] (Be Mg ⅢB ⅣB ⅦB )
12
6
3
54
12
6
3
54
12
6
3
54
A B A B A
找镁型的晶胞
1200
每个晶胞含原子数: 2 配位数: 12
空间占有率:
六方密堆积(镁型)的空间利用率计算:
四点间的夹角均为60°
先求S
在镁型堆积中取出六方晶胞,平行六面体的底是
平行四边形,各边长a=2r,则平行四边形的面积:
找铜型的晶胞
面心立方最密堆积的空间占有率 =74%
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆积 的典型代表
空间利用率
配位数
简单立方
Po(钋)
52%
6
体心立方 (钾型)
K、Na、Fe
68%
8
六方最密 (镁型)
Mg、Zn、Ti
74%
12
面心立方最密 (铜型)
Cu, Ag, Au
74%
12
晶胞
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
小结:高考常见题型 (一) 晶胞中微粒个数的计算, 求化学式
2020届高考化学复习《常见晶体模型及晶胞计算》
③六方最密堆积(镁型) Mg、Zn、Ti
六方最密堆积的配位数 =12 每个晶胞含 2 个原子
镁型[六方密堆积] (Be Mg ⅢB ⅣB ⅦB )
12
6
3
54
12
6
3
54
12
6
3
54ቤተ መጻሕፍቲ ባይዱ
A B A B A
找镁型的晶胞
1200
每个晶胞含原子数: 2 配位数: 12
空间占有率:
六方密堆积(镁型)的空间利用率计算:
思考:NaCl、CsCl同属AB型离子晶体, NaCl晶体中N a+的配位数与CsCl晶体中Cs+的配位数是否相等?
CaF2的晶体结构
(1)每个Ca2+周围等距且 紧邻的F-有 8 个, Ca2+配 位数为 8 。
(2)每个F-周围等距且紧 邻的Ca2+有 4 个, F-配位 数为 4 。
FCa2+
采纳这种堆积 的典型代表
空间利用率
配位数
简单立方
Po(钋)
52%
6
体心立方 (钾型)
K、Na、Fe
68%
8
六方最密 (镁型)
Mg、Zn、Ti
74%
12
面心立方最密 (铜型)
Cu, Ag, Au
74%
12
晶胞
原子晶体
金刚石
该晶胞实际分摊到的碳原子数为 (4 + 6 ×1/2 + 8 ×1/8) = 8个。
(1)设NaCl晶胞的边长为acm,则
示晶为胞中Na+和Cl-的最近距离(( 即小)立
方体的边长)为 a/2 cm,则晶胞中 同种离子的最近距离为 a/2 cm。
有关晶体的计算
4、晶胞密度的计算
4、晶胞密度的计算
石墨的密度:设碳原子半径为r,底面边长为a pm,高为h,层 间距为d,则h=2d。 均摊法算出石墨晶胞中有4个C原子(8顶点, 2面,4棱,1内)。
看底面
a 2r
a 2 2rsin60
5、微粒的空间坐标
Na+:4 Cl-: 4 Cs+:1 Cl-:1
KBr AgCl、 MgO、CaS、 BaSe
CsCl、CsBr、 CsI、TlCl
ZnS型
Zn2+:4 Zn2+:4 Zn2+:4 ZnS、AgI、 S2-: 4 S2-: 4 S2-:4 BeO
AB2 CaF2 型
Ca2+:8 Ca2+:8 Ca2+:4 F-: 4 F-: 4 F-: 8
8 4 πr 3 8 4 πr 3
3
3 100% 34%
a3
8
3 r
3
8、夹角求算
9、综合考察
例: 在一定温度下,NiO晶体可以自发地分散并形成 “单分子层”(如下图),可以认为氧离子作密致单 层排列,镍 离子填充其中,列式计算每平方米面积上 分散的该晶体的质量。 (已知NiO的摩尔质量约为74.7 g/mol,氧离子半径为140 pm)
碱土金属卤化 物、碱金属氧 化物。
3、边长(晶胞参数)和半径关系
(1)简单立方晶胞参数:边长a
球半径r 与晶胞边长 a 的关系:
a
a
a
a
a = 2r
3、边长(晶胞参数)和半径关系
(2)体心立方晶胞参数:边长a 球半径r 与晶胞边长 a 的关系:
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二. 晶体的配位数,密度,距离,空间利用率计算
1.课本模型图
一个CO2分子周围阳离子的配位数是阳离子的配位数是
有个分子紧邻阴离子的配位数是阴离子的配位数是
阳离子周围的阳离子阳离子周围最近的阳离子数
阴离子周围的阴离子阴离子周围最近的阴离子数CaF2
CaF2
F-的配位数是简单立方堆积体心立方堆积
Ca2+的配位数是配位数是配位数是
Ca2+周围的最近Ca2+数是
F-周围最近的F-数是
面心立方最密堆积六方最密堆积金刚石
配位数是配位数是配位数是
标出A,B,C各层的原子
2、在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石
的晶胞如右图所示,则其中Ti4+的配位数为化学式为
3.晶体中距每个X原子周围距离最近的Q原子有个.
每个Q原子周围距离最近的X原子有个,
Z原子周围距离最近的X有个,
每个X原子周围距离最近的Z原子有个,
每个Z原子周围距离最近的Q原子有个
4.若en若若若若若若 若
若若若若[Pt(en)2]Cl4若若若若若若若若若 若σ若若若若 若
配离子[PtEn)2]4+的配位数为,该配离子含有的微粒间的作用力类型有
5.立方氮化硼,其结构和硬度都与金刚石相似。
(1)晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3.(只要求列算式).(2)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标
明B与N的相对位置.
6.列式表示(NA表示阿伏伽德罗常数的值)
(1)钋原子半径为 r pm,相对原子质量为M,晶体钋的密度空间利用率(2)钠原子半径为 a pm,晶体钠的密度空间利用率
(3)银原子半径为 d cm,银晶体的密度空间利用率
(4)锌原子半径为 b nm 锌晶体的密度空间利用率
7.列式并计算
(1)铁原子半径为 r pm铁晶体有2种分别是钾型铜型,铁晶体的钾型铜型密度之比为(2)金刚石原子半径为 r pm列式并计算表示空间利用率
8.(1)已知CaF2晶体密度为dg/cm3则F﹣与F﹣的最短距离为nm,F﹣与Ca2+最短距离
为pm. (2)CaF2的Ca2+,F-半径分别为 r1,r2pm,把晶胞看成阳离子刚性球堆积,阴离子填充其中列式表示CaF2晶胞空间利用率 Ca2+间最近距离,F-间最近距离
9.已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm,列式表示其比表面积
m2/g。
答案
12, 6,6,12,12,8,8,6,6 8,4,12,6 6 8 12, 12, 4(1);
(2).
6000
D。
