金属晶体晶胞空间利用率计算
金属晶体晶胞中原子空间利用率的计算

金属晶体晶胞中原子空间利用率的计算作者:李春文来源:《中学化学》2019年第01期金属晶体中原子堆积方式复杂,每种堆积中原子空间利用率不尽相同,掌握金属晶体里晶胞中原子空间利用率对于解决所有晶胞的原子空间利用率问题具有触类旁通的作用。
研究金属晶体里晶胞中原子空间利用率,首先应该掌握求算它的基本步骤:先找到晶胞中所含原子数,然后根据晶胞中紧邻原子的位置关系找到原子半径与晶胞边长的关系,再根据空间利用率的求算方法即晶胞中原子所占的实际体积与晶胞中原子围成的几何图形的体积之比,求得空间利用率。
一、简单立方堆积简单立方堆积指的是相邻非密置层原子的原子核在同一直线,上的堆积。
这种堆积使晶胞结构为立方体型(如图1所示),处于顶点的两个原子紧邻。
晶胞中所含原子数为8x(1/8)=1,该原子所占的实际体积为(4/3)πr3。
由于处于顶点的两个原子紧邻,则原子半径与晶胞边长的关系为a=2r,那么晶胞中原子所围成的立方体的体积为(2r)3,所以简单立方堆积中原子空间利用率为二、体心立方堆积体心立方堆积指的是非密置层的另一种堆积方式,即将上层金属原子填人下层的金属原子形成的凹穴中,并使非密置层的原子稍稍分离。
每层均照此堆积,这种堆积方式称为体心立方堆积。
这种堆积方式使处于体对角线上的原子緊邻(如图2所示)。
晶胞中所含原子数为8x1/8+1=2,则晶胞中所含原子的实际体积为。
由于处于体对角线的原子紧邻,则原子半径与晶胞边长的关系为,所以体心立方堆积中原子空间利用率为三、六方最密堆积每层都是密置层堆积,堆积方式是将上层原子填入下层原子形成的凹穴中,这样的堆积会得到两种基本堆积方式,按ABABAB……的方式堆积称为六方最密堆积;按ABCABCA……的方式堆积称为面心立方最密堆积。
如图3所示,在六方最密堆积的晶胞结构中,体内原子位于平行六面体的一半的体心,即正三棱柱的体心,该原子与上下6个原子紧邻,则该原子与下面(或上面)3个原子构成正四面体结构。
晶胞结构
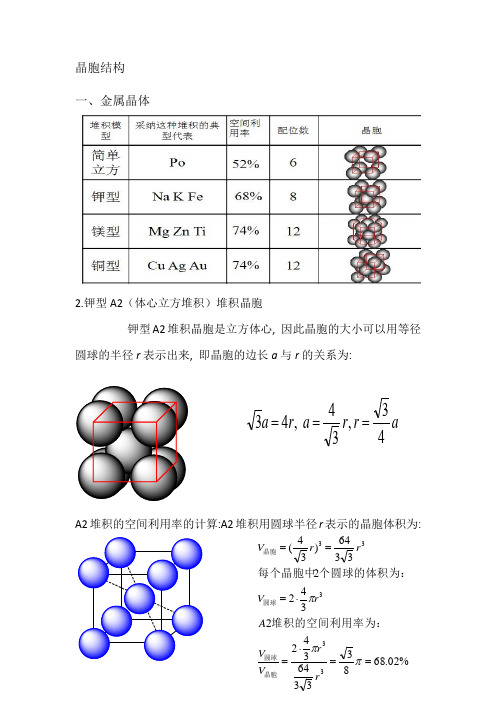
晶胞结构一、金属晶体2.钾型A2(体心立方堆积)堆积晶胞钾型A2堆积晶胞是立方体心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A2堆积的空间利用率的计算:A2堆积用圆球半径r 表示的晶胞体积为:ar r a r a 43,34 ,43===%02.68833364342234223364)34(33333==⋅=⋅===πππr r V V A rV rr V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中3.六方最密堆积(4)A1(面心立方最密堆积)A1是ABCABCABC······型式的堆积,从这种堆积中可以抽出一个立方面心点阵,因此这种堆积型式的最小单位是一个立方面心晶胞。
A1堆积晶胞是立方面心, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A1堆积空间利用率的计算:A1堆积用圆球半径r 表示的晶胞体积为:(5)A4堆积形成晶胞A4堆积晶胞是立方面心点阵结构, 因此晶胞的大小可以用等径圆球的半径r 表示出来, 即晶胞的边长a 与r 的关系为:A4堆积的空间利用率的计算:A4堆积用圆球半径r 表示的晶胞体积为: ra r a 22 ,42==%05.742312163441344 4216)22(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中ar r a r r a 83,38 ,8243===⨯=%01.34163335123484348 833512)38(33333==⋅=⋅===πππr r V V A r V r r V 晶胞圆球圆球晶胞堆积的空间利用率为:个圆球的体积为:每个晶胞中二、原子晶体1.金刚石立体网状结构,每个碳原子形成4个共价键,任意抽出2个共价键,每两个单键归两个六元环所有,而不是只归一个六元环所有(如图所示,红色的两个碳碳单键,可以构成蓝色和紫红色的两个六元环)。
晶体空间利用率计算

V球 空间利用率= 100% V晶胞 4 3 r 3 3 100% =52% 8r
1个晶胞中平均含有1个原子 4 3 V =(2r)3=8r3 V球= r 晶胞 3
2、体心立方堆积 a b a
b a a 2 2 2 2 (4r ) a b 3a
2 2 2
4 a r 3
【堆积方式及性质小结】
堆积方式 晶胞类型 空间利 配位数 用率 简单立方 简单立方 体心立方 体心立方 六方堆积 六方 52% 68% 74% 74% 6 8 12 实例
Po Na、K、Fe
Cu、Ag、Au Mg、Zn、Ti
面心立方 面心立方
12
空间利用率= 4 3 2 r 3 100% 3 a
4 3 2 r 3 100% 4 3 ( r) 3
3 100% 68% 8
3、六方最密堆积 hs
s 2r 3r 2 3r
2
s
V球 100% 空间利用率= V晶胞
4 3 V球 2 r 2r 3 2 6 2 V晶胞 s 2h 2 3r 2 r 8 2r 3 3
【例题1】现有甲、乙、丙、丁四种晶胞,可推 1:1 知甲晶体中与的粒子个数比为——————;乙 DC2 或C2D 晶体 的化学式为—————— ————;丙晶体的 化学式为EF或FE ;丁晶体的化学式为XY Z —————— ———。
2
B
A
Z D C F E X
甲乙丙Fra bibliotek丁Y
甲
乙
丙
【例题2】上图甲、乙、丙三种结构单元中,金属 1:2:3 原子个数比为—————————。 乙晶胞中所含金属原子数为8×1/8+6×1/2=4 晶胞中所含金属原子数为12×1/6+2×1/2+3=6
金属晶体四类晶胞空间利用率的计算知识讲解

金属晶体四类晶胞空间利用率的计算金属晶体四类晶胞空间利用率的计算高二化学·唐金圣在新课标人教版化学选修3《金属晶体》一节中,给出了金属晶体四种堆积方式的晶胞空间利用率。
空间利用率就是晶胞上占有的金属原子的体积与晶胞体积之比。
下面就金属晶体的四种堆积方式计算晶胞的空间利用率。
一、简单立方堆积:在简单立方堆积的晶胞中,晶胞边长a等于金属原子半径r的2倍,晶胞的体积V晶胞=(2r)3。
晶胞上占有1个金属原子,金属原子的体积V原子=4πr3/3 ,所以空间利用率V原子/V晶胞 = 4πr3/ (3×(2r)3)=52.33﹪。
二、体心立方堆积:在体心立方堆积的晶胞中,体对角线上的三个原子相切,体对角线长度等于原子半径的4倍。
假定晶胞边长为a ,则a2 + 2a2 = (4r)2, a=4 r/√3 ,晶胞体积V晶胞 =64r3/ 3√3 。
体心堆积的晶胞上占有的原子个数为2,原子占有的体积为V原子=2×(4πr3/3)。
晶胞的空间利用率等于V原子/V晶胞 =(2×4πr3×3√3)/(3×64r3)= 67.98﹪。
三、面心立方最密堆积在面心立方最密堆积的晶胞中,面对角线长度是原子半径的4倍。
假定晶胞边长为a,则a2 + a2 = (4r)2 ,a = 2√2r ,晶胞体积V晶胞=16√2r3。
面心立方堆积的晶胞上占有的原子数为4,原子占有的体积为V原子 = 4×(4πr3/3)。
晶胞的空间利用率等于V原子/V晶胞 =(4×4πr3)/(3×16√2r3)= 74.02﹪.四、六方最密堆积六方最密堆积的晶胞不再是立方结构。
晶胞上、下两个底面为紧密堆积的四个原子中心连成的菱形,边长a = 2r ,夹角分别为60°、120°,底面积s = 2r×2r×sin(60°) 。
晶体结构的分析与计算

(3)GaAs的熔点为1 238 ℃,密度为ρ g·cm-3,其晶胞结构如图所示。该 晶体的类型为__原__子__晶__体__,Ga与As以_共__价___键结合。Ga和As的摩尔质量 分别为MGa g·mol-1和MAs g·mol-1,原子半径分别为rGa pm和rAs pm,阿 伏加德罗常数值为NA,则GaAs晶胞中原子的体积占晶胞体积的百分率为 _4_π_×__13_0(_-M_30G_Na_+A_ρ_M(_r_A3G_sa)+__r_3A_s)_×__1_0_0_%___。
123456
3.(2020·四川武胜烈面中学高 二期中)有四种不同堆积方式 的金属晶体的晶胞如图所示, 下列有关说法正确的是 A.①为简单立方堆积,②为六方最密堆积,③为体心立方堆积,④为面
心立方最密堆积
√B.每个晶胞都是规则排列的
C.晶胞中原子的配位数分别为:①6,②8,③8,④12 D.空间利用率的大小关系为:①<②<③<④
4.(2020·哈尔滨第六中学高二期中)以NA表示阿伏加德罗常数的值,下列 说法错误的是
A.18 g冰(图1)中含O—H键数目为2NA B.28 g晶体硅(图2)中含有Si—Si键数目为2NA
√C.44 g干冰(图3)中含有NA个晶胞结构单元
D.石墨烯(图4)是碳原子单层片状新材料,12 g石墨烯中含C—C键数目为1.5NA
123456
解析 在氯化钠晶体中,Na+和Cl-的配位数都是6,则距离Na+最近的 六个Cl-形成正八面体,A项正确; 分子晶体的构成微粒是分子,每个分子为一个整体,所以该分子的化学 式为E4F4或F4E4,B项正确; 锌采取六方最密堆积,配位数为12,C项错误; KO2晶体中每个K+周围有6个紧邻的O-2 ,每个 O-2 周围有6个紧邻的K+, D项正确。故选C。
晶胞的计算

晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76] 晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为 a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。
晶胞的计算
晶胞的计算一、晶胞在高考中的地位分析:2008、2009年新课标,未对晶胞的计算进行考查;2010年新课标:37(4),一空,化学式的计算;2011年新课标:37(5),三空,晶胞中原子个数及密度的计算;2012年新课标:37(6),两空,晶胞密度、离子距离的计算。
二、常见的晶胞计算题:第一类:金属堆积方式的简单计算(空间利用率和密度)[选三P76]晶胞密度 =m(晶胞)/V(晶胞)空间利用率=[V(球总体积)/V(晶胞体积)]×100%【注】1m=10dm=102 cm=103 mm=106 um=109 nm=1012 pm①简单立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:②体心立方堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:③面心立方最密堆积:假设球的半径为r cm,则该堆积方式的空间利用率为:再假设该金属的摩尔质量为Mg/mol,N A为阿伏伽德罗常数的数值,试计算该晶胞的密度:【总结】必须掌握的常见晶胞及晶体结构分子晶体:干冰、冰晶胞图形、晶胞组成特点;原子晶体:金刚石(晶体硅)、二氧化硅晶胞组成特点、边长(体积、密度、原子最近距离)的计算方式;金属晶体:四种堆积方式的名称、图形、代表金属、边长(体积、密度、原子最近距离)的计算方式;离子晶体:NaCl、CsCl、CaF2晶胞图形、晶胞组成、边长(体积、密度、原子最近距离)的计算方式。
【练习】中学化学教材中展示了NaCl晶体结构,它向三维空间延伸得到完美晶体。
NiO(氧化镍)晶体的结构与NaCl 相同,Ni2+与最临近O2-的核间距离为a cm,计算NiO晶体的密度(已知NiO的摩尔质量为74.7 g/mol)。
(2)天然和绝大部分人工制备的晶体都存在各种缺陷,例如在某氧化镍晶体中就存在如图所示的缺陷:一个Ni2+空缺,另有两个Ni2+被两个Ni3+所取代。
其结果为晶体仍呈电中性,但化合物中Ni 和O的比值却发生了变化。
晶体空间利用率计算PPT课件
晶胞中的不同位置的微粒是被一个或几个 相邻晶胞分享的,因此一个晶胞所包含的 实际内容是“切割”以后的部分
计算方法:切割法
氯化钠晶体
顶点 棱上
钠离子 氯离子
体心 面心
思考:氯化钠 晶体中钠离子 和氯离子分别 处于晶胞的什
么位置?
方法小结(对于立方体结构)
位于顶点的微粒,晶胞完全拥有其1/8。 位于面心的微粒,晶胞完全拥有其1/2。 位于棱上的微粒,晶胞完全拥有其1/4。 位于体心上的微粒,微粒完全属于该晶胞。
The foundation of success lies in good habits
19
结束语
当你尽了自己的最大努力时,失败也是伟大的, 所以不要放弃,坚持就是正确的。
When You Do Your Best, Failure Is Great, So Don'T Give Up, Stick To The End 演讲人:XXXXXX 时 间:XX年XX月XX日
分比。
球体积
空间利用率 =
100%
晶胞体积
2、空间利用率的计算步骤:
(1)计算晶胞中的微粒数 (2)计算晶胞的体积
三、金属晶体空间利用率计算
1.简单立方堆积 立方体的棱长为2r,球的半径为r
过程:
1个晶胞中平均含有1个原子
2r
V球= 4 r3 V晶胞=(2r)3=8r
3
空间利用率= V球 100%
3r
r 3 2 3r2
2
2
3r 2
2 3
h
6r
2 6r 3
8 2r3
空间利用率= V球 100%
V晶胞
2r
金属晶体堆积方式
4、面心立方最密堆积
A1堆积:
抽出立方面心晶胞,又叫面心立方最密堆积 (cubic closest packing)简写为ccp 。
z
A
B
C
y
x
A
配位数12 空间利用率74% 晶胞内含有4个球。
1、简单立方堆积 -配位数:6
每个晶胞包含一个原子 空间利用率52%
14236 Nhomakorabea1
4
2
3 5
2、钾型(体心立方堆积) -配位数:8
每个晶胞包含2个原子 空间利用率68%
5
6
8
7
1
2
4
3
密堆积原理:原子、离子、分子的排布总是 趋向于配位数高,空间利用率大的紧密堆 积结构方式,最紧密的堆积往往是最稳定 的结构。
密置堆:第三层球放在第二层球的空隙上有两种方式
A B C A
重复ABC的堆积叫A1堆积,重复单位⃒ABC⃒。
A B A
重复AB的堆积叫A3堆积,重复单位⃒AB⃒。
3、六方最密堆积 A3堆积: 抽出六方晶胞,又叫六方最密堆积(hexagonal
closest packing)简写为hcp 。
A B A
2020高考热点---金属晶体四类晶胞空间利用率的计算
3、每个晶胞含 4个原子
4、晶胞边长为a
5、空间利用率=
六方立方晶体
六方最密堆积(镁型) 1、金属---Mg、Zn、Ti 2、六方最密堆积的配位数 12
3、每个晶胞含 2 个原子
4、晶胞边长为a a=2r 5、晶胞高为h h=
V球
2
4
3
r3
(晶胞中有2个球)
6、空间利用率=
V球 V晶胞 100% 74.05%
2、简单立方堆积的配位数 6
3、每个晶胞含 1个原子
4、晶胞边长为a a=2r
5、空间利用率=
体心立方晶体
1、体心立方堆积(钾型) K、Na、Fe 2、体心立方堆积的配位数 8
3、每个晶胞含 2 个原子
4、晶胞边长
5、空间利用率=
面心立方晶体
面心立方堆积
球半径为r
1、金属——铜型 Cu、Ag、Au
金属晶体的四种堆积模型对比
堆积模型
采纳这种堆 积的典型代
表
空间利 用率
配位数
简单立方 Po(钋) 52%
6
体心立方 (钾型)
K、Na、Fe
68%
2
面心立方最
密(铜型) Cu, Ag, Au 74%
12
晶胞
简单立方晶体
简单立方堆积
球半径为r
1、唯一金属——钋
