高考必记的重要的有机化学方程式
必修二 有机化学 方程式总结

乙烯与HX:C2H4+HX催CH3CH2X
乙烯与H2O:C2H4+H2O催CH3CH2OH
乙烯的加聚:nC2H4催[CH2-CH2]n
苯的燃烧: +15O2点12CO2+6H2O
苯的溴代:+Br2Br
苯的硝化:+HNO3浓硫酸50-60℃NO2+H2O
苯的磺化:+H2SO4(浓)70-80℃SO3H +H2O
乙醇与HX:C2H5OH+HX C2H5OX+H2O
乙酸与钠:2CH3COOH+Na 2CH3COONa+H2O
乙酸与NaOH:CH3COOH+NaOH CH3COONa+H2O
乙酸Na2CO3:CH3COOH+Na2CO3CH3COONa+H2O+CO2
乙醇与乙酸:CH3COOH+C2ห้องสมุดไป่ตู้5OH浓硫酸△CH3COOC2H5+H2O
必修二
甲烷和Cl2:CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
甲烷燃烧:CH4+2O2点CO2+2H2O
甲烷分解:CH41000℃C+2H2
乙烯燃烧:C2H4+3O2点2CO2+2H2O
乙烯与Br2:C2H4+Br2C2H4Br2
苯与H2:+3H2Ni△
乙醇和钠:2C2H5OH+2Na 2CH3COONa+H2
有机化学常用反应方程式汇总

有机化学常⽤反应⽅程式汇总光照光照光照光照⾼温CaO△催化剂加热、加压催化剂△催化剂有机化学⽅程式汇总1. CH 4 + Cl 2CH 3Cl + HCl 2. CH 3Cl + Cl 2 CH 2Cl 2 + HCl 3. CH 2Cl + Cl 2 CHCl 3 + HCl 4. CHCl 3 + Cl 2 CCl 4+ HCl 5. CH 4 C +2H 26. C 16H 34 C 8H 18 + C 8H 167. CH 3COONa + NaOH CH 4↑+ Na 2CO 38. CH 2 = CH 2 + Br 2 CH 2Br —CH 2Br9. CH 2 = CH 2OH 10. CH 2 = CH 2—CH 2Br 11. CH 2 = CH 2312. nCH 2 = CH 2 ] n13. nCH 22] n 14. 2CH 2CHO 15. CH ≡CH + Br 2 CHBr = CHBr 16. CHBr = CHBr+ Br 2 CHBr 2-CHBr 217. CH ≡CH + HCl H 2C = CHCl 18. nCH 2 = CH [ CH 2-CH ] n Cl Cl 19. CH ≡CH + H 2O CH 3CHO20. CaC 2 + 2H 2O CH ≡CH ↑+ Ca(OH)2 2 +H 2O H+H 2ONaOHH 2O 醇△140℃催化剂△24. + 3H 2 -NO 22O 26. 3CH ≡CH 27. CH 3CH 2Br + H 2O CH 3CH 2OH + HBr28. CH 3CH 2Br + NaOH CH 3CH 2OH + NaBr29. CH 3CH 2Br+ NaOH CH 2 = CH 2 + NaBr +H 2O30. 2CH 3CH 2OH+2Na 2CH 3CH 2ONa + H 2↑31. 2CH 3CH 2OH+O 2 2CH 3CHO + 2H 2O32. CH 3CH 2OH CH2 = CH 2↑+ H 2O 33.C 2H 5OH+C 2H 5OH C 2H 5OC 2H 5+H 2O 2O 2O O 3O + 2O+CO 33738. CH 339. 2CH 340. CH 34+2Ag ↓+3NH 3+H 2O41CH 3O42. 2CH 3COOH+2Na 2CH 3COONa+H 2↑ 43.2CH 3COOH+Na 2CO 3 2CH 3COONa+H 2O+CO 2↑浓硫酸△催化剂催化剂催化剂催化剂催化剂△催化剂加热、加压+ 浓硫酸CH2-CH244. CH3COOH+NaHCO3 CH3COONa+H2O+CO2↑45. CH3COOH + NaOH CH3COONa + H2O46. 2CH3COOH + Cu(OH)2 (CH3COO)2Cu + 2H2O47.CH3COOH+CH3CH2OH CH3COOCH2CH3 +H2O48. CH3COOCH2CH3+NaOH CH3COONa+CH3CH2OH49. nOHCH2CH2COOH→ [ OCH2CH2C ] n +H2O50. C6H12O+ 6H2O(l)51. C6H12O62CH3CH2OH + 2CO 252. C12H22O11+H2O C6H12O66蔗糖葡萄糖果糖53. C12H22O11+ H2O2C6H12O6麦芽唐葡萄糖54. (C6H10O5)n+ nH2O n C6H淀粉葡萄糖55. (C6H10O5)n+ nH2O n C6H12O6纤维素葡萄糖56.C17H33COO-CH2 C17H35COO-CH2C17H33COO-CH +3H2 C17H35COO-CHC17H33COO-CH2 C17H35COO-CH257. C17H35COO-CH2 CH2-OHC17H35COO-CH +3NaOH 3C17H35COONa+ CH-OH C17H35COO-CH2 CH2-OH58. CH2OH COOHCH2OH COOH1.HClClCHClCH+→24光HClClCHClClCH+→+2223光2.3.4.5.6.7.8.222Br CH CH CH CH +=-= 9.11.12. 13.14.15.16.17.OH NH Ag CHO CHOH HOCH 2342)(2)(+O H NH Ag COONH CHOH HOCH 2344232)(++↓+?→??18.19.20.21.⾼中有机化学知识点总结 1.需⽔浴加热的反应有:(1)、银镜反应(2)、⼄酸⼄酯的⽔解(3)苯的硝化(4)糖的⽔解(5)、酚醛树脂的制取(6)固体溶解度的测定凡是在不⾼于100℃的条件下反应,均可⽤⽔浴加热,其优点:温度变化平稳,不会⼤起⼤落,有利于反应的进⾏。
高考化学的重要化学方程式汇总高考化学有机部分化学方程式小结

《高考化学的重要化学方程式汇总:高考化学有机部分化学方程式小结》摘要:(l+l+l+),+3+3),()+高考化学必考题型分是有化学方程式所以学们不许牢牢掌握高重要化学方程式下面由编提供关高考化学重要化学方程式汇总希望对有助!化学重要化学方程式、非金属单质(、l、、、、、、)()、氧化性+ (冷暗处爆炸)+X(量)X(产物白色)(量)+XX(产物白色)+ (表示部分金属)+++XX+l(熔融,不能是溶液)l + l (光照或)3l + l3l +l3 l5l + l3l + l3l +l l3l+ ll + l+5l++63+0ll +l+l +l+l+ + +ll + l++3 3+K K++++3+l l3 (只能由单质制取不能由离子制取) +3 3 +3g g3 +3 3+3B B3 +6 3 +6K K3+6Rb Rb3 +l l+6 3 +3 3 +3Z Z3+L L、还原性++63(浓) +6++++66++3+3(稀) 3++3+++ 3++++5 0(常写成5)+3X X3(X表示lBr) X3+X X5+03(浓) 3+0+++l l+(足量)+(少量)++ +(生成水煤气) + +(制得粗硅) (粗)+l l(l+(纯)+l)(粉)++ (金刚砂)3、歧化反应l+l+l(加碱或光照促进歧化 (l+ ++l+l)l+l+l+ (l+l+l+)l+()l+(l)+ (l+l+l+)3l+6K(浓) 5Kl+Kl3+3 (3l+6 5l+l3+3)3+6 +3+3 (3+6 +3+3)+3K(浓)+33+3K (+3+33+3)+5+53+63+53+ +3+ +化学重要化学方程式二、金属单质 (,g,l,,)还原性+ + ++ +(爆炸)++ +++―++3+ +3++―++l l+ g+l gl g+Br gBrg+ g g+ g+ (只能由单质制备)g+ g()+g+l +gl g+Rbl gl+Rbg+g+g+g+ (g++g++)l+3l ll3l+3l3 (常温生成致密氧化膜而钝化氧气烧)l(g)+3+x(l3x)+g(铝汞齐)l+3 l3+3 l+r3 l3+r (铝热反应)l+3 l3+ l+3 l3+3l+6lll3+3 l+6+l3++3l+3l()3+3 l+6+l3++3l+6(浓)l()3+3+6 (l,冷,浓,3钝化)l+3(稀)l(3)3++ l+++3l3+++l++l+3 l++l+3+3BrBr3 3+ 3 + (炼钢程)++ (既能由单质制备又能由离子制备)3+(g) 3++ll+ +++++ll+ +++++ll+l(铁酸性环境下,不能把四氯化锡完全还原单质锡+ll+ ++++ 化学重要化学方程式三、非金属氢化物 (,l,,,3) 金属氢化物()、还原性l(浓)+ l+l+++l+ ++l+l(浓)+b bl+l+++l+b b++l+l(g)+ l+6l+KKl+l+5l+86 ++0l+++5l+86l+Kl3Kl+3l+36++5l+l33l+3l+Kr7Kl+rl3+3l+7++6l+r7r3++5l+7++l++l (气与l、Br、、、3气体不能共存) Br+ll+Br (l气与Br、、、3气体不能共存) +3(足量) + +(少量) ++3+ +(浓)++3+3(稀)3++3+++33++5+K+3+K+5+85++6+++5+83+Kr7+r()3+K+3+73+r7+8+r3++3+7+++6++8++ +3+3 3++33+3l+6l 83+3l+6l3++ll++3++++3+3(纯氧) +6 3+5 +63+65+6 (用氨清除)++ (生氢剂)+++++l +l+ +()+、酸性++(可测定矿样或钢样含量玻璃雕刻) +++l+l +++l+l (弱酸制强酸型反应)+++++g3g+3+g+g+++glg+l+g+g+++b(3)b+3 (铅试纸检验空气)+b+b+++gg+(银器空气变黑原因)3(液)++ (++3)3、3碱性3+XX (X、l、Br、、)3+33 3+++3+() 3+++3+l++3+l(侯德榜制碱用工业制备苏打苏打)3+ 3+++、不稳定性+ l +l ++ + 3 +3+化学重要方程式四、非金属氧化物(3、、、、3、、、5、、、、3、5、l、l3、l5、l7、l) 、低价态还原性(、、)++(这是气缓慢发生环境化学反应)+ 3 +3++l++l l+++++l+Br++Br Br+++++Br+++ ++++++++(用制硝酸工业吸收尾气和)+++ + +3+3 +3 + +、氧化性+3+3+K K3++K+++K(不能用淀粉K溶液鉴别溴蒸气和) ++3++ + +Z Z++g g+ (不能用扑灭由g,,B,,K等烧火灾)+ + +g g+3、与水作用+33+ 3+++3+3+ (不是硝酸酸酐)5+3 5+++35+(冷水)35+3(热水)3 (5极易吸水,可作气体干燥剂)5+3(浓)3+33+3l+ll7+l l7+++l、与碱性物质作用+3+()3+()3+33+()++(硫酸工业尾气处理)+()3+ (不能用澄清石灰水鉴别和可用品红鉴别) 3+gg3+()++3+3+3(量)+()3 ()3 ()++3 ()+ (工业制取尿素)+(量)3+ +3+(量)+3 +3+()(量)3+ ++ +3+(量)+()(3) ―+3+3+(3) +3+++3(不足)+l+3l()3+3+3+ll()3+3(足)+l+l()3+3++ll()3+3+65+65+3+65―+65+3+ 3 (炼钢造渣)+3+(常温下强碱缓慢腐蚀玻璃)+3 3+ (制取玻璃)+3 3+ (制取玻璃)++3++―3+―++++ (制取硝酸工业尾气吸收)++―3+化学重要化学方程式五、金属氧化物、低价态还原性6+3+3(3)3+++++3―3+++、氧化性+ (反应用制备)gl3几乎没有氧化性很难被还原gl般通电制g和l 3+3 +3(制还原铁粉)3+ 3+ + +3+66+8+3+6++―6++8+3+ 3 (炼钢程加入废钢作氧化剂)+ + (高温炼钢调节含量)+ + (高温炼钢调节含量)3、与水作用++++++++++(反应分两步++;+ 制备可利用类似反应B+(稀)B+) g+g()(缓慢反应)、与酸性物质作用+3 +3 g+3g+ll++++++3++(冷,稀)+g+g+g++g++l3+3l()3+3l3+6+l3++3l3+l+ (l3两性氧化物) l3+―l―++ll+++++3+6ll3+33+6+3++33+8ll+l3+3+8+3++++。
高三化学有机方程式汇总

学习好资料欢迎下载
高三有机方程式汇总
、烷烃反应类型反应方程式
取代反应
匕%+% " 9凡⑦+十方同时生成CH2c^、CHC^、CCl4
二、烯烃
反应类型反应方程式
加成反应
①能与H2、
HX、X2、
H2O加成 2 ②与X2加
成不需要
催化剂CH2=也+凡:、%巩
CHEHbErL CH2- CH2 Br B L
=强 + HX 催可剂》CHW% X
CH2 = CH2 + H20 催7剂1 CH3CH2OH
吗~CH= CH2 +期催?剂》风照萍或CH^CHCH^ X M
CHkCH —CH=CH2+E门-C1H2-CH-CH=CH3(1, 2 加成)
Er Br
CH L CH CH-CH2+Br2^ CH2 CH-CH /(L 4 加成)
Br Br
一吒CH,C也士聚乙烯
加聚反应
催化剂
“CH- - CH = CH^ -- 受上工——H CH—CH2七
3 2加蛰、加压 | "
匕*
的为=CH—CH= CH2催化剂、y H「UA=CH—C%上
三、芳香烃
四、炔烃
五、卤代烃
六、醇
七、苯酚
八、醛
九、酮
十、羧酸
十一、酯
十二、油脂
十三、糖类
十四、氨基酸
十五、蛋白质。
高中经典有机化学反应方程式

章末回顾排查专练(十二)排查一、重要有机反应方程式再书写1.2.2C 2H 5OH +2Na →2C 2H 5ONa +H 2↑; 3.CH 3CH 2OH ―――――――――→浓H 2SO 4170 ℃CH 2===CH 2↑+H 2O ; 4.C 2H 5OH +HBr ――→△ C 2H 5Br +H 2O ;5.2C 2H 5OH +O 2―――――――――→Cu 或Ag △2CH 3CHO +2H 2O ;9.2CH 3CHO +O 2―――――――――→催化剂△2CH 3COOH ; 10.CH 3CHO +H 2――――――――――→催化剂△CH 3CH 2OH ; 11.CH 3CHO +2Ag(NH 3)2OH ――→△ CH 3COONH 4+2Ag ↓+3NH 3+H 2O ;12.CH 3CHO +2Cu(OH)2――→△ CH 3COOH +Cu 2O ↓+2H 2O ;13.CH 3COOH +C 2H 5OH 浓H 2SO 4△CH 3COOC 2H 5+H 2O ;14.CH 3COOC 2H 5+H 2O 稀H 2SO 4△CH 3COOH +C 2H 5OH ;15.乙二醇和乙二酸生成聚酯16.排查二、常考易错再排查 1.按碳原子组成的分子骨架分,有机物可分为链状化合物和环状化合物,环状化合物又包括脂环化合物和芳香族化合物。
按官能团分,有机物可分为烃(烷烃、烯烃、炔烃、芳香烃)和烃的衍生物(卤代烃、醇、酚、醛、酸、酯等)。
( )2.具有相同分子式,不同结构的化合物互为同分异构体。
包括碳链异构(如CH 3CH 2CH 2CH 3与)、位置异构(如CH 3CH===CHCH 3与CH 3CH 2CH===CH 2)、官能团异构(如CH 3CH 2OH 与CH 3OCH 3)、顺反异构(顺2-丁烯与反2-丁烯)、手性异构等。
( )3.发生加成反应或加聚反应的有机物分子必须含有不饱和键。
2022年高考化学有机转化关系及反应方程式书写
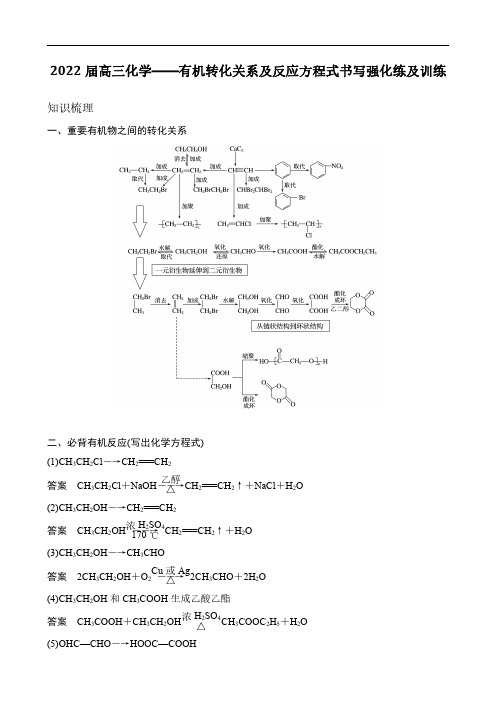
2022届高三化学——有机转化关系及反应方程式书写强化练及训练知识梳理一、重要有机物之间的转化关系二、必背有机反应(写出化学方程式)(1)CH 3CH 2Cl ―→CH 2===CH 2答案CH 3CH 2Cl +NaOH ――→乙醇△CH 2===CH 2↑+NaCl +H 2O(2)CH 3CH 2OH ―→CH 2===CH 2答案CH 3CH 2OH ――→浓H 2SO 4170℃CH 2===CH 2↑+H 2O (3)CH 3CH 2OH ―→CH 3CHO 答案2CH 3CH 2OH +O 2――→Cu 或Ag △2CH 3CHO +2H 2O(4)CH 3CH 2OH 和CH 3COOH 生成乙酸乙酯答案CH 3COOH +CH 3CH 2OH浓H 2SO 4△CH 3COOC 2H 5+H 2O (5)OHC—CHO ―→HOOC—COOH答案OHC—CHO +O 2――→催化剂△HOOC—COOH(6)乙二醇和乙二酸生成聚酯答案n HOCH 2—CH 2OH +n HOOC—COOH――→一定条件+(2n -1)H 2O (7)乙醛和银氨溶液的反应答案CH 3CHO +2Ag(NH 3)2OH ――→△CH 3COONH 4+2Ag ↓+3NH 3+H 2O(8)乙醛和新制Cu(OH)2悬浊液的反应答案CH 3CHO +2Cu(OH)2+NaOH ――→△CH 3COONa +Cu 2O ↓+3H 2O(9)答案(10)答案(11)和饱和溴水的反应答案(12)和溴蒸气(光照)的反应答案(13)和HCHO 的反应答案+(n -1)H 2O(14)酯在碱性条件的水解(以乙酸乙酯在NaOH 溶液中为例)答案CH 3COOC 2H 5+NaOH ――→△CH 3COONa +C 2H 5OH (15)和NaOH 的反应三、常考有机物的检验1.卤代烃中卤素的检验取样,滴入NaOH 溶液,加热至分层现象消失,冷却后加入稀硝酸酸化,再滴入AgNO 3溶液,观察沉淀的颜色,确定是何种卤素。
高三化学高考必记的化学方程式

高三化学高考必记的化学方程式一、非金属元素的反应1. 卤族元素(1)氯气H 2+Cl 2=====点燃2HCl2Fe +3Cl 2=====点燃2FeCl 3Cl 2+H 2O===HCl +HClO2NaOH +Cl 2===NaClO +NaCl +H 2O2Ca(OH)2+2Cl 2===Ca(ClO)2+CaCl 2+2H 2O6FeBr 2+3Cl 2===4FeBr 3+2FeCl 3(氯气少量)2FeBr 2+3Cl 2===2FeCl 3+2Br 2(氯气过量)[活学巧用] 氯水成分复杂,性质多样:强酸性——H +的性质;杀菌、漂白性——HClO 的性质;强氧化性——Cl 2的性质。
氯气溶于水,但不溶于饱和食盐水,因此可用饱和食盐水除去Cl 2中的HCl 。
Cl 2与NaOH 溶液的反应被用于实验室除去多余的Cl 2,常出现在框图推断中。
[易错警示] 氯气与FeBr 2溶液反应时,一定要注意二者量的关系,Cl 2首先氧化的是Fe 2+,然后氧化Br -;但Cl 2与FeI 2溶液反应时,首先氧化的是I -,然后氧化Fe 2+。
根据得失电子守恒可得出相应反应的离子方程式,如等物质的量的Cl 2与FeBr 2在溶液中反应时,其离子方程式为2Fe 2++2Cl 2+2Br -===2Fe 3++4Cl -+Br 2。
(2)含氯化合物2HClO=====光照2HCl +O 2↑Ca(ClO)2+CO 2+H 2O===CaCO 3↓+2HClONaClO +2HCl===NaCl +Cl 2↑+H 2OMnO 2+4HCl(浓)=====△MnCl 2+Cl 2↑+2H 2O[活学巧用] HClO 可作漂白剂和杀菌剂是由于HClO 具有强氧化性,长时间放置的氯水易变质是由于HClO 在光照条件下极易分解,所以新制的氯水需避光保存。
(3)卤素单质间的置换反应Cl 2+2NaBr===Br 2+2NaClCl 2+2NaI===I 2+2NaClBr 2+2KI===2KBr +I 2[活学巧用] 以上反应可用于比较Cl 2、Br 2、I 2氧化性(非金属性)的强弱或与CCl 4、淀粉溶液相结合用于溶液中Br -、I -的检验。
高考常考的化学方程式

..高考常考化学方程式〔一〕【说明】化学方程式是最重要的化学用语,每套高考试卷中都会考察。
本辑收录了高考无机化学方程式、离子反响方程式和有机反响方程式近300个,全面具体、书写准确、排版工整、方便记忆。
第一局部常考的无机化学方程式碱金属(钠、氧化钠、过氧化钠、氢氧化钠、钠盐)1、4Na+O2══2Na2O2、2Na + O2点燃Na 2O23、2Na+ Cl2点燃2NaCl4、2Na + S △Na2S〔爆炸〕5、2Na +2H2O══2NaOH + H2↑6、Na2O + H2O===2NaOH7、2Na2O +O2△2Na2O28、Na2O+ CO2══Na2CO39、Na2O+ 2HCl══2NaCl+ H2O10、2Na2O2 +2H2O══4NaOH + O2↑11、2Na2O2+2CO2══2Na2CO3+O212、2Na2O2+2H2SO4(冷、稀)══2Na2SO4+O2↑+2H2O13、2NaHCO3△Na2CO3+CO2+H2O14、NaHCO3+ NaOH══Na2CO3+ H2O15、Na2CO3+CO2+H2O══2NaHCO316、4Na+TiCl4(熔融)=4NaCl+Ti17、2Na+2NH3=2NaNH2+H218、NaH+H2O=NaOH+H2↑NaOH19、2NaOH+Si+H2O=Na2SiO3+2H2↑20、6NaOH+3S△2Na2S+Na2SO3+3H2O21、2NaOH+2Al+2H2O=2NaAlO2+3H2↑22、2NaOH(过量)+CO2=Na2CO3+H2O23、NaOH+CO2(过量)=NaHCO324、2NaOH+SiO2=Na2SiO3+H2O〔常温下强碱缓慢腐蚀玻璃〕25、2NaOH+Al2O3=2NaAlO2+H2O26、2NaOH+Cl2=NaCl+NaClO+H2O27、NaOH+HCl=NaCl+H2O28、NaOH+H2S(足量)=NaHS+H2O29、2NaOH+H2S(少量)=Na2S+2H2O30、3NaOH+AlCl3=Al(OH)3↓+3NaCl31、NaOH+Al(OH)3=NaAlO2+2H2O32、NaOH+NH4Cl△NaCl+NH3↑+H2O 33、2NaOH+P2O5=2NaPO3+H2O34、6NaOH+P2O5=2Na3PO3+3H2ONaAlO235、2NaAlO2+CO2+3H2O=2Al(OH)3↓+Na2CO336、3NaAlO2+AlCl3+6H2O=4Al(OH)3↓NaCl、NaClO、NaBr、NaI37、NaCl+H2SO4(浓)△NaHSO4+HCl↑38、H2SO4(浓)+2NaCl Na2SO4+2HCl39、2NaI+Cl2=2NaCl+I240、NaBr+H3PO4(浓)=NaH2PO4+HBr41、NaI+H3PO4(浓)=NaH2PO4+HI补充:2Na2O2+2H2O=4NaOH+O2↑(此反响分两步Na2O2+2H2O=2NaOH+H2O2;2H2O2=2H2O+O2↑。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高考必记的重要的有机化学方程式一、烃1.甲烷▲烷烃通式:C n H 2n+2 (n ≥1) (1)氧化反应甲烷的燃烧:CH 4+2O 2 CO 2+2H 2O 甲烷(烷烃)不能使酸性高锰酸钾溶液、溴水褪色。
(2)取代反应一氯甲烷:CH 4+Cl 2 CH 3Cl+HCl (一氯甲烷呈气态,其余三种均为油状液体)二氯甲烷:CH3Cl+Cl 2 CH 2Cl 2+HCl三氯甲烷:CH 2Cl 2+Cl 2 CHCl 3+HCl (CHCl 3又叫氯仿)四氯甲烷:CHCl 3+Cl 2CCl 4+HCl (CCl 4又叫四氯化碳,可作灭火剂,是一种重要的有机溶剂)2.乙烯乙烯的制取:CH3CH 2OH CH 2=CH 2↑+ H 2O (浓硫酸作催化剂、脱水剂)▲单烯烃通式:C n H 2n (n ≥2), 单环烷烃通式:C n H 2n (n ≥3) (1)氧化反应乙烯的燃烧:CH 2=CH 2+3O 2 2CO 2+2H 2O 乙烯(烯烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应与溴水加成:CH 2=CH 2+Br 2 CH 2Br —CH 2Br 与氢气加成:CH 2=CH 2 + H 2 CH 3CH 3与氯化氢加成:CH 2=CH 2+HCl CH 3CH 2Cl与水加成:CH 2=CH 2+H 2O CH 3CH 2OH(3)聚合反应乙烯加聚,生成聚乙烯:n CH 2=CH nn CH 2=CH —CH=CH CH 2—CH=CH —CH 2 n3.乙炔 n 2n-2 2)乙炔的制取:CaC 2+2H 2O CH ≡CH ↑+ Ca (OH )2(1)氧化反应乙炔的燃烧:2CH ≡CH +5O 2 4CO 2+2H 2O乙炔(炔烃)能使酸性高锰酸钾溶液、溴水褪色。
(2)加成反应 与溴水加成:CH ≡CH+Br 2 HC=CH 1,2—二溴乙烯BrCHBr=CHBr+Br 2 CHBr 2—CHBr 2 1,1,2,2CH ≡CH+2Br 2 CHBr 2—CHBr 2与氢气加成:CH ≡CH+H 2 CH 2=CH 2CH ≡CH +2H 2 CH 3—CH 3与氯化氢加成:CH ≡CH+HCl CH 2=CHCl(3)聚合反应氯乙烯加聚,得到聚氯乙烯:n CH 2 n乙炔加聚,得到聚乙炔:n CH ≡ n点燃光光光光浓硫酸170℃点燃Ni△催化剂加热、加压2-CH 2点燃Br 2—CHClCH=CHNi△Ni△ 图1 乙烯的制取图2 乙炔的制取4.苯▲苯及其苯的同系物通式:C n H2n-6 (n≥6)(1)氧化反应苯的燃烧:2C6H6+15O212CO2+6H2O 苯不能使溴水和酸性高锰酸钾溶液褪色。
苯的同系物能使酸性高锰酸钾溶液褪色。
(2)取代反应①苯与液溴在FeBr3催化作用下反应溴苯是难溶于水且密度比水大的无色油状液体。
除去溴苯中过量的溴,可以加入氢氧化钠溶液后再分液)②硝化反应+ HNO+ H2O(硝基苯是一种难溶于水且密度比水大的无色有苦杏仁味的有毒油状液体)(3)加成反应5.甲苯(1)氧化反应甲苯的燃烧:C7H8+9O27CO2+4H2O 甲苯(苯的同系物)不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(2)取代反应:注意在光照或催化剂条件下的取代位置+ Cl2 + HCl+ Cl2 + HCl甲苯硝化反应生成2,4,6-三硝基甲苯,简称三硝基甲苯,又叫梯恩梯(TNT)。
三硝基甲苯是一种淡黄色晶体,不溶于水;它是一种烈性炸药,广泛用于国防、开矿等。
二、烃的衍生物点燃点燃+Br+ HBrBrNO2+3HCH3|+3HNO3浓硫酸△O2N—CH3|—NO2|NO2+ 3H2OCH2Cl—CH3—CH336.溴乙烷:饱和一元卤代烃的通式为C n H 2n+1X(1)取代反应 溴乙烷的水解:C 2H 5Br + NaOH C 2H 5OH + NaBr(2)消去反应溴乙烷与NaOH 醇溶液反应:CH 3CH 2Br + NaOH CH 2=CH 2↑+ NaBr + H 2O7.乙醇:饱和一元醇分子的通式为C n H 2n+2O (n ≥1),醇类不能使溴水褪色,但能使酸性高锰酸钾溶液褪色。
(1)与钠反应乙醇与钠反应:2CH 3CH 2OH + 2Na 2CH 3CH 2ONa + H 2↑(乙醇钠)(2)氧化反应乙醇的燃烧: CH 3CH 2OH+3O 2 2CO 2 + 3H 2O乙醇的催化氧化:2CH 3CH 2OH+O 2 2CH 3CHO+2H 2O (乙醛)2Cu+O 2=2CuO (红变黑) CH 3CH 2OH + CuO CH 3CHO+Cu+H 2O (黑变红)乙醇也可被酸性KMnO 4溶液(紫红色褪去)、K 2Cr 2O 7溶液(橙红色变绿色)等强氧化剂氧化成羧酸。
(3)消去反应乙醇在浓硫酸作催化剂、脱水剂的作用下,加热到170℃生成乙烯。
CH 3CH 2OH CH 2 = CH 2↑+ H 2O注意:该反应加热到140℃时,乙醇进行另一种脱水方式,生成乙醚。
2C 2H 5OH C 2H 5—O —C 2H 5 + H 2O (乙醚)(4)取代反应①乙醇与浓的氢卤酸反应: C 2H 5OH+HX C 2H 5X + H 2O ②酯化反应(浓硫酸作催化剂、吸水剂)8.苯酚 苯酚俗称石 炭酸,是一种弱酸,不能使指示剂变色。
纯净的苯酚是无色晶体,露置在空气中会因氧化显粉红色。
苯酚具有特殊的气味,熔点43℃,常温下水中溶解度不大,当温度高于65℃时可与水以任意比互溶。
苯酚易溶于有机溶剂,故常用乙醇清洗苯酚。
苯酚有毒,是一种重要的化工原料。
【酚类能使溴水和酸性KMnO 4溶液褪色】 (1)苯酚的酸性+ H +(苯酚钠)2苯酚与Na 2CO 3反应:▲苯酚钠与CO 2反应: +CO 2+H 2O + NaHCO 3▲酚醛缩聚反应:(2)取代反应(可发生酯化反应)+ 3Br 2 ↓+ 3HBr(三溴苯酚,白色沉淀。
此反应可用于酚羟基的定性、定量检验)(3)显色反应:酚类物质遇Fe 3+ 溶液显紫色。
显色反应可用于酚羟基的检验。
(4)加成反应:+ 3H 2 (环己醇)醇△Cu/Ag△ 浓硫酸140℃—OH +NaOH + H 2O —ONa —ONa —OH—OH—Br Br — OH| Br | H 2O△点燃浓硫酸170℃△—OH + Na 2CO 3 + NaHCO 3—ONa —OH +2Na 2 + H 2↑熔融 —ONa —O - —OH —OH Ni△—OH9.乙醛:饱和一元醛分子的通式为C n H 2n O (n ≥1)乙醛是无色,具有刺激性气味的液体,沸点20.8℃,密度比水小,易挥发。
【醛类能使溴水和酸性KMnO 4溶液褪色】 (1)加成反应乙醛与氢气反应:CH 3CHO + H 2 CH 3CH 2OH(2)氧化反应乙醛与氧气反应:2CH 3CHO + O 2 2CH 3COOH (乙酸)乙醛的银镜反应:CH 3CHO +2Ag(NH 3)2OH CH 3COONH 4+2A g ↓+3NH 3+H 2O (乙酸铵)注意:硝酸银与氨水配制而成的银氨溶液中含有Ag(NH 3)2OH (氢氧化二氨合银),这是一种弱氧化剂,可以氧化乙醛,生成Ag 。
银氨溶液必须现配现用,制备银氨溶液的有关方程式如下: Ag ++NH 3·H 2O===AgOH ↓+ NH 4+(现象:产生白色沉淀)AgOH+2NH 3·H 2O===[Ag(NH 3)2]++OH -+2H 2O (现象:白色沉淀逐渐溶解,溶液变澄清)【银镜反应之后试管壁附着的银可用稀硝酸洗涤干净】乙醛还原氢氧化铜:CH 3CHO+2Cu (OH )2 +NaOH CH 3COONa+Cu 2O ↓+3H 2O乙炔水化法制乙醛:CHO CH O H CH CH 32−−→−+≡催化剂10.乙酸:饱和一元羧酸分子的通式为C n H 2n O 2 (n ≥1)(1)乙酸的酸性(具有酸的五点通性)乙酸的电离:CH 3COOH CH 3COO -+ H +(2)酯化反应:(反应实质是酸脱去羟基,醇脱去氢原子。
浓硫酸作催化剂、吸水剂)(乙酸乙酯)11.乙酸乙酯乙酸乙酯是一种具有香味的无色油状液体,密度比水小,难溶于水,能发生水解反应。
▲水解反应: 注意酚酯类碱水解CH 3COO -+2NaOH→CH 3COONa+-ONa+H 2OCH 3COOC 2H 5+H 2O CH 3COOH+C 2H 5OHCH 3COOC 2H 5+NaOH CH 3COONa + C 2H 5OH12.其它重要的化学方程式①↑+−−→−+∆432CaO 3CH CO Na NaOH COONa CH (脱羧反应) ②24H 2C CH +−−→−高温③乙烯氧化法制乙醛:CHO CH 2O CH CH 23P T 222、一定催化剂−−→−+=④C 12H 22O 11+H 2O C 6H 12O 6+ C 6H 12O 6 ⑤C 12H 22O 11 + H 2O 2C 6H 12O 6蔗糖 葡萄糖 果糖 麦芽糖 葡萄糖⑥(C 6H 10O 5)n + nH 2O nC 6H 12O 6 ⑦C 6H 12O 6 + 6O 2 6CO 2 + 6H 2O (生理氧化供能)淀粉或纤维素 葡萄糖 葡萄糖⑧6CO 2 + 6H 2O C 6H 12O 6 +6O 2 ⑨C 6H 12O 6 2C 2H 5OH +2CO 2↑(发酵生成酒精)葡萄糖 葡萄糖 酒精 ⑩☆1,3—丁二烯的加成反应:▲1,2加成:CH 2=CH —CH=CH 2+Br 2 BrCH 2CHBrCH=CH 2▲1,4加成:CH 2=CH —CH=CH 2+Br 2 BrCH 2CH=CHCH 2Br▲全部加成:CH 2=CH —CH=CH 2+2Br 2 BrCH 2CHBrCHBrCH 2Br☆1,3①自身加聚:②与碳碳双键的加聚:Ni△催化剂△水浴加热△无机酸△催化剂 催化剂催化剂△ 光照、叶绿素酶酒化酶催化剂 nCH 2=C —CH=CH 2 CH 2—C = CH —CH 2 n CH 33nCH 2=CH —CH=CH 2 +nCH=CH 2 催化剂CH 2—CH=CH —CH 2—CH —CH 2 n C 6H 5 C 6H 5。
