碳酸钠含量测定
混合碱中各组分含量的测定实验报告

混合碱中各组分含量的测定实验报告混合碱是指由多种碳酸盐组成的碱性物质,常见的有碳酸钠、碳酸钾等。
在实际应用中,混合碱被广泛应用于玻璃生产、化学工业、石化工业等领域。
在这些应用中,混合碱的组成成分及其含量的测定非常重要。
本次实验旨在通过测定混合碱中各组分的含量,探究其成分及其含量变化对混合碱性质的影响。
实验中我们选择了碳酸钠和碳酸钾作为混合碱的组分,通过滴定法和重量法测定了混合碱中两种组分的含量。
实验过程中,我们首先制备了一定比例的碳酸钠和碳酸钾混合物,并将其加入纯水中溶解。
我们在溶液中加入了甲基橙指示剂,然后使用盐酸滴定溶液,直到溶液呈现橙色为止。
通过滴定计算我们得出了混合碱中碳酸钠的含量,其计算公式为:碳酸钠含量(%)= (V1-V2) × C1 × 10 × 10 / (m × 1.06)其中,V1为滴定过程中加入的盐酸体积,V2为滴定过程中的终点体积,C1为盐酸溶液浓度,m为样品重量。
接下来,我们使用重量法测定了混合碱中碳酸钾的含量。
我们首先将混合碱样品加入烧杯中,然后在电炉中加热烘干。
烘干后,我们将烧杯放入干燥器中,等待其冷却后,使用天平测定样品质量。
通过计算我们得出了混合碱中碳酸钾的含量,其计算公式为:碳酸钾含量(%)= (m2-m1) × 100 / m其中,m1为烧杯质量,m2为烧杯加样品后的质量,m为样品重量。
通过实验,我们得出了混合碱中碳酸钠和碳酸钾的含量分别为30.2%和69.8%。
此外,我们还得到了混合碱的理论含量,即碳酸钠含量为30%、碳酸钾含量为70%。
通过与理论值的比较,我们发现实验测得的值与理论值非常接近,这说明我们的测定结果是准确可靠的。
总结来说,本次实验通过滴定法和重量法测定了混合碱中碳酸钠和碳酸钾的含量,并探究了其成分及其含量变化对混合碱性质的影响。
通过实验我们得出的结论是混合碱中碳酸钾的含量较高,这说明混合碱具有比较强的碱性。
离子膜法烧碱中碳酸钠含量的测定

离子膜法烧碱中碳酸钠含量的测定烧碱(又称熟碱)是一种半熟的加碱制品,其原料是一定比例的碳酸钠与硅酸钠,在熔化的过程中,溶解了部分氢氧化物,又称钠碱交换法处理。
测定烧碱中碳酸钠含量是烧碱质量检验非常重要的指标之一。
常用的烧碱中碳酸钠含量测定方法主要有滴定法、分光光度法等。
近年来,离子膜法由于其简单快捷的特点,被广泛用于烧碱中碳酸钠含量的测定。
离子膜电位计是用于测定烧碱中碳酸钠含量的仪器,它利用离子膜的电解质透过导电率的测定,从而可迅速准确地测定烧碱中碳酸钠含量。
离子膜电位计测定烧碱中碳酸钠含量的基本原理是:把烧碱溶液加入校准液容器,将烧碱溶液加入系统中,当离子膜电位计的检测液两腔中的浓度差越大,离子膜电位计反映出来的电位就越大。
离子膜电位计通过对测定液浓度的测定,从而可以准确地测定出烧碱中碳酸钠含量。
离子膜法测定烧碱中碳酸钠含量的具体步骤是:(1)准备校准液:准备含有碳酸钠的校准液,按照标准液的标准浓度调节,将校准液倒入离子膜电位计的腔室中,充分搅拌。
(2)溶质的测定:将准备好的烧碱溶液加入到校准液容器中,经过一定的搅拌后,将试样液倒入离子膜电位计的测定室中,用离子膜电位计进行测定。
(3)测定数据的处理:将记录下来的测定结果进行处理,以计算出烧碱中碳酸钠的具体含量。
以上就是离子膜法烧碱中碳酸钠含量的测定的基本步骤。
离子膜法是一种快速、准确的烧碱中碳酸钠含量测定方法,但它也有一些局限性,例如测试物质必须是溶质,而且测试中也不能使用复杂的混合溶液。
此外,从现实应用的角度出发,实验操作过程中,应按规定正确操作,避免误操作,以确保结果准确。
综上所述,离子膜法烧碱中碳酸钠含量的测定是一种快速、简便、准确的方法。
但它也有局限性,并且要求实验人员按规定正确操作,以确保实验结果准确。
检验碳酸钠的方法

检验碳酸钠的方法
首先,最常用的方法之一是酸碱滴定法。
首先将碳酸钠溶解于水中,然后用酚
酞指示剂滴定至终点。
通过滴定所需的酸的体积,可以计算出碳酸钠的含量。
这种方法简单易行,准确性较高,被广泛应用于实验室和生产现场。
其次,还可以利用重金属离子沉淀法来检验碳酸钠。
将碳酸钠溶液与过量的重
金属离子溶液反应,生成沉淀,然后通过过滤、干燥、称重等步骤,计算出碳酸钠的含量。
这种方法对于含量较高的碳酸钠样品效果较好,但操作过程较为繁琐。
此外,还可以利用酸度法来检验碳酸钠的含量。
将碳酸钠样品溶解于水中,然
后用酸溶液滴定至中和终点,通过滴定所需的酸的体积,计算出碳酸钠的含量。
这种方法操作简便,但对于含量较低的碳酸钠样品可能会出现准确度不高的情况。
最后,还可以利用熔融法来检验碳酸钠的含量。
将碳酸钠样品与熔融剂混合,
然后在高温条件下熔融,通过冷却后的产物的重量变化,计算出碳酸钠的含量。
这种方法适用于含量较高的碳酸钠样品,但操作过程较为复杂,需要高温条件下进行,操作要求较高。
综上所述,检验碳酸钠的方法有多种,可以根据具体情况选择合适的方法。
在
实际操作中,需要根据样品的性质、含量和实验条件等因素综合考虑,选择最合适的检验方法,以保证检验结果的准确性和可靠性。
碱液中氢氧化钠及碳酸钠含量的测定实验报告

碱液中氢氧化钠及碳酸钠含量的测定实验报告碱液中氢氧化钠及碳酸钠含量的测定实验报告一、引言在化学实验中,准确测定溶液中的物质含量是非常重要的。
本实验旨在通过酸碱滴定法,测定碱液中氢氧化钠(NaOH)及碳酸钠(Na2CO3)的含量。
酸碱滴定法是一种常用的定量分析方法,基于酸碱中和反应的化学原理进行测定。
二、实验原理本实验采用酸碱滴定法,通过滴定一定浓度的酸溶液来测定碱液中的氢氧化钠及碳酸钠含量。
滴定过程中,酸溶液与碱溶液发生中和反应,根据酸溶液的浓度和滴定过程中酸溶液用量的知识,可以计算出碱液中目标物质的含量。
三、实验步骤1. 实验前准备:准备好所需的实验器材,包括滴定管、容量瓶、酸溶液(已知浓度)、指示剂等。
2. 预处理样品:取一定量的碱液样品,加入适量的酸溶液进行预处理,使样品中的碱物质完全转化为酸物质。
3. 滴定过程:将预处理后的样品溶液倒入容量瓶中,加入适量的指示剂。
用滴定管滴加已知浓度的酸溶液,同时搅拌容器中的溶液,直到指示剂的颜色发生明显变化。
4. 记录滴定数据:记录滴定过程中酸溶液的用量,以及滴定终点的颜色变化。
5. 计算含量:根据滴定数据和酸溶液的浓度,计算出碱液中氢氧化钠及碳酸钠的含量。
四、实验结果与分析根据实验所得滴定数据和已知酸溶液的浓度,我们计算出了碱液中氢氧化钠及碳酸钠的含量。
根据滴定终点的颜色变化,可以确定滴定反应的终点,并由此计算出所需物质的含量。
五、实验讨论在本实验中,我们使用了酸碱滴定法来测定碱液中氢氧化钠及碳酸钠的含量。
酸碱滴定法是一种常用的定量分析方法,具有操作简便、准确度高的特点。
通过本实验,我们成功地测定了目标物质的含量,得到了较为准确的结果。
六、实验总结本实验通过酸碱滴定法,成功测定了碱液中氢氧化钠及碳酸钠的含量。
实验结果表明,酸碱滴定法是一种准确度较高的定量分析方法,可以满足实验需求。
通过本实验的实践,我们对酸碱滴定法的原理和操作方法有了更深入的了解,提高了实验技能。
碳酸钠含量测定解析
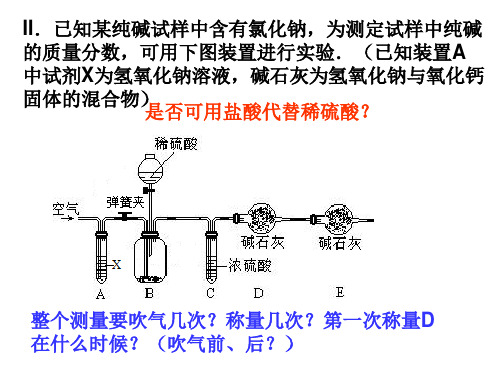
二、样品中NaOH的含量测定
有哪些方法? 小刚认为可以通过沉淀法计算碳酸钠的质量,他称取了 该混合物样品10.0g,按下列步骤进行实验:
CaCl2 + Na2CO3→CaCO3 ↓ + 2NaCl NaOH Na2CO3 CaCO3 NaOH 、 NaCl 、 CaCl2
过滤 (1)“操作1”中的操作是__________ (2)加入过量氯化钙溶液发生反应的化学方程式是 CaCl 2+Na2CO3→CaCO3↓+2NaCl _________________________ 。如何证明所加CaCl2已足量? 将反应后的溶液静置,取上层清液滴加 CaCl2,若无沉淀则过量。 _________________________________________________ CaCl2、NaOH、NaCl (3)滤液中的溶质成分是__________________________ 100 (4)固体A的相对分子质量为________ ,混合物中氢氧化钠 79.1% 的质量分数为__________ 沉淀未洗涤干净 (5)若上述试验的测定结果偏大,可能原因是____________
小明认为可以通过气化法计算碳酸钠的质量,他选用了 如下装置进行实验。
(1)如图1所示(铁夹夹持的仪器是理想无摩擦注射器),把 Xg的混合物与足量稀硫酸反应后,测定产生的CO2气体的体积。 将注射器活塞拉出一定距离, 检查该装置的气密性的方法是___________________________ 一段时间后松开活塞,活塞能回到原位则不漏气 ___________________________________________________ , 本实验中为什么选用硫酸进行试验而不用盐酸_____________ 浓盐酸具有挥 发性,会影响气体体积的测定。 _________________________ 。
食品添加剂碳酸钠含量标准

食品添加剂碳酸钠含量标准
《食品添加剂碳酸钠含量标准》
一、碳酸钠是一种常用的食品添加剂,主要用于改善食品的质地,增强食物口感,延长食物的保质期,保证食品的安全性和卫生质量。
因此,碳酸钠含量的标准被制定为:
1、水果或蔬菜的碳酸钠含量应不超过150毫克/千克。
2、面包、饼干、淹面条等食品碳酸钠含量应不超过600毫克/
千克。
3、糖果、巧克力和糕点的碳酸钠含量应不超过800毫克/千克。
4、其它食品的碳酸钠含量应不超过1000毫克/千克。
二、为保证食品的安全性,以及消费者的健康,有关部门将碳酸钠含量标准应用于所有食品添加剂及食品的生产过程中。
如果某种食品的碳酸钠含量超过上面规定的标准,生产者将被责令停止生产,并将予以处罚。
- 1 -。
碳酸钠含量检测方法

碳酸钠含量检测方法
1. 酸碱滴定法:这是一种常用的碳酸钠含量检测方法。
其原理是利用碳酸钠与酸反应生成二氧化碳的性质,通过滴定酸的用量来计算碳酸钠的含量。
具体操作是将待测样品溶解在水中,加入已知浓度的酸溶液,用酚酞作为指示剂,当溶液由红色变为无色时,即为滴定终点。
根据酸的用量和浓度,可以计算出碳酸钠的含量。
2. 重量法:该方法基于碳酸钠与氯化钙反应生成碳酸钙沉淀的原理。
将待测样品溶解在水中,加入过量的氯化钙溶液,使碳酸钠完全反应生成碳酸钙沉淀。
过滤沉淀,并将其干燥、称重。
根据沉淀的质量和化学计量关系,可以计算出碳酸钠的含量。
3. 电位滴定法:电位滴定法是一种基于电位变化来确定滴定终点的方法。
在碳酸钠含量检测中,通常使用盐酸作为滴定剂,用玻璃电极作为指示电极,检测溶液的电位变化。
当滴定剂与碳酸钠反应达到等当点时,电位会发生突跃,通过记录滴定过程中的电位变化,可以确定等当点,从而计算出碳酸钠的含量。
4. 原子吸收光谱法:原子吸收光谱法是一种基于原子吸收光谱原理的分析方法。
将待测样品溶解在水中,通过原子吸收光谱仪测定碳酸钠的特征吸收峰的强度,根据标准曲线或内标法,可以计算出碳酸钠的含量。
需要注意的是,不同的检测方法适用于不同的样品类型和检测要求。
在选择检测方法时,需要考虑样品的性质、检测精度、实验条件等因素。
同时,为了获得准确可靠的检测结果,需要严格按照操作规程进行实验操作,并进行适当的质量控制和验证。
项目二碳酸钠的制备及含量测定(双指示剂法)

实验二十一碳酸钠的制备及含量测定(双指示剂法)一、【目的要求】1、了解工业上制备纯碱(碳酸钠)的“联合制碱法”的基本原理;2、学会利用各种盐类溶解度的差异使其彼此分离的基本技能;3、了解复分解反应和热分解反应的条件;4、初步学会用双指示剂法测定碳酸钠的含量。
二、【实验原理】1、制备原理:碳酸钠又名苏打,工业上叫纯碱,用途很广。
工业上的联合制碱法是将二氧化碳和氨气通入氯化钠溶液中,先生成碳酸氢钠,再在高温下灼烧,使它失去一部分二氧化碳,转化为碳酸钠。
NH+CO+H20 +NaC— NaHC3+NH4C12NaHC3 N@CG+CG+HbO在第一个反应中,实质上是碳酸氢铵与氯化钠在水溶液中的复分解反应,因此本实验直接用碳酸氢铵与氯化钠作用来制取碳酸氢钠:NHHC(3+NaC1=NaHGONHC1NH 4HCQ NaC1 NaHC C和NH4C1同时存在于水溶液中,是一个复杂的四元交互体系。
它们在水溶液中的溶解度互相发生影响。
不过,根据各纯净盐在不同温度下在水中的溶解度的互相对比,仍然可以粗略地判断出从反应体系中分离几种盐的最佳条件和适宜的操作步骤。
各种纯净盐在水中的溶解度(克/ 100克水)见下表。
010203040506070R090100NaCI35.73583636336.6373733R.43939.8NHjHCOi J.915,82127■-二■---NaHCO^ 6.9ft. 159.611.112.714.4516.4-—■NH4CI29.433337r241445.S50455.260.265.6713773当温度超过35C, NHHCO就开始分解,所以反应温度不能超过35C。
但温度太低又影响了NHHCO勺溶解度,所以反应温度又不宜低于30Co从表中可以看出,NaHCO在30^35C温度范围内的溶解度在四种盐中是最低的,所以当使研细的固体NHHC0溶于浓的NaC1溶液中,在充分的搅拌下就析出NaHC錦体。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
(三)操作步骤
1.试样溶液制备
精确称取试样10g(称准至0.001g)于100ml烧杯中。
加入40ml 新煮沸并冷却的蒸馏水,小心地用玻璃棒捣碎较硬颗粒,用煮沸过的蒸馏水定量转移至500ml容量瓶中,并稀释到刻度,充分搅动混匀后备用。
将样品溶液小心地用双层慢速定性滤纸过滤,弃去前20ml,收集滤液于250ml容量瓶中。
2.测定
(1)移取50ml滤液于500ml锥形瓶中,加入50ml新煮沸过的蒸馏水,3~4滴酚酞指示剂溶液,然后用0.2mol几盐酸标准溶液滴定至酚酞终点。
以酚酞为指示剂滴定含大量碱性盐的洗涤剂溶液时,通常显示不出从粉红到无色的明显突变,因此,以滴定至浅粉红色即为终点。
滴定耗用盐酸标准溶液的体积为V
1。
然后加入3~4滴甲基橙指示剂溶液,继续用0.2mol/L盐酸标准溶液滴定至甲基橙终点。
在电热板上加热至沸,如红色退去,应再滴加盐酸使变红。
必须小心不得超过指示剂终点。
如果万一过量时,用l~2滴0.1mol几氢氧化钠溶液调至恰为终点。
滴定耗用盐酸标准溶液的体
积为V
2(包括V
1
在内的总值)。
(2)移取50ml滤液于另一500ml锥形瓶中,加入50ml新煮沸过
的蒸馏水,然后加入与滴定值V
2
完全相等的0.2mol几盐酸标准溶液,
在电热板上加热至沸。
如果洗涤剂中含有过硼酸盐存在,则加热至刚沸即止,以避免硼酸随水蒸气挥发。
用流动水冷却锥形瓶,加几滴甲基橙指示剂,必要时加几滴
0.1mol几盐酸或氢氧化钠溶液调到甲基橙终点(所需盐酸体积加至V
2
中,
所需氢氧化钠体积加至V
3
中)。
然后加3~4滴酚酞指示剂溶液,用
0.2mol/L氢氧化钠标准溶液滴定至持久的粉红色。
如果洗涤剂中含有肥皂,、滴定时必须十分缓慢地进行,并充分摇动以中和被释出的脂肪酸。
回滴定酸化试液耗用氢氧化钠标准溶液的体积为V
3。
