2 热点题型4 纯碱样品中碳酸钠质量分数的测定
(完整)初中化学图表型计算题+答案

图形类计算题1、用“侯氏联合制碱法”制得的纯碱常含有少量的氯化钠。
为测定某纯碱样品中碳酸钠的含量,小明称取该纯碱样品3.3g,充分溶解于水中,再滴加氯化钙溶液,产生沉淀的质量与加入氯化钙溶液的质量关系如图所示。
求:(1)该纯碱样品中碳酸钠的质量分数。
(精确到0.1%)(2)所加入氯化钙溶液的溶质质量分数。
2、已知Na2cO3的水溶液呈碱性,在一烧杯中盛有20.4gNa2cO3和NaCl组成的固体混合物。
向其中逐渐滴加溶质质分数为10%的稀盐酸。
放出气体的总质量与所滴入稀盐酸的质量关系曲线如下图所示,请根据题意回答问题:(1)当滴加稀盐酸至图中B点时,烧杯中溶液的pH7(填>、=、<)。
(2)当滴加稀盐酸至图中A点时,烧杯中为不饱和溶液(常温),通过计算求出其中溶质的质量分数。
(计算结果保留一位小数)第2题3、将29.1g由NaCl和BaCl2组成的固体混合物溶解于94.2mL水中(=1g/cm3),向所得溶液中滴加质量分数为14.2%的Na2sO4溶液,至恰好完全反应。
下图是所加Na2sO4溶液质量与生成沉淀质量的关系图,计算:(1)生成沉淀的质量是多少?(2)所得溶液中溶质的质量分数为多少?第3题4、刘明用石灰石(杂质不与酸反应,也不溶于水)和稀盐酸反应制取二氧化碳,在准备将反应后的废液倒进废液缸时,发现实验桌上有一瓶未知质量分数的Na2cO3溶液,他决定利用该废液,测定Na2cO3溶液中溶质的质量分数。
他将废液过滤,然后向废液中慢慢滴加Na2c03溶液,加入Na2cO3溶液的质量与生成沉淀质量的关系如图所示。
2323(1)在加入Na2cO3溶液的过程中,开始时没有发现沉淀生成,说明滤液中的溶质除含有%@在2外,还含有;(2)计算NacO溶液中溶质的质量分数。
(计算结果精确到0.1%)23第4题5、在化学实验技能考试做完“二氧化碳的制取和性质”实验后,废液桶中有大量的盐酸与氯化钙的混合溶液(不考虑其他杂质)。
高考化学一轮复习课件:题型突破4碳酸钠质量分数测定的实验探究

(7)若所取样品的质量为m g,反应前量气管C的读数为V1 mL,反应结束后量气 V1-V2
管C的读数为V2 mL,则样品中NaHCO3和Na2CO3的物质的量之和为_2_2__4_0_0__m_o_l (气体体积均已换算为标准状况下的体积)。 解析 根据碳原子守恒,1 mol 碳原子对应 1 mol 二氧化碳,二氧化碳的物质的量 为V221-40V02 mol,所以样品中 NaHCO3 和 Na2CO3 的物质的量之和为V221-40V02 mol。
123
A 滴定法
消耗盐酸的体积
准盐酸滴定
B 量气法 将样品与盐酸反应,生成的气体全部被碱石灰吸收 碱石灰增加的质量
C 重量法 将样品放入烧瓶中,置于电子天平上,加入足量盐酸 减少的质量
D 量气法 将样品与盐酸反应,气体通过排水量气装置量18·徐州一模)为了测定NaCl、Na2CO3·10H2O和NaHCO3的混合物中各组分 的含量,某同学设计如下实验:取一定质量的混合物,通过测量反应前后②和 ③装置质量的变化,测定该混合物中各组分的质量分数。下列说法中错误的是
g×100%=119076mn ×100%。
专题精练 ZHUANTIJINGLIAN
1.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g样品进行实验, 下列实验方法所对应的实验方案和测量数据合理的是
选项 实验方法
实验方案
测量数据
√ 将样品配成100 mL溶液,取10 mL,加入酚酞,用标
A.①②③中可以依次盛装碱石灰、无水CaCl2、碱石灰 B.硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气,直至a处出来的空气不
再使澄清石灰水变浑浊为止
√C.若将①装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量偏大
2020年中考复习 物质质量分数的测定和探究 练习题

物质质量分数的测定和探究1、实验室新购买了一批双氧水(H2O2)溶液,某兴趣小组的同学要测定其质量分数,他们设计如图所示的装置,其实验的操作步骤如下:①组装仪器,并检查装置的气密性;②在A. B.C三个仪器中装入药品,其中双氧水溶液质量为50g;③用电子秤称量出整套装置的总质量为498.6g;④关闭a处止水夹,打开A仪器的阀门,向锥形瓶中加入全部的双氧水溶液,随即关闭A仪器的阀门;⑤充分反应后,打开a处止水夹,向装置中持续缓慢地鼓入X气体;⑥第二次称量整套装置的总质量为497g.(1)本实验采用的装置中,A仪器的名称是___(2)为尽可能减小测量误差,请结合测量原理判断,操作⑤中鼓入的X气体是__ _.A. 氦气B.经干燥处理的空气C.除去氧气后的空气(3)根据题意,计算双氧水溶液中溶质的质量分数,写出计算过程。
2、为了测得工业纯碱中碳酸钠的质量分数(纯碱中常含少量NaCl),小明同学设计的实验装置如图甲,准确称取一定量的纯碱样品,从分液漏斗中滴入稀硫酸。
(1)图甲中装置发生的化学方程式为:__ _。
(2)小红觉得小明的实验装置会导致较大的误差,故设计了图乙的装置,请你写出图乙装置的优势(写出两点即可):_ __。
(3)小红用图乙装置进行实验步骤为:①准确称取盛有碱石灰的干燥管的质量为158.0g,再准确称取11.0g纯碱样品并全部放入A中;②组装全部反应装置并检查气密性,关闭d;由e逐滴加入稀硫酸至不再产生气泡为止;③打开d,慢慢鼓入空气10min;④再称干燥管的总质量为162.4g。
该产品中碳酸钠的质量分数为:__,若没有B装置,而直接通入空气,实验最后使得碳酸钠的质量分数__ _(填“偏大”、“偏小”或“不变”)。
3、有些晶体按比例带有一定量的结晶水,带有结晶水的晶体在一定温度下会脱去结晶水.草酸晶体(H2C2O4•xH2O)在常温下是一种无色透明晶体.草酸晶体受热时分解的化学方程式为:H2C2O4•xH2O===(x+1)H2O+CO2↑+CO↑某化学兴趣小组的同学利用该信息以及所学的知识设计并开展实验,测定草酸晶体中结晶水的质量分数.(图中固定装置已略去,装置气密性良好,装置A、B中的试剂足量,注射器量程足够)Ⅰ.测量装置A、B的质量,排尽注射器中的空气,连接装置;Ⅱ.取质量为m的草酸晶体,加热至完全分解,将产物全部通入以上装置;Ⅲ.测量并记录装置A增加的质量为a,装置B增加的质量为b,装置C读数为V;Ⅳ.甲、乙、丙三位同学分别利用装置A、B、C所得数据计算该草酸晶体中结晶水的质量分数.请回答下列问题:(1)装置A中盛放的液体是_ __;装置B的作用是__ _;装置C的作用之一是测量__ _的体积.(2)乙同学对利用装置B测量结果计算的可靠性经行反思与评价,认为反应后装置A中残留的气体会使自己的计算结果__ _(填“偏小”或“偏大”).(3)甲同学依据装置A测量结果计算结晶水的质量分数为__ _(用代数式表示).4、【2019·绍兴押题】工业烧碱具有较好的杀菌消毒作用且廉价易得,但工业烧碱中常含有杂质碳酸钠。
工业纯碱中碳酸钠含量的测定

b、外界空气中的CO2和水蒸气可能进入装置
C、产生的CO2气体还有部分留在了装置中
改进后的装置:
②该实验中两次向装置中鼓入空气,两次的作用分别是:
第一次:排除装置中原有的CO2气体;
第二次:将反应产生的CO2全部从装置中排除;
③让空气先通过氢氧化钠溶液的目的:除去空气中的CO2气体
问题:请同学们设计获得m(Na2CO3)原理和方案,并说明你要测定的数据。
①加入过量的强酸→CO2排液→测V(CO2)
②加入过量的强酸→碱石灰吸收CO2→测m(CO2)
③加入过量Ba2+→过滤→洗涤→烘干→称量m(CaCO3)
⑤已知浓度的强酸至滴定完全→测定V(酸)
我以学生感兴趣的日常生活中的实例为突破口,抓住定量实验设计的步骤这一主线,将原理设计、方案的优化、装置步骤的设计与优化等一一串联起来。使学生更容易理解和形成知识网络。
在整个教学过程中,注意发挥学生的自主性和创造性,从而达到提高学生的分析问题和解决问题的能力,创设益于学生思维、探索的情境激发学生的学习兴趣,提高四十分钟的课堂效率,深化素质教育。
过渡:我们确定了实验方案之后,接下来就是实验步骤和装置的设计。
方案一:测CO2的质量
思考:①请从下图中的装置中选择适当的装置和试剂来完成CO2质量的测定。
学生讨论:
主要问题:
a、被CO2带出来的水蒸气被碱石灰吸收
b、外界空气中的CO2和水蒸气可能进入装置
C、产生的CO2气体还有部分留在了装置中
讨论解决:
小结:实验设计的一般步骤
明确目的、要求→实验原理设计→实验原理方案优化→定量实验步骤和装置的设计→定量实验步骤和装置的优化
综合计算
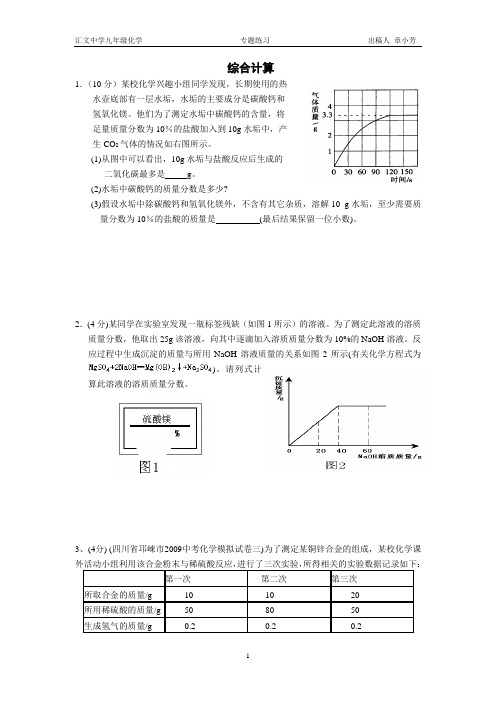
综合计算1.(10分)某校化学兴趣小组同学发现,长期使用的热水壶底部有一层水垢,水垢的主要成分是碳酸钙和氢氧化镁。
他们为了测定水垢中碳酸钙的含量,将足量质量分数为10%的盐酸加入到10g水垢中,产生CO2气体的情况如右图所示。
(1)从图中可以看出,10g水垢与盐酸反应后生成的二氧化碳最多是g。
(2)水垢中碳酸钙的质量分数是多少?(3)假设水垢中除碳酸钙和氢氧化镁外,不含有其它杂质,溶解10 g水垢,至少需要质量分数为10%的盐酸的质量是(最后结果保留一位小数)。
2.(4分)某同学在实验室发现一瓶标签残缺(如图1所示)的溶液。
为了测定此溶液的溶质质量分数,他取出25g该溶液,向其中逐滴加入溶质质量分数为10%的NaOH溶液。
反应过程中生成沉淀的质量与所用NaOH溶液质量的关系如图2所示(有关化学方程式为)。
请列式计算此溶液的溶质质量分数。
3、(4分) (四川省邛崃市2009中考化学模拟试卷三)为了测定某铜锌合金的组成,某校化学课外活动小组利用该合金粉末与稀硫酸反应,进行了三次实验,所得相关的实验数据记录如下:第一次第二次第三次所取合金的质量/g 10 10 20所用稀硫酸的质量/g 50 80 50生成氢气的质量/g 0.2 0.2 0.2(1) 试计算该铜锌合金中含锌的质量分数。
(2)所用合金与稀硫酸恰好完全反应时所得溶液中溶质的质量分数。
4. 某化学兴趣小组的同学对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所用的稀硫酸与铁样品恰好完(1).同学所用的稀硫酸与铁样品恰好完全反应 (2)计算样品中的铁的质量分数是多少?(3)计算恰好完全反应后所得溶液中溶质的质量分数?(烧杯质量为25.4克)5、为测定某Na 2CO 3样品(混有NaCl )中Na 2CO 3的质量分数,某同学设计了以下方案:称取 样品11.8 g 于烧杯中,加20g 水完全溶解后,向其中加入150g CaCl 2溶液,恰好完全反应, 过滤得到10 g 沉淀,试通过计算确定:(1)样品中Na 2CO 3的质量分数(精确到0.1%); (2)该同学过滤所得溶液中溶质的质量分数。
工业纯碱中常含有少量的NaCl等杂质,下图中的仪器装置可用来测定纯碱中Na2CO3的质量分数
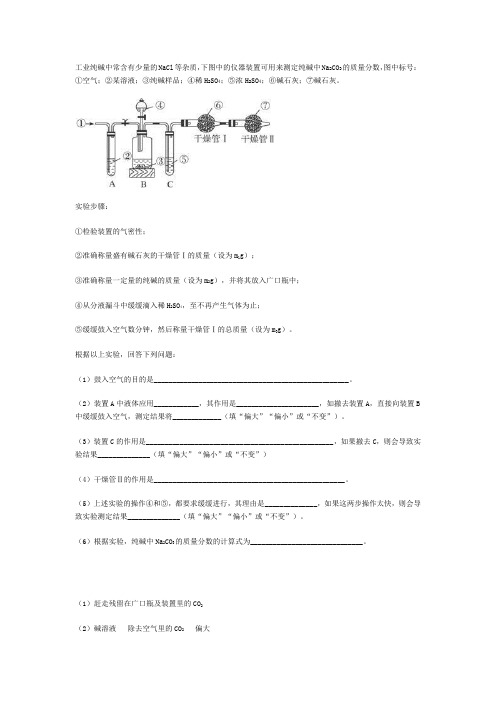
工业纯碱中常含有少量的NaCl等杂质,下图中的仪器装置可用来测定纯碱中Na2CO3的质量分数,图中标号:①空气;②某溶液;③纯碱样品;④稀H2SO4;⑤浓H2SO4;⑥碱石灰;⑦碱石灰。
实验步骤:①检验装置的气密性;②准确称量盛有碱石灰的干燥管Ⅰ的质量(设为m1g);③准确称量一定量的纯碱的质量(设为m2g),并将其放入广口瓶中;④从分液漏斗中缓缓滴入稀H2SO4,至不再产生气体为止;⑤缓缓鼓入空气数分钟,然后称量干燥管Ⅰ的总质量(设为m3g)。
根据以上实验,回答下列问题:(1)鼓入空气的目的是____________________________________________________。
(2)装置A中液体应用____________,其作用是______________________,如撤去装置A,直接向装置B 中缓缓鼓入空气,测定结果将_____________(填“偏大”“偏小”或“不变”)。
(3)装置C的作用是__________________________________________________,如果撤去C,则会导致实验结果______________(填“偏大”“偏小”或“不变”)(4)干燥管Ⅱ的作用是___________________________________________________。
(5)上述实验的操作④和⑤,都要求缓缓进行,其理由是______________,如果这两步操作太快,则会导致实验测定结果______________(填“偏大”“偏小”或“不变”)。
(6)根据实验,纯碱中Na2CO3的质量分数的计算式为______________________________。
(1)赶走残留在广口瓶及装置里的CO2(2)碱溶液除去空气里的CO2偏大(3)除去CO2中混有的水蒸气偏大(4)防止吸收空气中的CO2和H2O(g)进入干燥管Ⅰ(5)使反应产生的CO2能与碱石灰充分反应完全吸收偏小(6)×100%。
微专题8实验测定碳酸钠(碳酸氢钠)的质量分数

将样品与盐酸反应,生成的气体全部被
B
量气法 碱石灰吸收
碱石灰增加的质量
将样品放入烧瓶中,置于电子天平上,
C
重量法 加入足量盐酸
减少的质量
将样品与盐酸反应,气体通过排水量气
D
量气法 装置量气
排出水的体积
高考总复习第1轮 化学
返回导航
第三章 金属及其化合物
解析:用酚酞作指示剂达到滴定终点时,Na2CO3 与盐酸发生反应:Na2CO3 +HCl===NaCl+NaHCO3,依据消耗盐酸的量可以计算出样品中 Na2CO3 的量, 进而确定样品中 Na2CO3 的质量分数,A 正确;测量碱石灰增重的方法是重量法 而不是量气法,且碱石灰增重的质量还包括挥发的水和 HCl,B 错误;样品中加 入足量盐酸,因盐酸的质量未知,无法通过重量法测量 Na2CO3 的质量,C 错误; 因部分 CO2 能溶解到水里,与水反应生成 H2CO3,故排出水的体积并不是全部 CO2 的体积,D 错误。
__N_a_H__C_O__3 _的__质__量__分__数__测__定__结__果__偏__小__,__N_a_C__l _的__质__量__分__数__测__定__结__果__偏__大_________。
高考总复习第1轮 化学
返回导航
第三章 金属及其化合物
②E 处干燥管中盛放的药品是_碱__石__灰_,其作用是_防__止__空__气__中__的__C_O__2_和__水__蒸__气_ __进__入__D_中__影__响___测__定__结__果______,如果实验中没有该装置,则会导致测得的 NaHCO3 的质量_偏__大_(填“偏大”“偏小”或“无影响”)。
第三章 金属及其化合物
第三章 金属及其化合物
碳酸钠分数的测定
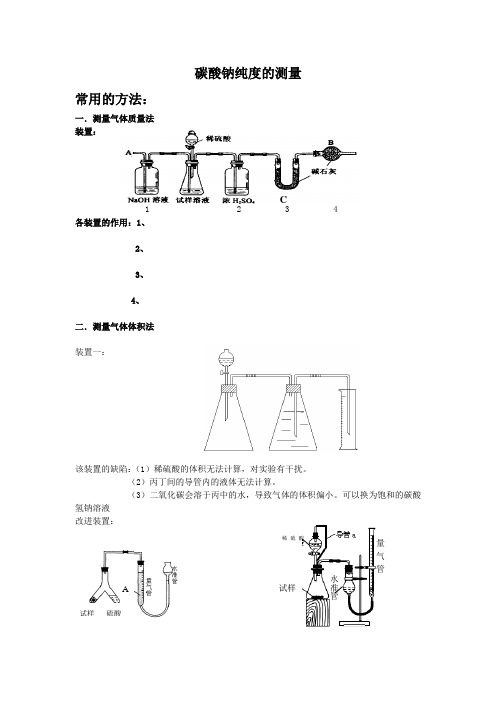
碳酸钠纯度的测量常用的方法:一.测量气体质量法装置:1 2 3 4各装置的作用:1、2、3、4、二.测量气体体积法装置一:该装置的缺陷:(1)稀硫酸的体积无法计算,对实验有干扰。
(2)丙丁间的导管内的液体无法计算。
(3)二氧化碳会溶于丙中的水,导致气体的体积偏小。
可以换为饱和的碳酸氢钠溶液改进装置:C 试样 硫酸 A 试样 稀硫酸量气管 水准管A为饱和碳酸氢钠溶液三.沉淀法步骤:1、取样品称量;2、加水溶解;3、加入足量沉淀剂氯化钡溶液或氯化钙溶液足量沉淀剂的目的:氯化钡溶液比氯化钙溶液好原因:沉淀剂不可以用氢氧化钙:4、过滤、洗涤、干燥、称量洗涤的目的:洗涤的装置名称:洗涤的方法:检验洗涤干净的方法:四.中和滴定法五、差量法;例题:为测定碳酸氢钠纯度(含有少量氯化钠),学生设计了如下几个实验方案(每个方案均称取m1 g样品),请回答每个方案中的问题。
[方案I]选用重量法进行测定:可用下图中的装置进行实验。
(1)A装置中NaOH溶液的作用是_________________,若直接向试样溶液中鼓人空气会导致实验测定结果________(填“偏高”、“偏低”或“无影响”)(2)该方案需直接测定的物理量是。
[方案II]选用滴定法进行测定:(3)称取m1 g样品,配成100mL溶液,取出20mL,用c mol/L的标准HCl溶液滴定,消耗体积为v mL,则该试样中碳酸氢钠质量分数的计算式为:[方案III]选用气体体积法进行测定:可用右图中的装置进行实验。
(4)为了减小实验误差,量气管中加入的液体X为(5)通过实验,测得该试样中碳酸氢钠质量分数偏低,产生这种现象的原因可能是_________ a.测定气体体积时未冷却至室温b.测定气体体积时水准管的水面高于量气管的水面c.Y型管中留有反应生成的气体d.气体进入量气管前未用浓硫酸干燥C试样硫酸X[(6)操作Ⅱ的名称是________________________(7)实验中需要的仪器有电子天平、蒸发皿、玻璃棒等,还需要的玻璃仪器是(8)在转移溶液时,如溶液转移不完全,则碳酸氢钠质量分数的测定结果_________(填“偏高”、“偏低”或“无影响”)答案(1)吸收空气中的CO 2,偏高(2)装置C 反应前后质量(3)(5×c ×v ×10-3×84 )/ m 1 (4)NaHCO 3(其他合理答案也可)(5)b (6)蒸发练习1、(全国卷I )已知某纯碱试样中含有NaCl 杂质,为测定试样中纯碱的质量分数,可用右图中的装置进行实验。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
热点题型4 纯碱样品中碳酸钠质量分数的测定
——科学探究与创新意识
[热点精讲]
1.气体法
(1)测定原理:Na 2CO 3+H 2SO 4===Na 2SO 4+H 2O +CO 2↑。
依据CO 2的体积确定Na 2CO 3的物质的量,进而确定其含量。
(2)实验操作:向m g 纯碱样品中加入足量的稀硫酸,准确测量产生CO 2气体的体积为V mL(已折算为标准状况)。
(3)数据处理
纯碱样品中Na 2CO 3的质量为V 22 400 mol ×106 g ·mol -1=106V 22 400
g ,则纯碱样品中Na 2CO 3的质量分数为106V 22 400 g m g ×100%=53V 112m
%。
2.沉淀法
(1)测定原理:Na 2CO 3+BaCl 2===BaCO 3↓+2NaCl 。
依据BaCO 3沉淀的质量,确定Na 2CO 3的物质的量,进而确定其含量。
(2)实验操作:先将m g 纯碱样品溶于水配成溶液,向溶液中加入过量的BaCl 2溶液,经过滤、洗涤、干燥得 BaCO 3 沉淀的质量为n g 。
(3)数据处理
纯碱样品中Na 2CO 3的质量为n g 197 g ·mol
-1×106 g ·mol -1=106n 197 g ,则纯碱样品中Na 2CO 3的质量分数为106n 197 g m g ×100%=106n 197m
×100%。
[热点精练]
1.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl),准确称量W g 样品进行实验,下列实验方法所对应的实验方案和测量数据合理的是( )
气
解析:选A。
用酚酞做指示剂时,Na2CO3与盐酸发生反应Na2CO3+2HCl===2NaCl+CO2↑+H2O,依据消耗盐酸的量可以计算出样品中Na2CO3的量,进而确定样品中Na2CO3的质量分数,A项正确;测量碱石灰增重的方法是重量法而不是量气法,B项错误;样品中加入足量盐酸,因盐酸的质量未知,无法通过重量法测量Na2CO3的质量,C项错误;因部分CO2能溶于水,与水反应生成H2CO3,故排出水的体积并不是CO2的体积,D项错误。
2.为了测定NaCl、Na2CO3·10H2O和NaHCO3的混合物中各组分的含量,某同学设计如下实验:取一定质量的混合物,通过测量反应前后②和③装置质量的变化,测定该混合物中各组分的质量分数。
下列说法中错误的是()
A.①②③中可以依次盛装碱石灰、无水CaCl2、碱石灰
B.硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止
C.若将①装置换成盛放NaOH溶液的洗气瓶,则测得的NaCl含量偏大
D.实验过程中一直通入空气,停止加热后再停止通入空气
解析:选C。
根据实验目的和装置的连接顺序可知,装置①用于吸收空气中的CO2和水蒸气,可以使用碱石灰;装置②吸收Na2CO3·10H2O和NaHCO3分解生成的水蒸气,可以使用无水CaCl2;装置③吸收碳酸氢钠分解生成的CO2,使用碱石灰,A项正确;实验前必须将装置中的水蒸气和CO2赶尽,避免影响测定结果,硬质玻璃管加热前,应关闭b,打开a,缓缓通入空气,直至a处出来的空气不再使澄清石灰水变浑浊为止,B项正确;若将①装置换成盛放NaOH溶液的洗气瓶,则会增加水的质量,使测得Na2CO3·10H2O和NaHCO3的含量偏高,NaCl的含量偏低,C项错误;实验过程中一直通入空气,停止加热后再停止通入空气,D项正确。
