水的pH值调整及计算
水处理调节ph值加药量计算

以NaOH控制PH值
参数
7.00
7.00
40 g/mol
1.00E-07 mol/l 1.00E-07 mol/l PH=
7.00
10.00%
0.0000 g/l
需反应的离子量
【H】 【H】加入 浓度 加药量
1.00E-07 mol/l 0.00E+00 mol/l PH=
5.00% 0.0000 g/l
PH(原始) PH(要求) H2SO4 【H】 【OH】 浓度 加药量
以H2SO4控制PH值
参数
7.00
7.00
98 g/mol
1.00E-07 mol/l 1.00E-07 mol/l PH=
7.00 需反应的离子量
5.00%
0.0001 g/l
PH(原始) PH(要求)
NaOH 【H】 【OH】 浓度 加药量
参数 7.00
7.00
36.5 g/mol 1.00E-07 mol/l 1.00E-07 mol/l PH= 7.00 需反应的离子量
10.00% 0.0000 g/l
合计加药量
PH(原始) PH(要求) CaOH 【H】 【OH】 浓度 加药量
0.0000 g/l PH由 7.00 到 7.00 的加药量 以Ca(OH)2控制PH值
参数 7.00
7.00
74 g/mol 1.00E-07 mol/l 1.00E-07 mol/l PH= 7.00 需反应的离子量
10.00% 0.0000 g/l
【H】 【H】加入 浓度 加药量
1.00E-07 mol/l 0.00E+00 mol/l PH=
10.00% 0.0000 g/l
酸碱平衡及其PH值计算

c(H 3O ) c(NH 3 )
c(
NH
4
)
5.6
1010
HS- + H2O
H3O+ + S2-
K
a
(HS
)
c(H 3O ) c(S c(HS )
2
)
7.1 1015
K
a
越大,酸的强度越大,由
K
a
(HAc)
>
K
a
(NH
4
)
>
K
a
(HS
由二级平衡: HS平衡浓度: 1.1 10-4
H+ + S2-
1.1 10-4
y
K1/K2>102 可做一元
弱酸处理
Ka2 = [H+][S2-]/[HS-] = 7.1 10-15 y = Ka2 = [S2-] = 7.1 10-15
酸根离子浓度 近似等于二级
电离常数
结论:
多元弱酸中,若K1K2K3…,通常K1/K2>102,求[H+] 时, 可做一元弱酸处理。
加入1滴(0.05ml) 1mol·L-1 NaOH
50ml纯水pH = 7
pH = 3
pH = 11
50mLHAc—NaAc
[c(HAc)=c(NaAc)=0.10mol·L-1]
pH = 4.74
pH = 4.73
pH = 4.75
缓冲溶液:具有能保持本身pH值相对稳定性能的溶液 (也就是不因加入少量强酸或强碱而显著改变pH值的溶液)。
称为碱的解离常数。K
b
越大,碱的强度越大。一
水的电离和溶液的酸碱性之PH值的计算(上课用)

练习:
1、下列关于盐酸与醋酸两种稀溶液的说法正确的 是( )
B
A.相同浓度的两溶液中c(H+)相同
B.100mL0.1mol/L的两溶液能中和等物质的量的 氢氧化钠 C.pH=3的两溶液稀释100倍,pH都为5
D.两溶液中分别加入少量对应的钠盐,c(H+)均明 显减小
2、常温下,有pH=12的NaOH 溶液100 mL,若将 其pH变为11。(下列混合溶液体积变化不计,保 留1位小数。) ①若用水,应加入 900 mL; ②若用pH=10的NaOH 溶液,应加入 1000 mL ③若用pH=2的盐酸溶液,应加入 900/11 mL
= —lg (Kw) = —lg (1×10—14) = 14
1、简单计算:
例1、求25 ℃时 10-5mol/L、0.1mol/L、 1mol/L盐
酸的pH分别为多少?
5、1、0
例2、求25 ℃时 10-5mol/L、0.1mol/L、1mol/LNaOH溶 液的pH分别为多少?
解法1: 解法2:
六、溶液PH值的计算
问 题 类 型
1、简单计算 2、酸碱混合计算问题 3、酸碱溶液稀释问题
【知识回顾】
pH值的计算方法:
pH= —lg c(H+) pOH= —lg c(OH )
— —
pOH + pH = —[lg c(OH )+ lg c(H+) ]
= —lg [c(OH )· c(H+) ]
—
稀释后所得溶液的PH 5 4 9 10 ≠8 约为7 ≠6 约为7
pH=5的稀盐酸加水稀释1000倍
pH=9的NaOH溶液加水稀释1000倍
(1)、强酸或强碱:在水中完全电离,加水稀释后不 会有溶质进一步电离,故仅仅是体积增大的因素导 致酸溶液中的C(H+)或碱溶液中的C(OH- )减小。
水质管理——PH值的调整方法【精选文档】

水质管理--PH值的调整方法调整PH的目的养鱼先养水,这句话大家不陌生,但是怎么理解这句话的真正含义呢?我的理解是:养水是指养殖用水的内在质量。
我们用来“养水"的办法很多,比如,建立健全的硝化系统,培养出优质硝化细菌,水中添加氧气,和各类营养成分,通过检测毒素和微量元素而达到控制水中各种物质的含量,我们也可以借助其他一些手段间接观测水的质量。
比如pH值(KH GH NH3+NH4 NO2 NO3 )测量.那我们测量pH值得目的是什么呢?为什么要测量ph值?如果pH值不合乎我们鱼类的最佳生存要求怎么办?是不是直接调节pH值或是加入一些物质调节就可以呢?下面我与大家一起思考.在我们养鱼水中,如果pH值出现了波动,那肯定是水质出现了变化而带动了pH值发生了变化,如果此时直接调节pH值再标准也不能解决水质的问题,虽然pH值调到了正常,但是水中的硝酸盐或其他有毒物质不但不会减少的,相反有的会因为pH的变动而加速累计.关于水质的好坏与pH值的测量,我引用一句话说明,可能不是很恰当,但愿能说明白问题,-—“醉翁之意不在酒,而在于水体之中".我们监测pH值的目的也不是在于单纯调节指数的高和低,,而是通过其指数的高低知道水质的变化情况,从而调整好水质,用调整好的水来改变pH值。
所以现在很多鱼友测量pH值的目的,是为了调节pH值而调节pH值,是非常错误的,是不懂其养水的原理而为之。
尤其是调节跌酸水质,更不能单单的从pH值上下手,他需要一个有主有次综合的办法去调理水质,首先要弄明白在养殖水中跌酸的的根本原因是什么,再从根本上下手.看看是否因为硝化细菌数量增多,氧化作用下生成的硝酸过多,溶于水后产生H+使水质变酸,最终积累下硝酸盐水质老化的原因,还是因为其他什么原因。
只有找到根本原因才能对症下药。
硝化系统引起的跌酸在弄明白了跌酸的主要原因后,针对其做出动作,而不是一概而论的。
先谈谈主要的吧——硝化系统过强而引起的跌酸:在治理本质的基础上(降低硝化作用)的同时,还要注意一些辅助手段,减少氨源,(换水)加强水体KH值,KH值不等于暂时硬度,他是形成暂时硬度的必要条件,它在水中的作用主要是缓冲PH值的变化,KH值之所以起到缓冲作用,是因为HCO3能发生可逆的水解平衡反映。
水的PH值调整计算书
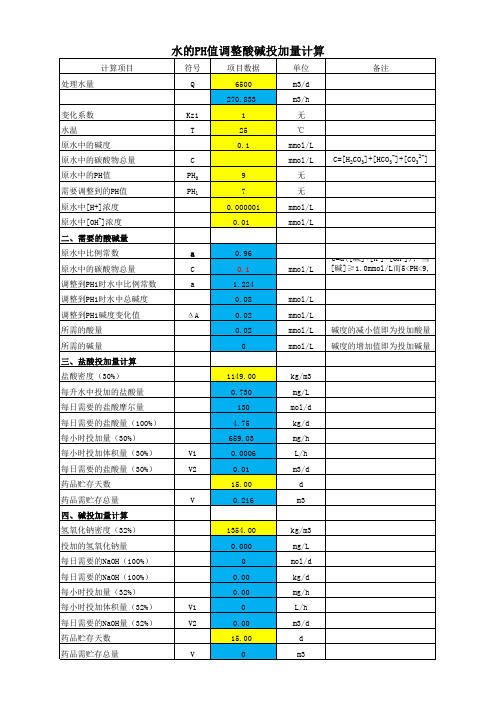
计算项目符号项目数据单位处理水量Q6500m3/d270.833m3/h 变化系数Kz11无水温T25℃原水中的碱度0.1mmol/L原水中的碳酸物总量C mmol/L 原水中的PH值PH09无需要调整到的PH值PH17无原水中[H+]浓度0.000001mmol/L 原水中[OH-]浓度0.01mmol/L 二、需要的酸碱量原水中比例常数a0.96原水中的碳酸物总量C0.1mmol/L 调整到PH1时水中比例常数a 1.224调整到PH1时水中总碱度0.08mmol/L 调整到PH1碱度变化值ΔA0.02mmol/L 所需的酸量0.02mmol/L 所需的碱量0mmol/L 三、盐酸投加量计算盐酸密度(30%)1149.00kg/m3每升水中投加的盐酸量0.730mg/L 每日需要的盐酸摩尔量130mol/d 每日需要的盐酸量(100%) 4.75kg/d 每小时投加量(30%)659.03mg/h 每小时投加体积量(30%)V10.0006L/h 每日需要的盐酸量(30%)V20.01m3/d 药品贮存天数15.00d药品需贮存总量V0.216m3四、碱投加量计算氢氧化钠密度(32%)1354.00kg/m3投加的氢氧化钠量0.000mg/L 每日需要的NaOH(100%)0mol/d 每日需要的NaOH(100%)0.00kg/d 每小时投加量(32%)0.00mg/h 每小时投加体积量(32%)V10L/h 每日需要的NaOH量(32%)V20.00m3/d 药品贮存天数15.00d药品需贮存总量V0m3C=[H2CO3]+[HCO3-]+[CO32-] C=a([碱]+[H]+[OH]);当[碱]≥1.0mmol/L而5<PH<9,碱度的增加值即为投加碱量碱度的减小值即为投加酸量水的PH值调整酸碱投加量计算备注。
有关pH值计算及判断”

pH值计算及判断[要点扫描]1.单一溶液的pH值计算2.酸酸混合或碱碱混合溶液pH值计算3.酸碱混合(pH值之和为14)①强酸和强碱②强酸和弱碱③弱酸和强碱[知识梳理]1.在应用pH值计算时,首先要注意体系的温度,一般不作说明通常是指,随着温度的升高,水的电离被,水的离子积Kw ;2. 常温下,在任何水溶液中都存在水的电离,此时溶液中水的离子积均为同一常数,它是;3. 强酸溶液每稀释10倍pH值一个单位,而弱酸溶液稀释10倍pH值改变一个单位;强碱溶液每稀释10倍pH值一个单位;4. 两种不同pH值的强酸混合时先计算溶液中的浓度的变化,再转换为pH值;两种不同pH值的强碱混合时先计算溶液中的浓度变化,再根据水的离子积计算出浓度最后再转换为pH值;当一种强酸(或强碱)与另一种弱酸(或弱碱)混合时,要注意强酸(或强碱)和稀释对弱酸(或弱碱)电离的影响.5. 酸碱混合时首先考虑发生的中和反应,酸碱按反应方程式中化学计量数的比(物质的量之比)反应,反应需要量与酸碱是否完全电离基本无关,是否完全电离只影响到酸碱中和反应的和反应后溶液的性;6. 常温下pH+pOH=14[例题解析]例1.在同体积pH=3的H2SO4、HCl、HNO3、CH3COOH溶液中,加入足量锌粉,以下说法正确的选项是:( )A H2SO4中放出H2最多B 醋酸中放出H2最多C HCl和HNO3放出H2一样多D HCl比HNO3放出H2少例2.在1升浓度为c摩/升的弱酸HA溶液中,HA、H+和A-的物质的量之和为nc摩,那么HA的电离度是( )(A)n×100% (B)n×100%/2 (C)(n-1)×100% (D)n%例3〔06某某理综10〕以下关于电解质溶液的表达正确的选项是A.常温下,pH=7的NH4Cl与氨水的混合溶液中离子浓度大小顺序为c〔Cl-〕>c〔NH4+〕>c〔H+〕>c〔OH-〕B.将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低C.中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同D.常温下,同浓度的Na2S与NaHS溶液相比,Na2S溶液的pH大例4.〔06年某某市一模,7〕常温时,纯水中由水电离的c(H+)=a,pH=1的盐酸中由水电离的c(H+)=b,0.2mol•L-1的盐酸与0.1mol•L-1的氢氧化钠溶液等体积混合后,由水电离的c(H+)=c,那么A、B、c的关系正确的选项是A.a>b=c B.a>c>b C.c>b>a D.b>c>a例5. 某温度下纯水的c〔H+〕=2.0×10-7mol/L。
溶液PH值的计算

第二节水的电离和溶液的酸碱性 第二节水的电离和溶液的酸碱性
一、单一液体PH值的计算 单一液体PH值的计算 PH 0.1mol/L的HCl溶液中 溶液中, 1. 0.1mol/L的HCl溶液中,C(H+)=1×10-1 × PH= ___ 1 求酸PH, 直接求 直接求C(H+). 求酸 溶液中, 2、0.05mol/L的Ba(OH)2溶液中, 0.05mol/L的
பைடு நூலகம்
1 .将PH相同的盐酸和醋酸分别稀释到原来的 将 相同的盐酸和醋酸分别稀释到原来的 m倍和 倍,已知稀释后两溶液的 相同,m 倍和n倍 已知稀释后两溶液的 相同, 已知稀释后两溶液的PH相同 倍和 和n的关系为:( C ) 的关系为:( 的关系为 A m=n B m>n C m<n D 无法确定 2 .将物质的量浓度相同的盐酸和醋酸分别稀释 将物质的量浓度相同的盐酸和醋酸分别稀释 到原来的m倍和 倍和n倍 已知稀释后两溶液的 已知稀释后两溶液的PH相 到原来的 倍和 倍,已知稀释后两溶液的 相 的关系为:( 同,m和n的关系为:( B ) 和 的关系为 A m=n B m>n C m<n D 无法确定
pH值计算1 pH值计算1—— 强酸的稀释 值计算 例题: 值等于5的盐酸溶液 例题:在25℃时,pH值等于 的盐酸溶液 ℃ 值等于 (1)稀释到原来的 倍,pH 值等于多少? 6 稀释到原来的10倍 值等于多少? 稀释到原来的 (2)稀释到 稀释到1000倍后, pH值等于多少? 7 倍后, 值等于多少? 稀释到 倍后 值等于多少 强酸溶液的稀释 直接求稀释后C(H+), 再求 . 溶液的稀释, 再求PH. 强酸溶液的稀释,直接求稀释后 pH值计算 值计算2 pH值计算2—— 强碱的稀释 例题: 25℃ pH值等于 值等于9的强碱溶液 例题:在25℃时,pH值等于9的强碱溶液 稀释到原来的10倍 值等于多少? (1) 稀释到原来的 倍,pH 值等于多少? 8 (2) 稀释到 稀释到1000倍后, pH值等于多少? 7 倍后, 值等于多少? 倍后 值等于多少 强碱溶液的稀释 先求稀释后C(OH-),然后用KW求 溶液的稀释, 然后用K 强碱溶液的稀释,先求稀释后 然后用 再求PH. C(H+),再求 . 再求 无论稀释多少倍,溶液的PH只能接近7 酸的PH 无论稀释多少倍,溶液的PH只能接近7,酸的PH PH只能接近 永远小于7,碱的PH永远大于7 7,碱的PH永远大于 永远小于7,碱的PH永远大于7
饮用水ph值标准

饮用水ph值标准饮用水是人类日常生活中必不可少的一部分,而水的PH值则是评价水质的一个重要指标。
PH值是指水溶液中氢离子活度的负对数,通常用来表示水的酸碱度。
饮用水的PH值标准对人体健康有着重要的影响,因此我们需要了解饮用水的PH值标准及其对人体的影响。
首先,根据世界卫生组织的标准,饮用水的PH值应该在6.5-8.5之间。
这个范围内的水被认为是对人体健康无害的,能够满足人体的日常饮水需求。
当水的PH值低于6.5时,水呈酸性,可能会对人体的肠胃系统造成一定程度的刺激,长期饮用会影响人体的健康。
而当水的PH值高于8.5时,水呈碱性,也会对人体的健康造成影响,可能引起胃肠道问题。
其次,不同PH值的水对人体的影响也是不同的。
在PH值为7左右的中性水中,人体的吸收能力最强,对身体的影响最小。
而当水的PH值偏向酸性或碱性时,就会对人体产生一定的影响。
例如,酸性水可能会导致胃酸增多,引起消化不良,而碱性水可能会导致身体过于碱化,影响人体的代谢和免疫功能。
此外,饮用水的PH值也会影响水的口感。
一般来说,PH值在6.5-8.5之间的水口感最好,清爽宜人。
而酸性水味道会比较刺激,碱性水则会显得有些苦涩。
因此,为了保证饮用水的口感和健康,我们应该选择PH值适宜的水进行饮用。
针对不同PH值的水,我们可以采取一些措施进行调整。
例如,对于酸性水,可以通过加入一定量的碱性物质(如小苏打)来调整水的PH值;而对于碱性水,则可以通过加入一些酸性物质(如柠檬汁)来进行调整。
但需要注意的是,调整水的PH值需要谨慎,以免对水质造成其他影响。
总的来说,饮用水的PH值标准是对人体健康至关重要的。
了解和控制饮用水的PH值,可以有效保障我们的健康。
因此,在日常生活中,我们应该选择符合PH值标准的饮用水,并注意保持水质的稳定,以保障自己和家人的健康。
希望每个人都能喝到健康的水,保持健康的生活方式。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
水的pH值调整及计算
碳酸化合物的一级电离
[ H+][HCO3]
CO2 =
K1
推导公式为:
CO2
[ H+] = K1
[HCO3]
已知25℃时,K1=4.45×10-7,Pk = 6.35 ,可以得出
pH = 6.35+Lg[HCO3] - Lg[CO2]
如果pH值大于8.3,产生二级电离
[HCO3]
[ H+] = K2
[CO32-]
已知25℃时,K2=4.69×10-11,Pk = 10.329 ,可以得出pH = 10.329+Lg[HCO3]- Lg[CO32-]
1、原水中CO2二氧化碳的计算
CO2 =
注:式中pH(R) 为原水
的pH值
举例运算:如用户填入HCO3(以CaCO3计)为350mg/L(以CaCO3计),那么原水中的CO2二氧化碳含量计算为:
CO2 =350÷(10 7.0-6.3)=350÷100.7=69.83 mg/L(以CO2计)
注:用户没有进行pH值的调整的需求,可直接根据公式计算输出结果。
如果用户调整pH 值,则需重新计算。
因为加入硫酸和盐酸后会改变HCO3、SO4、Cl 的离子含量,影响CO2含量。
所以当用户需要调整pH值,则Feed CO2含量需重新计算。
原理如下:H2SO4+2HCO3- 2CO2+2H2O+SO42-
HCl+HCO
3- CO
2
+H
2
O+Cl-
以盐酸为例:
HCl+HCO
3- CO
2
+H
2
O+Cl-
36.5 61 44 18 35.5
每加1mg/L的盐酸(100%)产生1.205mg/L的CO2,同时减少1.37mg/L的HCO3(以CaCO3计)。
推导公式为:
[HCO3]
pH=6.35+Lg R = 6.35+Lg
[CO2]
CO2= [HCO3] ×10 6.3-pH
代入公式中
[HCO3]-1.37[HCL]
HCO3(以CaCO3计)
R =
[CO 2] +1.205[HCL ]
得到
HCl 投加量 = 2、加酸量的计算及Feed Water (膜系统进水)水质数据的修正。
***.** mg/L as HCl 或 ***.** mg/L as
投加盐酸(HCl )的计算公式: HCl 投加量 = 注:公式中的HCO 3(R )是指原水中的含量,但是单位必须是(以CaCO 3计)的含量数据。
pH(T)是指用户所设定的pH 值,而pH(R)是指原水的pH 值。
投加盐酸(H 2SO 4)的计算公式 : H 2SO 4投加量=
注:公式中的HCO 3(R )是指原水中的含量,但是单位必须是(以CaCO 3计)的含量数据。
pH(T)是指用户所设定的pH 值,而pH(R)是指原水的pH 值。
举例计算: 假设用户输入的Raw water 的HCO 3含量为430ppm ,Cl 离子含量为119.8 ppm ,SO 4离子含量为130 ppm ,pH 值为7.0,而其想控制Feed water 的pH 值为5.5,选择加入两种酸类的情况是什么?加入不同的酸类后,调整修正的参数又有哪些?怎样计算? 解:1、首先将Raw water 的HCO 3含量430ppm 的单位转换为(以CaCO 3计)。
430ppm ×0.819(转换系数)=352.17mg/L(以CaCO 3计)
2、如果加入盐酸(HCl )所需要的量
HCl = =218.39 mg/L as HCl (100%)
加入盐酸(HCl )后,Feed water 水质需修正的参数: 公式1: HCO 3(F )= HCO 3(R )-1.37×HCl
= 352.17-1.37×218.39 mg/L
= 52.98 mg/L (以CaCO 3计)= 52.98 mg/L (以
CaCO 3计)÷0.819 = 64.69ppm
公式2: CO 2(F )= CO 2(R )+1.205×HCl 由于 CO 2(R )的参数需计算,导出公式CO 2(R ) = 那么 CO 2(R )= 352.17÷(10 7.0-6.3)=70.27 mg/L (以CO 2计) ,将此值
代入公式。
CO 2(F )= 70.27 mg/L +1.205×218.39 mg/L = 333.43 mg/L (以CO 2
计)
公式3: Cl (F )= Cl (R )+0.973×HCl
=119.8pp m +0.973×218.39 mg/L = 332.29ppm
注意:进水Feed water 的TDS 值按照修正的参数重新标定。
计算过程中精度保持在小数点后两位,第三位四舍五入。
HCO 3(R )×(1-10pH(T)- pH(R))
1.205×10pH(T) - 6.3+1.37
HCO 3(R )×(1-10pH(T)- pH(R))
0.898×10pH(T) - 6.3
+1.02 352.17×( 1-105.5 - 7.0)
1.205×105.5 - 6.3 +1.37
HCO 3(以CaCO 3计)
10 pH (R )-6.3 HCO 3(R )×(1-10pH(T)- pH(R))
1.205×10pH(T) - 6.3+1.37
3、如果加入盐酸(HCl )所需要的量
H 2SO 4 = = 293.37 mg/L as H 2SO 4 (100%) 加入盐酸(HCl )后,Feed water 水质需修正的参数:
公式1: HCO 3(F )= HCO 3(R )-1.02×H 2SO 4
=352.17-1.02×293.37mg/L=52.94 mg/L (以CaCO 3计)÷0.819=64.63 ppm
公式2: CO 2(F )= CO 2(R )+0.898×H 2SO 4
= 70.27 mg/L +0.898×293.37 mg/L =333.72 mg/L (以CO 2计)
公式3: SO 4(F )= SO 4(R )+0.98×H 2SO 4 =130 pp m +0.98×293.37 mg/L=417.50 ppm
注意:进水Feed water 的TDS 值按照修正的参数重新标定。
计算过程中精度保持在小数点后两位,第三位四舍五入。
352.17×( 1 - 105.5 - 7.0) 0.898×105.5 - 6.3 +1.020。
