复习(水环境化学)1
水环境化学复习重点

水环境化学复习重点绪论水体(水质系):水以及水中悬浮物、溶解性物质、水生生物、底泥在内的一个完整的综合体系。
水质:指水及其中所存在的各类物质(包括物理、化学物质及生物)所共同表现出来的综合特性(物理、化学和生物学)。
水环境化学:主要研究水中的化学物质,包括各种污染物在水体中的环境行为及化学过程关系等的科学我国水资源现状:•循环利用率比发达国家低50%•人均水资源≈美国同比的1/4•我国大中等城市2/3缺水•100多座城巿废水排放超标82%•75%的湖泊富营养化•我国东部、南部地区水资源相对比较丰富,而西部、北部地区水资源比较缺乏•缺水:水量、分布不均、水质型(污染)水环境与水产养殖的关系:水产养殖讲授天然水中存在的物质的种类、形态、迁移转化的规律。
掌握这些规律,可以指导我们进行养殖水质的调控,帮助我们进行有关水域生态学的研究。
一个地区水产养殖业的发展,不能超越水域环境的自净能力,过度的发展,养殖废水无任何处理地向自然水体、包括海域排放,将加速水域富营养化,恶化水质,引起疾病传播。
水产养殖的稳产高产离不开养殖水环境的调控。
水质的好坏直接影响到水产平的质量与产量。
如:①盲目施用氮肥造成氨中毒,使全池种鱼死亡。
②杀灭浮游动物引起气泡病,造成夏花鱼苗大量死亡。
③水质变坏后盲目大量投放鱼种造成损失。
第一章天然水中主要离子:4种阳离子(Ca2+,Mg2+,Na+,K+)和4种阴离子(HCO3^2-,CO3^2-,SO4^2-,Cl-)☆含盐量:指天然水中含有可溶性无机盐为主的物质总量,以∑S表示,是判定天然水性质的依据。
(是天然水的一项重要水质指标,反映天然水含盐量的参数通常有离子总量(ST)、矿化度(TDS)、盐度(S%0)和氯度(Cl%0)。
)☆盐度:当海水中的碘和溴被相当量的氯所取代、碳酸盐全部变为氧化物、有机物完全氧化时,海水中所含全部固体物的质量与海水质量之比,以10^-3或%0为单位,用符号S%0表示。
水环境化学1
α0 , α1 , α2为分布系数,与pH 有关。
因此封闭碳酸体系各主要形态与pH有关,而CT与pH无关
④开放碳酸体系特点及各主要形态计算 特点: * CT ≠常数 * [H CO *]总保持与大气相平衡的固定数值 2 3 即:[CO 2 (aq)] = KH p CO 2
CT = [H2CO 3 *] /α0 =[CO 2 (aq)] /α0 = KH p CO 2 /α0 [HCO 3 - ] = α1KH p CO 2 /α0 = K1 KH p CO 2 / [H+ ]
(3)水生生物
自养 异养
几个问题 天然水中主要离子总量可以粗略地作为TDS
A.名词—总含盐量(TDS)(≡总溶解固体量)
TDS=[Ca 2 + +Mg 2 + + Na+ +K+ ]+ [HCO3 - + SO4 2 - +Cl - ]
总含盐量 (总溶解固体量)为1000~10000 mg/L
的天然水称为咸水(淡水的总含盐量< 1000mg/L)
[CO32-] = K2[HCO3-] / [H+]
(2)
= 4.69×10-11×1.00×10-3 /1.00×10-8
= 4.69 ×10-6mol.L-1
例2
若 水 体 pH 升 高 到 10.00, 碱 度 仍 保 持
1.00×10-3 mol•L-1 ,再计算该水体中各碱度 成分的浓度。 碱度 = [ HCO3-] + 2[CO32-] + [ OH-]( mol.L-1) [OH-] = 1.00×10-4 mol.L-1
查表3-1(教材P102),氧气在25℃水中的亨利常数 KO2=1.28×10-8moL/(L· Pa) 则根据亨利定律,氧气在水中的溶解度为: [O2(aq)]=KO2· 2=1.28×10-8×0.2029×1.013×105 PO =2.63×10-4moL/L 由于氧的分子量为32,所以其溶解度为8.4mg/L或8.4PPm. 结论:25℃时 [O2(aq)]=8.4mg/L 问:若已知25℃湖水中溶解氧浓度为0.32 mg/L,大气中氧的分压 为多少?
环境化学水环境化学第一节

氧气溶解度随着温度的升高而降低:
Lg(C2/C1) = △H / (2.303R) ( 1/T1 - 1/T2 )
当温度从0 ℃升到35 ℃时,氧在水中的溶解度将从 14.74mg/L降低到7.03mg/L。
自学 CO2 的溶解度
pCO2 =(1.0130-0.03167)×105×3.14×10-4 = 30.8 (Pa) [CO2(aq)] = KH ·pCO2 = 3.34×10-7×30.8 = 1.028×10-5 mol·-1 L CO2在水中离解,则: [H+] = [HCO3-] [H+]2/[CO2] = K1 = 4.45×10-7 [H+] =(1.028×10-5× 4.45×10-7)1/2 = 2.14×10-6 mol·-1 L [HCO3-] =[H+] =(1.028×10-5×4.45×10-7)1/2= 2.14×10-6mol·-1 L pH = 5.67 故CO2在水中的溶解度应为[CO2] + [HCO3-] = 1.24×10-5mol·-1 L
一种气体在液体中的溶解度正比于液 体所接触的该种气体的分压。
氧在水中的溶解度与水的温度、氧在水中的分压及水中含盐 量有关。在1.0130×105Pa、25℃饱和水中溶解度为8.32mg/L。
水在25℃时的蒸气压为0.03167×105Pa。而空气中 氧的含量为20.95%, 氧的分压为: pO2=(1.10310 –0.03167)×105×0.2095=0.2065×105 代入亨利定律即可求出氧在水中的摩尔浓度为: [O2(aq)]=KH · O2 p =1.26×10-8×0.02065×105=2.6×10-4 氧的分子量为32,因此其溶解度为8.32mg/L
水环境化学复习资料.pdf

水环境化学研究水体化学物质的来源、存在形态、迁移转化、生态效应及污染水体的治理方法等。
1000g海水中含有盐类物质35g,含盐量为3.5%配置3.5gY盐→96.5g水海中的鱼为什么不会死亡?海洋中的植物为什么能生存?鱼鳃中有一种泌氯细胞(氯化物分泌细胞),具有把盐分排出体外的功能。
海洋中植物在汲水的时候,植物细胞也有排出盐分的功能。
所以我们吃的鱼、贝、虾、蟹和海带、紫菜等海洋生物时并不感到咸味。
植物通过细胞渗透压控制离子的进入,可以排出盐分;动物通过主动运输、泌氯细胞吧盐分排出体外。
把海水转化为淡水有哪些方法?蒸馏法(成本高、消耗大量能源、效率较低)、膜分离法世界上最大的湖欧亚大陆的里海(咸水)里海是世界上最大的湖泊,死海是世界陆地表面最低点,贝加尔湖是世界上最深的湖泊,巴尔喀什湖一半是淡水,一半是咸水中国:(咸水/内陆)青海湖(淡水)鄱阳湖陌生的岛上如何获取淡水?地下水、大气水、生物水证明大气中有水?从冰箱中拿出的饮料罐外壁有水珠地球上淡水总储量最多的水体是冰川海洋水、陆地水、大气水的划分依据是水的空间分布目前,人类能利用的淡水主要是江河水、淡水湖泊和浅层地下水1993年确定了世界节水日3月22日地球上的水存在的主要形式是固体水的分子结构:不是直线型水分子特点:1.极性很大,表面张力大、相似相溶;2.分子间有很强的氢键,熔沸点高,水结冰体积变大,保证了地球生物的存活水的基本性质:1.物理性质:沸点(373K)和冰点(273K,随压强的增大而降低)、蒸发热、密度(277K4℃最大,)、表面张力、比热1Cal·K-1·kg-1)、介电常数和偶极矩(水在常温下能够溶解离子型化合物的少数溶剂之一)2.化学性质:水的化学稳定性、水合作用、水的电离、水解水的某些异常性质及其意义性质特点意义状态一般为液态提供生命介质、流动性热容非常大良好的传热介质,调节环境和有机体的温度熔解热非常大使水处于稳定的液态,调节水温蒸发热非常大对水蒸气的大气物理性质有意义,调节水温密度4℃极大水体冰冻始于表面,控制水体中温度分布,保护水生生物,水的反膨胀性质具有重要影响和意义,对水生动植物的生存和繁衍极其关键表面张力非常大生理学控制因素,控制液滴等表面现象介电常数非常大高度溶解离子性物质并使其电离水合非常广泛对污染物是良好溶剂和载体,改变溶质生物化学性质离解非常少提供中性介质透明度大透过可见光和长波紫外线,在水体深处可发生光合作用广义上的水指处于自然界中的所有的水,具有水的所有特征和性能。
第3章水环境化学1

可从CO2的酸离解常数K1计算出:
[H+]= [HCO3-]
[H+]2/[CO2] =k1=4.45×10-7
[H+]=2.14×10-6 mol/L
pH=5.67
故CO2在水中的溶解度应为[CO2]十[HCO3-]=1.24×l0-5 mol/L。
第二十一页,共68页。
★⑷水生生物:
水生生物体可分为自养生物和异养生物。
pG=(p标-p水蒸汽)×V%
式中:KH:各种气体在一定温度下的亨利定律常数;pG:各 种气体的分压。
但是:亨利定律不能说明气体在溶液中进一步的化学反应 ,如:
H2CO3 = H+ + HCO3-
HCO3- = H+ + CO32-
第十六页,共68页。
表表3-34-125℃25时℃一时些一气些体气在体水在中水的中亨的利亨定利律定常律数常数
氧的分子量为32,因此其溶解度为8.32mg/L。
气体的溶解度随温度升高而降低,这种影响可由C1ausius-C1apeyron方
程式显示出:
lgc2 H (1- 1) c1 2.303T R1 T2
温度从0℃升高到35℃时,氧在水中的溶解度从14.74mg/L降低到
7.03mg/L。
第二十页,共68页。
3.地球上水的分布
地球上的水分布在海洋、湖泊、沼泽、河流、冰川、雪地、 以及大气、生物体、土壤和地层。水的总量约为13.86亿km3,其
中海水占96.5%,淡水为0.35亿km3,占总水量的2.35%。 比较容易开发利用的,与人类生活和生产关系密切的淡水
储量为400多万km3,仅占淡水的11%,总水量的0.3%。
阳离子
第三章-水环境化学(第一次课)

ii 表示方法
总含盐量(Total Dissolved Solids-TDS),也称总矿化度: 水中所含各种溶解性矿物盐类的总量称为水的总含盐量。
总含盐量=Σ阳离子+Σ阴离子
iii 测定
重量法
总含盐量=溶解固形物
cT
[H
2 CO
* 3
](1
K1 [H
]
K1K 2 [H ]2
)
0
[H2CO*3
]
1
cT
(1
K1 [H ]
K1K 2 [H ]2
) 1
说明pH决定它们的 含量多少
1
[HCO
3
]
cT
[H ] (
K1
1
K2 [H
) ]
1
2
[CO32 ] cT
([H ]2 K1K 2
[H ] 1)1 K2
lg c2 H • ( 1 1 ) 15.59103 ( 1 1 ) c1 2.303R T1 T2 2.3038.314 298.15 273.15
c2 8.289 1.778 14.74mg / L
0 ℃时的含量14.74mg/L 20 ℃时为9.227mg/L
2.在一个标准大气压下,25℃时CO2在水中的溶解度。已知 CO2在干空气中的含量为0.0314%(体积)。
氧气的分压为
0.9813105 20.95% 0.2056105 Pa
[G(O2) ] KH PG 1.26108 0.2056105 2.590104 mol / L
[G(O2) ] 2.590104 32 8.289mg / L
水环境化学(1)-10-20
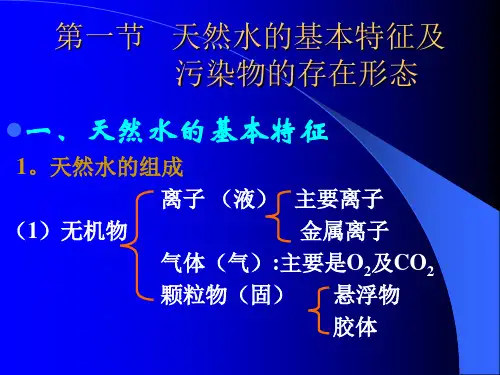
第一节 天然水的基本特征及污染物的存在形态
一、天然水体的基本特征 (Basic Character of Natural Waters) 1、天然水的组成(Constitution of Natural Waters)
可溶性物质 悬浮物 悬浮物质 颗粒物 水生生物
(1) 天然水的主要离子组成: K+, Na+, Ca2+, Mg2+, HCO3-, NO3-, Cl-, SO42- 为天然水中常
[CO2(aq)] = KH Pco2 = 3.34×10-7×30.8
= 1.028×10-5 mol.L-1
CO2在水中离解,则: [H+] = [HCO3-]
[H ] K1 = 4.45×10-7 [CO2 ]
[H+] =( 1.028×10-5× 4.45×10-7)1/2 = 2.14×10-6 mol.L-1 pH = 5.67
2
CO2在水中的溶解度:
[CO2] + [ HCO3-]
= 1.028×10-5+ 2.14×10-6
= 1.24×10-5 mol.L-1
= 0.55 mg.L-1
(4)水生生物
水生生物直接影响水中许多物 质的存在,具有代谢、摄取、转化、 存储和释放等的作用。
如藻类的生成和分解
106CO2+16NO3+HPO42-+122H2O+18H++ (痕量元素)
而 对于 开 放 体 系来 说 ,[HCO3-] 、[CO32-] 和CT 均 随pH改变 而 变 化 ,但
[H2CO3*]总保持与大气相平衡的固定数值。
因此,在天然条件下开放体系是实际存在的,而封闭体系是计算短时 间溶液组成的一种方法,即把其看作是开放体系平衡过程中的一个微小阶段, 在实用上认为是相对稳定而加以计算。
水环境化学复习资料-终极版.doc
第一章、天然水的理化性质1、离子总量:天然水中各离子总量之和,常用S T表示,单位为mg/L或mmol/L。
4种阳离子(钙离子、镁离子、钠离子、钾离子)4种阴离子(碳酸氢根、碳酸根、硫酸根、氯)2、矿化度:以一定量过滤水样在105-110℃烘干称重的方法测定其可溶性总固体物质的量 ,包括水中溶解的非挥发性有机物3、氯度:沉淀0.3285234Kg海水中全部卤素离子所需纯标准银的克数 ,在数值上即为海水的氯度 ,用符号Cl表示 ,单位为1×10-34、盐度:当海水中的溴和碘被相当量的氯所取代、碳酸盐全部变为氧化物、有机物完全氧化时,海水中所含全部固体物的质量与海水质量之比3、天然水的依数性:稀溶液蒸气压下降、沸点上升、冰点下降值都与溶液中溶质的质量摩尔浓度成正比,而与溶质的本性无关。
4、透明度:光线进入水中的程度,适宜透明度为20~40cm5、真光层:光照充足,光合作用速率大于呼吸作用速率的水层6、营养生成层;植物光合作用合成的有机物多于呼吸作用消耗的有机物,有机物的净合成大于零的水层。
光照不足,光合作用速率小于呼吸作用速率的水层为营养分解层。
7、补偿深度:有机物的分解速率等于合成速率的水层深度,大约为透明度的2~2.5倍8、离子活度:离子的有效浓度。
9、水体流转混合的两个因素:风力引起的涡动混合,密度差引起的对流混合10、温跃层:水温在垂直方向出现急剧变化的水层。
北方鱼类在室外越冬时,要注意防风处理,避免池水对流使池底水温变化,影响鱼类生长,室外海水越冬池底保温关键:添加低盐度的海水或者淡水。
常量>50mmol/L 50umol/L<微量<50mmol/L 恒量<50umol/L通过水面进入水中的太阳辐射,一部分被水中的溶存物质吸收,一部分被散射,一部分继续向深处穿透。
几种淡水鱼耐盐能力:草鱼>团头鲂>鲢鱼盐度与温度的线性关系,在(24.9 -1.35)处达到最大的密度11、水体的温度分布规律一、湖泊(水库)四季典型温度分布(1)冬季的逆分层期水温随着深度的增加而缓慢升高,到底层水温可以达到或小于密度最大时的温度(2)春季全同温期水温在密度最大的温度以下时,温度的升高会使密度增大,表面温度较高的水就会下沉,下面较低的水就会上升,形成密度流。
环境化学:第三章 水环境化学 1
第一节 天然水的基本特征及污染物的存在形态
②
CO2的溶解度
已知: 干空气中CO2的含量为0.0314%(体积),水
在25℃时蒸气压为0.03167×105 Pa, CO2的亨利定律
常数是3.34×10-7mol/(L·Pa) (25℃), CO2溶于水后发生
的化学反应是:
CO2+H2O = H++HCO3-
CO32-
60
α 40
20
0
2
4
6
8
10
pH
图3-1 碳酸化合态分布图
12
第一节 天然水的基本特征及污染物的存在形态
对于开放体系,应考虑大气交换过程:
[CO 2 (aq)] K H pCO 2
CT [CO 2 (aq)] / 0
1
0
K H pCO 2
1
K1
[HCO ] CT 1
人均水资源量相当于世界人均量的1/4。已经被联合
国列为13个贫水国家之一。
第一节 天然水的基本特征及污染物的存在形态
一、天然水的基本特征
1.天然水的组成
天然水体——包括水、水中的溶解物、悬浮物
以及底泥和水生生物。
天然水的组成按形态分为:可溶性物质和悬浮物质。
悬浮物质包括:
悬浮物、颗粒物、水生生物等。
一般情况下,天然水中存在的气体有O2、CO2、
H2S、N2和CH4等。
表3-2 海水中主要溶解气体的含量范围
气体
含量范围
/mg·L-1
O2
0~8.5
N2
CO2
H2S
Ar
8.4~14.5
水环境化学复习-第一二章
绪论:水质系:水及其中溶存的物质构成的体系构成水质系1、 天然水质系的构成:⑴天然水的主要成分极其复杂性:①物质种类繁多且含量悬殊。
②溶解物质分散程度复杂。
③存在各种生物。
⑵天然水的化学成分的形成:①大气淋溶②从岩石土壤中的淋溶③生物作用④次级反应与交换吸收作用⑤工业废水、生活污水和农业退水2、水环境化学:是研究天然水体化学物质的来源、存在形态、迁移转化、生态效应及污染水体治理的一门科学。
3、水环境化学课程内容::①水环境化学成分的动态规律②水质控制方法③水质化验技术第一章:天然水的主要理化性质1、哪些可以反应天然水含盐量的参数?特点是? 常有离子总量、矿化度、盐度、氯度① 离子总量:指天然水的各种离子的含量之和。
常用mg/L 或mmol/L 或g/kg 、mmol/kg 单位表示②矿化度:矿化度是水中所含无机矿物成份的总量。
本书指用过氧化氢氧化后蒸发,在105~110℃干燥剩余的残渣,然后称重,即用蒸干称重法得到的无机矿物成分的总量.在蒸发过程中往往有损失,所以矿化度〈水中的离子总量.③ 氯度:海水样品的氯度相当于沉淀海水样品中全部卤族元素所需纯标准银的质量与改海水样品质量之比的0.3285234倍,用10-3作单位,Cl 符号表示。
④ 海水的盐度:当海水中的溴和碘被相当量的氯所取代、碳酸盐全部转化成氧化物、有机物完全氧化时,海水中所含固体质量与海水的质量之比,以10-3作单位,用S ‰(千分号)表示.S ‰=0.030+1。
80655Cl ‰(盐度和氯度的关系)离子总量〉矿化度>盐度 其他如海水的折光率,海水的密度等这些都与海水含盐量密切相关。
离子总量、矿化度概念较多用来反映内陆水的含盐量;盐度、氯度则是反映海水含盐量的参数。
2、天然水的化学分类方法 ⑴按照矿化度的分类方法淡水 矿化度<1g/L (1g/L 是基于人的味觉,当大于1g/L 时,人感觉咸味) 微咸水 1-25g/L ( 25g/L 是微咸水和海水的分界线) 具海水盐度的水 25-50g/L 盐水 〉50g/L⑵按主要离子成分的分类——阿列金分类法(要知道用符号表分类) ① 含阴离子最多的分为三类:P23 搞清类,组,型A 将HCO 3-和1/2CO 32- 才,统称为碳酸盐类,用符号C 表示 : b 1/2SO 42-为一类,为硫酸盐类,用符号S 表示; c Cl -为一类,称氯化物类,用符号Cl 表示天然水 质系天然溶存物质 人工源污染物 水悬浮物胶态物溶解物质{}{}3310103285234.0--=Ag W Cl②含阳离子最多分为三组:Ca-钙组、Mg-镁组、Na,K-钠组③阴阳离子比例分为四个型:每组仅有三个型的水存在.一单位电荷为基本单元④> 在每一组内一般只能有其中3个型的水存在。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
活度系数的大小与离子强度有 关,离子强度的概念由G.N.Lewis和
M.Randall于1921年提出。
1 2 ci Z i 2 i
u :离子强度;
ci: i 离子的浓度; Zi : i 离子所带电荷数
作业1: H2O2是水处理常用的氧化剂,在MnO2 催化剂存在下很容易分解成O2和H2O2: 2H2O2 O2+2H2O
反应:
A P
t 0
t t
微分式
cA,0
0
cA
cA,0 cA
dcA r k1cA dt
一级反应的积分速率方程
--integral rate equation of first order reaction
不定积分式
dcA cA k1dt
定积分式
t dcA cA,0 cA 0 k1dt cA
气体溶解平衡、酸碱平衡
(1)亨利定律、Clausius-Clapeyron 方程 (2)碳酸平衡 (3)酸度、碱度
总碱度 在测定一已知体积水样(V ml)总碱度时,可 用一个强酸标准溶液(浓度为M mol/L)滴定,用 甲基橙为指示剂,直到溶液由黄色变成橙红色 (pH约4.3)停止滴定,消耗强酸体积V1(ml)。
ln cA k1t 常数
cA,0 cA
k1t )
一级反应的半衰期(half-life time)方程
半衰期是指反应发生后,达到剩余反应物浓度 占起始反应物浓度一半所需的时间。记为t1/2 一级反应的半衰期:
CA,0 1 ln 2 t1 ln k1 0.5CA,0 k1 2
P70 习题3-2,3-3,3-8
第四章 天然水中的化学平衡
热力学动力学 (1) 一级反应的微分速率方程、积分 速率方程、半衰期; (2)吉布斯自由能变及标准平衡常数
(3)离子的活度;离子强度
一级反应的微分速率方程
---differential rate equation of first order reaction)
通过实验,在不同时间测定H2O2的浓度,得
到以下数据(见EXCEL表),求解该反应的
反应级数和反应速率常数。
作业2:已知水中CaCO3(s)的形 成和溶解有如下可逆反应 Ca2+ + HCO3CaCO3(s) + H+ 假定[Ca2+] =[HCO3- ]=1×10-3 mol • L-1 ,pH=7,水温为25℃ ,问此时是 否有CaCO3(s)沉淀产生?
M V1 总碱度(m ol/ L) V
碱度的实际应用----水的肥力 当水体的碱度为1.00×10-3mol/L,由于CO2消耗 生成多少生命体能使水体的pH 由7.0升高到 10.0? (计算实质:反应前后减少的无机碳(CT的变化量)
求该海水的离子强度。
计算: 某工业水含[Ca2+] = 1×10-3 mol/L , [HCO32-]= 2×10-3 mol/L, pH =8.7,温度为10℃ ,
水中离子强度I= 5×10-3 mol/L ,
请判断水的稳定性? (10℃时K为102.34,并查表知在该离子强 度下γ(Ca2+)=0.75, γ(HCO3-)=0.93)
1.34
0.034
28.5
1.24
39.3
0.98
11.6 168
0.48 2.75
12.3
6.91
0.35 0.07
0.034
1.24
1.96
0.96 2.75
0.35 0.14
第三章 天然水的污染及其主要污染物 (1)水污染;点源、非点源污染; (2) 水体污染物类型; (3)BOD;COD;持久性有机污染物; (4)毒作用的生物化学机制
当水中离子浓度较高时,由于离子间的静电 作用,使离子的行为受到束缚,即离子活度要 小于离子浓度,小于的程度可用活度系数来表 达。
{i} =γ
i
[i]
{i}: i离子的活度(活度表征化学反应速率或反 应能力等与化学反应有关的性质 ); [i]:i离子的浓度(浓度表征某组分的含量)。 γ
i
: i离子的活度系数。
例:测得某海水
[K+]= 0.010 mol • L-1 [Cl-]= 0.56 mol • L-1 [Na+]= 0.48 mol • L-1 [SO42-]= 0.028 mol • L-1 [Mg2+]= 0.054 mol • L-1 [HCO3-]= 0.0024 mol • L-1 [Ca2+]=0.010 mol • L-1 [CO32-]= 0.00027 mol • L-1
笔试(开卷)考试题型
(1) 填空 (20分)
(2)名词解释 (20分)
(3)分析简答 (30分) (4)计算 (30分)
第一章
绪论
环境史上二十世纪八大公害事件; 环境化学的定义、分支学科?
第二章 天然水
(1)水的分子结构特点;水的基本性质及其主 要生物效应;水的同位素组成(同位素分馏、 千分差等)
Fe3+ + 3H2O === Fe(OH)3(s)+3H+ K3=1.1×10-4
2Fe3+ +2H2O === Fe2(OH)24++2H+ K=1.23×10-3 计算pH等于7时水体中铁的各形态的浓度?
P41
K+ mg/L mmol/L mEq/L Na+
习题 2-7
Ca2+ Mg2+ HCO3ClSO42-
• 水环境化学 • (复习)
本课程的主体内容
• 1、绪论 • 2、天然水化学 ;
• 3、天然水的污染及其主要污染物 ;
• 4、天然水中的化学平衡;
• 5、水环境中的界面过程;
• 6、水环境中的微生物化学过程 ; • 7、水环境中的光化学过程; • 8、水环境化学的主要研究方法
成绩结构(共3学分): 1.实验成绩 2.理论成绩 二篇小论文 平时成绩 期末考试 占0.5学分 占2.5学分,组成为: 30% 10% 60% (开卷)
(2) 天然水的组成(八大离子、腐殖质等); (3)天然水的分类; (4)海水的物理化学特征( Marcet—Dittmar恒 比定律、盐度、氯度); (5)典型的风化反应类型。
(5)天然水的分类
P20 在 pH≤7的天然水中,铁离子可发生 下列水解反应:
Fe3+ + H2O === FeOH2++H+ K1=8.9×10-4 Fe3+ + 2H2O === Fe(OH)2++2H+ K2=4.9×10-7
