炭铁磷硫在氧气中燃烧的实验及现象
初中化学必考的80个试验现象

20.在三氯化铁溶液中滴加氢氧化钠溶液:红褐色沉淀生成。
21.盛有生石灰的试管里加少量水:反应剧烈,发出大量热。
22.将一洁净铁钉浸入硫酸铜溶液中:铁钉表面有红色物质附着,溶液颜色逐渐变浅。
23.将铜片插入硝酸汞溶液中:铜片表面有银白色物质附着。
24.向盛有石灰水的试管里,注入浓的碳酸钠溶液:有白色沉淀生成。
67.乙醇在空气中燃烧:火焰呈现淡蓝色。
68.将乙炔通入溴水:溴水褪去颜色。
69.将乙炔通入酸性高锰酸钾溶液:紫色逐渐变浅,直至褪去。
70.苯与溴在有铁粉做催化剂的条件下反应:有白雾产生,生成物油状且带有褐色。
71.将少量甲苯倒入适量的高锰酸钾溶液中,振荡:紫色褪色。
72.将金属钠投入到盛有乙醇的试管中:有气体放出。
11.向盛有少量碳酸钾固体的试管中滴加盐酸:有气泡产生。
12.加热试管中的硫酸铜晶体:蓝色晶体逐渐变为白色粉末,且试管口有液滴生成。
13.钠在氯气中燃烧:剧烈燃烧,生成白色固体。
14.点燃纯净的氯气,用干冷烧杯罩在火焰上:发出淡蓝色火焰,烧杯内壁有液滴生成。
15.向含有氯离子的溶液中滴加用硝酸酸化的硝酸银溶液,有白色沉淀生成。
55.将点燃的镁条伸入盛有二氧化碳的集气瓶中:剧烈燃烧,有黑色物质附着于集气瓶内壁。
56.向硫酸铝溶液中滴加氨水:生成蓬松的白色絮状物质。
57.向硫酸亚铁溶液中滴加氢氧化钠溶液:有白色絮状沉淀生成,立即转变为灰绿色,一会儿又转变为红褐色沉淀。
58.向含 Fe3+的溶液中滴入 KSCN 溶液:溶液呈血红色。
63.加热(170℃)乙醇与浓硫酸的混合物,并使产生的气体通入溴水,通入酸性高锰酸钾溶液:有气体产生,溴水褪色,紫色逐渐变浅。
炭,铁,磷,硫在氧气中燃烧的实验及现象
初中化学常见物质在氧气中燃烧的实验
一.红磷在氧气中燃烧
一.实验操作
①用记号将集气瓶中的水面上方的容积分为5等分;
②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;
③冷却至室温后,松开弹簧夹。
二.实验现象
四.集气瓶中水的作用
小于
大于
六.注意
实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以
是氢氧化钠
二.铁丝在氧气中燃烧
一.实验现象
①在空气中加热铁丝只能烧到发红,不燃烧
②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体
二.实验操作
①
a.
硫(淡黄色固体)
硫的熔点很低,所以燃烧时为液态
在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色
二.实验现象
蓝紫色火焰,放出热量,生产有刺激性气味的气体
三.注意事项
硫的用量不能过多,防止造成空气污染
四.集气瓶底部留有少量水的作用
①吸收有毒气体二氧化硫
四.木炭在氧气中燃烧
..
④。
(完整版)物质在氧气中燃烧现象归纳
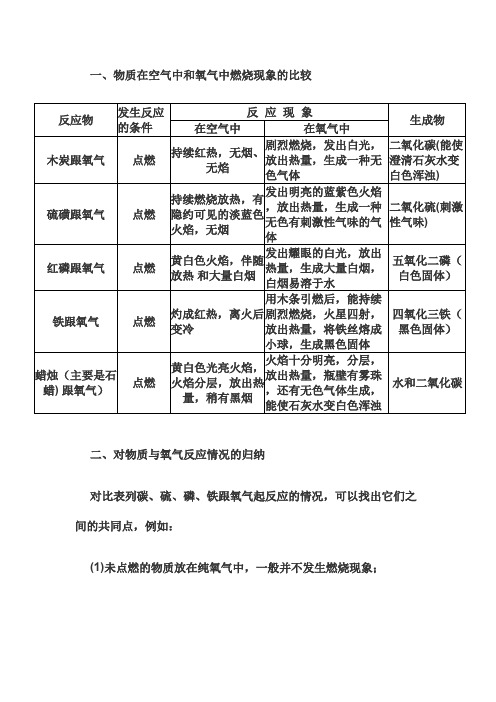
一、物质在空气中和氧气中燃烧现象的比较
二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
反 应 现 象
反应物发生反应的条件在空气中在氧气中
生成物木炭跟氧气
点燃
持续红热,无烟、
无焰
剧烈燃烧,发出白光,
放出热量,生成一种无
色气体
二氧化碳(能使澄清石灰水变白色浑浊)硫磺跟氧气点燃
持续燃烧放热,有
隐约可见的淡蓝色
火焰,无烟
发出明亮的蓝紫色火焰
,放出热量,生成一种
无色有刺激性气味的气
体
二氧化硫(刺激性气味)红磷跟氧气点燃
黄白色火焰,伴随
放热 和大量白烟
发出耀眼的白光,放出
热量,生成大量白烟,
白烟易溶于水
五氧化二磷(白色固体)铁跟氧气点燃
灼成红热,离火后变冷用木条引燃后,能持续
剧烈燃烧,火星四射,放出热量,将铁丝熔成
小球,生成黑色固体四氧化三铁(黑色固体)
蜡烛(主要是石蜡) 跟氧气)
点燃黄白色光亮火焰,
火焰分层,放出热
量,稍有黑烟
火焰十分明亮,分层,
放出热量,瓶壁有雾珠
,还有无色气体生成,
能使石灰水变白色浑浊
水和二氧化碳
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
物质在氧气中燃烧现象归纳

二、对物质与氧气反应情况的归纳
对比表列碳、硫、磷、铁跟氧气起反应的情况,可以找出它们之间的共同点,例如:
(1)未点燃的物质放在纯氧气中,一般并不发生燃烧现象;
(2)物质在燃烧时有的有火焰、有的无火焰,有的冒烟、有的不冒烟,烟和焰色也各有不同;
(3)在空气中原来不能燃烧(或不能持续燃烧)的物质,在纯氧气中却能燃烧起来,且燃烧得十分剧烈;
(4)前四个实验都是某物质跟氧气相互起化学反应,产生了一种新物质,属于化合反应;
(5)这五种物质都是与氧发生了化学反应,故都属于氧化反应。
铁、磷、硫、碳反应符号表达式和实验现象

化学作业:
1、写出下列物质燃烧的现象:
2、分子有哪些性质?
答:
3、课本P52,第2题
反应现象
铁在氧气中燃烧
硫在空气中燃烧
硫在氧气中燃烧
磷在空气中燃烧
木炭在空气中燃烧
木炭在氧气中燃烧
化学作业
1、写出下列物质燃烧的现象:
反应现象
铁在氧气中燃烧
硫在空气中燃烧
硫在氧气中燃烧
化学练习姓名学号成绩
一、木炭还原氧化铜实验中
①网罩的作用:;
②实验现象,;
③实验结束,应先,再;
④化学方程式;
三、反应化学方程式:
(1)碳在空气中充分燃烧;
(2)碳在空气中不充分燃烧;
(3)碳与二氧化碳高温反应;
(4)实验室制取二氧化碳;
(5)一氧化碳在空气中燃烧;
(6)一氧化碳与氧化铜加热反应;
(7)一氧化碳与氧化铁加热反应;
四、填空
①检验气体是否CO2,将气体通入
此反应的化学方程式;
②③④小题除杂
②CO2(CO)将气体通过
此反应的化学方程式;
③CO(CO2)将气体通入
此反应的化学方程式;
④CaO(CaCO3)将固体
此反应的化学方程式;
3、写出实验室抽取氧气的三种方法的化学方程式
氯化钾双氧水
高锰酸钾
化学练习姓名学号成绩
反应现象
化学方程式
铁在氧气中燃烧
镁条在空气中燃烧
硫在氧气中燃烧
磷在空气中燃烧
木炭在氧气中燃烧
2、空气的成分按体积:N2占,O2占,稀有气体占,CO2占,
3、写出实验室抽取氧气的三种方法的化学方程式
磷在氧气里燃烧的实验现象

磷在氧气里燃烧的实验现象
一、实验准备
实验材料:红磷、燃烧匙、氧气瓶
实验器材:火焰架、酒精灯、烧杯、计时器
实验步骤:
1.将红磷放入燃烧匙中,用酒精灯加热至燃烧。
2.将燃烧匙插入氧气瓶中,点燃红磷。
3.观察红磷在氧气中的燃烧现象。
4.记录燃烧所需时间和燃烧后的现象。
二、实验过程
1.红磷在氧气中燃烧,迅速产生大量白烟,火焰呈黄色。
2.随着燃烧的进行,白烟逐渐增多,最终形成白色固体。
3.燃烧过程中,可以听到轻微的噼啪声,这是由于红磷与氧气反应产生热量和气体所致。
4.燃烧结束后,烧杯内壁出现水珠,这是由于红磷燃烧放出大量的热,使周围空气中的水蒸气凝结成水珠。
三、实验结果与分析
1.实验结果:红磷在氧气中燃烧,产生大量白烟和黄色火焰,最终形成白色固体。
燃烧过程中有噼啪声,燃烧结束后烧杯内壁出现水珠。
2.结果分析:红磷在氧气中燃烧是放热反应,因此可以解释烧
杯内壁出现水珠的现象。
红磷与氧气反应生成五氧化二磷,这是一种白色固体,因此可以解释最终形成白色固体的现象。
同时,红磷燃烧时产生大量白烟,这是因为五氧化二磷颗粒分散在空气中形成白烟。
四、结论
通过本次实验,我们观察到红磷在氧气中燃烧的现象,并对其进行了分析。
实验结果表明,红磷与氧气反应是放热反应,生成物为五氧化二磷白色固体。
此外,我们还发现实验过程中有噼啪声和烧杯内壁出现水珠的现象。
这些结果证明了红磷在氧气中燃烧的特性,为我们进一步了解化学反应提供了实验依据。
在今后的学习中,我们可以运用本次实验的结论来解释其他相关化学现象和反应机理。
初中化学物质燃烧现象及其方程式总结

1、镁条在空气中燃烧现象:银白色固体燃烧,发出耀眼的白光,放出大量热,生成一种粉末状的白色固体物质。
化学方程式:2Mg + O 2 =点燃2MgO2、红磷在空气中燃烧现象:红色固体燃烧,发出黄白色火焰,放出热量,产生大量白烟,生成一种白色粉末状固体物质。
化学方程式:4P + 5O 2 =点燃 2P 2O 53、木炭在氧气中燃烧现象:黑色固体剧烈燃烧,发出白光,放出大量热,生成一种无色无味并能使澄清石灰水变浑浊的气体物质。
化学方程式:C + O 2 =点燃 CO 24、硫在氧气中燃烧现象:淡黄色固体燃烧,产生明亮的蓝紫色火焰〔硫在空气中燃烧产生微弱的淡蓝色火焰〕,放出热量,生成一种无色有刺激性气味的气体物质。
化学方程式:S + O 2 =点燃 SO 25、铝在氧气中燃烧现象:银白色固体燃烧,发出耀眼的白光,放出大量热,生成一种粉末状的白色固体物质。
化学方程式:4Al + 3O 2 =点燃 2Al 2O 36、铁丝在氧气中燃烧现象:银白色固体剧烈燃烧,火星四射,放出大量热,生产一种黑色固体物质。
化学方程式:3Fe + 2O 2 =点燃 Fe 3O 47、氢气在空气中燃烧现象:无色气体燃烧,产生淡蓝色火焰,放出热量,在火焰上方罩一个冷而枯燥的烧杯,烧杯内壁有水珠产生。
化学方程式:2H 2 + O 2 =点燃 2H 2O8、一氧化碳在空气中燃烧现象:无色气体燃烧,产生蓝色火焰,放出热量,有能使澄清石灰水变浑浊的气体物质产生。
化学方程式:2CO + O 2 =点燃2CO 29、甲烷在空气中燃烧现象:无色气体燃烧,产生明亮的蓝色火焰,放出热量,在火焰上方罩一个冷而枯燥的烧杯,烧杯内壁有水珠产生,同时有能使澄清石灰水变浑浊的气体物质产生。
化学方程式:CH 4 + 2O 2 =点燃 CO 2 + 2H 2O10、酒精在空气中燃烧现象:无色液体燃烧,产生淡蓝色火焰,放出热量,在火焰上方罩一个冷而枯燥的烧杯,烧杯内壁有水珠产生,同时有能使澄清石灰水变浑浊的气体物质产生。
碳硫磷铁在氧气中燃烧的化学方程式

碳硫磷铁在氧气中燃烧的化学方程式1. 引言在化学反应中,物质的燃烧一直是备受关注的话题。
其中,碳、硫、磷、铁等金属元素在氧气中的燃烧过程更是引人注目。
本文将从化学方程式的角度出发,深入探讨碳、硫、磷、铁在氧气中燃烧的过程和特点,从而帮助读者更深入地理解这一化学现象。
2. 碳在氧气中的燃烧碳是一种常见的元素,其在氧气中的燃烧反应是我们日常生活中经常能够观察到的现象。
碳在氧气中燃烧,会产生二氧化碳和大量的热能。
其化学方程式如下所示:C + O2 → CO2这个简单的化学方程式揭示了碳燃烧的基本过程,同时也说明了碳和氧气之间的化学反应。
此反应释放出的热能也是我们在实际应用中利用的重要能源之一。
3. 硫在氧气中的燃烧与碳类似,硫在氧气中的燃烧也是一种常见的化学反应。
硫在氧气中燃烧的化学方程式如下所示:S + O2 → SO2通过这个化学方程式,我们可以看到硫在氧气中燃烧时会生成二氧化硫。
这一反应也释放出大量的热能,产生明亮的火焰。
4. 磷在氧气中的燃烧磷在氧气中燃烧的化学方程式如下所示:P + O2 → P4O10磷和氧气的化学反应产生了氧化物——氧化四磷,其燃烧过程同样伴随着强烈的光和热能的释放。
这一现象也是我们在实验室或者其他场合中常常观察到的化学反应之一。
5. 铁在氧气中的燃烧铁在氧气中燃烧的化学方程式如下所示:4Fe + 3O2 → 2Fe2O3这一化学方程式揭示了铁和氧气之间的化学反应,产生了氧化铁。
铁在氧气中燃烧的特点是会产生大量的热能,并且会生成明亮的火花。
6. 总结与回顾通过以上对碳、硫、磷、铁在氧气中燃烧的化学方程式的深入探讨,我们可以了解到不同物质在氧气中燃烧的过程和产物。
碳、硫、磷、铁在氧气中燃烧的化学方程式反映了它们在氧气环境中的活性和化学特性,也给我们提供了更多了解这些元素特性的方式。
个人观点与理解在实际生活和工作中,了解碳、硫、磷、铁等元素在氧气中的燃烧特性对我们的日常生活和工作具有一定的指导意义。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
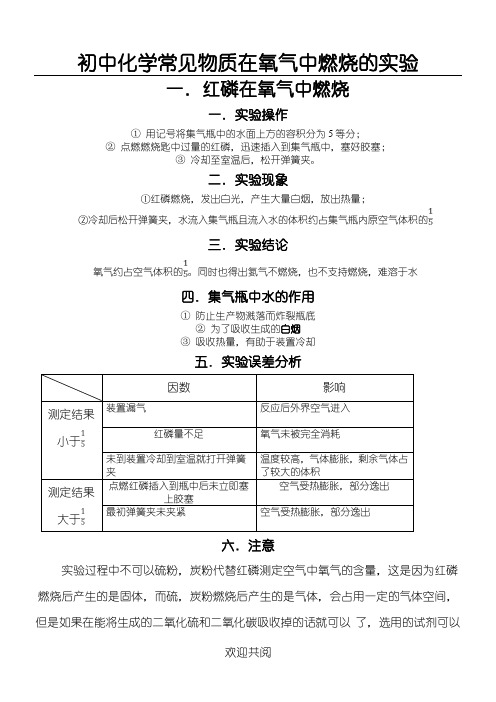
初中化学常见物质在氧气中燃烧的实验
一.红磷在氧气中燃烧
一.实验操作
①用记号将集气瓶中的水面上方的容积分为5等分;
②点燃燃烧匙中过量的红磷,迅速插入到集气瓶中,塞好胶塞;
③冷却至室温后,松开弹簧夹。
二.实验现象
①红磷燃烧,发出白光,产生大量白烟,放出热量;
②冷却后松开弹簧夹,水流入集气瓶且流入水的体积约占集气瓶内原空气体积的1
5三.实验结论。
同时也得出氮气不燃烧,也不支持燃烧,难溶于水氧气约占空气体积的1
5
四.集气瓶中水的作用
①防止生产物溅落而炸裂瓶底
②为了吸收生成的白烟
③吸收热量,有助于装置冷却
五.实验误差分析
六.注意
实验过程中不可以硫粉,炭粉代替红磷测定空气中氧气的含量,这是因为红磷燃烧后产生的是固体,而硫,炭粉燃烧后产生的是气体,会占用一定的气体空间,但是如果在能将生成的二氧化硫和二氧化碳吸收掉的话就可以了,选用的试剂可以是氢氧化钠
二.铁丝在氧气中燃烧
一.实验现象
①在空气中加热铁丝只能烧到发红,不燃烧
②在氧气中剧烈燃烧,火星四射,放出大量热,生产黑色固体
二.实验操作
①为了达到铁丝燃烧的温度而采取的两个主要措施是:
a.铁丝绕成螺旋状(目的:增大铁丝的受热面积)
b.系一根火柴棍(目的:引燃火柴给铁丝预热)
②等火柴快要燃尽时再将铁丝放入集气瓶的原因是:
a.充分给铁丝预热
b.减少未燃尽的火柴对瓶内氧气的消耗
③使铁丝与氧气充分反应,操作方法是:把铁丝由上而下缓慢插入集气瓶
④底部放水或砂石的目的:
a.防止铁丝燃烧后产生的高温熔融物溅落炸裂瓶底
⑤注意:铁丝不能用生锈的,若用生锈的铁丝,使用前需要打磨
三.硫在氧气中燃烧
一.硫的性质
硫(淡黄色固体)
硫的熔点很低,所以燃烧时为液态
在空气中燃烧:淡蓝色;在氧气中燃烧:蓝紫色
二.实验现象
蓝紫色火焰,放出热量,生产有刺激性气味的气体
三.注意事项
硫的用量不能过多,防止造成空气污染
四.集气瓶底部留有少量水的作用
①吸收有毒气体二氧化硫
四.木炭在氧气中燃烧
..
实验现象
①木炭在空气中只能烧到发红;
②木炭在氧气中燃烧能发出白光
③放出热量
④生产能使澄清石灰水边浑浊的气体(加入了第四个实验才能说明这个现象,不然不能说变
浑浊的这个现象)。
