中考化学总复习专题训练-专题五-常见的计算题试题
2023年中考化学专题复习---计算题

2023年中考化学专题复习-计算题一、计算题1.将10g赤铁矿样品(杂质既不溶于水,也不参与反应)放入烧杯中,再加入100g稀硫酸,恰好完全反应,过滤,得到滤液和2g滤渣。
请计算。
(1)赤铁矿样品中氧化铁的质量是______g。
(2)所用稀硫酸的溶质质量分数?(写出计算过程)2.某校化学研究性学习小组了解到,某石材厂新购进一批石灰石原料(其所含的杂质既不溶于水,也不溶于盐酸,高温时也不发生反应)。
甲、乙、丙、丁四位同学分别取该石灰石样品,并取稀盐酸200g平均分成....4份进行实验,结果如下:实验甲乙丙丁加入样品的质5101520量/g生成CO2的质1.76 3.52 4.40m量/g求:(1)m=_________;(2)所用稀盐酸中溶质的质量分数为_____。
3.将3.2g某红棕色粉末与足量的碳充分反应,将产生的二氧化碳气体全部通入足量的澄清石灰水中,得到3g白色沉淀。
计算:(1)生成二氧化碳的质量;______(2)红棕色粉末中氧元素的质量分数。
______4.N(NO2)3是科学家2011年发现的一种新型火箭燃料。
计算:(1)N(NO2)3中氮、氧元素的质量比;(2) gN(NO2)3中含28g氮元素。
5.某同学用20 g含杂质的碳酸钠混合固体制取氢氧化钠(杂质不溶于水),用于制作“叶脉书签”。
操作过程如下:(1)实验中玻璃棒的作用是______。
(2)计算混合固体中碳酸钠的质量分数。
6.根据所示的实验和提供的数据、图像,回答下列问题:求:(1)a 的质量_______g 。
(2)b 点溶液质量______。
(写出计算过程)(3)恰好完全反应后所得溶液中溶质质量分数______。
(写出计算过程)7.实验室有一瓶标签腐蚀的氢氧化钠溶液,为测量其溶质质量分数,小明做了如下实验:①取20g 氢氧化钠溶液于烧杯;①滴加无色酚酞;①滴加20%的稀硫酸至恰好褪色;①称量实验后烧杯内溶液总质量。
(1)将50g98%的浓硫酸稀释为20%的稀硫酸需加水的质量为______g 。
中考化学总复习题型复习(五)化学计算题习题(2021年整理)

(云南专版)2019年中考化学总复习题型复习(五)化学计算题习题编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望((云南专版)2019年中考化学总复习题型复习(五)化学计算题习题)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为(云南专版)2019年中考化学总复习题型复习(五)化学计算题习题的全部内容。
题型复习(五)化学计算题题型之一根据化学式的计算1.(2014·云南)酚酞(C20H14O4)是实验室常用的指示剂。
下列说法不正确的是(D)A.酚酞是有机物B.酚酞由碳、氢、氧三种元素组成C.酚酞的相对分子质量为318D.酚酞中碳、氢、氧元素的质量比为20∶14∶42.(2018·保山市腾冲县模拟)不管是普通湿纸巾还是婴儿湿巾中,都含有一种常见原料丙二醇(化学式C3H8O2),它是一种容易渗透到皮肤中的石油化工溶剂,对身体的危害不容忽视。
下列关于丙二醇的说法正确的是(B)A.丙二醇的相对分子质量为76 gB.丙二醇是由碳、氢、氧三种元素组成的C.丙二醇中氧元素的质量分数最小D.丙二醇中碳、氢、氧三种元素的质量比是3∶8∶23.(2018·乐山)三硝基胺[N(NO2)3]可用作火箭的燃料,下列关于三硝基胺的说法正确的是(C) A.三硝基胺由三种元素组成B.三硝基胺的相对分子质量为152 gC.一个三硝基胺分子中含有10个原子D.三硝基胺中氮、氧元素的质量比为2∶34.(2018·贵阳)2018年国际禁毒日主题是“抵制毒品,参与禁毒".大麻酚是一种毒品,吸食后对身体有严重的危害.大麻酚的化学式为C21H26O2,下列说法正确的是(B)A.大麻酚属于氧化物B.大麻酚含有三种元素C.大麻酚含有49个原子D.大麻酚中C、H、O的质量比为21∶26∶25.(2018·苏州)茉莉花香气的成分有多种,乙酸苯甲酯(C9H10O2)是其中的一种。
中考化学总复习专题训练 专题五 常见的计算题试题

专题五常见的计算题类型一有关化学式的计算1.(2016,临沂)我国科学家屠呦呦因发现青蒿素(化学式C15H22O5),荣获2015年诺贝尔生理学或医学奖,请计算:(1)青蒿素中氢、氧元素的质量比为11∶40。
(2)28.2g青蒿素中含碳元素的质量为18g。
2.(2015,兰州)苯甲酸钠(C7H5O2Na)是一种食品添加剂,广泛用于食品工业中。
请计算:(1)C7H5O2Na的相对分子质量是144;(2)C7H5O2Na中碳、氧两种元素的质量比是21∶8;(3)14.4 g苯甲酸钠中含有钠元素多少克?(写出计算过程)14.4 g 苯甲酸钠中含有钠元素的质量为14.4 g×23144×100%=2.3 g 。
3.(2016,天津)尿素[CO(NH2)2]是氮肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
计算:(1)CO(NH2)2中共含有4(写数字)种元素;(2)CO(NH2)2的相对分子质量是60;(3)若CO(NH2)2中含有3 g氮元素,则该CO(NH2)2的质量为6.4g(计算结果精确到0.1 g)。
4.(2016,济宁)随着人们生活水平的提高,小汽车走进了千家万户。
车用防冻液“冬天防冻、夏天防沸、全年防水垢、防腐蚀”的优良性能被爱车族广泛使用。
现国际上普遍使用的是乙二醇[(CH2OH)2]水基型防冻液。
请回答:(1)乙二醇的相对分子质量为62;(2) 乙二醇中C、H、O元素的质量比为12∶3∶16。
5.(2016,安徽)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。
现有含1.6 kg硫酸铜的工业废液,加入铁粉回收铜,请计算:(1)硫酸铜中铜元素的质量分数。
(2)理论上与硫酸铜反应消耗铁粉的质量。
解:(1)硫酸铜中铜元素的质量分数=6464+32+16×4×100%=40%;(2)设理论上与硫酸铜反应消耗铁粉的质量为x:Fe+CuSO4===Cu+FeSO456 160x 1.6 kg56x =1601.6 kgx =0.56 kg答:(1)硫酸铜中铜元素的质量分数为40%;(2)理论上与硫酸铜反应消耗铁粉的质量为0.56 kg 。
2020中考必备化学第六部分专题五化学计算题

解:设碳酸钠的质量为x,生成氯化钠的质量为y。
Na2CO3+2HCl 106
2NaCl+H2O+CO2↑
117
44
x
y
4.4 g
x=10.6 g,y=11.7 g
所得溶液中NaCl的质量分数为
×100%=7.5%
答:所得溶液中NaCl的质量分数为7.5%。
2. (2019乐山) 生铁和钢都是由铁和碳组成的合金,生 铁中碳的含量为2%~4.3%,钢中碳的含量为 0.03%~ 2%,为测定某种铁合金中碳的含量,小王同学取5.8 g 质量的合金样品盛放在重量为50 g的烧杯中,并向其中 逐滴加入94.6 g稀盐酸至恰好完全反应,烧杯和剩余物 的总质量150.2 g (1)恰好完全反应时,生成氢气的质量为____0_.2___g。 (2)样品中碳的质量分数。(计算结果保留到0.1%) (3)反应后得到的溶液中溶质的质量分数。(计算结果保 留到0.1%)
以在医生的指导下口服葡萄糖酸钙口服溶液来补钙。
图6-5-2为某品牌“葡萄糖酸钙口服溶液”的部分说明。 葡萄糖酸钙的相对分子质量为430,请计算:
葡萄糖酸钙口服溶液 Calcium Gluconate Oral Solution 【成分】本品每毫升含葡萄糖酸钙[(C6H11O7)2Ca]100
mg(相当于钙9 3 mg)。 【包装】每支装10 mL,每盒12支。
解:设样品中铁的质量x,生成FeCl2的质量为y。
Fe+2HCl
FeCl2+H2↑
56
127 2
x
y 0.2 g
x=5.6 g,y=12.7 g
(2)铁合金中碳的质量分数为
×100%=3.4%
初三化学计算复习题

初三化学计算复习题在初三化学学习中,计算题是不可或缺的一部分。
通过解决化学计算题,可以帮助学生巩固知识点,培养解决问题的能力。
本文将为你提供一些典型的初三化学计算复习题,帮助你更好地准备化学考试。
一、质量计算1. 甲烷(CH4)的相对分子质量是16克/摩尔,计算以下问题:(1) 8克的甲烷分子中含有几个碳原子?答:甲烷分子中只含有一个碳原子。
(2) 8克的甲烷分子中含有几个氢原子?答:甲烷分子中含有4个氢原子。
(3)甲烷中1克碳原子的质量占整个甲烷分子质量的百分比是多少?答:1克碳原子的质量占整个甲烷分子质量(16克)的百分比为6.25%。
2. 有一种化合物的化学式为H2SO4,计算以下问题:(1)该化合物的相对分子质量是多少?答:H2SO4的相对分子质量为98克/摩尔。
(2) 1克的该化合物中含有多少个氧原子?答:1克的H2SO4中含有0.32个氧原子。
(3)该化合物中含有多少克的氧元素?答:H2SO4中含有32克的氧元素。
二、物质的量计算1. 计算下列物质的物质的量:(1) 10克的氧气(O2)物质的量是多少?答:氧气的相对分子质量为32克/摩尔,因此10克的氧气物质的量是0.3125摩尔。
(2) 5克的二氧化碳(CO2)物质的量是多少?答:二氧化碳的相对分子质量为44克/摩尔,因此5克的二氧化碳物质的量是0.1136摩尔。
2. 计算下列物质的质量:(1) 0.5摩尔的甲烷(CH4)的质量是多少?答:甲烷的相对分子质量为16克/摩尔,因此0.5摩尔的甲烷的质量是8克。
(2) 0.25摩尔的硫酸(H2SO4)的质量是多少?答:硫酸的相对分子质量为98克/摩尔,因此0.25摩尔的硫酸的质量是24.5克。
三、溶液计算1. 计算以下问题:(1)有一溶液中含有20克的氯离子(Cl-),如果溶液的体积为500毫升,计算该溶液中氯离子的浓度。
答:氯离子(Cl-)的浓度等于质量除以体积,所以该溶液中氯离子的浓度为40克/升。
中考化学专题总复习:化学计算题
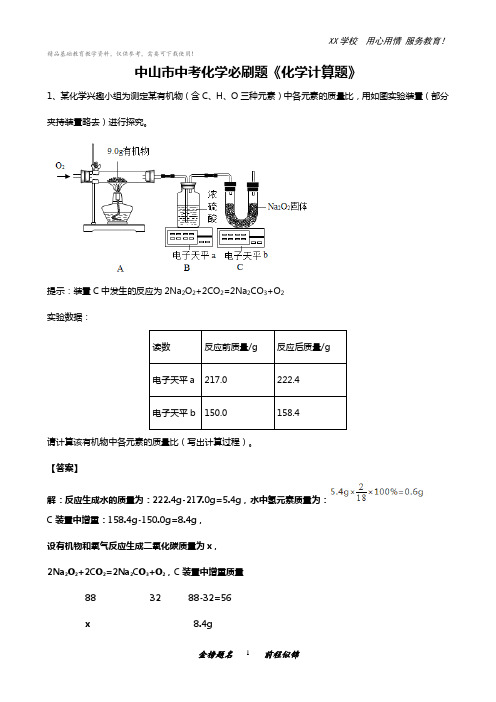
精品基础教育教学资料,仅供参考,需要可下载使用!中山市中考化学必刷题《化学计算题》1、某化学兴趣小组为测定某有机物(含C、H、O三种元素)中各元素的质量比,用如图实验装置(部分夹持装置略去)进行探究。
提示:装置C中发生的反应为2Na2O2+2CO2=2Na2CO3+O2实验数据:读数反应前质量/g 反应后质量/g电子天平a 217.0 222.4电子天平b 150.0 158.4请计算该有机物中各元素的质量比(写出计算过程)。
【答案】解:反应生成水的质量为:222.4g-217.0g=5.4g,水中氢元素质量为:C装置中增重:158.4g-150.0g=8.4g,设有机物和氧气反应生成二氧化碳质量为x,2Na2O2+2CO2=2Na2CO3+O2,C装置中增重质量88 32 88-32=56x 8.4gx=13.2g,二氧化碳中碳元素质量为:则有机物中氧元素质量为:9.0g-3.6g-0.6g=4.8g,该有机物中碳、氢、氧三种元素的质量比为:3.6g:0.6g:4.8g=6:1:8,答:该有机物中碳、氢、氧三种元素的质量比为6:1:8。
2、工业盐酸中通常溶有少量的FeCl3而呈黄色,小红为测定某工业盐酸中HCl的含量进行如下实验:取某工业盐酸l00g,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。
请回答下列问题:(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是g。
(2)该工业盐酸中HCl的质量分数是多少(写出计算过程)【答案】解:(1)由图可知,完全反应后生成沉淀的质量为2.14g。
(2)由图可知,与氯化铁反应的氢氧化钠溶液的质量为172g-160g=12g;设消耗的氢氧化钠的质量为xFeCl3+3NaOH═Fe(OH)3↓+3NaCl;120 107x 2.14gx=2.4g氢氧化钠溶液的溶质质量分数=与盐酸反应的氢氧化钠的质量为:160g×20%=32gHCl+NaOH═H2O+NaCl;36.5 40y 32gy=29.2g该工业盐酸中HCl的质量分数是:答案:(1)2.14。
中考化学专项训练计算题(好分题型总结)

中考专项训练——计算题的总结初中化学计算题的有多种,其中包括化学式计算、化合价计算、化学方程式计算、溶液计算、化学方程式和溶液简单综合计算、应用质量守恒定律计算等,下面针对近几年年各地中考试题中的计算题进行一下归类:一、有关化学式计算题:计算相对分子质量组成元素质量比求某一元素的质量分数通过物质质量求元素质量通过元素质量求物质质量1、(2012.贵阳市)化学实验室加热用的酒精灯里的燃烧是乙醇,化学式为CH3CH2OH,试计算:(1)一个乙醇分子里含有个原子;(2)乙醇的相对分子质量为;(3)乙醇中碳元素的质量分数为多少?(写出计算过程)第一种:标签型化学式计算题:1、(2012.佛山市)(3分)钙是人体必须的常量元素,每日必须摄入足够量的钙。
目前市场上的补钙药剂很多,右图是某种品牌的补钙药品的部分说明书。
请回答下列问题:(1)CaCO3中钙元素的质量分数为。
(2)若每片钙片的质量为1g,则钙片中钙元素的质量分数为。
(3)如果按用量服用,每天摄入钙元素的质量为g。
2、(2012.眉山市)(3分)人体缺少钙元素会影响健康,因此每日需摄人足够的钙。
市场上某钙制剂的说明书如右图所示,请仔细阅读,并进行计算。
(1)葡萄糖酸钙相对分子质量为____(2)葡萄糖酸钙中氢、氧元素的质量比为(3)按说明书服用钙片时,每天能够补充的钙为mg(精确到0.1)。
第二种:叙述型化学式计算题:1、(2012.百色市)(3分)黄曲霉素(C17H12O6)是污染粮食(大米、花生等)的真菌霉素,人类的特殊基因在黄曲霉素作用下会发生突变,危害身体健康。
请回答:(1)每个黄曲霉素分子中含有个原子;(2)黄曲霉素分子中氢、氧元素的质量比为;(3)黄曲霉素的相对分子质量为。
第三种:综合型化学式计算题:1、(2012.昆明市)(6分)(1)天然气主要成分甲烷的化学式为CH4,按下列要求进行计算:①甲烷的相对分子质量为:②甲烷中碳、氢两种元素的质量比为。
初三中考化学专题练习--计算题(含参考答案最新)

中考化学专题练习--计算题1根据所示的实验和提供的数据、图像,回答下列问题:(2) b 点溶液质量。
(写出计算过程)(3)恰好完全反应后所得溶液中溶质质量分数。
(写出计算过程)2、实验室常用过氧化钠与水反应制取氧气,反应的化学方程式如下: 2N@Q+2HO=4NaOH+O ,试计算:(1) 15.6g 过氧化钠与足量的水反应可以生成多少克氧气? (2)标准状况下,氧气的密度约为1.43g/L ,多少空气中才可能含有这么多氧气。
(计算结果保留到 0.1 )3、某纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠》 96%为测定该产品中碳酸钠的质 量分数,进行了以下实验:取11.0 g 纯碱样品放入烧杯中, 称得烧杯及所盛纯碱样品的总质量为 158.0 g , 再把100 g 稀盐酸平均分成四份依次加入样品中,每次均充分反应。
实验数据记录如下:所加盐酸的次数 第一次 第二次 第三次 第四次烧杯及所盛物质总质量/g H181.2 204.4 228.6 253.6请你据此分析计算:(1) 第一次加入稀盐酸充分反应后,生成二氧化碳的质量是 ____________ g 。
(2) 该产品中碳酸钠的质量分数是否合格?(要求写出计算过程,结果精确到0.1%)。
.L WX MJBff輿 JLM求:(1) a 的质量(3) 根据实验数据,在坐标纸上绘制出所加稀盐酸质量与生成气体质量关系的曲线。
(不要求写出计算过程,只画出曲线即可)工业盐酸lOOg,滴加一定溶质质量分数的NaOH溶液,测得加入NaOH溶液质量与反应生成的沉淀质量关系如图所示。
请回答下列问题:(1)FeCl3与NaOH恰好完全反应时,生成沉淀的质量是__________(2 )计算氢氧化钠溶液的溶质质量分数。
(写出计算过程)(3)该工业盐酸中HCI的质量分数是 __________ 。
5、钙是人体中的常量元素,缺钙时可通过食用保健药剂来增加摄入量。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
专题五常见的计算题类型一有关化学式的计算1.(2016,临沂)我国科学家屠呦呦因发现青蒿素(化学式C15H22O5),荣获20XX年诺贝尔生理学或医学奖,请计算:(1)青蒿素中氢、氧元素的质量比为11∶40。
(2)28.2g青蒿素中含碳元素的质量为18g。
2.(2015,兰州)苯甲酸钠(C7H5O2Na)是一种食品添加剂,广泛用于食品工业中。
请计算:(1)C7H5O2Na的相对分子质量是144;(2)C7H5O2Na中碳、氧两种元素的质量比是21∶8;(3)14.4 g苯甲酸钠中含有钠元素多少克?(写出计算过程)14.4 g 苯甲酸钠中含有钠元素的质量为14.4 g×23144×100%=2.3 g 。
3.(2016,天津)尿素[CO(NH2)2]是氮肥中最主要的一种,其含氮量高,在土壤中不残留任何有害物质,长期施用没有不良影响。
计算:(1)CO(NH2)2中共含有4(写数字)种元素;(2)CO(NH2)2的相对分子质量是60;(3)若CO(NH2)2中含有3 g氮元素,则该CO(NH2)2的质量为6.4g(计算结果精确到0.1 g)。
4.(2016,济宁)随着人们生活水平的提高,小汽车走进了千家万户。
车用防冻液“冬天防冻、夏天防沸、全年防水垢、防腐蚀”的优良性能被爱车族广泛使用。
现国际上普遍使用的是乙二醇[(CH2OH)2]水基型防冻液。
请回答:(1)乙二醇的相对分子质量为62;(2) 乙二醇中C、H、O元素的质量比为12∶3∶16。
5.(2016,安徽)早在西汉时期的《淮南万毕术》中就记载“曾青得铁则化为铜”,成为现代湿法冶金的先驱。
现有含1.6 kg硫酸铜的工业废液,加入铁粉回收铜,请计算:(1)硫酸铜中铜元素的质量分数。
(2)理论上与硫酸铜反应消耗铁粉的质量。
解:(1)硫酸铜中铜元素的质量分数=6464+32+16×4×100%=40%;(2)设理论上与硫酸铜反应消耗铁粉的质量为x:Fe+CuSO4===Cu+FeSO456 160x 1.6 kg56x =1601.6 kgx =0.56 kg答:(1)硫酸铜中铜元素的质量分数为40%;(2)理论上与硫酸铜反应消耗铁粉的质量为0.56 kg 。
类型二 有关化学方程式的计算 6.(2016,南充)现有50 g 氯化钙溶液与100 g 碳酸钠溶液恰好完全反应,将反应后的混合液过滤后得到溶液的质量为140 g 。
(反应的化学方程式为CaCl 2+Na 2CO 3===CaCO 3↓+2NaCl)(1)生成沉淀的质量是10_gg 。
(2)求碳酸钠溶液中溶质的质量分数是多少? 解:设参加反应碳酸钠的质量为x CaCl 2+Na 2CO 3===CaCO 3↓+2NaCl 106 100 x 10 g106100=x 10 gx =10.6 g 碳酸钠溶液中溶质的质量分数是10.6 g100 g×100%=10.6%答:碳酸钠溶液中溶质的质量分数是10.6%。
7.(2015,益阳)某同学向过氧化氢溶液中加入二氧化锰制取氧气,相关数据如下:请计算:(1)该同学制得氧气的质量为1.6_g 。
(2)该同学所用过氧化氢溶液的溶质质量分数。
(相对原子质量:H -1、O -16) 解:设参加反应的H 2O 2的质量为x 。
2H 2O 2=====MnO 22H 2O +O 2↑ 68 32 x 1.6 g 68x =321.6 g x =3.4 g3.4 g68 g×100%=5% 答:该同学所用过氧化氢溶液的溶质质量分数是5%。
8.(2016,泉州)工厂烟气脱硫工艺,不仅能消除二氧化硫,还能将其转化为硫酸钙(CaSO 4)等产品,实现“变废为宝”。
反应的化学方程式为:2CaCO 3+O 2+2SO 2===2CaSO 4+2CO 2,现用1.25 t 含碳酸钙80%的石灰石吸收烟气中的二氧化硫。
求:(1)石灰石中碳酸钙的质量。
(2)可吸收二氧化硫的质量。
解:(1)1.25 t 含碳酸钙80%的石灰石中碳酸钙的质量=1.25 t×80%=1 t 。
(2)设理论上碳酸钙能完全吸收二氧化硫的质量为x :2CaCO 3+O 2+2SO 2=====高温2CaSO 4+2CO 2 200 128 1 t x 2001 t =128xx =0.64 t答:(1)石灰石中碳酸钙的质量为1 t ; (2)可吸收二氧化硫的质量为0.64 t 。
类型三 有关溶液的计算9.(2016,荆门)将氯化钠与碳酸钠的混合物15.0 g ,溶于100 mL 水中,向所得溶液中滴加5.55%的氯化钙溶液至完全反应,如图是所加氯化钙溶液与生成沉淀质量关系图,求恰好完全反应时:(1)原混合物中,碳酸钠的质量。
(2)所得溶液中,溶质质量分数。
(计算结果精确至0.1%)解:(1)设原混合物中碳酸钠的质量为x ,参加反应的氯化钙溶液的质量为y ,生成氯化钠的质量为z 。
Na 2CO 3+CaCl 2═CaCO 3↓+2NaCl 106 111 100 117 x 5.55%y 5 g z106x =1111.55%y =117z =1005 gx =5.3 gy =100 g z =5.85 g100 mL 水的质量为100 g ,故所得溶液中,溶质质量分数= 15 g -5.3 g +5.85 g15 g +100 g +100 g -5 g×100%≈7.4%答:(1)原混合物中,碳酸钠的质量为5.3 g ; (2)所得溶液中,溶质质量分数为7.4%。
10.(2016,孝感)向盛有一定质量稀硫酸的烧杯中逐渐加入10 g 锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8 g 。
请根据关系图分析并计算:(1)稀硫酸反应完时,产生氢气的质量为0.2g ,消耗锌粒质量为6.5g 。
(2)该稀硫酸中溶质的质量分数(写出计算过程)。
解:设锌的质量为x ,稀硫酸中溶质的质量为y Zn +H 2SO 4===ZnSO 4+H 2↑ 65 98 2 x y 0.2 g65x =98y =20.2 g解得:x =6.5 g y =9.8 g (2)该稀硫酸中溶质的质量分数: 9.8 g109.8 g -10 g +0.2 g×100%=9.8%答:该稀硫酸中溶质的质量分数是9.8%。
类型四 综合计算11.(2015,兰州)现有家庭食用碱样品12 g(主要成分Na 2CO 3,其他成分不与酸反应),向其中加入某未知浓度的盐酸,生成气体的质量与加入盐酸的质量关系如图。
请计算:(1)食用碱中碳酸钠的纯度是多少?(2)盐酸中溶质的质量分数是多少?(要求写出计算过程,结果精确到0.1)解:(1)设12 g 纯碱样品中含Na 2CO 3的质量为x ,100 g 盐酸中含氯化氢的质量为y 。
Na 2CO 3+2HCl===2NaCl +H 2O +CO 2↑ 106 73 44x y 4.4 g106x =73y =444.4 gx =10.6 g y =7.3 g纯碱样品中的Na 2CO 3的质量分数是10.6 g12 g×100%=88.3%12.(2016,威海)实验室有一瓶久置的氢氧化钠固体,某同学想了解其变质情况,称取5g 样品于烧杯中,加入30 g 水使之完全溶解,再向烧杯中缓缓加入过量的氢氧化钡溶液,完全反应后,生成沉淀1.97 g 。
求:(1)样品中碳酸钠的质量分数。
(2)反应后所得溶液中氢氧化钠的质量。
解:(1)设样品中碳酸钠的质量为x ,生成的氢氧化钠的质量为y : Na 2CO 3+Ba(OH)2===BaCO 3↓+2NaOH 106 197 80 x 1.97 g y106197=x 1.97 g 19780=1.97 g y 解得:x =1.06 g y =0.8 g样品中碳酸钠的质量分数是:1.06 g 5 g×100%=21.2%(2)反应后所得溶液中氢氧化钠的质量是:5 g -1.06 g +0.8 g =4.74 g 答:(1)样品中碳酸钠的质量分数是21.2%;(2)反应后所得溶液中氢氧化钠的质量是4.74 g 。
13.(2015,娄底)马英同学取某地石灰石样品12 g 进行测定实验,现将100 g 稀盐酸分五次加入石灰石样品中(杂质不溶于水也不参与反应),充分反应后测得生成气体的总质量如表所示:试求:(1)m 的值为3.3g 。
(2)12 g 石灰石样品中碳酸钙的质量等于10g 。
(3)反应完全后最终溶液中氯化钙的质量分数?(写出计算过程,计算结果精确至0.1) 解:设反应生成CaCl 2的质量为x 。
CaCO 3+2HCl===CaCl 2+H 2O +CO 2↑ 111 44 x 4.4 g111x =444.4 gx =11.1 g 完全反应后最终溶液中氯化钙的质量分数是11.1 g10 g +100 g -4.4 g ×100%≈10.5%答:反应完全后最终溶液中氯化钙的质量分数为10.5%。
14.(2014,甘肃)为了节约林木资源,近几年兴起了石头纸。
石头纸可用沿海水产养殖中产生的大量废弃贝壳制得。
为了测定某种贝壳中碳酸钙的质量分数,取贝壳25 g ,加入200 g 稀盐酸,恰好完全反应,称得反应后物质的总质量为216.2 g 。
(假设贝壳中其他物质不与盐酸反应且不溶于水)。
请你计算:(1)贝壳中碳酸钙的质量分数;(2)反应后所得溶液中溶质的质量分数(精确到0.1%)。
解:根据质量守恒定律,生成二氧化碳的质量为25 g +200 g -216.2 g =8.8 g 。
设25 g 贝壳中所含CaCO 3的质量为x ,反应生成CaCl 2的质量为y 。
CaCO 3+2HCl===CaCl 2+CO 2↑+H 2O 100 111 44 x y 8.8 g(1)100x =448.8 gx =20 g25 g 贝壳中所含CaCO 3的质量分数为20 g25 g ×100%=80%(2)111y =448.8 gy =22.2 g反应后溶液的质量为20 g +200 g -8.8 g =211.2 g 反应后所得溶液中溶质的质量分数为22.2 g211.2 g×100%≈10.5%答:(1)贝壳中碳酸钙的质量分数为80%;(2)反应后所得溶液中溶质的质量分数为10.5%。
15.(2014,武威)某纯碱样品中含有少量氯化钠。
为测定样品中碳酸钠的质量分数,现称取该样品11 g ,加入到盛有50 g 稀盐酸的烧杯中,恰好完全反应,最后称得烧杯中溶液的质量为56.6 g 。
