微波场中 KCl 浓度对几丁质脱乙酰反应的影响
食品微波干燥过程中的化学变化
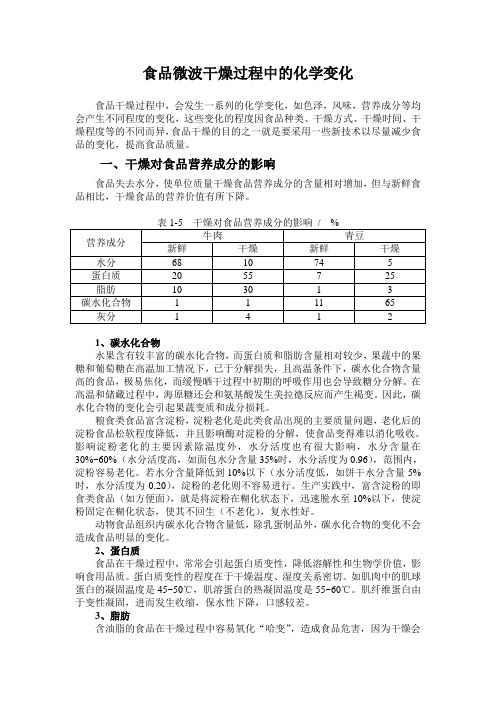
食品微波干燥过程中的化学变化食品干燥过程中,会发生一系列的化学变化,如色泽,风味,营养成分等均会产生不同程度的变化,这些变化的程度因食品种类、干燥方式、干燥时间、干燥程度等的不同而异,食品干燥的目的之一就是要采用一些新技术以尽量减少食品的变化,提高食品质量。
一、干燥对食品营养成分的影响食品失去水分,使单位质量干燥食品营养成分的含量相对增加,但与新鲜食品相比,干燥食品的营养价值有所下降。
表1-5 干燥对食品营养成分的影响/ %营养成分牛肉青豆新鲜干燥新鲜干燥水分68 10 74 5蛋白质20 55 7 25脂肪10 30 1 3碳水化合物 1 1 11 65 灰分 1 4 1 21、碳水化合物水果含有较丰富的碳水化合物,而蛋白质和脂肪含量相对较少,果蔬中的果糖和葡萄糖在高温加工情况下,已于分解损失,且高温条件下,碳水化合物含量高的食品,极易焦化,而缓慢晒干过程中初期的呼吸作用也会导致糖分分解。
在高温和储藏过程中,海原糖还会和氨基酸发生美拉德反应而产生褐变。
因此,碳水化合物的变化会引起果蔬变质和成分损耗。
粮食类食品富含淀粉,淀粉老化是此类食品出现的主要质量问题,老化后的淀粉食品松软程度降低,并且影响酶对淀粉的分解,使食品变得难以消化吸收。
影响淀粉老化的主要因素除温度外,水分活度也有很大影响,水分含量在30%~60%(水分活度高,如面包水分含量35%时,水分活度为0.96),范围内,淀粉容易老化。
若水分含量降低到10%以下(水分活度低,如饼干水分含量5%时,水分活度为0.20),淀粉的老化则不容易进行。
生产实践中,富含淀粉的即食类食品(如方便面),就是将淀粉在糊化状态下,迅速脱水至10%以下,使淀粉固定在糊化状态,使其不回生(不老化),复水性好。
动物食品组织内碳水化合物含量低,除乳蛋制品外,碳水化合物的变化不会造成食品明显的变化。
2、蛋白质食品在干燥过程中,常常会引起蛋白质变性,降低溶解性和生物学价值,影响食用品质。
微波场中甲壳素非均相碱法脱乙酰反应动力学研究

第 5卷
的烧杯 ) 在 一 定 功 率 下 处 理 一 段 时 间 。处 理 结 束 ,
基 金 项 目 : 广 东 省 科 技 厅 攻 关 项 目 资 助 ( 号 编
20C0 1) 0 2 2 3 4
作 者 简 介 :李 作 为 (9 3一) 男 , 读 博 士 研 究 生 . 师 。 17 , 在 讲
维普资讯
6
广 东 轻 工 职 业 技 术 学 院 学 报
NO 2 .
2 6 00
微波场 中甲壳 素非均相碱法脱 乙酰反应动 力学研究
李作为 张立彦 曾庆 孝
( .广 东 轻 工 职 业 技 术 学 院 食 品 与 生 物 工 程 系 , 东 广 州 50 4 : 1 广 160 2 华 南 理 工 大 学 轻 工 与 食 品 学 院 广 东 广 州 50 0 ) . 130
维普资讯
第 5卷 第 2 期
20 年 6月 06
广 东 轻 工 职 业 技 术 学 院 学 报
J 0URN AL F GU ANG D0 NG N DU S 0 I TRY TECHNI CAL COLLEGE
VO. 15
J un
甲壳 素在 一 定 温度 下 , 与一 定 浓度 的 N O 溶 aH 液反 应脱 去 乙酰 基 , 成 壳 聚糖 。该 反 应 为 固液 反 生 应体 系 , 属于 非均 相反 应 。 由于 两相 的存在 , 反应 中 的物质 扩散及 传 递存 在 困难 研究 , 于 一 级 化 学 反 应 属 。在 常 规加 热 条 件
应速 率及 动力 学情 况 , 即密 闭式 、 开放式 两种微 波处
机 , 国 O t ; S一8 美 s rG e 6型 电动 振 动 筛 , 虞 县 仪 器 上
微波消解和电位滴定法测定重整催化剂中总氯含量

微波消解和电位滴定法测定重整催化剂中总氯含量豆祥辉,钱 梅,张爱东(中国石油兰州石化公司质量检验中心,甘肃兰州 730060)摘 要:介绍一种采用高效微波加热消解法处理试样,利用电位滴定法测定重整催化剂中总氯含量的方法,并对该方法的最佳条件进行了探讨。
相比较而言,该方法分析速度快,精度能够满足分析方法的要求。
关键词:微波消解;电位滴定法;重整催化剂;氯中图分类号:T U991.21 前言连续重整装置催化剂中氯含量在重整过程中对催化剂的活性和选择性影响极大,催化剂上的氯含量偏低会使催化剂氯解活性增强,使循环氢纯度上升,生成油芳含和辛烷值下降,C5液体收率下降等;偏高则会使催化剂的加氢裂化活性过强,使循环氢纯度下降,产氢率下降,C5液体收率下降,生成油发黄,苯含量增加,重芳烃含量减少,总温降减少等,这均不利于催化剂活性的正常发挥,因此必须严格控制重整催化剂中氯含量。
目前通常采用UOP291《蒸煮和电位滴定法测定铂重整催化剂中总氯含量》,但其采用的蒸煮法处理试样时间较长(十几小时甚至二十几小时),方法分析速度缓慢,无法满足重整装置连续化生产配合的需要。
为此,我们采用了高效微波加热消解法处理试样(35分钟),极大地缩短了分析时间。
结果表明,该方法精度能够满足分析方法的要求。
2 方法概要取一定量催化剂后,用水合肼还原,再加入硫酸浸析,在微波加热炉中消解,消解液转移到烧杯后,用硝酸银进行电位滴定。
3 试验部分3.1 仪器电位滴定仪:输入阻抗大于1012Ω,精确度达到±2mV;高效微波加热炉:SH9402型或其它同类型仪器;高效微波消解罐:MD-21型或其它同类型仪器。
3.2 试剂及材料硫酸溶液:7.0mol/L~7.5mol/L;水合肼溶液:将5g水合肼稀释至1L;硝酸银溶液:0.01mol/ L和0.1mol/L标准水溶液;1.5伏干电池;滤纸。
4 结果与讨论4.1 消解时间的选择选取不同的消解时间,测定试样的总氯含量,结果见下图1。
微波活化对Ca(OH)2孔隙结构及脱氯性能的影响

第1 第1期 卷 0
环 境 工 程 学 报
Ch n s o r a o n i n n a gn e i i e e J u n l fE vr me tl o En i e rn
微 波 活化 对 C ( H) a O 2孔 隙结 构 及 脱 氯性 能 的影 响
.
o i e e cia e a l swa e td o e ho ia in s se Re u h w t a h r s a D ma i e f r fdf r nta tv td s mp e stse n a d c lrn t y tm o s hs s o h tt e e i n o f i 1t o m
d cቤተ መጻሕፍቲ ባይዱlrn t n p ro ma c fCa OH) ehoiai o fr n eo ( o 2
Z agY nu J i a L Q nh i Me gA h n hn a g o i J y n i iga a n n io g
( e a oaoyf h r l ce c n o e E g e r go Mii r o d c t n T ig u nvri , e ig 10 8 ) K yL b rt o T e in ea dP w r n i ei f ns y f u ai , s h a U i s y B in 0 0 4 r r ma S n n t E o n e t j
v rey. e q a tt f3 ~2 m ir — o e n r a e o p o i r o e a e o h a es l Th u n iy o 0 n m c o p r s i c e s s t r vde mo e p r r a frt e s mpl u i g a t a e d rn c i — v t n. e e m ir — o e r oal tl e rc ns m e u ig d c lra to M ir wa e a tv to to t a c i o Th s c o p r sa e ttly u i z d o o u d d rn e ho i n in. co v cia in a p i la — i m
《食品理化检测技术》期终考试试卷A及答案

《食品理化检测技术》期终考试试卷(A 卷)适用专业:一、填空题(每空1分,共13分) 1、我国的推荐性国家标准的代号为 。
2、从大量的检测对象中抽取有代表性的一部分样品供分析化验用,叫做 。
3、测定样品中水分含量:对于样品是易分解的食品,通常用 方法;对于样品中含有较多易挥发的成分,通常选用 。
3、测定总挥发酸的时候,因一部分酸是以结合态的形式存在,通常我们加入 使结合态的挥发酸离析。
4、直接滴定法测定还原糖含量时,影响测定结果的主要操作因素是反应液碱度、热源强度、煮沸时间和。
5、罗紫哥特里测定牛乳中脂肪含量时,加入石油醚的作用是 。
6、凯氏定氮法测定食品中的蛋白质含量,在消化时,添加CuSO 4的作用是 。
7、食品中氨基酸态氮含量的测定中,加入甲醛的作用是 。
8、测定蔬菜中V C 含量时,加入草酸溶液的作用是 。
9、测定食品中汞含量时,一般不能用 进行预处理。
10、对某人的味觉敏感度进行测定时,酸、甜、苦、咸四种基本味道所对应的是 、蔗糖、盐酸奎宁、氯化钠四种味感物质。
11、在一定温度下,同一密度瓶分别称取等体积的样品溶液和蒸馏水的质量,两者之比即为该样品溶液的 。
。
二、选择题(每小题1分,共30分)1、萃取属于下列哪种样品预处理方法( )A、有机物破坏法B、溶剂抽提法C、蒸馏法D、色层分离法2、下列那种方法可以不经过分离干扰成分的操作而消除其干扰作用( )A、控制酸度B、使用掩蔽剂c、溶剂浸提D、旋转蒸发3、下列计算结果应取()有效数字:3.8654×0.015÷0.681×2300+26.68A、5位B、2位C、3位D、4位4、在有效数字的运算规则中,几个数据相加减时,它们的和或差值的有效数字位数的保留应以()A、小数点后位数最少的数据为准B、计算器上显示的数字为准C、有效数字位数最少的数据为准D、绝对误差最大的数据为准5、测定牛乳中的水分时,加入海砂的作用是()。
黄粉虫几丁质酶的纯化及性质

黄粉虫几丁质酶的纯化及性质谢晓兰;曾炜;高平章;陈显柱;陈小莲【摘要】以黄粉虫为材料,采用盐析、亲和柱层析、Sephadex G-100分子筛及DE-52离子交换柱层析等制得纯化倍数约33倍,回收率为38%,比活力为294.7U/mg的几丁质酶制剂.在此基础上,以胶体几丁质为底物,考察黄粉虫几丁质酶的性质.结果表明:该酶催化水解几丁质的Km值为71.4mg/L;酶的最适pH值是6.0;最适温度为45℃左右;酶在pH 5.0~7.0,45℃以下酶活力稳定性较好.Na+和K+对酶活无影响;Ca2+、Cu2+对酶活起先扬后抑作用;Mn2+、Mg2+、Fe3+、Al3+对该酶活力均具有不同程度的抑制作用.%In this paper,Chitinase from Tenebrio molitor Linneeus was purified by extraction and ammonium sulfate fractionation,then chromatography on chitin Affinity column followed by Sephadex G-100 and DEAE-cellulose(DE-52) columns.The specific activity of the purified chitinase was 294.7 U/mg.the recovery rate of chitinase was 38%,and the multiple of purification was about 33 times.The characterization of chitinase from Terebrio molitor Linneeus was studied.The Michaelis constant Km value of chitinase was determinded to be 71.4 mg/L.The optimum pH and optimum temperature of chitinase for the hydrolysis of colloidal chitin(enzyme substrate) were determined to be pH 6.0 and 45 ℃,respectively.The stability of chitinase was investigated,and the results show that the enzyme is stable in a pH range from 5.0 to 7.0 and at temperatures under 45 ℃.The effects of metal ions on the enzyme were also studied.The results indicates that Na+ and K+ have no any effect on the enzyme activity.But Ca2+ and Cu2+ activates the enzyme activity atlow concentration,and they inactivate it at highconcentrations.Mn2+,Mg2+,Fe3+,Al3+ inhibite the enzyme.【期刊名称】《泉州师范学院学报》【年(卷),期】2012(030)004【总页数】6页(P56-61)【关键词】黄粉虫;几丁质酶;纯化;酶学性质【作者】谢晓兰;曾炜;高平章;陈显柱;陈小莲【作者单位】泉州师范学院化学与生命科学学院福建省分子生物与药物化学重点实验室,福建泉州362000;泉州师范学院化学与生命科学学院福建省分子生物与药物化学重点实验室,福建泉州362000;泉州师范学院化学与生命科学学院福建省分子生物与药物化学重点实验室,福建泉州362000;泉州师范学院化学与生命科学学院福建省分子生物与药物化学重点实验室,福建泉州362000;泉州师范学院化学与生命科学学院福建省分子生物与药物化学重点实验室,福建泉州362000【正文语种】中文【中图分类】Q356.1黄粉虫(Tenebrio molitor Linneeus),俗称面包虫,属节肢动物门,昆虫纲,鞘翅目,拟步行甲科,拟步甲族,拟步甲属,是一种大型的仓储害虫.其全身是宝,不仅是生理学、遗传学的实验材料,还是营养丰富的高蛋白资源[1].几丁质酶(EC 3.2.1.14)广泛存在于各种微生物、动物和植物中,是一类能把几丁质降解成N-乙酰氨基葡萄糖或者寡聚N-乙酰氨基葡萄糖的水解酶,在自然界的碳循环中具有重要的作用[2].此外,几丁质酶与生物体自溶、形态发生和营养代谢具有密切关系.在植物体内,几丁质酶具有增强植物防卫能力的功能[3-4].在昆虫体内,几丁质酶与昆虫的周期性蜕皮具有相关性,蜕皮前几丁质酶的表达量增加以促进蜕皮,而后酶的表达量减少以抑制蜕皮[5-6].近年来,国内外对微生物几丁质酶的研究较多,对动物几丁质酶的研究相对比较薄弱.目前,国内外关于黄粉虫的生理特性、饲养方法有不少报道,但与其生长密切相关的酶学研究却很少.国内外有关黄粉虫几丁质酶的分离纯化及性质研究还未见报道.本实验以黄粉虫为材料,采用盐析、亲和柱层析、Sephadex G-100分子筛柱层析、DEAE-52离子交换柱层析等方法纯化几丁质酶制剂,并在此基础上,进一步研究酶催化胶体几丁质水解的最适pH、最适温度、pH稳定性、热稳定性、米氏常数等酶学性质,研究结果将为黄粉虫几丁质酶的开发利用奠定基础.1 材料与方法1.1 材料黄粉虫(厦门花鸟市场);几丁质(上海生物工程有限公司);Sephadex G-100、DE-52(Sigma公司);葡萄糖、结晶苯酚、亚硫酸氢钠、酒石酸钾钠、3,5-二硝基水杨酸、各种金属离子的无机盐及其余试剂均为国产分析纯试剂. 1.2 方法1.2.1 胶体几丁质的制备称取2g片状的几丁质,加入20mL 85%的浓磷酸溶解,室温下放置2d后,用蒸馏水反复冲洗胶状几丁质至pH 5.0以上,再用蒸馏水调胶体几丁质至终浓度为1%[7].1.2.2 再生几丁质的制备将20g几丁质浸在200mL 47%NaOH溶液中,121℃下于烘箱保温20min后冲洗至中性,50℃烘干得脱乙酰几丁质[7].采用Molano法,称取脱乙酰几丁质10g于150mL 10%乙酸中溶解,静置12h,加入500mL 95%乙醇,搅拌均匀后静置几分钟,玻璃纤维过滤,加入15mL乙酸酐于滤液中,电磁搅拌至混合液形成凝胶为止.再静置30min后用小刀切成小块,冲洗至中性后用组织捣碎机捣碎2次(每次2s).于4℃下保存备用.1.2.3 还原糖浓度的测定参见文献[8],以葡萄糖作标准曲线,采用DNS法测定还原糖浓度.1.2.4 蛋白质浓度的测定参见文献[8],以牛血清白蛋白作标准曲线,采用考马斯亮蓝染色结合法测定蛋白质浓度.柱层析图谱的蛋白峰测定用紫外吸收法监测OD280nm的光密度值.1.2.5 酶活力和比活力的测定酶活力测定的原理:胶体几丁质+几丁质酶→N-乙酰氨基葡萄糖(还原糖).0.5 mL 1%胶体几丁质和0.5mL 0.1mol/L pH 6.0磷酸缓冲液混合后在45℃下预热10min,加入0.5 mL几丁质酶液,45℃下反应1h后,沸水浴20min终止反应,并迅速冷却后再加入1.5mL DNS试剂,再沸水浴20min后,冷却到室温后用蒸馏水定容至25mL,摇匀,离心后取上清,并以灭活的等量酶液做空白对照,在500nm波长下测吸光度.根据葡萄糖标准曲线,求出酶解反应体系的还原糖浓度,以还原糖的生成速度来测定酶活性大小.酶活力单位定义为在上述条件下,每小时水解胶体几丁质产生1μmol/L N-乙酰氨基葡萄糖(还原糖)所需的酶量.比活力定义为每毫克酶蛋白具有的酶活力单位数.1.2.6 几丁质酶的分离纯化取适量黄粉虫,按照1∶3(质量∶体积)的比例加入预冷的0.1mol/L pH 6.0磷酸缓冲液,匀浆后抽提1h以上,离心虹吸得清液;往清液缓慢加入固体硫酸铵至35%饱和度,盐析4h后,离心得清液;再往清液追加硫酸铵至75%饱和度,盐析4h以上,离心收集沉淀.沉淀用少量0.1mol/L pH 6.0磷酸缓冲液溶解,并透析至无,浓缩离心去沉淀,得几丁质酶粗酶液.粗酶液进行几丁质亲和柱层析,用含0.5mol/L NaCl的缓冲液淋洗,流速70mL/h;之后用0.05mol/L pH 10的甘氨酸-氢氧化钠缓冲液洗脱,流速30mL/h,收集酶活力峰,透析浓缩,用1mol/L HCl调pH至中性.进行Sephadex G-100凝胶过滤柱层析,用pH 6.0的磷酸缓冲液洗脱,流速10mL/h.收集酶活力峰.最后过DE-52离子交换柱层析,用含0~0.4mol/L NaCl 0.02mmol/L pH 6.8的磷酸缓冲液梯度洗脱,流速12mL/h,收集酶活力峰得几丁质酶液.以上操作均在4℃低温下进行,离心均是18000g离心15min,柱床规格均为2.6×30cm.1.2.7 几丁质酶催化胶体几丁质水解的动力学参数测定采用1.2.5酶活力测定方法,改变底物浓度,测定酶促反应速率,用Lineweaver-Burk双倒数作图法,求得酶催化胶体几丁质水解的米氏常数Km值.1.2.8 几丁质酶的最适反应温度及热稳定性按1.2.5酶活力测定方法,改变测活温度,其他条件不变,测定酶在不同反应温度下所具有的酶活力,以最高酶活为100%,考察酶的最适反应温度.另外,将几丁质酶在不同温度下保存1h后,取出按1.2.5正常测活方法,与4℃下保存的酶的活力为基准比较,检测酶残余活力,以此考察酶的温度稳定性.1.2.9 几丁质酶的最适反应pH及pH稳定性按1.2.5酶活力测定方法,0.5mL 1%胶体几丁质分别和0.5 mL 0.1mol/L不同pH的磷酸缓冲液混合后在45℃下预热10min,加入0.5mL几丁质酶液,45℃下反应1h后,测活.考察酶在不同反应pH下所具有的酶活力,以最高酶活为100%,确定酶的最适pH.此外,将几丁质酶液分别置于不同pH的缓冲体系中,于4℃下放置12h后,按1.2.5的方法测定酶活力,分别取出0.5mL几丁质酶处理液加入45℃下预热的0.5mL 1%胶体几丁质和0.5mL 0.1mol/L pH 6.0的磷酸缓冲液混合液中反应1h后,测活,以未处理的酶的活力为基准,检测酶残余活力,研究几丁质酶的pH稳定性.1.2.10 金属离子对酶活力的影响在45℃,pH 6.0的测活体系中,加入不同浓度的金属离子,测定出酶的相对活力,分析它们对酶活力的影响.2 结果2.1 黄粉虫几丁质酶的分离纯化以黄粉虫为提取几丁质酶的材料,按1.2.6方法,用0.1mol/L pH 6.0磷酸缓冲液抽提处理,硫酸铵分级分离初步纯化,获得粗酶制剂.经再生几丁质亲和柱层析、Sephadex G-100凝胶过滤柱层析和DE-52离子交换柱层析等步骤纯化,获得提纯约33倍,比活力为294.7U/mg的酶制剂.再生几丁质亲和柱层析、Sephadex G-100柱层析和DE-52柱层析的洗脱图谱分别见图1~3,提纯过程各步骤结果总结于表1.表1 黄粉虫几丁质酶各步分离纯化结果?2.2 黄粉虫几丁质酶的动力学参数测定分别以0.5mL的0.2%、0.6%、1.0%、1.4%、1.8%(即浓度分别为0.2、0.6、1.0、1.4、1.8mg/mL)胶体几丁质为底物,加入0.5mL 0.1mol/L pH 6.0磷酸缓冲液,45℃预热10min后加入0.5mL几丁质酶液,测定底物反应速率,用Lineweaver-Burk双倒数作图法,求得黄粉虫几丁质酶催化胶体几丁质水解的米氏常数(Km)值.由图4的横轴截距求得动力学常数Km值为71.4mg/L.2.3 黄粉虫几丁质酶的最适温度及热稳定性按1.2.8方法考察黄粉虫几丁质酶催化水解几丁质的最适温度及热稳定性,实验结果如图5.结果表明,酶的最适温度为45℃左右;在45℃以上,随着温度的升高,酶促反应速度逐渐下降.当温度升高至55℃时,酶活性降低了72.97%;当温度升高到65℃时,酶活性仅为5.41%.进一步研究几丁质酶在不同的温度下经热处理1h后的剩余酶活力,结果表明:酶在45℃下热稳定性较好,随温度的升高,热稳定性急剧降低,当在高于65℃下热变性1h后,酶活力将近为0.图5 温度对黄粉虫几丁质酶活力的影响图6 pH对黄粉虫几丁质酶活力的影响2.4 黄粉虫几丁质酶的最适pH及pH稳定性用1.2.9方法研究黄粉虫几丁质酶催化水解几丁质的最适pH及pH稳定性,结果见图6.由图可知,该酶催化几丁质水解的最适pH值为6.0,在pH 5.0~7.0之间稳定性相对比较好,一旦高出该范围,酶活降低得较快.2.5 金属离子对黄粉虫几丁质酶活力的影响2.5.1 正一价金属离子对酶活力的影响以KCl、K2SO4、NaCl为效应物,往几丁质酶测活体系中加入不同浓度的效应物,考察Na+、K+和Cl-、SO2-4对几丁质酶活力的影响.结果见表2.由表可见,在0~20mmol/L的效应物浓度范围内,KCl、K2SO4、NaCl对黄粉虫几丁质酶催化几丁质水解产生还原糖的活力没有明显影响.结果表明,Na+和K+对酶活力无影响效应,无机酸根离子Cl-、SO2-4对酶活力也无影响.表2 正一价金属离子对黄粉虫几丁质酶活力的影响KCl浓度/mmol·L-1A500nm K2SO4浓度/mmol·L-1 A500nm NaCl浓度/mmol·L-1 A500nm 0.0 0.030 0.0 0.030 0.0 0.0304.0 0.029 4.0 0.030 4.0 0.0318.0 0.028 8.0 0.031 8.0 0.03212.0 0.030 12.0 0.029 12.0 0.03116.0 0.029 16.0 0.029 16.00.02920.0 0.030 20.0 0.029 20.0 0.0292.5.2 部分二价碱土金属离子对酶活力的影响以CaCl2、MgCl2为效应物,考察0~5mmol/L浓度范围内的CaCl2、MgCl2对几丁质酶活力的影响,结果如图7.由图可知,Ca2+对几丁质酶活力具有先扬后抑作用,当Ca2+浓度为1~3mmol/L时,对几丁质酶活具有激活作用,酶活最高达116.67%;当Ca2+浓度为4mmol/L时,Ca2+开始对酶活呈现抑制作用,酶活降低7.67%,当Ca2+浓度为5mmol/L时,酶活降低了20%.而Mg2+对几丁质酶活力几乎无影响. 图7 Ca2+、Mg2+对黄粉虫几丁质酶活力的影响图8 Cu2+、Mn2+对黄粉虫几丁质酶活影响2.5.3 部分正二价过渡金属离子对酶活力的影响研究0~20mmol/L浓度范围内的CuCl2、MnCl2对几丁质酶活力的影响,结果如图8.由图可知:Cu2+浓度为4mmol/L时,对酶活有微弱的激活作用,酶活提高6.67%,但随着Cu2+浓度的增加,激活作用减小,并转为抑制作用,当Cu2+浓度为18.5mmol/L时,使酶活下降50%.Mn2+对酶活具有较强的抑制作用,当 Mn2+浓度为4mmol/L 时,酶活降低23.33%;当 Mn2+浓度为13 mmol/L时,相对酶活剩下50%.2.5.4 正三价金属离子对酶活力影响研究0~20mmol/L浓度范围的FeCl3、Al2(SO4)3对几丁质酶活力的影响,结果如图9.由图可见:Fe3+对酶活有微弱的抑制作用;Al 3+对酶活抑制作用较强,当Al 3+浓度为4mmol/L时,酶活降低13.33%,但当Al 3+达一定浓度时,抑制作用趋于稳定.图9 Fe3+、Al3+对黄粉虫几丁质酶活力的影响3 讨论目前,国内外已报道了不同来源的几丁质酶的分离纯化及性质研究,但对昆虫等动物几丁质酶的研究较少.本文从黄粉虫体内提取几丁质酶,并对其性质进行一系列的研究.研究结果显示,采用盐析、亲和柱层析、Sephadex G-100分子筛及DEAE-32离子交换等可制得纯化倍数约33倍、回收率为38%、比活力为294.7U/mg的几丁质酶制剂,表明该纯化工艺合理、可行.蛋白酶具有高效性、专一性、反应条件温和性、活力可调控性及对外境环境条件的敏感性等特点,酶的性质研究对酶的开发、保存具有重要意义.本文对黄粉虫几丁质酶进行性质研究,结果表明:黄粉虫几丁质酶的最适温度为45℃左右,最适pH为6.0.图5最适温度曲线及热稳定曲线显示,当酶在温度为30℃下保存1h后,酶活力与4℃下保存的酶活力相当;酶在30~45℃范围内保存,酶活力随温度升高出现轻微下降;酶在大于45℃下保存,酶活力迅速下降.说明酶在45℃下具有良好的稳定性.图6最适pH曲线与pH稳定性曲线显示,酶在pH 6.0下保存,酶活力基本没有丧失,酶在pH 5.0、7.0下保存酶活力出现轻微下降,表明酶在pH 5.0~9.0之间具有良好的稳定性.各种金属离子对酶活力的影响显示,Ca2+、Cu2+对酶活有先扬后抑作用,Mn2+对酶具有较强的抑制作用,Fe3+、Al 3+对酶活有微弱的抑制作用,Mg2+、Na+和K+对酶活无影响.研究结果与已有的报道相比较,酶的最适温度、最适pH值以及金属离子对酶活力的影响等性质均有差异.李友宾等报道罗氏沼虾肝胰腺几丁质酶最适pH值为4.0,最适温度55℃[7].姚祥春等研究发现单胞菌产几丁质酶最适pH值为7.0左右,最适反应温度为45℃左右[9].蔡荟酶等报道金龟子绿僵菌几丁质酶最适pH值为5.0,最适反应温度为50℃[10].碱土金属中,Mg2+对单胞菌产几丁质酶、金龟子绿僵菌几丁质酶均有激活作用[9-10],但对黄粉虫几丁质酶无影响;Ca2+对单胞菌产几丁质酶具有先扬后抑作用[9],与本实验类似,但对苏云金芽孢杆菌几丁质酶起抑制作用[11].Cu2+、Mn2+、Fe3+对单胞菌产几丁质酶均有抑制作用[9],但Cu2+对黄粉虫几丁质酶先表现微弱激活后转为抑制.这些差异表明不同来源几丁质酶的性质有所不同,这可能与不同生物来源的几丁质酶的生理功能不尽相同有关.参考文献:[1]陈耀溪.仓储害虫[M].北京:中国农业出版社,1989.[2]黄乾生,谢晓兰,陈清西.几丁质酶的结构特征与功能[J].厦门大学学报:自然科学版,2008(12):232-235.[3]ZHU Q,MATHER E A,MASOUD S,et al.Enhanced proteion againstfungal attack by constitutive co-expressing of chitinase and glucanase genes in transgenic tobacco[J].Biotechnology,1994,12:807-812. [4]WANG S Y,SHAO B,YE X Y,et al.Purification and characterization of a chitinase from peanut(A rachishy pogaea L.)[J].Journal of Food Biochemistry,2008,32:32-45.[5]肖业臣,罗晓斌,冯佩富,等.昆虫几丁质酶的研究进展[J].生物技术,2003,13(1):38-39.[6]刘明艳,张洪斌,胡雪芹,等.昆虫来源的几丁质酶的分离纯化及酶学性质[J].生物工程学报,2010,26(3):404-409.[7]李友宾.罗氏沼虾肝胰腺几丁质酶的亲和-消化纯化方法初探[J].湛江海洋大学学报,2001,21(2):69-71.[8]李建武,陈丽蓉,陈雅蕙,等.生物化学实验原理和方法[M].北京:北京大学出版社,1994.[9]姚祥春,金伟军.单胞菌产几丁质酶的酶学性质研究[J].现代食品科技,2008,24:227-229.[10]蔡荟酶,刘斌.金龟子绿僵菌几丁质酶的纯化及性质[J].中国粮油学报,2010,25(4):56-60.[11]黄小红,许雷,陈清西,等.金属离子对苏云金芽孢杆菌几丁质酶活力的影响[J].农业生物技术学报,2005,13(2):264-265.。
KCl部分替代NaCl对腊肉蛋白质氧化、降解及质构的影响

KCl部分替代NaCl对腊肉蛋白质氧化、降解及质构的影响甘潇;李洪军;王兆明;周心雅;贺稚非【摘要】为探讨KCl部分替代对腊肉蛋白质氧化,降解和腊肉质构特性的影响,该研究以KCl 30%,50%,70%(质量分数)分别替代NaCl的低盐腊肉,100% NaCl含量的对照组腊肉为研究对象,检测了腊肉的蛋白质氧化,降解,脂肪氧化和质构特性,并对蛋白质降解,蛋白质氧化和脂肪氧化与质构特性等进行了相关性分析.结果表明,KCl 70%替代组腊肉蛋白质氧化,蛋白质降解程度显著高于对照组,且质构特性均显著区别于对照组.此外,低盐腊肉的蛋白质氧化和蛋白质降解与质构特性有显著相关性.【期刊名称】《食品与发酵工业》【年(卷),期】2019(045)004【总页数】7页(P167-173)【关键词】低盐;腊肉;蛋白质氧化;蛋白质降解;脂肪氧化;质构【作者】甘潇;李洪军;王兆明;周心雅;贺稚非【作者单位】西南大学食品科学学院,重庆,400715;西南大学食品科学学院,重庆,400715;重庆市特色食品工程技术研究中心,重庆,400715;西南大学食品科学学院,重庆,400715;西南大学食品科学学院,重庆,400715;西南大学食品科学学院,重庆,400715;重庆市特色食品工程技术研究中心,重庆,400715【正文语种】中文NaCl是腌腊肉制品的必需配料。
由于高钠盐的过度摄入有导致发生高血压,中风和冠心病的风险[1],因此国内外食品工作者一直致力于低盐腌腊肉制品的研究工作[2-5]。
低盐肉制品的研究旨在保持传统肉制品品质的基础上最大化地降低NaCl 的含量。
KCl是减少腌腊肉制品中氯化钠含量的最广泛研究的钠盐替代品。
大量研究报道指出,KCl的适度替代对腌腊肉制品的品质不会造成明显的不利影响[6-8]。
在腊肉生产过程中,蛋白质氧化与降解是形成腊肉特征色泽、风味及质构品质的必要步骤。
蛋白质氧化诱导的结构修饰可以改变蛋白质功能并因此影响肉制品的质量,尤其是在肉制品加工过程中,机械作用会破坏细胞的整体结构并打破其抗氧化防御体系,导致蛋白质氧化的高度敏感性[9],蛋白质氧化对肉制品的持水力,凝胶特性[10]和质构特性[11]等都会有一定的影响。
微波化学法脱除油菜籽饼粕中硫苷的研究

微波化学法脱除油菜籽饼粕中硫苷的研究于洋;王承明【摘要】利用微波化学脱除法及响应面设计法对菜籽饼粕中硫苷的脱除工艺进行研究.对多种化学试剂脱毒效果进行比较,筛选最佳试剂,并在单因素的基础上,选定饼粕初始含水量、微波时间、化学试剂浓度3个因素,通过响应面分析得到了优化组合条件.最佳工艺条件是:CaCl2处理菜籽饼粕后,在700 W微波条件下,饼粕初始含水率为33.7%,微波时间为2.29 min,化学试剂质量分数为3.2%,硫苷脱除率为69.27%.%Microwave - chemistry extraction of glucosinolate from rapeseed meal was studied by adopting response surface methodology design. One from twelve reagents was selected as de - glucosinolate reagent by comparing their extraction effects. Three factors, such as initial moisture of meal, extraction time and chemical reagent concentration ,were investigated on the basis of single factor tests. By analyzing the response surface plots ,the optimal conditions were established. Results:The optimal conditions are treating rapeseed meal with chemical reagent CaCl2 at concentration of 3.2%, microwave power 700 W, initial moisture of meal 33.7%, and extraction time 2.29 min. The corresponding removal rate of glucosinolate is 69.27%.【期刊名称】《中国粮油学报》【年(卷),期】2011(026)003【总页数】5页(P47-51)【关键词】硫苷;脱除;微波;化学试剂;响应曲面法【作者】于洋;王承明【作者单位】农业部食品安全评价重点开放实验室,华中农业大学食品科学技术学院,武汉,430070;农业部食品安全评价重点开放实验室,华中农业大学食品科学技术学院,武汉,430070【正文语种】中文【中图分类】TQ645.9+9硫代葡萄糖苷(glucosinolate)简称硫苷,硫苷是油菜种子中的主要有害成分。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
3.3 KCl 浓度对几丁聚糖分子量的影响 从图 5 可以看出,随着 KCl 浓度的上升(反应时间为 10 min,下同),几丁聚糖分子量开始呈 现下降趋势,当 KCl 浓度达到 0.2 mol/L 附近时,几丁聚糖分子量却开始呈现上升的趋势. 这种现 象与体系对微波的吸收相关. 因为随着 KCl 浓度的增加,加大了几丁聚糖分子热运动以及大分子 之ห้องสมุดไป่ตู้碰撞几率,从而加快了几丁聚糖大分子链的降解. 但是当 KCl 浓度达到 0.2 mol/L 附近时,由 KCl 浓度增加而产生的对微波的吸收减少成为了主要影响因素,温度相应降低,分子的运动也相 应减弱,所以分子链受到破坏的几率也就减少,分子量因而随之逐渐增大.
[NH 2 ] = {0.016(C1V1 − C2V2 ) [W (1 − CH 2 O )]} × 100% ,
DD = 203[NH 2 ] {42[NH 2 ] + 16} × 100% ,
(1) (2)
式中 C1, C2 为盐酸和 NaOH 标准溶液浓度(mol/L), V1, V2 为加入的盐酸和 NaOH 标准溶液体积(ml), 0.016 为 1 ml 盐酸溶液(1 mol/L)相当的胺量(g),W 为样品的质量(g),CH2O 为样品水份含量. 2.2.3 几丁聚糖分子量的测定 几丁聚糖是一种线性大分子聚合物,其分子量测定方法有粘度法、光散射法、端基分析法、 渗透压法、蒸汽压法、高压液相色谱法、凝胶色谱法和超过滤法等[13]. 本工作采用粘度法,根据 经验公式 Mark−Houwink 方程计算:
C O O NHAc C
+ NaOH
n
O O NH2
+ NaAc.
n
(4)
因为在整个反应体系中 NaOH 远远过量,所以可以假定反应速率只与乙酰胺基浓度有关,这 种情况下,脱乙酰反应又可看作一个拟一级反应[15]. 按照一级反应的特点,要想完全脱除乙酰基 要花很长时间. 这一点从图 1 中也可以看出,随着反应时间的延长,脱乙酰度的增加越来越慢. 另 一方面,几丁质粉末在浓 NaOH 溶液中不溶而形成悬浮液,脱乙酰反应可以看作一缩核反应. 几 丁质颗粒的外层很快参与反应,但随着反应的进行,传质阻力影响了反应的进行,从而导致了反 应速率下降. 随着反应的进行,几丁聚糖的分子量也随之减小. 这是因为,在利用强碱进行脱乙酰反应的 同时,会发生几丁质、几丁聚糖分子链的断裂降解,从而导致粘度下降、分子量降低. 结果如图 2 所示. 从图中可以看出, 刚开始时, 分子量下降趋势较慢, 随着反应时间的延长, 反应温度的升高, 加速了分子链的断裂降解,造成了分子量减小的速度趋快.
图 2 反应时间对几丁聚糖分子量的影响 Fig.2 Effect of reaction time on MW of chitosan
3.2 KCl 浓度对几丁聚糖脱乙酰度的影响 从图 3 可以看出,反应体系的温升要低于对照组([KCl]=0);随着 KCl 浓度的上升,温升随之 下降,脱乙酰度也呈下降趋势,见图 4. 但在实验范围内,脱乙酰度均大于对照组. KCl 浓度增加会增加体系的损耗角正切值(tgδ ),导致对微波的吸收增加,但是随着 tgδ 上升, 微波的穿透深度下降,受到微波作用的体积也就变小;另外,tgδ 随着温度的上升而下降[7]. 综合 这些因素的影响, 整个体系对微波能的吸收减少, 从而导致了整个体系的温度下降. 但在微波场中, 离子的快速极化作用会促进、强化能量的传递,而导致反应物分子间碰撞机率增加,促进了脱乙 酰反应, 在较低离子浓度下([KCl]=0.05 mol/L), 脱乙酰度达到 79.26%, 与对照组相比(DD=69.84%), 提高了 13.5%. 但是,随着离子浓度的上升,温升的影响越来越大,所以脱乙酰度呈现出下降趋势. 离子类型对几丁质脱乙酰反应的影响这里没有考虑.
84 82 80 78 76 74 72 70 68 66 64
9.0 Molecular weight (× 10 )
-5
Degree of deacetylation (%)
8.5 8.0 7.5 7.0 6.5 6.0
[NaOH]=45% solid:liquid=1:20 [KCl]=0.05 mol/L
2
实 验
几丁质以虾壳为原料按照文献[11]方法实验室自制,并粉碎至 60 目(约 250 µm);NaOH,化学
2.1 原料与实验装置
收稿日期:2002−09−16,修回日期:2002−11−11 作者简介:仰振球(1973−),男,安徽省安庆市潜山县人,博士研究生,化学工艺专业.
38
过 程 工 程 学 报
3
结果和讨论
几丁聚糖脱乙酰度与反应时间的关系如图 1 所示. 从图可以看出, 固液比为 1:20, NaOH 浓度
3.1 反应时间对几丁聚糖脱乙酰度和分子量的影响 为 45%,在微波场中进行脱乙酰反应,连续反应 4 min,脱乙酰度可以达到 65.4%. 持续 20 min 左 右,脱乙酰度即可达到 80%以上. 开始脱乙酰度随反应时间的延长增大较快,但是反应 12 min 后,
[NaOH]=45%, solid:liquid=1:20, [KCl]=0.05 mol/L
2
4
6
8
10
12
14
16
18
20
22
2
4
6
8
10
12
14
16
18
20
22
Reaction time (min)
Reaction time (min)
图 1 反应时间对几丁聚糖脱乙酰度的影响 Fig.1 Effect of reaction time on DD of chitosan
第 3 卷第 1 期 2003 年 2 月
过 程 工 程 学 报 The Chinese Journal of Process Engineering
Vol.3 No.1 Feb. 2003
微波场中 KCl 浓度对几丁质脱乙酰反应的影响
仰振球, 宋宝珍, 欧阳藩
(中国科学院过程工程研究所,北京 100080)
1
前 言
几丁质(Chitin),又名甲壳素、甲壳质、壳多糖,自然界中每年的生物合成量达 100 亿吨,仅
次于结构类似的纤维素, 在自然界的碳氮循环中起着重要的作用. 几丁质经脱乙酰化处理后得到的 产物称为几丁聚糖(Chitosan),又称壳聚糖. 几丁质和几丁聚糖及其衍生物不仅具有许多独特的物 化特性,而且具有良好的生物相容性和生物可降解性,广泛应用于食品、化妆品、轻工、印染、 环保和生物医药等领域[1−5] 以甲壳类动物壳(虾、蟹)为原料,先用盐酸脱钙,再用碱进行脱蛋白、脱乙酰反应,通过控制 反应温度和反应时间,可以得到一定脱乙酰度的几丁聚糖. 尽管这种工艺简单、操作方便,但是存 在着反应时间长(十几个小时左右)、污染比较严重、生产成本高等许多缺点. 因此许多新的制备方 法及工艺过程正在研究开发. 微波可以促进化学反应的进行. 据报道[6],在微波场中,用 4−氰基苯氧离子与氰苄的 SN2 亲 核取代反应可以使反应速率提高 1 240 倍,并且提高了产率. 微波对反应的作用除了与反应的类型 有关外,还与微波的强度、频率、调制方式以及体系的环境有关[7]. 在微波场中介质的加热机理有 两种,即离子传导(ionic conduction)和偶极子转动(dipole rotation). 影响离子传导的因素是离子浓 度、离子迁移率和溶液的温度. 随离子浓度的增大,介质的损耗因子增大. 温度不仅影响离子溶液 中介质耗散因子,对离子迁移率和浓度场均有影响[8]. 微波场能加快几丁质脱乙酰反应[9,10]. 本工作重点考察了在固定微波频率(2.45 GHz)、固定调 制方式条件下,体系环境的重要因素—KCl 浓度的变化对微波场中几丁质脱乙酰反应的影响.
[η ] = KM α ,
(3)
式中,[η]为特性粘度;K, α为常数,对几丁聚糖溶液体系,与几丁聚糖的脱乙酰度有关,根据文 献[14]进行修正;M 为粘均分子量. 称取 50 mg 几丁聚糖,溶于 20 ml 缓冲溶液(0. 2 mol/L 醋酸+0.1 mol /L 醋酸钠缓冲溶液),采 用乌氏粘度计测量几丁聚糖溶液的粘度. 体系温度由恒温水浴保持在(30±0.1)oC. 2.2.4 几丁聚糖结构的 13C CP/MAS NMR 表征 对于难溶性样品,固体核磁技术可以避免样品溶解而测定其波谱特征信息. 本文用
0.5
0.0
0.1
0.2
0.3
0.4
0.5
[KCl] (mol/L)
[KCl] (mol/L)
图 3 KCl 浓度对体系温度的影响 Fig.3 Temperature vs. concentration of KCl
图 4 KCl 浓度对几丁聚糖脱乙酰度的影响 Fig.4 DD vs. concentration of KCl
摘 要:研究了 KCl 浓度对几丁质在微波场中脱乙酰反应的影响. 结果表明,引入盐离子促进了 反应的进行. 随着反应时间的延长,几丁聚糖的脱乙酰度上升,但上升速度逐渐变慢,呈一级反应 特征;分子量随时间延长而降低. 脱乙酰度随 KCl 浓度上升而减小,但在实验范围内,均高于对 照组. 当[KCl]=0.05 mol/L 时脱乙酰度达到 79.26%, 与对照组相比(脱乙酰度=69.84%)提高了 13.5%. 随 KCl 浓度的上升, 分子量开始减小, 当 KCl 浓度上升到 0.2 mol/L 附近时, 分子量又呈上升趋势. 这是由于 KCl 浓度影响体系介质损耗角正切值, 在较高 KCl 浓度时降低了体系对微波的吸收能力. 关键词:几丁质;几丁聚糖;微波;脱乙酰反应 中图分类号:TQ039 文献标识码:A 文章编号:1009−606X(2003)01−0037−06
3卷
