知识点2-波谱分析简介
波谱分析

波谱分析波谱分析是一种重要的科学技术方法,它在多个领域有着广泛的应用。
本文将为读者介绍波谱分析的原理、方法以及其在不同领域中的应用,希望能够带给读者一些有关波谱分析的基础知识。
波谱分析是一种通过对信号频谱的分析,来研究信号特性的方法。
它主要通过将信号转化为频域来进行分析,以便更好地理解信号的频率成分。
波谱分析通常包括以下步骤:信号采样、转换为频域信号、频域信号分析以及结果展示。
在波谱分析中,最基础的是信号采样。
信号采样即将连续的模拟信号转化为离散的数字信号。
通过采样,我们获得了离散的信号数据,为后续的分析提供了基础。
转换为频域信号是波谱分析的关键步骤。
这一步骤主要通过傅里叶变换来实现,将时域信号转化为频域信号。
傅里叶变换能够将信号分解成一系列频率成分,使得我们能够更加清晰地了解信号的频率特征。
在波谱分析的频域信号分析阶段,我们可以使用不同的方法来对信号进行进一步的分析。
常见的方法包括功率谱分析、相位谱分析、自相关分析等。
功率谱分析可以帮助我们了解信号各个频率成分对总体信号功率的贡献程度,相位谱分析可以揭示信号的相位变化规律,自相关分析则是通过计算信号与其自身的相关性来分析信号的周期性变化。
波谱分析在不同的领域中都有广泛的应用。
在通信领域中,波谱分析可以用于信号传输中的频率选择性衰减的检测和修复;在音频领域中,波谱分析可以用于声音信号的处理和音乐分析;在医学领域中,波谱分析可以用于心电图和脑电图的分析,帮助医生进行诊断和治疗。
此外,波谱分析在材料科学、地震学、天文学等领域也有广泛应用。
在材料科学中,波谱分析可以用于材料结构的研究和分析;在地震学中,波谱分析可以用于地震波的研究和地震活动的监测;在天文学中,波谱分析可以用于星体的研究和宇宙的探索。
总结起来,波谱分析是一种基于信号频谱的分析方法,它通过将信号转化为频域信号来研究信号的特性。
波谱分析包括信号采样、转换为频域信号、频域信号分析以及结果展示等步骤。
波谱分析知识点
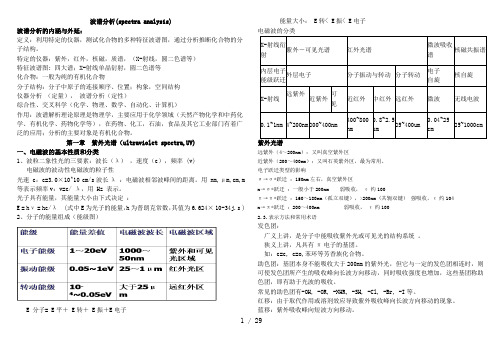
波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率 (v)电磁波的波动性电磁波的粒子性光速 c:c=3.0×10^10 cm/s波长λ :电磁波相邻波峰间的距离。
用nm,μm,cm,m 等表示频率v:v=c/ λ,用 Hz 表示。
光子具有能量,其能量大小由下式决定:E = hν =hc/λ (式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s )2、分子的能量组成(能级图)E 分子= E平+ E转+ E振+E电子能量大小: E转< E振< E电子X-射线衍射紫外-可见光谱红外光谱微波吸收谱核磁共振谱内层电子能级跃迁外层电子分子振动与转动分子转动电子自旋核自旋X-射线远紫外近紫外可见近红外中红外远红外微波无线电波0.1~1nm 4~200nm 200~400nm400~800nm0.8~2.5um25~400um0.04~25cm25~1000cm 紫外光谱远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。
电子跃迁类型的影响σ→σ*跃迁:150nm左右,真空紫外区n→σ*跃迁:一般小于200nm 弱吸收,ε约100π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104n→π*跃迁:200~400nm 弱吸收,ε约1002.3.表示方法和常用术语发色团:广义上讲,是分子中能吸收紫外光或可见光的结构系统。
波谱解析知识点总结

波谱解析知识点总结一、波谱解析的基本原理1. 光谱学基础知识光谱学涉及到物质对光的吸收、发射、散射等现象,它是物质分析的重要手段之一。
常见的光谱包括紫外光谱、可见光谱、红外光谱、拉曼光谱等。
每种光谱方法都有其独特的应用领域和分析特点。
2. 原子光谱原子光谱是指研究原子吸收、发射光谱的一门学科,主要包括原子吸收光谱和原子发射光谱。
原子光谱可以用于分析金属元素和非金属元素的含量,它是分析化学中的重要手段。
3. 分子光谱分子光谱是指研究分子在光的作用下吸收、发射、散射等现象的一门学科,主要包括紫外光谱、红外光谱、拉曼光谱等。
分子光谱可以用于研究分子的结构和性质,对于有机化合物的分析具有重要意义。
4. 核磁共振波谱核磁共振波谱是指研究核磁共振现象的一门学科,它可以用于研究原子核的磁共振现象,得到有关物质结构和性质的信息。
核磁共振波谱在有机化学、生物化学等领域有着广泛的应用。
二、波谱解析的仪器和设备1. 分光光度计分光光度计是用于测量物质吸收、发射光谱的仪器,它可以测量紫外、可见、红外等波段的光谱,是分析化学中常用的仪器之一。
2. 核磁共振仪核磁共振仪是用于测量核磁共振波谱的仪器,它可以测量氢、碳等核的共振信号,得到物质的结构和性质信息。
3. 质谱仪质谱仪是用于测量物质离子的质量和荷质比的仪器,它可以得到物质的分子量、结构等信息,是很多化学分析的重要手段。
4. 激光拉曼光谱仪激光拉曼光谱仪是用于测量拉曼光谱的专用仪器,它可以用激光光源激发样品,得到与分子振动信息有关的拉曼光谱。
三、波谱解析的应用领域1. 化学分析波谱解析技术在化学分析中有着广泛的应用,它可以用于定量分析、质量分析、结构分析等多个方面,对于复杂的化合物和材料有很高的分析能力。
2. 药物研发波谱解析技术在药物研发中有着重要的应用,它可以用于研究药物的成分、结构和性质,对于新药物的研究和开发有很大帮助。
3. 生物医学波谱解析技术在生物医学领域有着广泛的应用,它可以用于研究生物分子的结构和功能,对于临床诊断和治疗有着重要意义。
波谱分析II

助色团(auxochrome) : 本身并无近紫外吸收,但与发色团相连时,常常要影响 λmax和εmax的基团。例如:
B¡¡ ¡ lmax 255nm( e 230) OH B¡¡lmax 270nm( e 1450) ¡ Cl B¡¡lmax280nm( e 1430)
特点:助色团一般是带有p电子的基团。例如:
-OH ¡-NH2 ¡-OR ¡ 2 ¡ ¡ ¡ -NR -SR -X
红移与蓝移 红移(red shift) (深色位移,bathochromic shift): 由取代基或溶剂效应引起的λmax向长波方向移动 的 现象。 蓝移(紫移,blue shift) 由取代基或溶剂效应引起的λmax向短波方向移动的 现象。 增色效应与减色效应 增色效应——使最大吸收强度(εmax)↑的效应。
单位:nm
最低波长极限
水
甲醇 异丙醇
210
215 215
二氯甲烷
氯仿 四氯化碳
235
245 265
甘油
乙醇 正丁醇 丙酮 乙醚
1,1-二氯乙烷
230
215 210 330 210
苯
乙烷 庚烷 环己烷 十氢萘
280
210 210 210 200
235
选取溶剂需注意下列几点:
1) 当光的波长减小到一定数值时,溶剂会对它产生强 烈的吸
强度强( e >104 ) 苯环上的p p*电子跃迁所引起 波长一般在230 ~ 270 nm p p*电子跃迁所引起
各种吸收带举例:
CH=CH2 K´ £ lmax 244nm( e 12000) ø º B´ £ lmax 282nm( e 450) ø º
CH3 OH CH=CH2 E2´ £ lmax 208nm( e 2460) ø º E2´ £ lmax 210nm( e 6200) ø º K´ £ lmax 244nm( e 12000) ø º
波谱分析知识点
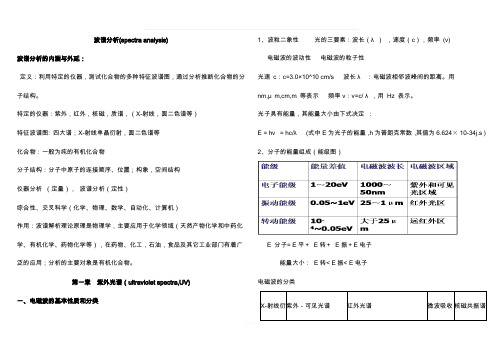
波谱分析(spectra analysis)波谱分析的内涵与外延:定义:利用特定的仪器,测试化合物的多种特征波谱图,通过分析推断化合物的分子结构。
特定的仪器:紫外,红外,核磁,质谱,(X-射线,圆二色谱等)特征波谱图: 四大谱;X-射线单晶衍射,圆二色谱等化合物:一般为纯的有机化合物分子结构:分子中原子的连接顺序、位置;构象,空间结构仪器分析(定量),波谱分析(定性)综合性、交叉科学(化学、物理、数学、自动化、计算机)作用:波谱解析理论原理是物理学,主要应用于化学领域(天然产物化学和中药化学、有机化学、药物化学等),在药物、化工,石油,食品及其它工业部门有着广泛的应用;分析的主要对象是有机化合物。
第一章紫外光谱(ultraviolet spectra,UV)一、电磁波的基本性质和分类1、波粒二象性光的三要素:波长(λ),速度(c),频率(v)电磁波的波动性电磁波的粒子性光速c:c=3.0×10^10 cm/s 波长λ:电磁波相邻波峰间的距离。
用nm,μm,cm,m 等表示频率v:v=c/ λ,用Hz 表示。
光子具有能量,其能量大小由下式决定:E = hν = hc/λ(式中E为光子的能量,h为普朗克常数,其值为6.624× 10-34j.s )2、分子的能量组成(能级图)E 分子= E平+E转+E振+E电子能量大小:E转< E振< E电子电磁波的分类紫外光谱远紫外(4~200nm):又叫真空紫外区近紫外(200~400nm):又叫石英紫外区,最为常用。
电子跃迁类型的影响σ→σ*跃迁:150nm左右,真空紫外区n→σ*跃迁:一般小于200nm 弱吸收,ε约100 π→π*跃迁:160~180nm(孤立双键),>200nm (共轭双键)强吸收,ε约104 n→π*跃迁:200~400nm 弱吸收,ε约100 2.3.表示方法和常用术语发色团:广义上讲,是分子中能吸收紫外光或可见光的结构系统。
波谱解析知识点总结

波谱解析知识点总结
波谱解析是一种重要的分析技术,用于确定不同化学物质的组成和结构。
以下是一些波谱解析的知识点总结:
## 红外光谱学
-红外光谱是一种分析技术,用于确定化合物中的功能性基团和化学键类型。
-红外光谱图谱中峰的位置和强度可以提供有关样品的信息,例如它的结构和杂质。
-峰的位置是由化学键的振动频率决定的,峰的强度则取决于化学键的极性和吸收系数。
## 质谱学
-质谱学是一种分析技术,用于确定化合物的分子量和组成。
-质谱图谱中,峰的位置和强度可以提供有关样品的信息,例如它的分子量、化合物的结构和分子离子的分布。
-峰的位置是由分子离子质量-电荷比决定的,峰的强度则取决于分子离子的相对丰度。
## 核磁共振
-核磁共振是一种分析技术,可以确定化合物的分子结构和组成。
-核磁共振图谱中峰的位置和强度可以提供有关样品的信息,例如它的结构、分子间的相对位置和化学环境。
-峰的位置是由核自旋能级决定的,峰的强度则取决于核自旋数和相对丰度。
以上是波谱解析的一些基本知识点总结。
不同的波谱技术可以提供不同的信息,使用合适的技术对样品进行分析可以提高分析的准确性和灵敏度。
知识点2-波谱分析简介

可见光 近红外光 中红外光 远红外光 微波 射频
400-750nm 0.75-2.5mm 2.5-50mm 50-1000mm 0.1-100cm 1-1000m
2.5104-1.3104 1.3104-4103 4000-200 200-10 10-0.01 10-2-10-5
7.5108-4.0108 4.0108-1.2108 1.2108-6.0106 6.0106-105 105-102 102-0.1
分子中的这三种运动状态都对应有一定的能 级。即在分子中存在着电子能级、振动能级和转 动能级。其中电子能级的间距最大(每个能级间 的能量差叫能级差),振动能级次之,转动能级 的间距最小。 如果用E电子, E振以及 E转表示各能级差, 则:
E电子> E振> E转
能级跃迁
E转 ‹ E振 ‹ E电 电子能级间跃迁的 同时,总伴随有振动和 转动能级间的跃迁。即 电子光谱中总包含有振 动能级和转动能级间跃 迁产生的若干谱线而呈 现宽谱带。
E2 (激发态)
E
光谱仪
E E1(基态)
A
当用光照射分子时,分子就要选择性的吸收某些 波长(频率)的光而由较低的能级E1跃迁到较高能级 E2上,所吸收的光的能量就等于两能级的能量之差: E = E1 - E2
物质对光的选择性吸收 M + 热 M + 荧光或磷光
M + h 基态 E1
3.1-1.7 1.7-0.5 分子振动能级 0.5-0.02 210-2-410-4 410-4-410-7 410-7-410-10 分子转动能级 分子转动,电 子自旋 电子自旋、核自旋
讨论:
1(1)转动能级间的能量差ΔΕr:0.005~0.050eV,跃 迁产生吸收光谱位于远红外区。远红外光谱或分子转动光谱 ; 1(2)振动能级的能量差ΔΕv约为:0.05~1eV,跃迁 产生的吸收光谱位于红外区,红外光谱或分子振动光谱;
大学本科有机化学02 波谱分析

因此一个质子的化学位移是由其周围的化学环境决 定的,可以通过核磁共振区别不同化学环境的氢.
化学位移的差别非常微小,约为百万分之十,使 用不便,而且仪器频率(成正比)不同,结果也不 同.因此一般采用相对数值。以四甲基硅(CH3)4Si (TMS: tetramethylsilane)为标准物质,规定:它 的化学位移为零,确定其他氢的化学位移值。
屏蔽效应——感应磁场在质子处的磁矩方向与外加磁 场相反,氢核所感受到的实际磁场B有效小于外磁场 B0 ,这种作用称屏蔽效应。 B有效 = B0 - B感应
no shielded nuclei
shilded nuclei
吸收移向高场
有机分子中每个氢原子核所处的化学环境不同, 在外加磁场中产生的抗磁的感应磁场大小不同,因 此,不同核发生共振所需的外加磁场强度也就不同, 会给出不同位置的吸收信号。
分子内部的运动: —— 电子运动—— 电子能级 —— 共价键的振动—— 振动能级 —— 原子核自旋运动
根据电磁波的波长 ()划分为几个不同的区域,如下
图所示:
质谱:不是由于吸收电磁波而产生的吸收光谱,而 是分子被打碎,不同碎片排列组成的谱,但是它同 以上三种方法一起用于结构鉴定,谱图也相似,故 统称为波谱。
四、紫外光谱在有机化合物结构鉴定中的应用
1. 判定分子中是否有共轭体系或某些官能团存在 例如:分子在200-400nm区内无吸收,化合物多为饱和化
合物或简单烯炔烃。如果光谱中有很多吸收带,且有一 些在可见光区,说明分子中有共轭体系。 如在270-350nm区有弱吸收<100,在200-260nm以内 无吸收,可推断只有一个含未共用电子对的不饱和基团, 如C=O,C=N等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
紫外及可见光
400nm 800nm
红外光
2.5mm 25mm
无线电波
600MHz 60MHz
微波、 电视波
200-800nm:引起电子运动能级跃迁,
得到紫外及可见光谱; 2.5-25μm:引起分子振、转能级跃 迁,得到红外光谱; 60-600MHz:核在外加磁场中取向能 级跃迁,得到核磁共振谱。
由图可见,在每一个电子能级上有许多间距较小 的振动能级,在每一个振动能级上又有许多间距更小 的转动能级。由于这个原因,处在同一电子能级的分 子,可能因振动能量不同而处于不同的能级上。同理, 处于同一电子能级和同一振动能级上的分子,由于转 动能量不同而处于不同的能级上。
用电磁波照射有机分子时,分子便会吸收那 些与分子内的能级差相当的电磁波,引起分子振 动、转动或电子运动能级跃迁,即分子可选择性 地吸收电磁波使分子内能提高。用仪器记录分子 对不同波长的电磁波的吸收情况,就可得到吸收 光谱。
四、应用与发展 波谱解析作为一门较新学科,近年来得到快速的发展,但早 在19世纪50年代。人们就开始应用目视比色法,不久Beer发现了 以其名字命名的Beer定律。19世纪末就已经开始了IR和UV-Vis测 定,进入20世纪,随着科学技术的发展,仪器性能改进,实验方 法革新特别是计算机的应用,使波谱法得到突飞猛进的发展。波 谱法种类越来越多,应用范围也越来越广。核磁共振、质谱、X射 线衍射法等的应用为化合物结构解析、组成及含量分析带来的革 命性的变化。例如吗啡从鸦片中提出来到最后确定其结构大约用 了150年的时间。若使用现代的波谱分析手段可能几天,甚至几小 时即可完成。
可见光 近红外光 中红外光 远红外光 微波 射频
400-750nm 0.75-2.5mm 2.5-50mm 50-1000mm 0.1-100cm 1-1000m
2.5104-1.3104 1.3104-4103 4000-200 200-10 10-0.01 10-2-10-5
7.5108-4.0108 4.0108-1.2108 1.2108-6.0106 6.0106-105 105-102 102-0.1
v
c
cv
式中: ν 为频率,单位为 Hz 10 c 为光速,其量值 = 3 × 10 cm.s-1 λ 为波长 (cm), 也用nm作单位(1nm=10-7 cm) _ v 1cm长度中波的数目,单位cm-1
微粒性:可用光量子的能量来描述:
E hv
hc
式中: E 为光量子能量,单位为 J h 为Planck 常数,其量值为 6.63 × 10-34 J s-1
分子中的这三种运动状态都对应有一定的能 级。即在分子中存在着电子能级、振动能级和转 动能级。其中电子能级的间距最大(每个能级间 的能量差叫能级差),振动能级次之,转动能级 的间距最小。 如果用E电子, E振以及 E转表示各能级差, 则:
E电子> E振> E转
能级跃迁
E转 ‹ E振 ‹ E电 电子能级间跃迁的 同时,总伴随有振动和 转动能级间的跃迁。即 电子光谱中总包含有振 动能级和转动能级间跃 迁产生的若干谱线而呈 现宽谱带。
1(3)电子能级的能量差ΔΕe较大1~20eV。 电子跃迁产生的吸收光谱在紫外—可见光区, 紫外—可见光谱或分子的电子光谱
波谱的产生是物质内部的运动在外部的一种表 现的形式,并且不同类型的光谱反应了物质内部不 同的运动状态。因此可通过光谱峰位、形状确定分 子结构。
波谱解析法由于其快速、灵敏、准确、重现性 好等特点,在有机结构分析和鉴定研究中起着 重要的作用,已成为结构分析和鉴定常用的分析工 具和重要的分析方法,是化学专业学生必须掌握的 基本技能,波谱解析理论和技术已成为重要的专 业基础课程之一。
400 nm 800 nm 2.5mm 25 mm 波长 能量
10cm 长 低
电磁波谱 c
波谱区名称* 射线 X射线 远紫外光 近紫外光 波长范围** 10-4-10-2 nm 10-2-10nm 10-200nm 200-400nm 波数 /cm-1 1011-109 1010-106 106-5104 5104-2.5104 频率范围 MHz 31015-31013 31013-31010 31010-1.5109 1.5109-7.5108 光子能量*** eV 1.2107-1.2105 1.2106-1.2102 125-6 6-3.1 原子及分子的 价电子或成键 电子能级 跃迁能级类型 核内部能级 内层电子能级
按波长不同电磁波可以分成:
Electromagnetic Spectrum
三、分子运动能级
分子运动:平动、振动、转动、核外电子运动等
量子化的(能量变化不连续)
E电子> E振> E转
§物质分子内部四种运动形式: 1.平动 2.振动 3.转动 4.价电子运动 §分子具有四种不同能级:平动能级、振动能级和转动能级 、电子能级。 §四种能级都是量子化的,且各自具有相应的能量。 §分子的内能:平动能量E平、振动能量E振 、转动能量E转、 电子能量E电。 即E= E平 + E振 + E转 + E电 平动能量E平只与温度有关,对 分子光谱的意义不大,可以不 考虑
第一章 绪论
《有机波谱分析》主要是以光学理论为基 础,以物质与光相互作用为条件,建立物质分子结 构与电磁辐射之间的相互关系,从而进行物质分子 几何异构、立体异构、构象异构和分子结构分析及 鉴定的方法。该法主要包括: 紫外吸收光谱法(UV)
Ultraviolet absorption spectrometry 红外吸收光谱法(IR) 吸收光谱 Infrared absorption spectrometry 核磁共振波谱法(NMR) Nuclear Magnetic Resonance spectrometry 质谱分析法(MS) Mass spectrometry
γ射线→ X 射线→紫外光→可见光→红外光→微波→无线电波
外层电子跃迁 分子振,转能级跃迁 核自旋能级跃迁
电磁辐射(电磁波)按照波长或频率大小有序排列成谱,叫做电磁波谱 。
紫外-可见光谱
γ射线 X射线 紫外光 可见光
红外光谱 红外光谱
近 中红外 远 微波 1mm
核磁共振 核磁共振
射频
0.01 nm 10 nm 短 高
E2 (激发态)
E
光谱仪
E E1(基态)
A
当用光照射分子时,分子就要选择性的吸收某些 波长(频率)的光而由较低的能级E1跃迁到较高能级 E2上,所吸收的光的能量就等于两能级的能量之差: E = E1 - E2
物质对光的选择性吸收 M + 热 M + 荧光或磷光
M + h 基分子振动能级 0.5-0.02 210-2-410-4 410-4-410-7 410-7-410-10 分子转动能级 分子转动,电 子自旋 电子自旋、核自旋
讨论:
1(1)转动能级间的能量差ΔΕr:0.005~0.050eV,跃 迁产生吸收光谱位于远红外区。远红外光谱或分子转动光谱 ; 1(2)振动能级的能量差ΔΕv约为:0.05~1eV,跃迁 产生的吸收光谱位于红外区,红外光谱或分子振动光谱;
M* 激发态
(△E)
E2 :
E = E2 - E1 = h 量子化 ;选择性吸收
电子的跃迁吸收光的波长主要在真空紫外到可 见光区,对应形成的吸收光谱,称为电子光谱或紫 外-可见吸收光谱。 分子的振动能级差一般需吸收红外光才能产生 跃迁。故分子振动产生的吸收光谱又称红外光谱。
X-射线
200nm
一、吸收光谱的产生: 物质与电磁辐射相互作用时,能够引起分子内 部某种运动能级的变动,从而吸收某种波长的电磁 辐射,将此电磁辐射信号强度对波长或波数记录下 来就得到所谓的光谱,用于物质结构的分析,称为 有机化合物波谱解析。 吸收光谱的产生可表示为: 有机分子 + 电磁辐射
选择性吸收 仪器记录
光谱
二、电磁辐射的基本性质与分类 电磁辐射或叫电磁波具有波、粒二向性: 波动性:可用波长()、频率(v)和波数(v)来描述。
