正丁醚的制备实验
正丁醚实验报告

正丁醚实验报告简介正丁醚,化学式为C4H10O,是一种醚类有机化合物,具有无色、易挥发和有刺激性气味的特点。
该实验旨在通过合成正丁醚并对其进行表征和分析,探究相关化学反应的机理和原理。
实验步骤1.醇酸酯化反应:将正丁醇和浓硫酸加入反应瓶中,加热反应约30分钟。
2.中和反应:将反应混合物缓慢加入稀氢氧化钠溶液中,直到中和完全。
3.蒸馏提取:将反应混合物用蒸馏装置进行蒸馏提取,得到正丁醚纯品。
实验结果通过合成正丁醚的实验步骤,我们成功合成了高纯度的正丁醚。
实验中观察到以下现象:1.醇酸酯化反应:加热反应瓶后,反应混合物渐渐变为混浊状态,表明酯化反应已经进行。
2.中和反应:将反应混合物缓慢加入稀氢氧化钠溶液中,观察到反应混合物逐渐变为透明状态,表明中和反应完全。
3.蒸馏提取:通过蒸馏装置对反应混合物进行提取,收集到的正丁醚纯品呈无色液体。
分析和讨论在实验过程中,通过观察实验现象和结果,我们可以对实验原理进行分析和讨论:1.醇酸酯化反应–正丁醇和浓硫酸反应生成正丁醇硫酸酯,是醇酸酯化反应的中间产物。
–此反应通常在加热条件下进行,加热可以提高反应速率和产率。
–反应机理涉及醇和酸之间的酯化作用,生成酯化产物。
2.中和反应–正丁醇硫酸酯与稀氢氧化钠溶液反应,生成相应的正丁醚和硫酸钠。
–中和反应是为了去除硫酸根离子,使得纯净的正丁醚得以分离和提取。
3.蒸馏提取–蒸馏装置通过升华和凝结的原理,实现对液体的分离提取。
–正丁醚在较低的沸点下升华,经凝结后得到纯净的液体正丁醚。
实验总结通过实验,我们成功合成了高纯度的正丁醚,并对合成过程进行了分析和讨论。
掌握了醇酸酯化反应、中和反应和蒸馏提取等实验技术和原理。
这对我们进一步了解有机化合物的合成方法和表征过程具有重要意义。
参考文献[1] 徐文彩. 有机合成实验教程[M]. 高等教育出版社, 2012.[2] 李磊, 梁威. 有机化学实验指导[M]. 科学出版社, 2017.。
正丁醚制备实验报告doc

浓H2SO4
主反映 2C4H9OH?????C4H9OC4H9?H2O 134~135?C浓H2SO4副反映 C4H9 OH????CH?CH?2HO22CH5?135?C
【要紧仪器及实验装置图】
要紧仪器如表1所示。
表1要紧仪器 要紧实验装置图如图1所示。
图1.分水装置制备正丁醚
正丁醚制备实验报告
篇一:正丁醚实验报告
XX 年 12 月 7 日 姓 名 系年级组 别 同组者 科 目 有机化学实验 题 目 制备正丁醚仪器编号
【实验目的】
1. 把握分子间脱水制醚的反映原理和实验方式。
2. 学习利用分水器,进一步训练和熟练把握回流、加热和萃取等大体操作。 【实验原理】
利用醇钠与卤代烃反映合成醚,这种合成方式的反映机理是烷氧负离子对卤代烷或硫酸酯的亲核取代反映。醇分子间脱水生成醚是制备简单醚的常常利用方式。用硫酸作为催化剂,在不同的温度下正丁醇和硫酸作用生成的产物会有不同,主
1.如何得知反映已经比较完全?
答:分水器全数被水充满时,能够为反映比较完全。
2.反映物冷却后什么缘故要倒入50ml水中?各步的洗涤目的安在?
答:反映物倒入50ml水中以除去正丁醇。在5%NaOH溶液中以除去副产品丁烯,加水除NaOH,加饱和CaCl2除去水与醇。
3.可否用本实验方式由乙醇和2-丁醇制备乙基仲丁基醚?你以为用什么方式比较好?
水、8mL5%氢氧化钠溶液、8mL水和8mL饱和氯化钙溶液洗涤,然后用1g无水氯化钙干燥。
3.搭好蒸馏装置,搜集140~144℃的馏分。
六、实验数据
空烧瓶的质量:71.66g
盛有产物的烧瓶的质量:74.68g
产物质量:m=74.68-71.66=3.02
制备正丁醚的方法

制备正丁醚的方法
制备正丁醚(n-butyl ether)的一种常用方法是醇酸酯化反应。
具体步骤如下:
1. 准备原料:乙醇(或甲醇)、正丁醇(或丁醇)、硫酸(或磷酸)。
2. 在一个反应瓶中加入适量的正丁醇。
3. 慢慢加入硫酸(或磷酸),并用搅拌棒搅拌均匀。
4. 将乙醇(或甲醇)滴加到反应瓶中,同时加热反应瓶,维持反应温度在60-70C。
5. 反应持续进行,可以观察到产物正丁醚的生成。
反应通常需要持续数小时。
6. 反应结束后,冷却反应瓶,并用水进行稀释。
得到的混合溶液中含有正丁醚和硫酸(或磷酸)。
7. 将混合溶液倒入分离漏斗中,与等量的醚溶剂(如乙醚)进行萃取,以分离正丁醚。
8. 分离得到的醚层,用无水氯化钠(或硫酸钠)干燥,去除溶剂中的水分。
9. 通过蒸馏纯化得到纯正丁醚。
需要注意的是,在进行这个反应时,需要注意操作的安全性,因为硫酸和磷酸都具有腐蚀性。
操作时应佩戴化学安全眼镜和手套,并在通风良好的实验室中进行。
正丁醚的制备实验

正丁醚的制备1、制备止和制备乙醚在实验操作上什么不同?为什么答:制备乙的操作是;边反应、边滴加、边从体系中分离乙醚,使平衡向右移动蒸装置为60℃的水浴,无明火,用直型冷凝管,尾按管通下水道,冰水浴接收而正丁醚采用分水装置,用空气冷凝管冷凝,不断利用分水器除去副产物水,使平衡向有利于正丁醚的移动。
3、反应结束后为什么要将混合物倒入25ml水中?各步洗涤的目的是什么?答:反应物冷却后倒入25ml水中,是为了分出有机层,除去沸石和绝大部分溶于水的物质。
水洗,除去有机层中的大部分醇,碱洗,中和有机层中的酸;10ml水洗,除去碱和中和产物;2x10ml饱和氯化钙溶液,除去有机层中的大部分水和醇类。
4,能用本实验的方法由乙醇和2-丁醇制备乙基仲丁基醚你认为用什么方法较合适?答,不能,容易得到乙醚、仲丁基醚以及乙基仲丁基醚的混合物。
更好的办法是威廉姆逊法,即用卤代烃与醇钠反应,路线有二乙醇钠与仲丁基卤或者卤乙烷与仲丁醇钠。
分水器的使用原理:在室温下,有机试剂和水互不互溶,但是可以形成共沸物,水的密度比有机溶剂大。
当分水器内充满了溶剂,溶剂与水在分水器中分层,水积在分水器下部,溶剂返流到反应体系里去。
核心点为:与水共沸不互溶,密度比水小。
5为什么制备正丁醚时温度要控制在130~140°C?这个温度才会发生对应醇分子间脱水反应,高了会生成1-丁烯,低了速率慢,还会生成其他副产物,只有这个温度,正丁醚的产量才最高注意事项(1)制备正丁醚的较宜温度是130~140 C ,但开始回流时,这个温度很难达到,因为正丁醚可与水形成共沸物(沸点94.1 C,含水33.4%);另外,正丁醚与水及正丁醇形成三元共沸物(沸点90.6 C,含水29. 9%,正丁醇34. 6%),正丁醇也可与水形成共沸物(沸点93C,含水44. 5%),故应在100~115 C之间反应半小时之后可达到130“C以上。
(2)在碱洗过程中,不要太剧烈地摇动分液漏斗,否则生成乳浊液,分离困难。
正丁醚的制备

试验装置(粗产品旳精制)
注意事项: 1.安装顺序 2.温度计旳位置 3.冷凝管旳种类 及使用范围
五、试验流程
正丁醇 浓H2SO4
回流 过程
分水器
有机层
无水
CaCl2
干燥
粗正丁醚
分液 漏斗
有机层
50 %
H2SO4
洗涤
蒸馏
搜集正丁醚馏分 (140~144℃)
问题五 为何用50%H2SO4洗涤粗产品?
2C4H9OH————H2O
×
2 74 g
18g
12.5 g
x x=1.52g
本试验是用12.5g正丁醇脱水制取正丁 醚,应该脱水旳量为1.52g
所以,在试验此前预先在分水器里加
(V-2)ml水,V为分水器旳体积,加上反应 后来生成旳水一起恰好充斥分水器,而使 汽化冷凝后旳反应物正丁醇、正丁醚等恰 好溢流返回反应瓶中,从而到达自动分离 旳目旳。
正丁醚旳制备
一、试验目旳
1.掌握醇分子间脱水制备醚旳反 应原理和试验措施;
2.学习使用分水器旳试验操作。
二、试验原理
主反应
副反应
反应特点:
(1)可逆反应:为提升反应产率,本试验采用边反应边 把生成旳水与反应体系分离,从而使平衡向右移动。
(2)需酸催化:浓硫酸为催化剂。
三、主要试剂及产品旳物理常数
分
名称
子 量
性状
折 光 率
密度
熔点 ℃
沸点 ℃
溶解度 (水)
正丁醇 74.1 无色液 1.399 0.89 -89.8 118
915
不不
正丁醚 130.23 无色液 1.3992 0.764 -98 142.4 小于
正丁醚的制备实验报告

*分水装置
因为原料正丁醇(沸点 117.7 ℃)和产物正丁醚(沸点 142 ℃)旳沸点都较高,故在控制 反应温度旳条件下,反应在装 有分水器旳回流装置中进行, 使生成旳水或水旳共沸物不断 蒸出,促使可逆反应朝有利于 生成醚旳方向进行。虽然蒸出 旳水中会夹有正丁醇等有机物, 但因为它们在水中溶解度较小, 比重又较小,浮于水层之上, 所以借分水器使大部分旳正丁 醇自动连续地返回反应瓶中继 续反应。
( 5 )反应开始回流时,因为有恒沸物旳存在, 温度不可能立即到达 135 ℃。但伴随水被蒸出, 温度逐渐升高,最终到达 135 ℃以上,即应停止 加热。假如温度升得太高,反应溶液会炭化变黑, 并有大量副产物丁烯生成。
( 6 )在碱洗过程中,不宜剧烈地摇动分液漏斗, 不然严重乳化,难以分层。
七、思索题
2、分离粗产物
待反应液冷却后,拆 下分水器,将仪器改 成蒸馏装置,再加二 粒沸石,蒸馏至无馏 出物为止。
3、洗涤粗产物
将馏出液倒入盛有 10mL 水旳分液 漏斗中,充分振摇,静置弃去下层 水液,上层粗正丁醚,依次用 5mL 水, 3mL 5% NaOH 、 3mL 水和 3mL 饱和氯化 钙溶液洗涤,分净 水层,将粗产物自漏斗上口倒入洁 净干燥旳小锥形瓶中,然后用 0.2 -0.4g 无水氯化钙干燥。
正丁醚旳制备
一、试验目旳
1 .掌握醇脱水制醚旳反应原理和实 验措施。
2 .学习使用分水器旳试验操作。
二、试验原理
醇分子间脱水生成醚是制备简朴醚旳常用措施。用硫酸作为 C催同H3化,CH剂主2C,要H在是2C不正H2同丁OH温醚度或13下丁H4~2正烯S1O3丁,54醇所℃和以硫反(C酸应H3作须CH用严2C生格H成控2C旳制H2产温)2物度O会。+有H不2O
有机化学正丁醚的制备实验报告
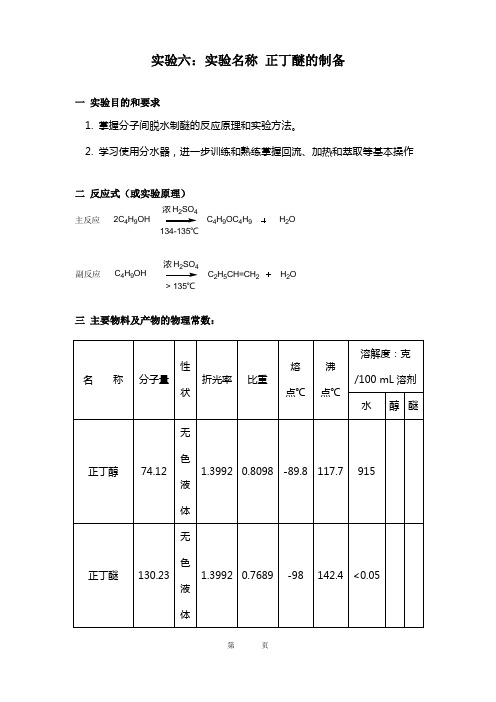
实验六:实验名称 正丁醚的制备一 实验目的和要求1. 掌握分子间脱水制醚的反应原理和实验方法。
2. 学习使用分水器,进一步训练和熟练掌握回流、加热和萃取等基本操作二 反应式(或实验原理)三 主要物料及产物的物理常数:2C 4H 9OH浓H 2SO 4C 4H 9OC 4H 9H 2O134-135℃浓H 2SO 4C 2H 5CH=CH 2H 2O> 135℃C 4H 9OH主反应副反应四主要物料用量及计算:五实验装置图六实验步骤流程在100 mL三口烧瓶中,加入31 mL正丁醇,将4.5 mL浓硫酸慢慢加入并摇荡烧瓶使浓硫酸与正丁醇混合均匀(1),加几粒沸石,按图4-13-1装置仪器。
三口烧瓶一侧口装上温度计,温度计水银球应浸入液面以下,中间分口装上分水器,分水器的上端接一回流冷凝管。
先在分水器内放置(V-3.5) mL 水(2),另一口用塞子塞紧。
将三口瓶放在电热套上空气浴小火加热至微沸,进行分水。
随着反应的进行,回流液经冷凝管收集在分水器内,分液后的水层沉于下层,上层有机相积至分水器支管时,即可返回烧瓶。
大约经1.5 h后,三口瓶中反应液温度可达134-136℃。
当分水器全部被水充满时停止反应。
若继续加热,则反应液变黑并有较多副产物烯生成。
将反应液冷却到室温后倒人盛有50 mL水的分液漏斗中,充分振摇,静置后弃去下层液体。
上层粗产物依次用25 mL水、15 mL 5%氢氧化钠溶液、15 mL水、15 mL饱和氯化钙溶液洗涤,然后用1~2 g无水氯化钙干燥。
干燥后的产物滤入25 mL蒸馏瓶中蒸馏,用空气冷凝管收集140-144℃馏分。
纯正丁醚的沸点142.4οC,n D201.3992。
本实验约需6小时七实验记录实验日期八产率计算产率=m1−m2m理×100%=12.822×100%=58.2%九讨论1. 加料时,正丁醇和浓硫酸如不充分摇动混匀,硫酸局部过浓,加热后易使反应溶液变黑。
正丁醚的制备有机实验

正丁醚的制备正丁醚常用作有机反应的溶剂。
实验室制备正丁醚的主要实验装置如下图:反应物和产物的相关数据如下合成正丁醚的步骤:①将6 mL浓硫酸和37 g正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:③待A中液体冷却后将其缓慢倒入盛有70 mL水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用40 mL水、20 mL NaOH溶液和40 mL水洗涤,分液后加入约3 g无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得纯净正丁醚11 g。
请回答:(1)步骤①中浓硫酸和正丁醇的添加顺序为______________________________。
写出步骤②中制备正丁醚的化学方程式______________________________。
(2)加热A前,需先从__________(填“a”或“b”)口向B中通入水。
(3)步骤③的目的是初步洗去,振摇后静置,粗产物应从分液漏斗的(填“上”或“下”)口分离出。
(4)步骤④中最后一次水洗的目的为______________________________。
(5)步骤⑤中,加热蒸馏时应收集__________(填选项字母)左右的馏分。
a.100℃b.117℃c.135℃d.142℃(6)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。
分水器中上层液体的主要成分为__________,下层液体的主要成分为__________。
(填物质名称)(7)本实验中,正丁醚的产率为__________。
(1)先加正丁醇,再加浓H2SO4或将浓H2SO4滴加到正丁醇中(2)b(3)浓H2SO4上(4)洗去有机层中残留的NaOH及中和反应生成的盐Na2SO4(5)d(6)正丁醇水(7)33.85%试题分析:(1)步骤①中浓硫酸和正丁醇的添加顺序为先加正丁醇,再加浓H 2 SO 4。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
正丁醚的制备实验
一,实验目的
1.学习醇分子间脱水制醚的反应原理和实验方法
2.学习分水器的原理及操作
二,实验原理
三,实验仪器及试剂
二颈烧瓶;球形冷凝管;石棉网;三角烧瓶(50ml);分水器;温度计;分液漏斗;蒸馏头。
正丁醇(31ml, 25g, 0.34mol);浓硫酸;无水氯化钙;氢氧化钠溶液(5%);饱和氯化钙溶液;沸石。
项目分子量熔点沸点折光率性状溶解度
(g)(℃)(℃)
正丁醚130.2-95.0142.4 1.3992透明液
体微溶于水
正丁醇74.12-88.9117.25 1.3993无色透
明,具
有特殊
气味微溶于水易溶于有机溶剂
四,实验步骤
五,实验数据的记录及处理
理论产量:实际产量:产率:
性状:
六,误差分析及问题讨论。
