物质在溶解过程中有能量变化吗?
物质溶解过程中的能量变化
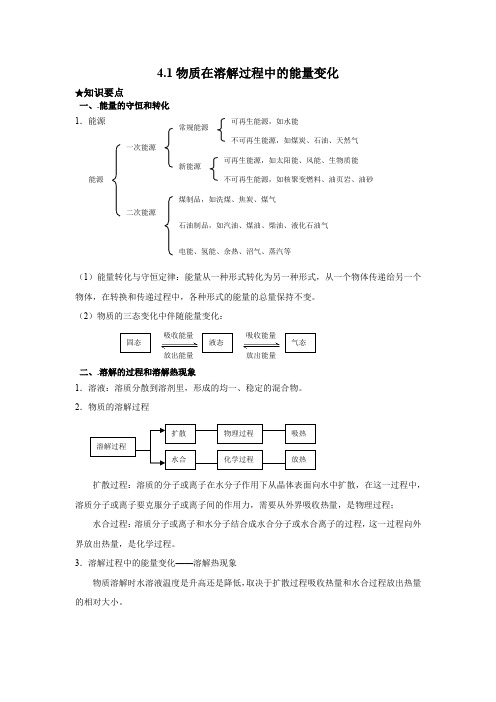
4.1物质在溶解过程中的能量变化★知识要点一、.能量的守恒和转化 1.能源(1)能量转化与守恒定律:能量从一种形式转化为另一种形式,从一个物体传递给另一个物体,在转换和传递过程中,各种形式的能量的总量保持不变。
(2)物质的三态变化中伴随能量变化:二、.溶解的过程和溶解热现象1.溶液:溶质分散到溶剂里,形成的均一、稳定的混合物。
2.物质的溶解过程扩散过程:溶质的分子或离子在水分子作用下从晶体表面向水中扩散,在这一过程中,溶质分子或离子要克服分子或离子间的作用力,需要从外界吸收热量,是物理过程; 水合过程:溶质分子或离子和水分子结合成水合分子或水合离子的过程,这一过程向外界放出热量,是化学过程。
3.溶解过程中的能量变化——溶解热现象物质溶解时水溶液温度是升高还是降低,取决于扩散过程吸收热量和水合过程放出热量的相对大小。
扩散 溶解过程 水合 物理过程 化学过程 吸热放热 能源 一次能源 二次能源 新能源 常规能源 可再生能源,如水能 不可再生能源,如煤炭、石油、天然气 可再生能源,如太阳能、风能、生物质能 不可再生能源,如核聚变燃料、油页岩、油砂 煤制品,如洗煤、焦炭、煤气石油制品,如汽油、煤油、柴油、液化石油气 电能、氢能、余热、沼气、蒸汽等 吸收能量 固态 液态 气态吸收能量 放出能量 放出能量三、溶解和结晶1.溶解:溶质分散到溶剂中的过程。
2.结晶:晶态溶质从溶液中析出的过程。
3.溶解和结晶的宏观现象和微观过程溶解和结晶作为宏观现象是不能同时观察到的。
但是,就微观粒子的运动状态而言,溶解和结晶这两个过程则是同时进行的相反(互逆)的过程,即在溶液里溶质进行溶解的同时,也进行着结晶,在一定条件下建立起一个动态平衡体系——溶解平衡。
4.溶解平衡在一定条件下的饱和溶液中,当物质溶解速率和物质晶体析出速率相等,这个溶液体系就达到了溶解平衡状态。
若改变外界的条件(包括改变溶剂量或温度),则可不同程度地改变微观粒子的溶解速率和结晶速率,原来的溶解平衡被破坏,并在新条件下建立新的平衡。
科普版九年级化学上册《单元物质的溶解过程》评课稿

科普版九年级化学上册《单元物质的溶解过程》评课稿1. 引言本篇评课稿旨在对科普版九年级化学上册的《单元物质的溶解过程》进行评价和总结。
本单元是九年级化学教学中的重要内容,涉及到物质的溶解过程及其背后的原理。
通过本单元的学习,学生将能够了解溶解的概念、溶解过程中的能量变化以及影响溶解的因素等。
2. 教材内容分析本单元的教材内容主要包括以下几个方面:2.1 溶解的概念教材首先介绍了溶解的概念,通过生活中的实际例子,让学生了解溶解是一种物质在溶剂中均匀分布的过程。
通过这一部分的学习,学生可以理解溶解的基本概念。
2.2 溶解过程中的能量变化接着,教材介绍了溶解过程中的能量变化,包括溶解过程中的吸热和放热现象。
通过示意图和简单的实验,让学生能够观察并理解溶解过程中热能的转化。
这对学生理解溶解过程中的能量变化有着重要的意义。
2.3 影响溶解的因素本单元还介绍了影响溶解的因素,包括溶质的种类、溶剂的种类、温度等。
通过对不同影响因素的实验操作及结果分析,学生可以了解不同因素对溶解过程的影响,并且能够解释一些现象,如温度升高溶质溶解度增大等。
2.4 溶液的浓度最后,教材讲解了溶液的浓度的计算方法和表示方式,包括质量分数、体积分数和摩尔浓度等。
通过实例的计算演示,学生能够熟练掌握溶液浓度的计算方法。
3. 教学设计与实施针对上述教材内容,本单元的教学设计与实施应包括以下方面:3.1 激发学生的学习兴趣在引入新知识之前,可以通过提问或展示一些和溶解相关的实际问题来激发学生的学习兴趣。
例如,通过“为什么在热天喝冰激凌会凉快呢?”这样的问题,引导学生思考和讨论,从而引入溶解的概念。
3.2 生活化实例辅助教学在讲解溶解的概念时,应该结合一些生活化的实例,让学生更容易理解。
例如,可以引导学生观察和描述一些日常生活中的溶解现象,如茶叶溶解在水中的过程等。
通过这些实例的引导,学生可以更加深入地理解溶解的过程。
3.3 实验操作与观察在介绍溶解过程中的能量变化和影响溶解的因素时,可以设计一些简单的实验操作,让学生亲自动手参与实验,观察实验现象并进行结果分析。
溶解过程中能量的变化是什么?

溶解过程中能量的变化是什么?
概述
溶解是物质从固态或气态转变为液态的过程。
在溶解过程中,
存在能量的转化和变化。
本文将探讨溶解过程中能量的变化以及相
关的能量转化原理。
能量转化原理
在溶解中,主要存在以下几种能量转化:
1. 吸热过程:当溶质与溶剂之间的相互作用力破坏时,需要提
供能量,这导致了能量的吸收。
因此,溶解过程中可以发生吸热反应。
2. 放热过程:当溶质与溶剂之间的相互作用力形成时,释放出
能量,这导致了能量的放出。
因此,溶解过程中可以发生放热反应。
能量变化
溶解过程中的能量变化可以包括以下几个方面:
1. 温度变化:当溶质与溶剂发生吸热反应时,会导致溶液的温
度升高;而当溶质与溶剂发生放热反应时,会导致溶液的温度降低。
2. 热量变化:吸热反应和放热反应分别导致溶解过程中的热量
增加和减少。
吸热反应吸收了外界的热量,使溶解过程变冷;而放
热反应释放出热量,使溶解过程变热。
3. 势能变化:溶质与溶剂之间的相互作用力形成或破坏时,会
引起势能的变化。
溶解过程中会伴随着溶质与溶剂之间的相互作用
能的变化。
结论
根据上述的能量转化原理和能量变化,我们可以总结出在溶解
过程中能量的变化是多方面的,包括吸热过程、放热过程以及温度、热量和势能的变化。
深入理解溶解过程中的能量变化有助于我们更
好地理解溶解现象及其相关的物理化学原理。
物质溶解过程中的能量变化

几种常见冷冻混合物的组成和最低温度
冷冻混合物的组成 41gNH4NO3和100g冰 19gNH4Cl和100g冰 23gNaCl和100g冰 22gMgCl2和100g冰 最低温度/℃ -17 -16 -21 -34
Байду номын сангаас
答:不一样.前者是氧化钙与水反应生成氢氧化钙而
放热,是由于发生化学变化而放热,而后者是溶解过程中放 热,溶解过程属于物理变化。
冷却剂
在生产、生活中常用冰做冷却剂,但冰只能提供0℃ 左右的低温。一些医疗和研究单位常需要更低的温度, 提供低温较方便的方法是用冷冻混合物。表6-4是几种常 见冷冻混合物的组成及所能达到的最低温度。
物质溶解
过程中的能量变化
物质溶解于水形成溶液的过程中,通常 伴随热量的变化。 有些物质溶解使溶液的温度升高。 例如:氢氧化钠; 碳酸钠 有些物质溶解使溶液的温度降低。
例如:KNO3、 NH4Cl 、 NH4NO3 有些物质溶解使溶液的温度没有明显的变化。
例如:氯化钠。
讨论:
氧化钙放入水中温度会明显的升高,氢氧 化钠放入 水中温度也会明显的升高,它们的原理一样吗?
剖析物质变化中的能量变化知识点

第四章剖析物质变化中的能量变化§4.1物质在溶解过程在有能量变化吗?引言:当煤、石油、天然气和食物在转化为其他物质时,给人们提供了各种形式的能量,在物质变化中,能量从一种形式转化为另一种形式。
物质存在三态:固态〔s〕、气态〔g〕液态〔l〕,物质的三态在转化过程也伴随着能量的转换。
吸收能量吸收能量固态〔体〕液体气态〔体〕放出能量放出能量在我们生活中经常利用三态变化来调整环境温度。
拓展:能源的种类:四种分类法来自太阳:生物质能,风能,煤,石油等。
①从能源的形成和来源角度来自地球部:地热能等。
来自核反响:裂变能、聚变能。
来自天体间引力:潮汐能。
②从能源利用状况角度分常规能源:石油、煤、天然气、水、生物等。
新能源:核能、地热能、海洋能。
③从能源的原有形态是否改变的角度分一次能源——自然界现存的一次能源:煤炭、石油、天然气。
二次能源——由一次能源加工转换而成的二次能源:电、氢能、汽油等。
④从能源是否能循环再生角度看可再生能源:水力、沼气等。
不可再生能源:煤、石油等。
一、物质溶解过程中的热现象Cl溶解是吸热的,NaOH溶解是放热的,而NaCl溶解放热和吸热均不明显。
NH4二、溶解的二个过程溶质溶解在水里,通常发生两个过程,一是溶质分子〔或离子〕受到水分子作用,向水中扩散的过程,在这种过程中,溶质分子或离子要克制分子或离子之间的引力,需要向外界吸收热量,这是一个物理过程〔物理变化〕。
另一个过程则是溶质分子或离子和水分子又结合成水合分子或水合离子的过程,这种过程放出热量是一个化学过程。
小结:扩散的过程水合过程溶解中的变化物理变化〔物理过程〕化学变化〔化学过程〕溶解中的能量变化吸热放热在溶解时:①当扩散过程吸收热量>水合过程放出的热量时,则总体表现为吸热。
②当扩散过程吸收热量<水合过程放出的热量时,则总体表现为放热。
③当扩散过程吸收热量≈水合过程放出的热量时,则总体表现为无显著的热量变化。
三、溶解和结晶结晶——将固体溶质的水溶液放在敞口的容器中让水慢慢地蒸发,或改变温度都可能使晶态溶质从溶液中析出,这个过程称为结晶。
物质在溶解过程中有能量变化吗

KNO3晶体放入饱和的KNO3溶液中,。——即降温结晶。常温、干燥空气中风化
Image
第二十三页,共二十三页。
等:溶解速率等于结晶速率。
动:动态平衡。仍在溶解、结晶。 定:溶液的浓度保持一定(yīdìng),不再变化。
第十六页,共二十三页。
课堂练习、
关于溶解平衡的说法不正确的是 。C
A、溶解平衡的本质是结晶速度(sùdù)等于溶解速度(sùdù)。 B、溶解平衡是个动态平衡,既有溶质的结晶
又有溶质的溶解。
Q吸<Q放 溶液(róngyè)温度升
高
Q吸≈Q放 溶液(róngyè)温度无明显变化
物质在溶解过程中总是伴随着能量的变化。表现出
来的放热或吸热现象,则是溶质微粒在扩散过程中的 能量变化的总效应。
第十一页,共二十三页。
解释(jiěshì)1:氯化铵晶体溶于水溶液温度降低?
解释(jiěshì)2:氯化钠晶体溶于水溶液温度为
分析现象:
1.将NaCl固体放入不饱和NaCl溶液中 2、将NaCl固体放入饱和NaCl溶液中 3、将50℃ KNO3饱和溶液温度降到20℃ 4、将少量KNO3晶体放入饱和的KNO3溶液中,
然后(ránhòu)加热溶液。
1.定义(dìngyì):当条件改变,晶态溶质从溶液
中析出,这个过程称为结晶(crystallize).
吸收的热量和放出的热量并不相等。
当吸热多于放热,就表现为吸热, 在溶解时,溶液的温度就降低。
当放热多于吸热,就表现为放热,
在溶解时,溶液的温度(wēndù)升高。
第十页,共二十三页。
溶解热的测定实验报告

溶解热的测定实验报告溶解热的测定实验报告引言:溶解热是指单位物质在溶剂中溶解时释放或吸收的热量。
它是研究溶解过程中能量变化的重要参数之一,对于了解溶解过程的热力学性质具有重要意义。
本实验旨在通过测定溶解热的方法,探究不同物质的溶解过程中的热力学特性。
实验部分:1. 实验原理:溶解热的测定可以通过定容热量计的方法进行。
在实验中,我们使用了恒温水浴槽来保持溶剂和溶质的温度稳定。
通过测量在溶解过程中溶液的温度变化,可以计算出溶解热的值。
2. 实验仪器和试剂:实验仪器:定容热量计、恒温水浴槽、温度计。
试剂:硫酸铜、氯化钠、氯化铵。
3. 实验步骤:(1)将定容热量计清洗干净,并用去离子水冲洗干净。
(2)将一定质量的溶质加入定容热量计中,记录下溶质的质量。
(3)将一定体积的溶剂加入定容热量计中,记录下溶剂的体积。
(4)将定容热量计放入恒温水浴槽中,使溶液温度达到恒定值。
(5)记录下溶液的初始温度。
(6)迅速将溶质加入到溶剂中,同时用玻璃棒搅拌均匀。
(7)记录下溶液的最高温度。
(8)根据实验数据计算出溶解热的值。
结果与讨论:通过实验测得的溶解热值如下:硫酸铜:-36.2 kJ/mol氯化钠:3.9 kJ/mol氯化铵:14.5 kJ/mol根据实验结果可以得出以下结论:1. 硫酸铜的溶解过程是吸热反应,即溶解热为负值。
这是因为在溶解过程中,硫酸铜与水发生了吸热反应,吸收了周围环境的热量。
2. 氯化钠的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化钠与水发生了放热反应,释放了热量。
3. 氯化铵的溶解过程是放热反应,即溶解热为正值。
这是因为在溶解过程中,氯化铵与水发生了放热反应,释放了热量。
实验中的误差主要来自于以下几个方面:1. 实验仪器的精确度:定容热量计和温度计的精确度会对实验结果产生影响。
在实验中,我们尽量选择精确度较高的仪器,以减小误差。
2. 实验操作的准确性:在实验过程中,对溶质和溶剂的质量和体积的测量需要准确无误,任何误差都会对最终结果产生影响。
溶解吸热和放热过程

物质溶解,一方面是溶质的微粒──分子或离子要克服它们本身的相互之间的吸引力离开溶质,另一方面是溶解了的溶质要扩散到整个溶剂中去,这些过程都需要消耗能量,所以物质溶解时,要吸收热量。
溶解过程中,温度下降原因就在于此。
在溶解过程中,溶质的微粒──分子或离子不仅要互相分离而分散到溶剂中去,同时,溶解于溶剂中的溶质微粒也可以和溶剂分子生成溶剂化物(如果溶剂是水,就生成水合物)。
在这一过程里要放出热量。
一种物质溶解在水里,究竟是温度升高还是降低,取决于溶解过程中两种过程所吸收或放出的热量的多少。
在溶解过程中,扩散过程,是分子挣脱彼此间分子引力的过程,这个过程,分子需要能量来转化为动能,也就需要从外界吸收热量;而水合过程应该是一个相反的过程,也就是分子多余的动能释放,转化为了热能,表征就是放热。
化学反应中吸热、放热的本质如何用分子动理论来解释化学反应中的能量变化是化学键能量不同导致的。
生成物与反应物的键能差就是反应吸热或放热的来源,而化学键的能量主要是电磁能,而不单纯的用分子动理论来解释假如只用分子动理论来,那么物理变化和化学变化就没有什么差别了。
电离是分两步进行的第一步是化合物形成离子,这是吸热过程第二步是离子与水形成水合离子,这是放热过程溶解最后是吸热还是放热取决于上面两个过程总的结果为什么有的物质溶解吸热有的放热?水合就是和水结合的意思.水分子里的氧上有两个不成键的电子对.而且氧的电负性大.使氢的电子被强烈吸引到氧附近.氢显示很强的正电性.氧显示很强的负电性.当物质放入水中.物质中的带正电的部分被水的氧吸引.带负电的部分被氢吸引.这样.离子化合物就分离成阴离子和阳离子.分别吸引了一层[水膜".很容易混在水里.物质就溶解了.例如NaCl.同样.某些共价化合物也被水强行分成阴阳离子.也就溶解在水中.例如HCl.还有一些比较[坚固"的共价化合物.但是有极性.就是含有带正电和负电的部分.这样也可以被水分别包围.也可以溶解.例如酒精CH3-CH2-OH.所以大部分没有极性的分子.就难溶于水.例如甲烷CH4.还有一些离子晶体不溶于水.例如BaSO4.是因为在分成离子的时候需要吸收能量.而水合的过程又放出能量.如果水合的时候放出的能量不够.就很有可能不足以让这种物质分成离子.所以就不溶了.如果放出的能量过多.就会变成热放出.就是溶解放热的物质.但是也有放出能量不够.但因为水分子有热运动能量.而水分子所含的能量并不均匀.物质仍然可以靠能量比较大的水分子提供的热运动能量而溶解的.这样就必须从外界吸收热量.就是溶解吸热的物质.由此可见.溶解吸热的物质远比放热的少请用分子动理论来解释晶体的熔化吸热而温度不变的原因这是由于晶体的分子是按一定的规则排列成为空间点阵的。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一节 物质在溶解过程中 有能量变化吗?
一、大自然中的能量转化过程
食物 太阳能 光合作用 动物
热能
动能
植物(生物能)
地壳运动 燃料 燃烧
矿物燃料(煤、石油、天然气)化学能
能量从一种形式转化为另一种形式,从一个物体传 递给另一个物体,在转换和传递的过程中,各种形式 的能量的总量保持不变。这就是能量守恒定律。
×
实验二:NaCl、NaOH、NH4NO3分别溶于水,用数 字测温仪分别测定溶液的温度。 实验现象:NaOH溶于水温度升高,NH4NO3溶于水 温度降低,NaCl溶于水温度几乎不变。 分析及解释:
1、除了扩散之外,物质溶解时还有一个放热过程。 2、NaOH溶解时,放热过程放出的热量大于扩散过程吸收 的热量,所以溶液温度升高。 3、NH4NO3溶解时,放热过程放出的热量小于扩散过程吸 收的热量,所以溶液温度降低 4、NaCl溶解时,放热过程放出的热量和扩散过程吸收的 热量差不多,所以溶液温度变化不明显
加入蔗糖的质量 10 g
20 g 30 g 40 g
现象 全部溶解
全部溶解
溶液的状态 不饱和溶液
不饱和溶液 饱和溶液 饱和溶液
Байду номын сангаас
全部溶解
不溶解
1、什么叫做结晶? 溶解在溶剂中的溶质微粒碰撞固体表面时,受 到固体表面微粒对它的吸引,不断在未溶解的溶 质表面聚集成晶体。这个过程就叫做结晶。 2、什么叫做溶解—结晶平衡? 单位时间内,扩散到溶液里的溶质微粒数目, 与回到固体表面的溶质微粒数目相等时,也就是 溶质溶解的速率等于结晶的速率,这时从表面看, 固体溶质不再减少,也不再增加,即为溶解平衡 状态。此时的溶液称为饱和溶液。
3、物质的溶解过程包括扩散过程和水合过程。 扩散过程吸热,水合过程放热,物质的溶解热 由这两个过程吸热和放热的代数和所决定。 4、物质在水溶液中以水合离子或水合分子的 形式存在。
四、溶解—结晶平衡
回忆:什么叫做饱和溶液? 某温度下蔗糖的溶解度为30g/100g水,现 向100g水中分批加入40g蔗糖,填写下表:
结论二:物质的溶解过程包括溶质分子或离子向水 中扩散的扩散过程和溶质分子或离子与水分子结合 生成水合分子或水合离子的水合过程,前者为物理 过程,吸收热量;后者为化学过程,放出热量,物 质溶解过程总体的热效应取决于吸热和放热的相对 大小。
溶解过程 变化过程 能量变化 扩散过程 (物理过程) 吸收能量Q(吸) 水合过程 (化学过程) 放出能量Q(放) 溶液温度变化
溶液达到溶解—结晶平衡时的示意图
溶解速率和结晶速率 溶解速率>结晶速率 溶解速率<结晶速 率 溶解速率=结晶速 率
看到的现象 溶质溶解 晶体析出 无溶质溶解, 也无晶体析出
溶液状态 不饱和 饱和 饱和
五、结晶水合物
1、什么是晶体? 自发形成且具有规则几何形状的固体叫做晶体。 2、什么是结晶水合物? 晶体从溶液中结晶析出时,结合的一定数目的水分 子叫结晶水,含有结晶水的物质叫做结晶水合物。 3、结晶水合物是纯净物还是混合物? 结晶水是结晶水合物结构及组成中的一部分, 通常有着固定的组成,因此是纯净物。
Q(吸) > Q(放)
总效应 Q(吸) < Q(放) Q(吸) ≈ Q(放)
温度降低
温度升高
温度不变
思考1:电解质溶液和非电解质溶液的溶解过程有 什么区别? NaCl → Na+ + Cl—
电解质的溶解过程还伴随着电离过程,非电解质则没 有电离过程。
思考2:NaCl溶液中存在哪些微粒?蔗糖溶液中呢?
溶质分子或离子
水合 离解
溶质的水合分子或水合离子
NaCl溶液中存在Na+、Cl—、水合钠离子、水合 氯离子、水分子,还有水分子微弱电离出的水合 氢离子(H3O+)、OH—。 蔗糖溶液中存在蔗糖分子、水合蔗糖分子、水分 子等。
小结
1、能量变化遵循守恒定律; 2、物态变化伴随着能量变化;
生活中常见的 “冰袋”和“暖 袋”就是利用了 溶解的热效应制 成的
由实验一可以得出什么结论?
结论一:物质溶解过程中存在溶质分子或离子向水中 扩散的过程
思考1:扩散过程是吸热还是放热的?为什么? 思考2:溶解过程中是否只有扩散过程?怎样证 明你的结论?
溶解除了 扩散过程 之外,一 定还有一 个放热的 过程
假设错误 若只有扩散过程 + 扩散是吸热过程
× √
物质溶解应全部为吸热 过程 证伪 若某物质溶解为放热过程
二、物质三态变化中的能量变化
基本规律一: 能量从高转化到低时,总有能量放出;从低转化到高 时,总要吸收能量。 基本规律二:
能 量 由 高 到 低
气态 吸收能量 放出能量 液态 吸收能量 放出能量 固态
已知空调的基本工作原 理就是利用制冷剂氟里昂 的液化—气化过程,以升 高室外温度为代价,来达 到降低室内温度的目的。 你能设计这个过程吗?
4、有哪些常见的结晶水合物? 石碱(Na2CO3· 10H2O)、胆矾(CuSO4· 5H2O)、 绿矾(FeSO4· 7H2O)、皓矾(ZnSO4· 7H2O)、 明矾(KAl(SO4)2· 12H2O) 5、风化 有些结晶水合物的结晶水不太稳定,在室温下 和干燥的空气中会失去一部分或全部结晶水,这 种现象叫做风化。 风化属于化学变化。 6、潮解 有些晶体能够吸收空气中的水蒸气,在晶体表 面逐渐形成溶液,这种现象叫做潮解。 潮解属于物理变化。
思考: 1、下雪天和融雪 天,哪个更冷? 2、被水蒸气烫伤 和被开水烫伤,哪 个更惨?
三、溶解的过程和溶解热现象
复习:什么叫做溶液?其特点是什么? 问题:溶液是如何形成的? 实验一:KMnO4溶于水 探究:怎样证明KMnO4溶液的颜色是MnO4—的颜色, 而不是K+的颜色? 1、证明K+无色; 2、证明MnO4—浓度降低,溶液的紫红色也随之降低; 3、证明是MnO4—与第2步中所加试剂反应,而非K+与之反应。
