物理化学课后答案第9章电解与极化作用PPT课件
合集下载
电解与极化教程课件

电解与极化教程课件
contents
目录
• 电解基本概念 • 极化现象 • 电解过程 • 极化过程 • 电解与极化的关系
01
电解基本概念
电解定义
电解是指在直流电的作用下,在电解质溶液中阳离子移向阴极,阴离子移向阳极, 发生氧化还原反应的过程。
电解是一种电化学过程,通过施加外部电流,使电解质溶液中的离子定向移动并 在电极上发生氧化还原反应。在电解过程中,阳离子向阴极移动,并在阴极上获 得电子发生还原反应;阴离子向阳极移动,并在阳极上失去电子发生氧化反应。
感谢观看
电解过程原理
电解过程原理基于法拉第定律和 电流电势差,当电流通过电解质 溶液时,溶液中的离子在电极上
发生氧化还原反应。
阳极上发生氧化反应,阴极上发 生还原反应,通过控制电流和电 压可以控制电解反应的速率和产
物。
电解过程中,离子的迁移和电荷 传递是关键步骤,影响电解效率。
电解过程应用
金属的电解精炼
根据空间分布的不同,极化可以分为 空间电荷极化和空间电场极化等类型。
按电场作用时间分类
根据电场作用时间的长短,极化可以 分为瞬时极化、静态极化和动态极化 等类型。
极化应用
01
02
03
介质材料
利用材料的极化特性,可 以制造各种介质材料,如 电容器、绝缘材料、微波 介质等。
传感器
利用材料的极化特性,可 以制造各种传感器,如电 容式传感器、电感式传感 器等。
电解在工业上用于制备金属、处理废水、生产化工产品等。在能源领域,电解可用于水分解制氢、燃 料电池发电等。在环保领域,电解可用于废水处理和重金属的回收。此外,电解还在电镀、食品工业 等领域有广泛应用。
02
极化现象
contents
目录
• 电解基本概念 • 极化现象 • 电解过程 • 极化过程 • 电解与极化的关系
01
电解基本概念
电解定义
电解是指在直流电的作用下,在电解质溶液中阳离子移向阴极,阴离子移向阳极, 发生氧化还原反应的过程。
电解是一种电化学过程,通过施加外部电流,使电解质溶液中的离子定向移动并 在电极上发生氧化还原反应。在电解过程中,阳离子向阴极移动,并在阴极上获 得电子发生还原反应;阴离子向阳极移动,并在阳极上失去电子发生氧化反应。
感谢观看
电解过程原理
电解过程原理基于法拉第定律和 电流电势差,当电流通过电解质 溶液时,溶液中的离子在电极上
发生氧化还原反应。
阳极上发生氧化反应,阴极上发 生还原反应,通过控制电流和电 压可以控制电解反应的速率和产
物。
电解过程中,离子的迁移和电荷 传递是关键步骤,影响电解效率。
电解过程应用
金属的电解精炼
根据空间分布的不同,极化可以分为 空间电荷极化和空间电场极化等类型。
按电场作用时间分类
根据电场作用时间的长短,极化可以 分为瞬时极化、静态极化和动态极化 等类型。
极化应用
01
02
03
介质材料
利用材料的极化特性,可 以制造各种介质材料,如 电容器、绝缘材料、微波 介质等。
传感器
利用材料的极化特性,可 以制造各种传感器,如电 容式传感器、电感式传感 器等。
电解在工业上用于制备金属、处理废水、生产化工产品等。在能源领域,电解可用于水分解制氢、燃 料电池发电等。在环保领域,电解可用于废水处理和重金属的回收。此外,电解还在电镀、食品工业 等领域有广泛应用。
02
极化现象
最新南大物化PPT09章电解与极化作用

进 入 夏 天 ,少 不了一 个热字 当头, 电扇空 调陆续 登场, 每逢此 时,总 会想起 那 一 把 蒲 扇 。蒲扇 ,是记 忆中的 农村, 夏季经 常用的 一件物 品。 记 忆 中 的故 乡 , 每 逢 进 入夏天 ,集市 上最常 见的便 是蒲扇 、凉席 ,不论 男女老 少,个 个手持 一 把 , 忽 闪 忽闪个 不停, 嘴里叨 叨着“ 怎么这 么热” ,于是 三五成 群,聚 在大树 下 , 或 站 着 ,或随 即坐在 石头上 ,手持 那把扇 子,边 唠嗑边 乘凉。 孩子们 却在周 围 跑 跑 跳 跳 ,热得 满头大 汗,不 时听到 “强子 ,别跑 了,快 来我给 你扇扇 ”。孩 子 们 才 不 听 这一套 ,跑个 没完, 直到累 气喘吁 吁,这 才一跑 一踮地 围过了 ,这时 母 亲总是 ,好似 生气的 样子, 边扇边 训,“ 你看热 的,跑 什么? ”此时 这把蒲 扇, 是 那 么 凉 快 ,那么 的温馨 幸福, 有母亲 的味道 ! 蒲 扇 是 中 国传 统工艺 品,在 我 国 已 有 三 千年多 年的历 史。取 材于棕 榈树, 制作简 单,方 便携带 ,且蒲 扇的表 面 光 滑 , 因 而,古 人常会 在上面 作画。 古有棕 扇、葵 扇、蒲 扇、蕉 扇诸名 ,实即 今 日 的 蒲 扇 ,江浙 称之为 芭蕉扇 。六七 十年代 ,人们 最常用 的就是 这种, 似圆非 圆 , 轻 巧 又 便宜的 蒲扇。 蒲 扇 流 传 至今, 我的记 忆中, 它跨越 了半个 世纪, 也 走 过 了 我 们的半 个人生 的轨迹 ,携带 着特有 的念想 ,一年 年,一 天天, 流向长
上一内容 下一内容 回主目录
返回
2021/1/12
超电势(overpotential)
在某一电流密度下,实际发生电解的电极电势 E(不可逆) 与平衡电极电势之间的差值称为超电势。
上一内容 下一内容 回主目录
返回
2021/1/12
超电势(overpotential)
在某一电流密度下,实际发生电解的电极电势 E(不可逆) 与平衡电极电势之间的差值称为超电势。
物理化学课件6.3章电解与极化作用

实验材料
电解槽、电极、电源、电解质溶液等。
电解实验的设计与操作
实验步骤 1. 准备实验材料,配置电解质溶液。
2. 将电极插入电解槽中,连接电源。
电解实验的设计与操作
3. 观察并记录电极反应现象,测量电流和电压。 4. 分析实验数据,得出结论。
极化作用的实验研究方法
实验目的
通过实验研究,探究极化作用对电极反应的影响,理解极化作用的原理。
电解分离与提纯
总结词
电解分离和提纯是利用电解的原理将混 合物中的不同组分进行分离或提纯的方 法。
VS
详细描述
电解分离是通过电解过程中不同物质在电 极上的吸附、氧化还原反应等特性差异实 现分离。电解提纯则是利用电解过程将杂 质去除,实现物质的纯化。
05 极化作用的应用
电化学反应器
电解槽
利用电解原理进行物质转 化的设备,如氯碱工业中 的隔膜电解槽和电解水制 氢装置。
详细描述
电镀是将金属离子在电场作用下还原成金属并沉积在阴极表面,用于表面防护和装饰。电冶金则是利 用电解过程提取金属,从矿石或盐类等原料中分离和提纯金属。
电解制取气体
总结词
电解水是制取氢气和氧气的常用 方法,具有清洁、高效的特点。
详细描述
通过电解水可以将水分子分解成 氢气和氧气,分别在阴极和阳极 析出。电解水制取的气体可用于 燃料电池、医疗、潜水等领域。
电极反应的极化曲线
极化曲线是描述电极电势与电流密度之间关系的曲线,可以用来研究电极反应的动 力学过程和机理。
在极化曲线上,可以根据电流密度的大小来判断电极反应的速率快慢,以及电极电 势偏离可逆电势的程度。
通过测量不同温度下的极化曲线,可以研究电极反应的热力学性质和动力学过程。
物理化学第九章

电池反应:Zn + 2MnO2 + 2NH4Cl Zn(NH3)2Cl2 + 2MnOOH
R T ②铅蓄电池
PbO2作正极,海绵状Pb作负极,H2SO4作电解液。 电池表示如下:Pb|H2SO4(ρ=1.28gcm-3)|PbO2
放电时:
负极(氧化):Pb + H2SO4 PbSO4 + 2H+ + 2e-
R T 一、常用的化学电源
①锌锰干电池 锌锰干电池是一次电池,通称干电池。 干电池的负极是锌,正极是石墨。石墨周围是MnO2, 电解质是NH4Cl、ZnCl2溶液。 电池可用下式表示:Zn|NH4Cl|MnO2|C
F 负极:Zn + 2NH4Cl Zn(NH3)2Cl2 + 2H++ 2e-
正极:2MnO2 + 2H+ + 2e- 2MnOOH
KOH
负极(氧化 H2) 2:OH 2H2O2e-
正极(还原 12O) 2 : H2O2e- 2OH
电池反应 H2 : 12O2 H2O
H2
F
OHOHOH-
多孔炭电极 图12-11 H2-O2燃料电池示意图
二、化学电源的效率
R T 化学电源将化学能转换为电能的(理想的)最大效率
εmax定义为:
F a(Fe2+)106 E(Fe2+|Fe)E(Fe2+|Fe)RzFTln10160.617V
R T 三、电解还原与氧化的应用
电解的应用
阴极产品:电镀、金属提纯、保护、产品的美化 (包括金属、塑料)和制备aH21,aH+10及7 有机物的还原产物等。
阳极产品:铝合金的氧化和着色、制备氧气、双 氧水、氯气以及有机物的氧化产物等。
R T ②铅蓄电池
PbO2作正极,海绵状Pb作负极,H2SO4作电解液。 电池表示如下:Pb|H2SO4(ρ=1.28gcm-3)|PbO2
放电时:
负极(氧化):Pb + H2SO4 PbSO4 + 2H+ + 2e-
R T 一、常用的化学电源
①锌锰干电池 锌锰干电池是一次电池,通称干电池。 干电池的负极是锌,正极是石墨。石墨周围是MnO2, 电解质是NH4Cl、ZnCl2溶液。 电池可用下式表示:Zn|NH4Cl|MnO2|C
F 负极:Zn + 2NH4Cl Zn(NH3)2Cl2 + 2H++ 2e-
正极:2MnO2 + 2H+ + 2e- 2MnOOH
KOH
负极(氧化 H2) 2:OH 2H2O2e-
正极(还原 12O) 2 : H2O2e- 2OH
电池反应 H2 : 12O2 H2O
H2
F
OHOHOH-
多孔炭电极 图12-11 H2-O2燃料电池示意图
二、化学电源的效率
R T 化学电源将化学能转换为电能的(理想的)最大效率
εmax定义为:
F a(Fe2+)106 E(Fe2+|Fe)E(Fe2+|Fe)RzFTln10160.617V
R T 三、电解还原与氧化的应用
电解的应用
阴极产品:电镀、金属提纯、保护、产品的美化 (包括金属、塑料)和制备aH21,aH+10及7 有机物的还原产物等。
阳极产品:铝合金的氧化和着色、制备氧气、双 氧水、氯气以及有机物的氧化产物等。
电解与极化教程课件

在离子传递过程中,离子从溶 液中传递到电极表面,同时伴 随着离子的迁移和浓度的变化 。
04
电解与极化的应用
电解的应用
电解在工业上的应用
电解广泛用于金属的冶炼、电镀、电解精炼等工业生产中 。通过电解,可以将金属从化合物中还原出来,或者将粗 金属提纯为高纯度的金属。
电解在环保领域的应用
电解技术也可用于处理废水、废气等环境污染物。通过电 解,可以将有毒有害物质分解为无害或低害物质,实现环 保目的。
03
电解技术可用于处理工业废水、重金属离子等,为环保领域提
供新的解决方案。
极化技术的发展趋势
新型极化材料的研发
01
研究具有高稳定性、高导电性的新型极化材料,提高
极化效率。
极化技术在传感器和执行器中的应用
02 拓展极化技术在传感器和执行器领域的应用,如电致
伸缩材料、电致变色材料等。
极化技术与信息技术的结合
电解与极化教程 课件
目录
• 电解与极化概述 • 电解过程 • 极化过程 • 电解与极化的应用 • 电解与极化的实验研究 • 电解与极化的未来发展
01
电解与极化概述
电解的定义与原理
定义
电解是指在电流通过电解质溶液或熔 融电解质时,在电场的作用下发生氧 化还原反应的过程。
原理
电解过程中,电解质溶液中的阴阳离 子在电场的作用下分别向两极移动, 并在电极上发生氧化还原反应,从而 产生电流。
通过控制电极的极化行为,可以提高电解效率 、减少副反应和节约能源,对于工业生产具有 重要的意义。
02
电解过程
电解质的分类
离子导体
电解质中的离子在电场作用下能够定向移动,如食盐、硫酸等。
电子导体
物理化学课后答案第9章电解与极化作用.ppt
2019/3/22
金属的电化学腐蚀和防腐
电化学腐蚀的例子:
铜板上的铁铆钉为什么特别容易生锈? 带有铁铆钉的铜板若 暴露在空气中,表面被潮 湿空气或雨水浸润,空气 中的CO2,SO2 和海边空气中 的NaCl溶解其中,形成电 解质溶液,这样组成了原 电池,铜作阴极,铁作阳 极,所以铁很快腐蚀形成 铁锈。
2 + 2 +
这时组成原电池的电动势为 0.204V ,是自发电池。
2019/3/22
腐蚀时阴极上的反应
(2)耗氧腐蚀 如果既有酸性介质,又有氧气存在,在阴极上发 生消耗氧的还原反应:
+ O( g ) + 4 H 4 e 2 HO 2 2
R T 1 E ( O|HO E l n 2 2 ,H) 4 4 F a a + O 2 H
R T E ( A | A ) E ( A | A ) l n a () 阳 z A z F
z z
2019/3/22
9.3 电解时电极上的反应
分解电压
确定了阳极、阴极析出的物质后,将两者的析出 电势相减,就得到了实际分解电压。
因为电解池中阳极是正极,电极电势较高,所以 用阳极析出电势减去阴极析出电势。
2019/3/22
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (2)电化学极化 电极反应总是分若干步进行,若其中一步反应
速率较慢,需要较高的活化能,为了使电极反应顺
利进行所额外施加的电压称为电化学超电势(亦称
为活化超电势),这种极化现象称为电化学极化。
2019/3/22
2019/3/22
氢气在几种电极上的超电势
2019/3/22
金属的电化学腐蚀和防腐
电化学腐蚀的例子:
铜板上的铁铆钉为什么特别容易生锈? 带有铁铆钉的铜板若 暴露在空气中,表面被潮 湿空气或雨水浸润,空气 中的CO2,SO2 和海边空气中 的NaCl溶解其中,形成电 解质溶液,这样组成了原 电池,铜作阴极,铁作阳 极,所以铁很快腐蚀形成 铁锈。
2 + 2 +
这时组成原电池的电动势为 0.204V ,是自发电池。
2019/3/22
腐蚀时阴极上的反应
(2)耗氧腐蚀 如果既有酸性介质,又有氧气存在,在阴极上发 生消耗氧的还原反应:
+ O( g ) + 4 H 4 e 2 HO 2 2
R T 1 E ( O|HO E l n 2 2 ,H) 4 4 F a a + O 2 H
R T E ( A | A ) E ( A | A ) l n a () 阳 z A z F
z z
2019/3/22
9.3 电解时电极上的反应
分解电压
确定了阳极、阴极析出的物质后,将两者的析出 电势相减,就得到了实际分解电压。
因为电解池中阳极是正极,电极电势较高,所以 用阳极析出电势减去阴极析出电势。
2019/3/22
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。 (2)电化学极化 电极反应总是分若干步进行,若其中一步反应
速率较慢,需要较高的活化能,为了使电极反应顺
利进行所额外施加的电压称为电化学超电势(亦称
为活化超电势),这种极化现象称为电化学极化。
2019/3/22
2019/3/22
氢气在几种电极上的超电势
2019/3/22
物理化学中国石油大学课后习题答案第9章

问当外加电压逐渐增加时,两电极上首先分别发生什么反应?这时外加电压至少为多
少?(设活度系数均为 1,并不考虑超电势)
( ) ϕ ϕ = = −0.250V 解: Ni2+ ,Ni
1.0 mol⋅kg −1 Ni2+ ,Ni
-1-
物理化学习题解答
ϕ ϕ( ) = = −0.402V Cd2+ ,Cd
1.0mol⋅kg−1 Cd 2+ ,Cd
ϕH+ ,H2
=
RT F
ln
a H
+
=
RT F
ln 10−7
= −0.414V
则在阴极上首先发生的反应是Ni2+还原成Ni析出
ϕCl2 ,Cl−
( ) 1.0mol⋅kg−1 = ϕ − Cl2,Cl−
RT F
ln
a Cl
−
= 1.304V
ϕO2 ,OH −
物理化学习题解答
ϕ Ag2O, Ag
= ϕ! AOH
−
= 0.344 − 8.314× 298 × ln 0.01 = 0.462V 96500
所以阳极先发生Ag氧化为Ag2O
E分解 = 0.462 − (−1.58) = 2.04V
7.在 298K , p! 压力时,以Pt为阴极,C(石墨)为阳极,电解含CdCl2(0.01 mol⋅kg-1)和 CuCl2(0.02 mol⋅ kg-1)的水溶液。若电解过程中超电势可忽略不计,试问:(设活度系数均 为 1)
H+ ,H2
则 −0.7924 > −1.1338 − 0.116 lg j j > 1.14×10−3 A ⋅ cm−2
即电流密度应控制在 1.14×10-3A·cm-2以下时,H2气才不会和锌同时析出。 5. 在 298K时,当电流密度为 0.1 A·cm-2时,H2(g)和O2(g)在Ag(s)电极上的超电势分别为 0.87 和 0.98V。今用Ag(s)电极插入 0.01mol· kg-1的NaOH溶液中进行电解,问在该条件下 在两个银电极上首先发生什么反应?此时外加电压为多少?(设活度系数为 1) 解:阴极可能发生的反应有:
电解与极化作用

属银。只讨论阴极。
假如阴极上析出的是银
Ag
(aAg
)
1
e
Ag(s)
Ag ,Ag
$ Ag , Ag
0.799V
假如阴极上析出的是氢:
H
(
a H
107 ) e
1 2
H2(g,
p$)
2H ,H2
0.05915 1 1 lg 107
0.414V
上一内容 下一内容 回主目录
返回
2020/9/28
在电解池中进行的反应
阴极: 阳极:
2H
(a H
)
2e
H2 (g,
p$ )
2Cl
(a Cl
)
Cl2
(
g,
p$
)
2e
上一内容 下一内容 回主目录
返回
2020/9/28
分解电压的测定
当开时加外电压时,尚没有氢气和氯气生成, 它们的压力几乎为零。稍稍增大外压,电极表面 上产生了少量的氢气和氯气,其压力虽小,但却 构成了一个原电池,它产生了一个与外加电压方 向相反的反电动势Eb。
E(理论分解 ) E(可逆)
上一内容 下一内容 回主目录
返回
2020/9/28
分解电压的测定
使用Pt电极电解HCl, 实验装置如图所示。
逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强
度I 和电压E,画出I-E曲
线。
上一内容 下一内容 回主目录
返回
2020/9/28
分解电压的测定
返回
2020/9/28
极化的类型
析出电势:
阳,析出 阳,可逆 阳 阴,析出 阴,可逆 阴
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
E (理 论 分 解 )E (可 逆 )
上一内容 下一内容 回主目录
返回
2020/9/27
分解电压的测定
使用Pt电极电解H2O, 加入中性盐用来导电,实 验装置如图所示。
逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强
度I 和电压E,画出I-E曲
线。
上一内容 下一内容 回主目录
电源
V
G
阳极 P t 阴极
分解电压的测定ຫໍສະໝຸດ 返回2020/9/27
分解电压的测定
外加电压很小时,几乎
无电流通过,阴、阳极上无 电
H2气和氧气放出。
流 I
随着E的增大,电极表面
3
产生少量氢气和氧气,但压
力低于大气压,无法逸出。 所产生的氢气和氧气构成了 原电池,外加电压必须克服 这反电动势,继续增加电压, I 有少许增加,如图中1-2段。
用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析。
上一内容 下一内容 回主目录
返回
2020/9/27
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
(2)电化学极化
电极反应总是分若干步进行,若其中一步反应 速率较慢,需要较高的活化能,为了使电极反应顺 利进行所额外施加的电压称为电化学超电势(亦称 为活化超电势),这种极化现象称为电化学极化。
氢气在几种电极上的超电 势如图所示。可见在石墨和汞 等材料上,超电势很大,而在 金属Pt,特别是镀了铂黑的铂电 极上,超电势很小,所以标准 氢电极中的铂电极要镀上铂黑。
物理化学电子教案—第九章
上一内容 下一内容 回主目录
返回
2020/9/27
第九章 电解与极化作用
9.1 分解电压 9.2 极化作用 9.3 电解时电极上的反应 9.4 金属的电化学腐蚀与防腐 9.5 化学电源
上一内容 下一内容 回主目录
返回
2020/9/27
9.1 理论分解电压
理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势
上一内容 下一内容 回主目录
返回
2020/9/27
超电势(overpotential)
在某一电流密度下,实际发生电解的电极电势 E(不可逆) 与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电 势使电极电势变小。
为了使超电势都是正值,把阴极超电势 (阴 ) 和阳极超 电势 (阳 ) 分别定义为:
2
1
E分解
电压E
测定分解电压时的电流-电压曲线
上一内容 下一内容 回主目录
返回
2020/9/27
实际分解电压
要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 (阴 ) 和 (阳 ) ,以及克服电 池电阻所产生的电位降 I R 。这三者的加和就称为实 际分解电压。
2
1
E分解
电压E
测定分解电压时的电流-电压曲线
上一内容 下一内容 回主目录
返回
2020/9/27
分解电压的测定
当外压增至2-3段,氢
气和氧气的压力等于大
电 流
气压力,呈气泡逸出,反电 I
动势达极大值 Eb,max。
3
再增加电压,使I 迅速增 加。将直线外延至I =0处,得
E(分解)值,这是使电解池 不断工作所必需外加的最 小电压,称为分解电压。
E可逆
η阴
η阳
电位
电解池中两电极的极化曲线
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
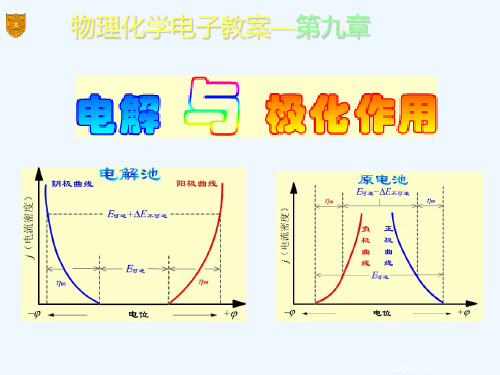
(2)原电池中两电极的极化曲线 原电池中,负极是阳极,
正极是阴极。随着电流密度的 增加,阳极析出电势变大,阴 极析出电势变小。由于极化, 使原电池的作功能力下降。
(阴)E(阴,平)E(阴,不可逆) E(阴,不可逆)E(阴,平)(阴)
(阳)E(阳,不可逆)E(阳,平) E(阳,不可逆)E(阳,平)(阳)
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
超电势或电极电势与电流密度之间的关系曲线称 为极化曲线,极化曲线的形状和变化规律反映了电化 学过程的动力学特征。
但可以利用这种极化降 低金属的电化腐蚀速度。
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
η阳
E可逆 -ΔE不可逆
η阴
j(电流密度)
负
正
极
极
曲
曲
线
线
E可逆
电位
电解池中两电极的极化曲线
上一内容 下一内容 回主目录
返回
2020/9/27
氢超电势
电解质溶液通常用水作溶剂,在电解过程中,H + 在阴极会与金属离子竞争还原。
利用氢在电极上的超电势,可以使比氢活泼的金 属先在阴极析出,这在电镀工业上是很重要的。
例如,只有控制溶液的pH,利用氢气的析出有超 电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。
上一内容 下一内容 回主目录
返回
2020/9/27
氢气在几种电极上的超电势
金属在电极上析出时超电势很小,通常可忽略不 计。而气体,特别是氢气和氧气,超电势值较大。
在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对平衡电势的偏离称为电极的极化。
上一内容 下一内容 回主目录
返回
2020/9/27
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
(1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。
E(分 解 )E(可 逆 )E(不 可 逆 )IR
E(不 可 逆 )(阳 )(阴 )
显然分解电压的数值会随着通入电流强度的增加而增加。
上一内容 下一内容 回主目录
返回
2020/9/27
9.2 极化作用
极化(polarization)
当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极平衡电势 E(阳,平) 和阴 极平衡电势E(阴,平) 。
(1)电解池中两电极的极化曲线
随着电流密度的增大,两 电极上的超电势也增大,阳极 析出电势变大,阴极析出电势 变小,使外加的电压增加,额 外消耗了电能。
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
阴极曲线
阳极曲线
E可逆+ΔE不可逆
j(电流密度)
上一内容 下一内容 回主目录
返回
2020/9/27
分解电压的测定
使用Pt电极电解H2O, 加入中性盐用来导电,实 验装置如图所示。
逐渐增加外加电压, 由安培计G和伏特计V分 别测定线路中的电流强
度I 和电压E,画出I-E曲
线。
上一内容 下一内容 回主目录
电源
V
G
阳极 P t 阴极
分解电压的测定ຫໍສະໝຸດ 返回2020/9/27
分解电压的测定
外加电压很小时,几乎
无电流通过,阴、阳极上无 电
H2气和氧气放出。
流 I
随着E的增大,电极表面
3
产生少量氢气和氧气,但压
力低于大气压,无法逸出。 所产生的氢气和氧气构成了 原电池,外加电压必须克服 这反电动势,继续增加电压, I 有少许增加,如图中1-2段。
用搅拌和升温的方法可以减少浓差极化,但也可 以利用滴汞电极上的浓差极化进行极谱分析。
上一内容 下一内容 回主目录
返回
2020/9/27
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
(2)电化学极化
电极反应总是分若干步进行,若其中一步反应 速率较慢,需要较高的活化能,为了使电极反应顺 利进行所额外施加的电压称为电化学超电势(亦称 为活化超电势),这种极化现象称为电化学极化。
氢气在几种电极上的超电 势如图所示。可见在石墨和汞 等材料上,超电势很大,而在 金属Pt,特别是镀了铂黑的铂电 极上,超电势很小,所以标准 氢电极中的铂电极要镀上铂黑。
物理化学电子教案—第九章
上一内容 下一内容 回主目录
返回
2020/9/27
第九章 电解与极化作用
9.1 分解电压 9.2 极化作用 9.3 电解时电极上的反应 9.4 金属的电化学腐蚀与防腐 9.5 化学电源
上一内容 下一内容 回主目录
返回
2020/9/27
9.1 理论分解电压
理论分解电压 使某电解质溶液能连续不断发生 电解时所必须外加的最小电压,在数值上等于该电 解池作为可逆电池时的可逆电动势
上一内容 下一内容 回主目录
返回
2020/9/27
超电势(overpotential)
在某一电流密度下,实际发生电解的电极电势 E(不可逆) 与平衡电极电势之间的差值称为超电势。
阳极上由于超电势使电极电势变大,阴极上由于超电 势使电极电势变小。
为了使超电势都是正值,把阴极超电势 (阴 ) 和阳极超 电势 (阳 ) 分别定义为:
2
1
E分解
电压E
测定分解电压时的电流-电压曲线
上一内容 下一内容 回主目录
返回
2020/9/27
实际分解电压
要使电解池顺利地进行连续反应,除了克服作 为原电池时的可逆电动势外,还要克服由于极化在 阴、阳极上产生的超电势 (阴 ) 和 (阳 ) ,以及克服电 池电阻所产生的电位降 I R 。这三者的加和就称为实 际分解电压。
2
1
E分解
电压E
测定分解电压时的电流-电压曲线
上一内容 下一内容 回主目录
返回
2020/9/27
分解电压的测定
当外压增至2-3段,氢
气和氧气的压力等于大
电 流
气压力,呈气泡逸出,反电 I
动势达极大值 Eb,max。
3
再增加电压,使I 迅速增 加。将直线外延至I =0处,得
E(分解)值,这是使电解池 不断工作所必需外加的最 小电压,称为分解电压。
E可逆
η阴
η阳
电位
电解池中两电极的极化曲线
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
(2)原电池中两电极的极化曲线 原电池中,负极是阳极,
正极是阴极。随着电流密度的 增加,阳极析出电势变大,阴 极析出电势变小。由于极化, 使原电池的作功能力下降。
(阴)E(阴,平)E(阴,不可逆) E(阴,不可逆)E(阴,平)(阴)
(阳)E(阳,不可逆)E(阳,平) E(阳,不可逆)E(阳,平)(阳)
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
超电势或电极电势与电流密度之间的关系曲线称 为极化曲线,极化曲线的形状和变化规律反映了电化 学过程的动力学特征。
但可以利用这种极化降 低金属的电化腐蚀速度。
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
η阳
E可逆 -ΔE不可逆
η阴
j(电流密度)
负
正
极
极
曲
曲
线
线
E可逆
电位
电解池中两电极的极化曲线
上一内容 下一内容 回主目录
返回
2020/9/27
氢超电势
电解质溶液通常用水作溶剂,在电解过程中,H + 在阴极会与金属离子竞争还原。
利用氢在电极上的超电势,可以使比氢活泼的金 属先在阴极析出,这在电镀工业上是很重要的。
例如,只有控制溶液的pH,利用氢气的析出有超 电势,才使得镀Zn,Sn,Ni,Cr等工艺成为现实。
上一内容 下一内容 回主目录
返回
2020/9/27
氢气在几种电极上的超电势
金属在电极上析出时超电势很小,通常可忽略不 计。而气体,特别是氢气和氧气,超电势值较大。
在有电流通过时,随着电极上电流密度的增加, 电极实际分解电势值对平衡值的偏离也愈来愈大,这 种对平衡电势的偏离称为电极的极化。
上一内容 下一内容 回主目录
返回
2020/9/27
极化的类型
根据极化产生的不同原因,通常把极化大致分为 两类:浓差极化和电化学极化。
(1)浓差极化 在电解过程中,电极附近某离 子浓度由于电极反应而发生变化,本体溶液中离子扩 散的速度又赶不上弥补这个变化,就导致电极附近溶 液的浓度与本体溶液间有一个浓度梯度,这种浓度差 别引起的电极电势的改变称为浓差极化。
E(分 解 )E(可 逆 )E(不 可 逆 )IR
E(不 可 逆 )(阳 )(阴 )
显然分解电压的数值会随着通入电流强度的增加而增加。
上一内容 下一内容 回主目录
返回
2020/9/27
9.2 极化作用
极化(polarization)
当电极上无电流通过时,电极处于平衡状态, 这时的电极电势分别称为阳极平衡电势 E(阳,平) 和阴 极平衡电势E(阴,平) 。
(1)电解池中两电极的极化曲线
随着电流密度的增大,两 电极上的超电势也增大,阳极 析出电势变大,阴极析出电势 变小,使外加的电压增加,额 外消耗了电能。
上一内容 下一内容 回主目录
返回
2020/9/27
极化曲线(polarization curve)
阴极曲线
阳极曲线
E可逆+ΔE不可逆
j(电流密度)
