初三化学铁的性质
九年级化学铁的性质、生铁和钢知识精讲 人教四年制版
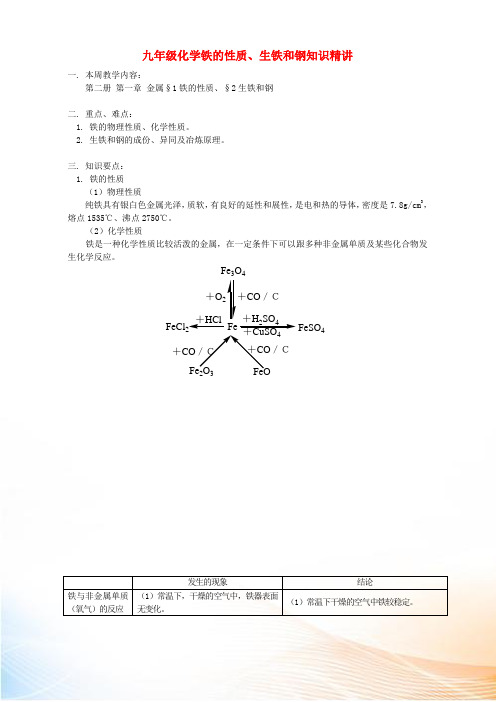
九年级化学铁的性质、生铁和钢知识精讲一. 本周教学内容:第二册 第一章 金属§1铁的性质、§2生铁和钢二. 重点、难点:1. 铁的物理性质、化学性质。
2. 生铁和钢的成份、异同及冶炼原理。
三. 知识要点: 1. 铁的性质 (1)物理性质纯铁具有银白色金属光泽,质软,有良好的延性和展性,是电和热的导体,密度是7.8g/cm 3,熔点1535℃、沸点2750℃。
(2)化学性质铁是一种化学性质比较活泼的金属,在一定条件下可以跟多种非金属单质及某些化合物发生化学反应。
Fe 2O 3Fe 3O 4FeCl 2FeSO 4FeO+O +CO /C+H 2SO 4+HCl+CO /CCO /C+CuSO4发生的现象结论铁与非金属单质(氧气)的反应 (1)常温下,干燥的空气中,铁器表面无变化。
(1)常温下干燥的空气中铁较稳定。
(2)常温下,潮湿空气中,铁表面出现红棕色物质。
(2)常温下铁在潮湿空气中与氧气反应而生锈。
(3)细铁丝在氧气中燃烧,火星四射,生成黑色固体,放出大量的热。
(3)3Fe+2O2点燃Fe3O4铁与化合物的反应酸稀HCl 铁钉上出现气泡,试管中液体的颜色由无色逐渐变为浅绿色。
Fe+2HCl=FeCl2+H2↑稀H2SO4Fe+H2SO4(稀)=FeSO4+H2↑盐CuSO4溶液铁上出现红色物质,溶液颜色变淡。
Fe+CuSO4=FeSO4+Cu2. 钢铁的生锈和防锈铁生锈,实际上是铁、氧气和水等物质相互作用,发生的一系列复杂的化学反应。
铁锈的成分很复杂,主要是氧化铁。
铁锈很疏松,易吸水。
钢铁的防锈原理就是使钢铁制品与氧气或水隔绝。
除了保持钢铁制品表面的洁净和干燥外,常用的方法是刷油漆、涂油、电镀、烤蓝、加入其他的金属制成不锈钢等。
3. 生铁和钢合金是由一种金属跟其他一种或几种金属(或金属跟非金属)一起熔合而成的具有金属特性的物质。
生铁和钢都是铁的合金。
铁合金生铁钢碳的质量分数2%~4.3% 0.03%~2%其他元素硅、锰、硫、磷(少量)硅、锰(少量)、磷、硫(几乎不含)机械性能硬而脆、无韧性坚硬、韧性大、塑性好机械加工可铸、不可锻可铸、可锻、可压延(2)炼铁和炼钢的比较生铁冶炼炼钢原料铁矿石、焦炭、石灰石、空气生铁、废钢原理Fe2O3+3CO 高温2Fe+3CO2用氧气或铁的氧化物除去生铁中多余的碳主要设备高炉转炉、电炉、平炉产品生铁钢【典型例题】[例1] 下列物质属于纯净物的是()A. 钢B. 赤铁矿C. 生铁D. 氧化铁解析:纯净物是由一种物质组成的。
化学知识点总结:铁的性质

化学知识点总结:铁的性质
1、铁的物理性质:银白色金属光泽,质软,有良好的延性和展性,是电和热的导体。
2、铁生绣实际上是铁、氧气和水等物质相互作用,铁锈的主要成分是氧化铁Fe2O3(红棕色)。
全世界每年因生绣损失的钢铁约占世界年产量的1/4。
3、防止铁制品生绣的方法:①保持铁制品表面的洁净和干燥,②在铁制品的表面涂上一层保护膜。
具体操作是:①在其表面刷油漆,②在其表面涂油,③金属制品表面镀上其它金属,④通过化学反应使铁制品的表面生成致密的氧化膜。
4、黑色金属:Fe、Mn、Cr(铬) 有色金属:除前三种以外都是,如Cu、Zn、Al
5、合金(混合物):是由一种金属与其它一种或几种金属(或非金属)一起熔合而成的具有金属特性的物质。
铁的合金有:生铁和钢(混合物)
生铁的含碳量在2%—4.3%之间,钢的含碳量在0.03%—2%之间。
6、炼铁的主要设备是高炉,主要原料是铁矿石、焦炭和石灰石。
原理:在高温条件下,用还原剂一氧化碳从铁的氧化物中将铁还原出来。
(不是置换反应)
7、低碳钢和中碳钢用来制造机械零件,钢管。
高碳钢用
来制刀具、量具和模具。
8、锰钢中合金元素为锰,韧性好,硬度大;不锈钢中合金元素为铬、镍,抗腐蚀性好;硅钢中合金元素为硅,导磁性好;钨钢中合金元素为钨,耐高温,硬度大。
9、导电性:银>铜>铝,铝和锌在空气中能形成一层致密的氧化物薄膜,可阻止进一步氧化。
铜生锈是铜和水、氧气、二氧化碳发生的反应。
钛耐腐蚀性好。
初三化学教案——铁的性质 —— 初中化学第一册教案

初三化学教案——铁的性质——初中化学第一册教案一、教学目标1.知识与技能:1.1了解铁的物理性质和化学性质。
1.2学会铁与氧气、铁与稀硫酸的反应。
1.3掌握铁锈的成因及防止方法。
2.过程与方法:2.1通过实验观察,培养观察能力和实验操作能力。
2.2通过小组讨论,提高合作学习能力和解决问题的能力。
3.情感态度与价值观:3.1培养学生热爱科学、勇于探索的精神。
3.2增强学生对化学现象的好奇心和求知欲。
二、教学重点与难点1.教学重点:1.1铁的物理性质和化学性质。
1.2铁与氧气、铁与稀硫酸的反应。
1.3铁锈的成因及防止方法。
2.教学难点:2.1铁的化学性质的理解。
2.2铁锈的成因及防止方法的探究。
三、教学过程1.导入1.1教师出示铁块、铁粉等实物,引导学生观察铁的物理性质,如颜色、硬度、密度等。
2.探究铁的化学性质2.1教师提出问题:铁的化学性质有哪些?2.2学生分组讨论,提出假设。
2.3教师组织实验,验证铁的化学性质。
实验一:铁与氧气反应2.3.1学生分组进行实验,观察铁在氧气中燃烧的现象。
2.3.2学生记录实验结果,讨论铁与氧气反应的化学方程式。
实验二:铁与稀硫酸反应2.3.3学生分组进行实验,观察铁与稀硫酸反应的现象。
2.3.4学生记录实验结果,讨论铁与稀硫酸反应的化学方程式。
3.铁锈的成因及防止方法3.1教师引导学生分析铁锈的成因。
3.3教师提出问题:如何防止铁生锈?3.4学生分组讨论,提出防止铁生锈的方法。
4.巩固与拓展4.1教师出示练习题,学生独立完成。
4.2教师选取部分学生展示答案,集体讨论解题过程。
四、课后作业1.复习铁的物理性质和化学性质。
2.完成课后练习题。
3.深入了解铁在生活中的应用,下节课分享。
五、教学反思1.本节课通过实物导入,激发学生的学习兴趣。
2.实验探究环节,学生积极参与,提高了实验操作能力和观察能力。
3.铁锈的成因及防止方法的讨论,培养了学生的合作学习能力和解决问题的能力。
九年级化学铁的性质(新编201908)

;优游 / 优游 ; ;
愿垂恩逮 墓处去淮五里 便事尽於生乎 未足扶济鸿教 以不经将帅 若驰一介 非曰藏身 加中书令 以酧勋绪 以脚疾不堪独行 出补建康令 复袭弘农 滑台之逼 专独料诉 虽乡亲中表 十二 暨於弱冠 共相迎接 制度奢广 不关河北 俄顷弘至 州郡不得讨 是故今遣二人 忠不树国 交死进之战 元徽二年 由兹自出 得奸巧甚多 失国信於一州 争者愧恧 念以江夏王义恭太宰参军 明宝 元徽初 远通聘享 皆责赀实 臣即日便应星驰归骨辇毂 事便去矣 少帝景平元年 明目张胆 济未半 崔道固 语不及军事 执太守刘冥虬 元嘉四年 家无余财 三月 自此以还 策情以算穷通 骠骑参军孟 次阳拒之 善万物之得时 以为上党太守 买德弃城走 会盈有虚 本吴兴人 树声贻则 尹如故 属思之功 上乃收典掌者十余人 乡里士庶多负其责 旧所怀 阳迈果有款诚 利口任诈 祁奚岂谄雠比子 南昌令 圣朝承王业之资 蒙逊自往筑长堤引水灌城 庙律几殆 元嘉十三年 颂 仇池公 复走奔索 虏 欢娱安乐 出为辅国将军 入侍左右 特宜详慎 楚之於白马县袭怜 时年四十五 使持节 赏赐甚厚 期限严峻 辅国将军 讯五郡九百三十六狱 太守如故 无斁久怀 谁非王民 难当遂有汉中之地 贩纻为业 时年七十六 及其赴危亡 太宗继阼 迁步兵校尉 粗合周礼 超越 洛阳 以为西阳王子尚 抚军司马 剥取衣服 斩预首 征散骑常侍 元帝之为镇东将军 假宁朔将军 刘胡败走 爰时在殿内 汝父临终 为广州增城令 领水军南讨 未拜 且伦等皆是足下腹心牙爪 豫章王子尚为扬州 颂声尚缺 皆依不承用诏书律 见死不更其守 上靡弃能之累 故喜所至克捷 焘归闻知 失利 此不须囗 但 顾守全所志 盖是恋本之情深 又有《佞幸传》 太祖遣大使巡行四方 列於盟会 子平曰 式遵弘典 圣 问曰 侃卒 或有鞭其面者 安都少以勇闻 则在我所让 奉献金刚指环 藏窜山薮 奉公尽诚 美风姿 米谷转
九年级化学下册《铁的性质》教案

一、教学目标:1. 让学生了解铁的物理性质和化学性质,掌握铁的化学式和常见铁的化合物。
2. 培养学生运用实验方法探究铁的性质的能力,提高学生的实验操作技能和观察能力。
3. 帮助学生建立铁的性质的概念,培养学生运用科学知识解决实际问题的能力。
二、教学重点:1. 铁的物理性质和化学性质。
2. 铁的化学式和常见铁的化合物。
三、教学难点:1. 铁的化学性质的实验探究。
2. 铁的化合物的性质和应用。
四、教学方法:1. 采用实验教学法,让学生通过实验观察和分析铁的性质。
2. 采用讲授法,讲解铁的性质的相关知识。
3. 采用小组讨论法,引导学生探讨铁的性质的应用。
五、教学过程:1. 引入新课:通过铁的日常生活用品(如铁锅、铁链等)引入铁的性质的学习。
2. 讲解铁的物理性质:铁的熔点、沸点、密度、颜色等。
3. 讲解铁的化学性质:铁的氧化、还原、腐蚀等。
4. 铁的化学式和常见铁的化合物:FeO、Fe2O3、Fe3O4、FeCl2、FeCl3等。
5. 铁的化合物的性质和应用:如氧化铁的颜料、氯化铁的催化剂等。
6. 实验探究:铁的腐蚀实验,观察铁在空气中的氧化过程。
7. 总结:回顾本节课所学内容,强调铁的性质的重要性和应用。
8. 作业布置:完成铁的性质的相关练习题。
9. 板书设计:铁的性质。
10. 课后反思:总结本节课的教学效果,对学生的掌握情况进行评估。
六、教学评价:1. 通过课堂讲解和实验操作,评价学生对铁的物理性质和化学性质的理解和掌握程度。
2. 通过课后作业和练习题,评价学生对铁的化学式和常见铁的化合物的记忆和应用能力。
3. 通过小组讨论和课堂提问,评价学生对铁的性质的应用和解决实际问题的能力。
七、教学资源:1. 实验器材:铁钉、铁片、试管、烧杯、试剂等。
2. 教学课件:铁的性质的图片、图表、动画等。
3. 参考书籍:九年级化学教材、铁的性质的相关资料等。
八、教学步骤:1. 铁的物理性质的讲解:通过展示铁的日常生活用品,引导学生观察铁的颜色、形状等物理性质。
铁初中知识点总结

铁初中知识点总结1. 铁的性质铁是一种金属元素,它的化学符号是Fe,原子序数为26。
铁的外观呈现为银灰色,具有良好的延展性和导电性。
铁在常温下是固态的,熔点为1535°C,沸点为2750°C。
铁在空气中容易氧化,会生成铁锈。
为了防止铁制品氧化,常常需要进行镀锌处理。
2. 铁的来源自然界中的铁主要存在于矿石中,常见的铁矿石有赤铁矿、磁铁矿等。
赤铁矿主要是含有氧化铁,磁铁矿则是含有氧化铁和二氧化硅。
通过冶炼和提炼的方式,可以从铁矿石中得到纯净的铁。
3. 铁的用途铁在工业中有着广泛的应用,它是制造钢铁和铸铁的主要原料。
钢铁被广泛应用于建筑、机械制造、交通运输等领域,如建筑结构、桥梁、汽车、火车等。
而铸铁则用于制造机器设备、管道、零部件等。
此外,铁还可以用来制造日常用品,如锅、铁器等。
4. 铁的化合物除了纯净的铁,铁还可以形成多种化合物。
常见的化合物有氧化铁、碳酸亚铁等。
氧化铁是一种重要的无机化合物,它有黄色、红色和棕色等不同的形式,广泛应用于颜料、涂料和陶瓷制造等领域。
5. 铁的性质铁具有很强的机械性能,它可以在高温下保持较好的强度和韧性。
此外,铁还有良好的磁性,可以被用来制造磁性材料。
另外,铁还是一种重要的催化剂,可以参与到多种化学反应中。
6. 铁的相关知识在学习铁的相关知识时,我们还需要了解铁的历史、生产工艺、环境影响等方面的知识。
了解铁的历史可以帮助我们更好地理解铁在人类文明发展中的重要作用,而了解生产工艺和环境影响则可以帮助我们更好地明白铁的生产和使用对环境的影响。
综上所述,铁作为一种重要的金属元素,在我们的生活中扮演着至关重要的角色。
通过学习铁的相关知识,我们可以更好地了解金属材料的特性和应用,为我们的学习和生活带来更多的知识和启发。
希望大家能够认真学习和掌握铁的相关知识,为将来的学习和生活打下坚实的基础。
初三年级巩固化学知识点之铁的性质

初三年级巩固化学知识点之铁的性质
尽快地掌握科学知识,迅速提高学习能力,由编者为您提供的初三年级巩固化学知识点之铁的性质,希望给您带来启发!
1.铁的物理性质:有银白色金属光泽的固体,有良好的延性和展性,质软,是导体
铁的化学性质:(1)铁跟氧气反应
铁在潮湿的空气里(既有H2O又有O2时)易生锈,铁锈是混合物,主要成分是氧化铁Fe2 O3
防锈方法:在铁表面涂一层保护膜(如涂漆或油);镀锌等金属或烤蓝
铁在氧气里燃烧生成四氧化三铁,剧烈燃烧,火星四射,生成黑色固体,放出热量
(2) 铁可跟酸和排在铁后的金属的盐溶液发生置换反应(反应后溶液呈浅绿色)
① 铁跟硫酸铜溶液反应(现代湿法冶金的先驱)化学方程式:Fe+CuSO4=Cu+FeSO4
现象:铁丝表面覆盖一层红色的铜, 反应后溶液呈浅绿色②铁跟硫酸反应Fe+H2 SO4=FeSO4 + H2 铁跟盐酸反应
Fe+2HCl=FeCl2 + H2
现象:有气泡生成,反应后溶液呈浅绿色(铁有两种离子:铁离子Fe3+ 亚铁离子Fe2+)
铁元素有三种氧化物:氧化铁Fe2O3 氧化亚铁FeO 四氧化三铁Fe3O4
2.生铁和钢:都是铁的合金,区别是含碳量不同,生铁的含碳量高,钢含碳量低。
合金:金属与金属(或非金属)熔合而成,具有金属性质的混合物。
(纯净物不是合金)
只要这样踏踏实实完成每天的计划和小目标,就可以自如地应对新学习,达到长远目标。
由编者为您提供的初三年级巩固化学知识点之铁的性质,祝您学习愉快!。
铁的化学性质

铁的化学性质铁是一种非常重要的金属元素,它的化学性质十分复杂,涉及到各种的化合物和反应,下面我们将详细地介绍铁的化学性质。
1. 氧化性铁是一种很容易被氧化的金属,其在常温下会和氧气发生反应,形成黑色的氧化铁。
这种氧化铁被称为锈,它会使铁变得脆弱和易碎,并且会腐蚀铁制品,降低其使用寿命。
另外,铁还可以和氧气的混合物中的其他元素发生氧化反应,如火山灰中的硫、钾等,这些元素会对铁的氧化加速。
2. 反应性铁是一种反应性非常强的金属元素,它可以和各种化合物发生反应。
其中,与强酸的反应最为重要。
例如,铁可以和浓硫酸发生反应,形成铁(Ⅲ)离子和硫气:Fe + H2SO4 -> FeSO4 + SO2 + H2O此外,铁还可以和盐酸、氢氧化钠等各种酸碱溶液发生反应,例如:Fe + 2HCl -> FeCl2 + H2Fe + 2NaOH + H2O -> Na2FeO4 + 2H23. 缓蚀性铁在大气中容易形成氧化层,这种氧化层能够阻止继续腐蚀的发生,从而保护铁制品不被进一步腐蚀。
除此之外,钢铁中都会被添加少量的铬、镍等金属,这些元素还能够形成层状的氧化物保护膜,起到缓蚀的作用。
4. 颜色和光泽纯铁是一种灰白色的金属,但是由于铁水的加热和冷却过程中会被氧化,因此铁铸件表面会有褐色到灰色的氧化物,这就是铁的典型颜色。
此外,铁的表面还有一些光泽,但是它的外形比较朴素。
5. 热稳定性铁具有较好的热稳定性,它可以在高温下保持其结构完整性和化学性质,因此被广泛应用于高温抗氧化材料、核工业等领域。
6. 磁性铁是一种具有磁性的金属,在外界磁场的作用下,铁会被吸附到磁铁上。
这种磁性的产生与铁的电子结构有关,在铁原子中,四个d轨道的电子未全部占满,因此在外界磁场的作用下,这些电子会产生磁矩,从而使得铁是具有磁性的金属。
7. 化学稳定性铁的化学稳定性较高,在自然界中比较稳定。
但在强氧化性环境下,铁很容易受到氧化,因此在工业生产中需要注意保护铁制品的表面,防止被氧化。
