由环己醇制备己二酸二酯
环己醇生成己二酸的原理

环己醇生成己二酸的原理
环己醇生成己二酸的原理分为两个步骤:1.环己醇氧化为己醛;2.己醛再氧化为己二酸。
首先,我们来看第一步。
环己醇氧化为己醛的反应通常使用氧气作为氧化剂,并在适当的温度和催化剂存在下进行。
反应的化学方程式如下所示:
环己醇+ [O] →己醛+ H2O
在这个反应中,环己醇失去一个氢原子并与氧气中的一个氧原子结合,生成己醛和水。
这个反应是一个氧化反应,可以将环己醇中的醇基(-OH)氧化成醛基(-CHO)。
接下来,我们来看第二步。
己醛再氧化为己二酸的反应也是一个氧化反应。
通常,这个反应也需要氧气作为氧化剂,并在适当的条件下进行。
反应的化学方程式如下所示:
己醛+ [O] →己二酸
在这个反应中,己醛中的羰基(C=O)被进一步氧化,生成己二酸。
与第一步相比,己醛中的羰基更容易被氧气氧化,因此只需单纯地加氧即可得到己二酸。
综上所述,环己醇生成己二酸的原理是通过两个氧化反应实现的。
首先,环己醇被氧气氧化为己醛,然后己醛再被氧气氧化为己二酸。
这两个反应均是氧化反应,并且需要适当的条件和催化剂才能进行。
这个反应在化工工业中有着广泛的应用,己二酸是一种重要的化工原料,用于生产尼龙、涂料、塑料等产品。
环己醇制备己二酸二酯

环己醇制备己二酸乙二酯一、实验目的1、综合训练有机化合物的制备、分离和提纯的操作技能。
2、通过本实验过程,使学生进一步了解消去反应、氧化反应和酯化反应的原理和特点。
二、实验原理已二酸与乙醇1:1反应,则不完全酯化HOOCCH2CH2CH2CH2COOH+C2H5OH→HOOCCH2CH2CH2CH2COOC2H5+H2O 已二酸与乙醇1:2反应,则完全酯化HOOCCH2CH2CH2CH2COOH+2C2H5OH→C2H5OOCCH2CH2CH2CH2COOC2H5+2H2O、实验仪器设备和试剂1、实验仪器设备:加热套;三颈烧瓶(250ml );真空泵;布氏漏斗;抽滤瓶;量筒(10ml );圆底烧瓶(100ml )铁架台;温度计(100℃与200℃各一个);胶头滴管;烧瓶250ml ;滤纸;天平;纸槽;滴液漏斗;冷凝管;分液漏斗。
等辅助工具。
2、实验所用试剂:环己醇;50%的硝酸;硫酸氢钠;无水乙醇;饱和碳酸钠溶液、实验步骤第一步:己二酸的制备一:1.如图一组装实验仪器2.分别量取25ml 浓HNO3(在量取过程中要注意戴橡胶手套,并小心不要溅到衣服上)与25ml 蒸馏水,在图中烧瓶中混合。
3.量取10ml 环己醇,倒入小烧杯中备用。
4.用加热套对HNO3加热到80℃停止加热,取出加热套,在烧瓶底下放250ml 的装有冷水的烧杯。
5.用滴管向烧瓶中“逐滴”滴加环己醇,保持反应温度在80-90℃,此反应会放出大量的热,如果超出反应温度用冷水降温。
6.滴加完毕,重新放入加热套中加热,保持反应温度在80-90℃,持续3分钟,使反应完全。
OH 3+ 8HNO 33HO 2C(CH 2)4CO 2H + 8NO + 7H 2O 8NO + 4O 2 8NO 2.待反应液稍冷后,将烧瓶放入冰水中冷却,使晶体析出。
2.将析出的晶体在布氏漏斗中进行抽滤。
用抽滤液洗出烧瓶中剩余的晶体。
用3ml冰水洗涤己二酸晶体,抽滤。
己二酸的制备1
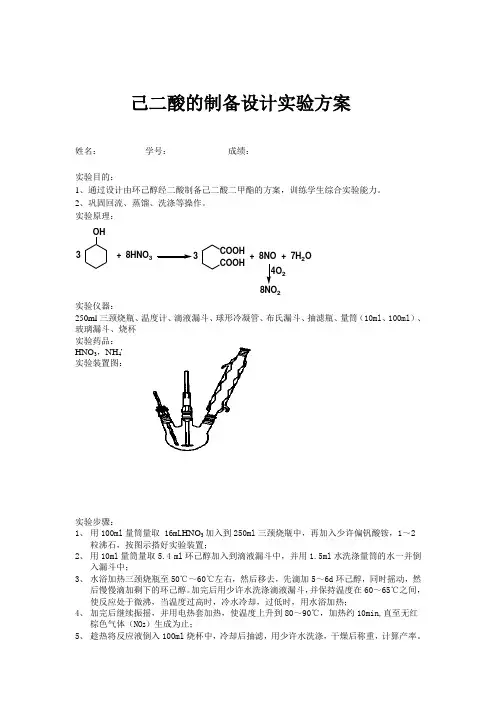
己二酸的制备设计实验方案姓名: 学号: 成绩:实验目的:1、通过设计由环己醇经二酸制备己二酸二甲酯的方案,训练学生综合实验能力。
2、巩固回流、蒸馏、洗涤等操作。
实验原理:OH+8HNO 3COOH COOH 3+8NO +7H 2O28NO 2实验仪器:250ml 三颈烧瓶、温度计、滴液漏斗、球形冷凝管、布氏漏斗、抽滤瓶、量筒(10ml 、100ml )、玻璃漏斗、烧杯实验药品:HNO 3,NH 4VO 3,环己醇,稀NaOH 吸收液实验装置图:实验步骤:1、 用100ml 量筒量取 16mL HNO 3加入到250ml 三颈烧瓶中,再加入少许偏钒酸铵,1~2粒沸石,按图示搭好实验装置;2、 用10ml 量筒量取5.4 ml 环己醇加入到滴液漏斗中,并用1.5ml 水洗涤量筒的水一并倒入漏斗中;3、 水浴加热三颈烧瓶至50℃~60℃左右,然后移去,先滴加5~6d 环己醇,同时摇动,然后慢慢滴加剩下的环己醇。
加完后用少许水洗涤滴液漏斗,并保持温度在60~65℃之间,使反应处于微沸,当温度过高时,冷水冷却,过低时,用水浴加热;4、 加完后继续振摇,并用电热套加热,使温度上升到80~90℃,加热约10min,直至无红棕色气体(NO 2)生成为止;5、 趁热将反应液倒入100ml 烧杯中,冷却后抽滤,用少许水洗涤,干燥后称重,计算产率。
6、实验数据记录与处理:n(环己醇)=5. 4(体积)×0.9624(d420)×0.98(含量)/100(FW)=0.0509moln(50%HNO3)=16(体积)×1.31(d420)×0.50(含量)/63(FW)=0.1663mol因为0.1663×3>0.0509×8,所以50%HNO3过量,计算时以环己醇的量为标准;己二酸的理论产量=0.0509×146(己二酸的FW) =7.4314g实际产量 =产率=参考文献:1、徐明波; 高耀初; 两种己二酸制备方法的改进[J]. 湖北师范学院学报(自然科学版) 2003年04期2、黄宇芳; 谢建刚; 张建州; 己二酸的合成[J]. 化学教育 2005年03期3、张红; 李阳; 制备己二酸的几种方法的比较[J]. 中国科技信息 2008年11期4、张晶晶,黄武,易清风等,环己醇电解氧化制备己二酸[J].期刊论文(应用化学)2008 年10期5、杨秀英等;己二酸制备方法的改进[J]. 山东师范大学学报(自然科学版) 2003年02期己二酸二甲酯的制备设计方案姓名:学号:成绩:实验目的;1、学习酯化反应的原理和己二酸二甲酯的制备方法2、巩固蒸馏、洗涤等操作技术实验原理:HOOC(CH2)4COOH+2CH3OH→CH3OOC(CH2)4COOCH3+2H2O实验仪器:100ml圆底烧瓶、球形冷凝管、干燥管、蒸馏头、直形冷凝管、接液管、锥形瓶、温度计、分液漏斗、烧杯、量筒(10ml、100ml),电热套实验药品:5g己二酸、23ml甲醇、浓硫酸4ml、碎冰、乙醚、饱和Na2CO3溶液、饱和NaCl 溶液、无水MgSO4实验装置图:实验步骤:1、称取5.0g己二酸加入到圆底烧瓶中,用量筒量取23ml甲醇倒入烧瓶中。
己二酸的制备实验报告

己二酸的制备实验报告一、实验目的1、掌握以环己醇为原料,通过硝酸氧化制备己二酸的原理和方法。
2、学习电动搅拌、控温、回流、过滤、重结晶等基本操作。
3、了解有机物制备过程中的产率计算和产品纯度分析。
二、实验原理己二酸是一种重要的有机二元羧酸,广泛应用于化工、塑料、纤维等领域。
本实验以环己醇为原料,在酸性条件下,用硝酸氧化制备己二酸。
化学反应方程式为:\\begin{align}3C_{6}H_{11}OH + 8HNO_{3} &\longrightarrow 3C_{6}H_{10}(COOH)_{2} + 8NO + 7H_{2}O\\\end{align}\三、实验仪器与药品1、仪器电子天平、电动搅拌器、恒温水浴锅、三口烧瓶(250 mL)、球形冷凝管、温度计(0 100℃)、布氏漏斗、抽滤瓶、玻璃棒、烧杯(500 mL、250 mL)、移液管(25 mL)、量筒(100 mL、50 mL)。
2、药品环己醇(分析纯)、浓硝酸(分析纯)、钒酸铵(催化剂)、蒸馏水。
四、实验步骤1、在 250 mL 三口烧瓶中,加入 100 mL 50%的硝酸溶液,安装好电动搅拌器、球形冷凝管和温度计。
2、称取 54 g 环己醇,用 25 mL 蒸馏水溶解,将其缓慢滴加到三口烧瓶中,同时开启搅拌,控制反应温度在 60 65℃之间。
3、滴加完毕后,继续搅拌 10 分钟,然后加入 01 g 钒酸铵作为催化剂。
4、升温至 80 90℃,保持回流反应 2 3 小时,期间密切观察反应现象,控制反应温度。
5、反应结束后,将反应液冷却至室温,然后倒入500 mL 烧杯中,缓慢加入适量的氢氧化钠溶液,中和至 pH 值为 7 8。
6、用布氏漏斗进行抽滤,得到己二酸粗产品。
7、将粗产品用蒸馏水进行重结晶,得到纯净的己二酸晶体。
8、干燥后称重,计算产率。
五、实验现象与记录1、滴加环己醇时,溶液逐渐变为黄色,有少量红棕色气体(NO₂)产生。
1.高锰酸钾氧化环己醇制备己二酸

1.高锰酸钾氧化环己醇制备己二酸己二酸是一种重要的有机化学品,广泛应用于聚酯树脂、塑料、涂料、医药等领域。
传统的制备方法采用氧化己烷或环己烯,但其存在烷基侧链或双键结构,对于制备高品质的聚酯树脂有一定的限制。
近年来,高锰酸钾氧化环己醇制备己二酸的方法逐渐得到重视。
1. 原理高锰酸钾是一种强氧化剂,具有高效、无毒、易得等特点。
环己醇是一种稳定的脂肪醇,易于用高锰酸钾进行选择性氧化。
高锰酸钾氧化环己醇生成的环己酮在酸催化下进行环氧化反应,得到环己酮酸。
环己酮酸与高锰酸钾反应,可生成己二酸。
2. 实验过程实验器材:高锰酸钾、环己醇、硫酸、烧瓶、漏斗、冷却器、隔水加热器等。
实验步骤:1)首先,将高锰酸钾5克与500毫升蒸馏水混合,搅拌至高锰酸钾完全溶解,得到高锰酸钾溶液;2)在烧瓶中加入环己醇25克,加入适量的高锰酸钾溶液,不断搅拌,使反应进行均匀。
此时,环己醇呈淡黄色,高锰酸钾悬浮在其上;3)经过数小时的反应,环己醇溶液变成深黄色,反应完全;4)将反应液倒入分液漏斗,加入稀硫酸,混合均匀,并用蒸馏水洗净;5)将溶液倒入隔水加热器中加温,提取己二酸。
3. 结果分析用高锰酸钾氧化环己醇制备己二酸的反应是一个多步反应,其中环己醇选择性氧化生成环己酮是关键步骤。
反应时间、温度、环己醇和高锰酸钾的摩尔比等均对反应产率有影响。
实验表明,在高锰酸钾氧化环己醇制备己二酸的反应中,最适宜的反应条件是高锰酸钾用量相对于环己醇为0.08,反应时间为5小时,反应温度为70℃。
4. 结论高锰酸钾氧化环己醇制备己二酸具有简单、无毒、高产率等优点,适用于工业化生产。
研究表明,在特定的反应条件下,利用高锰酸钾氧化环己醇制备己二酸是一种高效的方法,并有望应用于聚酯树脂、涂料、医药等领域。
由环己醇制备己二酸二酯

有机化学实验八由环己醇制备己二酸二酯实验项目性质:综合性实验实验所涉及课程:无机化学、分析化学、无机及分析化学实验计划学时:4学时一、实验目的1、综合训练有机化合物的制备、分离和提纯的操作技能。
2、通过本实验过程,使学生进一步了解消去反应、氧化反应和酯化反应的原理和特点。
3、通过实验,使学生了解科学研究的初步知识,训练学生按科技论文进行写实验报告,为毕业设计和就业奠定一定的科研基础。
二、预习与参考1、实验前查阅资料,了解消去反应、氧化反应和酯化反应的特点;2、充分预习实验内容,安排好实验次序,设计好实验原始数据的记录表;3、实验结束后按要求完成实验报告。
4、参考资料:[1] 高占先主编,《有机化学实验》,高等教育出版社,2004年6月第四版。
[2] 李兆陇阴金香等编写,《有机化学实验》,清华大学出版社,2000年。
[3] 谷亨杰编写,《有机化学实验》,高等教育出版社,2002年。
[4] 文瑞明等,硫酸氢钠催化合成己二酸二乙酯,应用化工,2001,30(4),21-22三、设计指标1、确定实验方法、实验过程,设计实验数据采集表格;2、设计产率的计算公式,以质量分数表示。
四、实验要求在掌握制备原理的基础上,做好以下工作:1、配平有关的反应方程式;2、按使用20g 环己醇为起始物进行设计;3、查阅有关反应物和产物及使用的其他物质的物理常数;4、分析资料,提出设计方案;5、列出使用的仪器设备,并画出仪器装置图;6、提出各步反应的后处理方案;7、提出产物的分析测试方法和打算使用的仪器。
实验部分:1、指导教师审查学生的设计方案;2、学生独立完成实验操作,如果失败,必须进行重做;3、鼓励学生按自己的合成思路,对不同的实验条件进行反复探索,总结经验。
4、提倡对所做实验的深入研究,不刻意追求完成实验的多寡;5、对所得产物都要进行测试分析;以分析测试手段来表征合成的结果;6、做好实验记录,教师签字确认。
附:实验步骤第一步:己二酸的制备一:1.如图一组装实验仪器2.分别量取25ml浓HNO3(在量取过程中要注意戴橡胶手套,并小心不要溅到衣服上)与25ml蒸馏水,在图中烧瓶中混合。
环己醇制备己二酸
方法一:环己醇制备己二酸(高锰酸钾)一、实验目的1.学习环己醇氧化制备已二酸的原理和了解由醇氧化制备羧酸的常用方法。
2.熟悉电动搅拌,抽滤等实验技术。
3.熟练掌握熔点的测定技术。
二、实验原理 己二酸(ADA ),又称肥酸。
常温下为白色晶体, 熔点152 ℃,沸点337.5 ℃。
主要用途:有机合成中间体,主要用于合成纤维 (尼龙-66,大约占己二酸总量的70%)其 它的 (30%) 在制备聚氨酯:PA-46,PA-66,PA-610,合成树脂,合成革,聚酯泡沫塑料, 塑料增塑剂,润滑剂,食品添加剂, 粘合剂, 杀虫剂,染料, 香料, 医药等领域得以广泛应用。
产量情况 1902年首次合成。
目前世界产量大约2.60 Mt/a ,并以3.36% 年增长率增长。
其中世界上最大的5 家企业是: Dupont (1.09 Mt/a)、Rhodia (417 kt/a)、Solutia (385 kt/a)、 BASF (240 kt/a) 和旭化成 (112 kt/a)。
2002年我国年生产能力12万t/a (巴陵石化,辽阳石化,太原化学,上海燎原化工,神马集团),市场消费量约为19.5万t/a 。
预计2010年全球ADA 生产能力有望达到3.32 Mt/a 。
制备羧酸最常用的方法是烯、醇、醛等的氧化法。
常用的氧化剂有硝酸、重铬酸钾(钠) 的硫酸溶液、高锰酸钾、过氧化氢及过氧乙酸等。
但其中用硝酸为氧化剂反应非常剧烈,伴有大量二氧化氮毒气放出,既危险又污染环境。
因而本实验采用环己醇在高锰酸钾的碱性条件发生氧化反应,然后酸化得到已二酸。
反应式H[O O ]O[]HOC O(CH 2)4OHOC环己醇 环己酮 己二酸OH MnO 338H 2+KMnO 4+HO 2C(CH 2)4CO 2H ++8KOH8三、仪器和药品抽滤装置、100℃温度计、环己醇、高锰酸钾、氢氧化钠、亚硫酸氢钠、浓盐酸、试纸。
四、实验步骤1.安装反应装置,在烧杯中加入6g 高锰酸钾和50mL0.3mol/L 氢氧化钠溶液,搅拌加热至35℃使之溶解,然后停止加热;2.在继续搅拌下用滴管滴加2.1mL环己醇,控制滴加速度,维持反应温度43~47℃,滴加完毕后若温度下降,可在50℃的水浴中继续加热,直到高锰酸钾溶液颜色褪去。
环己醇、己二酸工艺
环己醇、己二酸工艺环己醇、己二酸工艺是一种重要的化工生产过程,可以广泛应用于食品、医药、日用化学品等领域。
这种工艺利用己二酸和环己烷作为原料,经过一系列的化学反应和物理处理,最终得到环己醇和己二酸。
本文将详细介绍环己醇、己二酸工艺的原理、流程、应用和发展趋势等方面内容。
一、原理环己醇、己二酸工艺是一种典型的有机合成过程,主要利用己二酸经过酯化反应生成己二酸二酯,再与环己烷在催化剂作用下发生反应生成环己醇和己二酸。
其具体反应方程式如下所示:C6H12O4 + 2C6H12O → C12H22O4 + 2H2OC12H22O4 → C6H12(OH)COOH + HOOC(CH2)4COOH二、流程环己醇、己二酸工艺的生产过程可分为以下几个步骤:(1) 原料准备:用纯化的环己烷和己二酸作为原料,必要时添加稳定剂和抗氧化剂。
(2) 酯化反应:将己二酸和酯化剂加入反应釜内,并在合适条件下加热下进行酯化反应。
反应得到己二酸二酯。
(3) 环合反应:将己二酸二酯、环己烷和催化剂加入反应釜内,进行环合反应,最终得到目标产物环己醇和己二酸。
(4) 分离、净化与精制:将反应混合物通过酸化、萃取、蒸馏和结晶等方式进行分离、净化和精制,得到产品的纯化物。
三、应用环己醇、己二酸是重要的有机化学原料,广泛应用于食品、医药、化妆品、染料、塑料等领域。
其中一些常见的应用如下:(1) 食品:己二酸可用作食品保鲜剂和食品添加剂,环己醇可用作调味剂和香精。
(2) 医药:己二酸和环己醇可用于制备口服药物和外用药物的原料,还可以用于合成防腐剂和解热镇痛药等。
(3) 化妆品:己二酸和环己醇可用于制备洗发水、肥皂、香水和化妆品等。
(4) 染料:己二酸和环己醇可用于合成染料和颜料,具有良好的染色性能。
(5) 塑料:己二酸和环己醇可用于制备聚酯树脂和聚酯纤维,作为塑料的主要原料。
四、发展趋势随着人们对健康、环保、安全等方面要求的提高,环己醇、己二酸工艺的发展也呈现出一些新趋势:(1) 优化工艺:通过改进生产工艺和技术手段,提高反应效率和产物质量,减少废物和能源消耗,降低生产成本,提高市场竞争力。
《有机化学基础》课时作业11:3.1.2有机合成路线的设计和应用
第2课时 有机合成路线的设计和应用[对点训练]题组1 有机合成路线的选择和优化1.以下反应均可在一定条件下进行,其符合绿色化学原理的是( )①2CH 2===CH 2+O 2――→Ag②乙烷与氯气制备氯乙烷 ③乙醇与浓硫酸共热制取乙烯 ④乙烯在一定条件下制备聚乙烯 A .①②B .②③C .③④D .①④ 答案 D解析 以“原料分子中原子全部转变为所需产物”为依据进行分析,乙烷与氯气发生取代反应,生成产物有一氯乙烷、二氯乙烷、三氯乙烷等和氯化氢,原子不能全部转化为一种产物,不符合题意;乙醇在浓硫酸作用下生成乙烯、水及其他副产物,也不符合;而①④中反应物的原子可以完全转化为产物,符合要求。
【考点】 有机合成路线的设计 【题点】 绿色化学反应原理2.在有机合成中,常需要将官能团消除或增加,下列变化过程中的反应类型及相关产物不合理的是( )①乙烯―→乙二醇:CH 2===CH 2――→加成CH 2Br —CH 2Br ――→取代HOCH 2—CH 2OH ②溴乙烷―→乙醇:CH 3CH 2Br ――→消去CH 2===CH 2――→加成CH 3CH 2OH③1-溴丁烷―→1,3-丁二烯:CH 3CH 2CH 2CH 2Br ――→消去CH 3CH 2CH===CH 2――→加成CH 3CH 2CHBr —CH 2Br ――→消去CH 2===CH —CH===CH 2④乙烯―→乙炔:CH 2===CH 2――→加成CH 2Br —CH 2Br ――→消去CH ≡CH A .①② B .②③ C .②④ D .①④答案 B解析 ②项由溴乙烷―→乙醇,只需溴乙烷在碱性条件下水解即可,路线不合理;③项合成过程中CH 3CH 2CHBr —CH 2Br 发生消去反应所得产物为CH 3CH 2C ≡CH(CH 3CH===C===CH 2不稳定),合成路线及相关产物不合理。
【考点】 有机合成路线的设计 【题点】 有机合成路线的优化和选择 题组2 合成方法的应用3.以氯乙烷为原料制取乙二酸(HOOC —COOH)的过程中,要依次经过下列步骤中的( ) ①与NaOH 的水溶液共热 ②与NaOH 的醇溶液共热③与浓硫酸共热到170℃ ④在催化剂存在情况下与氯气反应 ⑤在Cu 或Ag 存在的情况下与氧气共热 ⑥与新制的Cu(OH)2悬浊液共热 A .①③④②⑥ B .①③④②⑤ C .②④①⑤⑥ D .②④①⑥⑤【考点】逆合成分析法 【题点】逆合成分析法 答案 C解析 采取逆向分析可知,乙二酸→乙二醛→乙二醇→1,2-二氯乙烷→乙烯→氯乙烷。
己二酸的制备
实验十一己二酸的制备
一、实验目的
1、学习使用环己醇制备己二酸的原理和方法
2、学习抽滤操作分离固液物质的方法
二、实验原理
OH
HNO
HOOCCH
2CH
2
CH
2
CH
2
COOH
三、实验仪器和药品
烧瓶、三口连接管、水浴锅、温度计、电炉、抽滤瓶、布氏漏斗、恒压滴液漏斗、环己醇、浓硝酸、冰块、滤纸、玻棒
装置图
四、实验步骤
1、在烧瓶中加入10ml水、10ml浓硝酸,混合均匀,并在水浴中加热至80摄氏度。
在恒压滴液漏斗中加入4.2ml环己醇。
控制滴速,使烧瓶中混合物温度控制在85-90摄氏度之间(必要时想水浴中添加冷水)。
当醇全部加入而且溶液温度降至80摄氏度以下时,将混合物在85-90摄氏度下加热约15min,使其充分反应。
2、将反应物放入冰水浴中冷却,析出的晶体经布氏漏斗抽滤得到,用3ml水洗涤滤饼,并将所得晶体尽量压干并称重。
五、实验数据处理
六、注意事项
1.环己醇和硝酸切不可用同一量筒量取。
2.实验产生的二氧化氮气体有毒,所以装置要求严密不漏气,并要作好尾气吸收。
3.反应完毕后,要趁热倒出反应液,若任其冷却至室温的话,己二酸就结晶析出,不容易倒出,造成产品的损失。
4.控制环己醇的滴加速度是制备己二酸实验的关键
5.制备羧酸采取的都是比较强烈的氧化条件,一般都是放热反应,应严格控制反应温度,否则不但倒影响产率,有时还会发生爆炸事故;
七、思考题
1、为什么必须严格控制氧化反应的温度?
2、如果烧瓶中温度超过90摄氏度,应如何处理?。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学实验八由环己醇制备己二酸二酯
实验项目性质:综合性实验
实验所涉及课程:无机化学、分析化学、无机及分析化学
实验计划学时:4学时
一、实验目的
1、综合训练有机化合物的制备、分离和提纯的操作技能。
2、通过本实验过程,使学生进一步了解消去反应、氧化反应和酯化反应的原理和特点。
3、通过实验,使学生了解科学研究的初步知识,训练学生按科技论文进行写实验报告,为毕业设计和就业奠定一定的科研基础。
二、预习与参考
1、实验前查阅资料,了解消去反应、氧化反应和酯化反应的特点;
2、充分预习实验内容,安排好实验次序,设计好实验原始数据的记录表;
3、实验结束后按要求完成实验报告。
4、参考资料:
[1] 高占先主编,《有机化学实验》,高等教育出版社,2004年6月第四版。
[2] 李兆陇阴金香等编写,《有机化学实验》,清华大学出版社,2000年。
[3] 谷亨杰编写,《有机化学实验》,高等教育出版社,2002年。
[4] 文瑞明等,硫酸氢钠催化合成己二酸二乙酯,应用化工,2001,30(4),21-22
三、设计指标
1、确定实验方法、实验过程,设计实验数据采集表格;
2、设计产率的计算公式,以质量分数表示。
四、实验要求
在掌握制备原理的基础上,做好以下工作:
1、配平有关的反应方程式;
2、按使用20g 环己醇为起始物进行设计;
3、查阅有关反应物和产物及使用的其他物质的物理常数;
4、分析资料,提出设计方案;
5、列出使用的仪器设备,并画出仪器装置图;
6、提出各步反应的后处理方案;
7、提出产物的分析测试方法和打算使用的仪器。
实验部分:
1、指导教师审查学生的设计方案;
2、学生独立完成实验操作,如果失败,必须进行重做;
3、鼓励学生按自己的合成思路,对不同的实验条件进行反复探索,总结经验。
4、提倡对所做实验的深入研究,不刻意追求完成实验的多寡;
5、对所得产物都要进行测试分析;以分析测试手段来表征合成的结果;
6、做好实验记录,教师签字确认。
附:实验步骤
第一步:己二酸的制备
一:1.如图一组装实验仪器
2.分别量取25ml浓HNO3(在量取过程中要注意戴橡胶手套,并小心不要溅到衣服上)与25ml蒸馏水,在图中烧瓶中混合。
3.量取10ml环己醇,倒入小烧杯中备用。
4.用加热套对HNO3加热到80℃停止加热,取出加热套,在烧瓶底下放250ml的装有冷水的烧杯。
5.用滴管向烧瓶中“逐滴”滴加环己醇,保持反应温度在80-90℃,此反应会放出大量的热,如果超出反应温度用冷水降温。
6.滴加完毕,重新放入加热套中加热,保持反应温度在80-90℃,持续3分钟,使反应完全。
注意事项:1.上述反应会产生NO2,应在通风橱中进行。
2.此反应放热较多,一定要逐滴加入,以免温度上升太高使反应失控.但也不要使温度降到80℃以下,以至反应太慢使未反应的环己醇积聚起来影响产率。
二:1.待反应液稍冷后,将烧瓶放入冰水中冷却,使晶体析出。
2.将析出的晶体在布氏漏斗中进行抽滤。
用抽滤液洗出烧瓶中剩余的晶体。
用3ml冰水洗涤己二酸晶体,抽滤。
再用3ml冰水洗涤一次,再抽滤。
3.等晶体变为雪白色且完全干燥时停止抽滤,取出滤纸,称量计算产率。
注意事项:在冷却的过程中要不停的转动烧瓶(不是晃动),避免洗出的晶体粘在烧瓶壁上。
如果仍有晶体粘在壁上可稍微加热使其脱落再重新冷却一次。
第二步:己二酸二乙酯的合成
1.将以上获得的己二酸晶体用纸槽小心地转移到三颈烧瓶中。
再添加半药匙NaHSO4作催化剂。
2 .向滴液漏斗中添加15ml无水乙醇,如图二组装仪器。
3 .用加热套给三颈烧瓶加热,当量程为200℃的温度计升高到120℃时,打开滴液漏斗阀门,逐滴滴加无水乙醇,使反应温度控制在120-125℃之间。
4.反应40min左右(从开始滴加乙醇算)取出加热套,让反应物自然冷却。
此时反应物已成为无色液体,NaHSO4晶体颗粒聚集在一起成为块状。
将产物从三颈烧瓶中倒出。
用饱和Na2CO3洗涤分液,除去其中的己二酸氢乙酯和NaHSO4.所得产物即为己二酸二乙酯,用量筒测己二酸二乙酯的体积根据密度计算产率。
五、实验仪器设备和试剂
1、实验仪器设备:
加热套;三颈烧瓶(250ml);真空泵;布氏漏斗;抽滤瓶;量筒(10ml);圆底烧瓶(100ml)铁架台;温度计(100℃与200℃各一个);胶头滴管;烧瓶250ml;滤纸;天平;纸槽;滴液漏斗;冷凝管;分液漏斗。
等辅助工具。
2、实验所用试剂:
环己醇;浓硝酸;硫酸氢钠;无水乙醇;饱和碳酸钠溶液
六、结果测试
按照设计的表格采集数据,记录实验中所有原始数据并进行结果的计算处理。
七、考核要求
1、实验考核按实验教学大纲要求进行考核。
2、实验成绩可按百分制登记,实验预习占30%,实验操作占40%,实验报告占30%。
八、实验报告格式及要求
1、实验报告以科技小论文的形式书写。
2、实验报告格式
(1)题目:实验项目名称
(2)作者、单位
(3)摘要(100字以内)
(4)关键词(3-5个,以分号隔开)
(5)正文:①引言:写明本次实验的目的、意义及采取的实验方法。
②实验原理:简述实验的基本原理及反应方程式、结果计算公式。
③实验仪器设备及材料:列出主要的仪器设备及材料。
④实验过程及实验原始数据:扼要写出实验步骤,列出实验原始数据。
⑤实验数据处理:对实验数据计算及结果表达。
⑥实验结果讨论:对实验进行小结,包括对实验条件与实验结果进行讨论,得出本次科学实验的结论。
(6)实验参考资料。
九、思考与讨论题
1、做本实验时,为什么必须严格控制好滴加环己醇的速度和反应物的温度?
2、本实验为什么必须在通风厨里进行?
3、写出用硝酸氧化环己醇成为己二酸的平衡方程式(假定硝酸的分解产物完全是二氧化氮)。
根据方程式计算己二酸的理论产量。
4、为什么要用过量的乙醇?
5、能否用浓氢氧化钠溶液代替饱和碳酸钠溶液来洗涤?。
