物理化学核心教程电子教案
物理化学核心教程05 化学平衡
5.2.3
液相反应的标准平衡常数
如果反应是在理想的稀溶液中进行
并假设溶剂不参加反应,忽略压力对凝聚系统 的影响
(r Gm )T , p
mB r G (T ) RT ln B m
m
B
(r Gm )T , p
cB r G (T ) RT ln B c
m
B
5.1.3
化学反应等温式
对于溶剂不参与反应的非理想稀溶液系统, 化学反应等温式为
B B
B < 0
BB 0 B B > 0
B
5.1.2
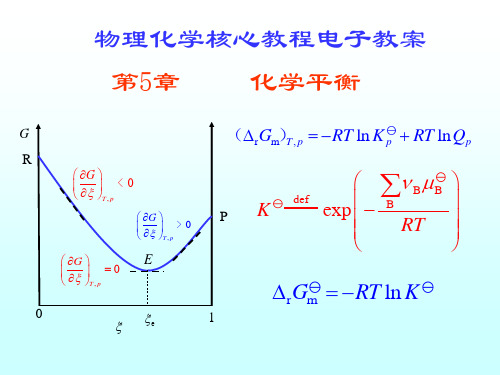
化学反应的方向与限度
以(r Gm), p 为判据 T
(rGm), p < 0 T (rGm), p 0 T (rGm), p > 0 T
反应自发向右进行,趋向平衡 反应达到平衡 反应自发向左进行,趋向平衡
5.1.3
B
B
代入标准平衡常数的定义式 得
pB K B p e
p
K
def
B
B B (T ) exp B RT
5.2.2
气相反应的标准平衡常数
pB K B p e
p
理想气体混合物反应系统
这就是理想气体混合物系统的化学反应等温式 称为化学反应的标准摩尔Gibbs自由能 变化值 与标准化学势一样,仅是温度的函数 称为压力商,由参与反应的气体的压 Qp 力决定 化学反应等温式的用处 若已知 r Gm (T ) 和 Q p ,就可以计算(rGm), p , T 来判断反应的方向和限度。
B pB K p B p e
物理化学核心教程1

pVam2
Vm
b
RT
a 的单位:
Pam6mol2
或 pnV22aVnbnRT
b 的单位:
m3 mol1
a,b 称为van der Waals 常数
上一内容 下一内容 回主目录
返回
2019/11/9
1.5.2 从临界参数求 a, b 值
(2 )pp 1p 2p k p B B 总压等于相同T,V 下,各组分的分压之和
(3)
pB p
nB n
xB
上一内容 下一内容 回主目录
返回
2019/11/9
1.3.3 Amagat 分体积定律
在相同的温度 T 和总压力 p 的条件下
(1 )V V 1 * V 2 * V k * V B * B
' 1
Vm
返回
2019/11/9
1.4.3 真实气体的 p-Vm 图
p l1'
C为临界点 TC, pC, Vm,C
C
l2
g2
l1
g1
l
上一内容 下一内容 回主目录
T3
TC
g
T 2g
T V
1 m
' 1
返回
p
Vm
TC
0
2p
V
2 m
TC
0
273K 293K
上一内容 下一内容 回主目录
返回
2019/11/9
思考题
答:
(1)左球温度升高,气体体积膨胀, 推动汞滴向右边移动。
(2)两球温度同时都升高10K,汞滴仍 向右边移动。因为左边起始温度低,升高 10K所占比例比右边大,283/273大于 303/293,所以膨胀的体积(或保持体积 不变时增加的压力)左边比右边大。
第八章 电化学
⒈ 在电极界面上发生化学变化物质的质量 与通入的电荷量成正比。
⒉ 通电于若干个电解池串联的线路中,当 所取的基本粒子的荷电数相同时,在各个电 极上发生反应的物质,其物质的量相同,析 出物质的质量与其摩尔质量成正比。
人们把在数值上等于1 mol元电荷的电量称为 Faraday常数。
已知元电荷电量 e 为 1.6022 1019 C
四、电化学的发展史
1600 1791 1799 1800 1807 1833 1839 1900 1884 Gilbert(英) Galvani (意大利) Volta (意大利) Davy(英) Faraday(英) Grove Nernst(德) Arrhenius(瑞典) 发现摩擦生电 发现生物电现象 发明电池 电解制碱金属 电解定律 氢氧燃料电池 Nernst方程 电离学说
在电解池中
阳离子迁向阴极,在
阴极上发生还原作用
阴 极
e-
-
电源 +
+
阳 极
e
-
Cation Cathode
阴离子迁向阳极,在 阳极上发生氧化作用
电解质溶液
Anion Anode
电解池
在电解池中 阳极上发生氧化作用
阴 极
e-
-
电源 +
+
阳 极
e
-
2Cl aq Cl2 (g) 2e
⒈ 是电化学上最早的定量的基本定律,揭示了
通入的电量与析出物质之间的定量关系。
⒉ 该定律在任何温度、任何压力下均可以使用。
⒊ 该定律的使用没有什么限制条件。 4. 适用于多个电化学装置的多个反应(串联)
电流效率
按Faraday定律计算所需理论电荷量 电流效率 100% 实际所消耗的电荷量
2024年度-物理化学全册电子教案

28
拓展延伸:前沿领域介绍及挑战性问题探讨
纳米材料物理化学
探讨纳米材料的特殊性质、制备 方法以及在能源、环境等领域的 应用前景。
生物物理化学
介绍生物大分子的结构、功能以 及生物体内的物理化学过程,如 蛋白质折叠、DNA复制等。
能源转化与存储
分析太阳能、风能等可再生能源 的转化与存储技术,以及新型电 池、超级电容器等能源存储器件 的原理与应用。
分子晶体
由分子间作用力结合而成,熔 点低、硬度小,具有各向异性 。
原子晶体
由原子通过共价键结合而成, 具有高熔点、高硬度、导电性 差等特点。
金属晶体
由金属阳离子和自由电子构成 ,具有导电、导热、延展性等
特性。
25
非晶体材料简介及发展趋势
非晶体材料概述
非晶体材料指内部结构无序的固 体材料,与晶体材料相比,缺乏 长程有序性。
原电池工作原理
利用化学反应产生电能,将化学能转化为电能。包括负极氧化、正极还原、离子迁移和电 子传递等过程。
电解池工作原理
在外加电压作用下,电解质发生电解反应,将电能转化为化学能。包括阳极氧化、阴极还 原、离子迁移和电子传递等过程。
原电池与电解池的区别与联系
原电池是自发进行的化学反应,而电解池需要外加电压才能发生反应;两者都涉及电极反 应和离子迁移,但方向和驱动力不同。
1 2
热力学能
系统内能的变化量,与做功和热量传递有关。
热力学第一定律表达式
ΔU = Q + W,表示系统内能的变化等于外界对 系统传递的热量与系统对外界做功之和。
3
热量与功
热量是系统与外界之间由于温差而传递的能量, 功是系统与外界之间由于力作用而传递的能量。
物理化学核心教程电子教案(精)

返回
2019/6/9
8.2.1 电导、电导率、摩尔电导率
基本质点的选取在计算摩尔电导率时要与浓度一致
Λ m
(MgCl2
)
Λ m
(MgCl2
)
Λ
c(MgCl2 )
m
2Λm
(
1 2
MgCl2
)
1 2
MgCl2
c
1 2
MgCl2
当浓度的单位用 mol dm3 时
②
电极①:
与外电源负极相接,是负极
电极从外电源得到电子, 发生还原反应
Cu2+ +2e Cu(s)
上一内容 下一内容 回主目录
返回
2019/6/9
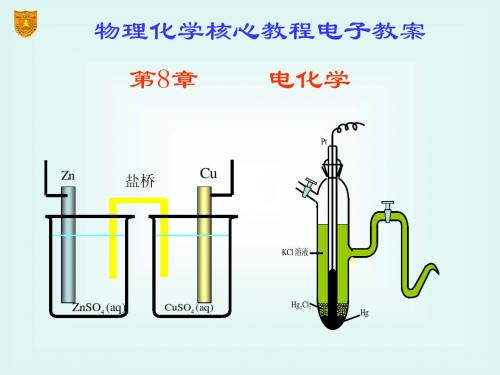
8.1.1 原电池和电解池
电解池 将电能转化为化学能的装置
电解池有两个半电池组成
当由两个Cu 电极组成电解池时 ①
②
电极②:
与外电源正极相接,是正极
发生氧化反应
Cu(s) Cu2+ +2e
电极的极性由外接电 源的极性所决定
上一内容 下一内容 回主目录
返回
2019/6/9
8.1.2 正极、负极、阴极和阳极
正极、负极 比较两个半电池的电势
电势高的极称为正极,电流从正极流向负极。 电势低的极称为负极,电子从负极流向正极。
Zn
负极
Cu
①
返回
2019/6/9
8.1.3 Faraday 定律
Faraday定律的文字表述
⒈ 通电于电解质溶液,在电极界面上发生化 学变化物质的质量与通入的电量成正比。
《物理化学》电子教案上册

《物理化学》电子教案上册第一章:引言1.1 课程介绍物理化学的定义和研究对象物理化学在科学和工程中的应用1.2 物理化学的发展简史物理化学的起源和发展过程重要的物理化学家和他们的贡献1.3 学习方法物理化学的学习要求和难点学习物理化学的方法和技巧第二章:物质的量及其计量2.1 物质的量的概念物质的量的定义和单位物质的量的性质和特点2.2 摩尔的概念摩尔的定义和符号摩尔质量的概念和计算方法2.3 物质的量的计算物质的量的基本计算公式物质的量的有关计算示例第三章:热力学第一定律3.1 热力学基本概念系统的定义和分类状态参量的概念和意义3.2 内能的概念和计算内能的定义和性质理想气体的内能计算公式3.3 热量和功的传递热量和功的定义和区别热量和功的传递方式及其计算第四章:热力学第二定律4.1 熵的概念熵的定义和性质熵增加的意义和实例4.2 热力学第二定律的表述克劳修斯表述和开尔文-普朗克表述熵增原理的应用和意义4.3 熵变和自由能的计算熵变的定义和计算公式自由能的定义和计算公式第五章:化学平衡5.1 平衡态的概念平衡态的定义和平衡态的特征平衡态的判断方法5.2 平衡常数的概念和计算平衡常数的定义和表示方法平衡常数的计算方法和应用5.3 化学平衡的移动勒夏特列原理的定义和内容化学平衡移动的实例和解释第六章:动力学基础6.1 反应速率的概念反应速率的定义和表示方法反应速率的影响因素6.2 反应速率定律零级、一级、二级反应速率定律的表达式反应速率定律的实验测定和应用6.3 化学动力学的计算反应速率常数的概念和计算方法反应速率与反应机理的关系第七章:电化学7.1 电化学基本概念电化学的定义和基本原理电解质和电极的定义及分类7.2 原电池和电解池原电池的构成和工作原理电解池的构成和工作原理7.3 电化学系列的计算电化学系列的概念和应用电极电势的计算和测定方法第八章:光学原理8.1 光的传播和折射光的传播方式和速度折射定律的表述和应用8.2 光的干涉和衍射干涉现象的产生和条件衍射现象的产生和条件8.3 光谱学的基本概念光谱的定义和分类光谱分析的方法和应用第九章:现代物理化学方法9.1 核磁共振(NMR)NMR的原理和应用NMR谱的解析和意义9.2 质谱法(MS)质谱法的原理和应用质谱图的解析和意义9.3 X射线衍射法X射线衍射法的原理和应用X射线晶体学的概念和基本原理第十章:物理化学实验10.1 实验基本操作实验安全常识和实验操作规范实验数据的记录和处理方法10.2 经典实验分析滴定法、比重法、熔点法等实验方法实验结果的分析和讨论实验报告的结构和内容要求重点解析1. 物质的量的概念及其性质和特点,摩尔的概念及其定义和符号,物质的量的计算方法和示例。
物理化学电子教案

一、教案基本信息物理化学电子教案课时安排:每章约45分钟教学目标:1. 让学生理解物理化学的基本概念和原理;2. 培养学生运用物理化学知识解决实际问题的能力;3. 提高学生对电子教案的使用和掌握能力。
教学工具:电子教案、PPT、实验器材等。
二、第一章绪论教学内容:1. 物理化学的定义和发展历程;2. 物理化学的研究对象和内容;3. 物理化学的学习方法和注意事项。
教学步骤:1. 介绍物理化学的定义和发展历程,引导学生了解物理化学的重要性;2. 讲解物理化学的研究对象和内容,让学生明确学习的目标;教学评估:1. 课后布置相关作业,检查学生对绪论部分的理解程度;2. 在下一节课开始时,简要回顾上节课的内容,了解学生的掌握情况。
三、第二章物质的量与状态教学内容:1. 物质的量的概念和单位;2. 摩尔的概念和计算;3. 常见的状态及其转变。
教学步骤:1. 讲解物质的量的概念和单位,让学生掌握基本的计量单位;2. 介绍摩尔的概念和计算方法,注意与物质的量的区别;3. 讲解常见的状态(固态、液态、气态)及其转变,引导学生理解状态变化的本质。
教学评估:1. 课后布置有关物质的量、摩尔计算的练习题,巩固学生对知识点的掌握;2. 在课堂上,通过提问等方式检查学生对状态转变的理解。
四、第三章化学平衡教学内容:1. 化学平衡的概念和条件;2. 平衡常数的含义和计算;3. 影响化学平衡的因素。
教学步骤:1. 讲解化学平衡的概念和条件,让学生明白平衡状态的特点;2. 介绍平衡常数的含义和计算方法,注意与反应速率常数的区别;3. 分析影响化学平衡的因素,如浓度、温度、压强等,引导学生理解平衡移动的原理。
教学评估:1. 课后布置有关化学平衡计算的练习题,巩固学生对知识点的掌握;2. 在课堂上,通过提问等方式检查学生对平衡常数和平衡移动的理解。
五、第四章化学动力学教学内容:1. 化学动力学的定义和研究对象;2. 反应速率的概念和计算;3. 反应速率定律的含义和应用。
物理化学电子教案第三章物理化学电子教案——第二章

YANGTZE NORMAL UNIVERSITY
任意可逆循环分为小Carnot循环
物理化学电子教案第三章物理化学 电子教案——第二章
YANGTZE NORMAL UNIVERSITY
任意可逆循环分为小Carnot循环
Q2 Q1 0
T2
T1
Q4 Q3 0
T4
T3
任意可逆过程
物理化学电子教案第三章物理化学 电子教案——第二章
YANGTZE NORMAL UNIVERSITY
熵的定义
Clausius根据可逆过程的热温商值决定于始终态而
与可逆过程无关这一事实定义了“熵”(entropy)
这个函数,用符号“S”表示,单位J 为K:1
设始、终态A,B的熵分别为S A 和 S B ,则:
YANGTZE NORMAL UNIVERSITY
§3.2 热力学第二定律
Clausius 的说法: “不可能把热从低温物体传到高温物体,而不 引起其他变化”
Kelvin 的说法:
“不可能从单一热源取出热使之完全变为功, 而不发生其他的变化”
后来被Ostward表述为:“第二类永动机是不可 能造成的”。
电子教案——第二章
YANGTZE NORMAL UNIVERSITY
熵的特点
(1)熵是系统的状态函数,是容量性质。
(2)可以用Clausius不等式来判别过程的可逆性 (3)在绝热过程中,若过程是可逆的,则系统的 熵不变。若过程是不可逆的,则系统的熵增加。 绝热不可逆过程向熵增加的方向进行,当达到平 衡时,熵达到最大值。 (4)在任何一个隔离系统中,若进行了不可逆过
Carnot定理推论:
所有工作于同温热源与同温冷源之间的可逆热机, 其热机效率都相等,即与热机的工作物质无关。
