热工基础各章总结及试题
热工基础_习题_解答

生物系统传输过程习题解答工程热力学第一章 热力学第一定律P18 (P23)1-1 解:大气压力a b P p 41.1006583224.133755=⨯=容器中气体的压力barP p a 3065.235.23065141.10065816.11999078.1000241.1006583224.133********.91020==++=+⨯+⨯=1-2 解:大气压力a b P p 41.1006583224.133755=⨯=容器中气体的绝对压力a vb P p p p 97.2066444.7999341.1006583224.13360041.100658=-=⨯-=-= 真空表的读数g b v mmH p p p 615)600755(770=--=-= 1-3 解:大气压力OmmH O mmH P P mmH p a a g b 2235.1012880665.919.9932519.993253224.133745745=÷==⨯==烟气的真空度a vb a v P p p p Om m H P gl gz p 66.9854053.78419.993258080665.953.78453.78430sin 2.080665.9108.030sin 23=-=-==÷==︒⨯⨯⨯⨯=︒⋅=⋅=ρρ1-6 解:气体膨胀所做的功kJ J V V p dV p pdV W V V V V 1801018.0)2.08.0(103.0)(6612112121=⨯=-⨯⨯=-===⎰⎰1-9 解:由已知条件得:JR dRR dR R R pdV W dRR dR R dV R V RKR KD p m P D p K KD p KD p V V R R a 87.2267)0016.0002563.0(102355)2.0225.0(1023554109420109420410750433434107502)/(103754.0101503443225.02.0433225.02.032322333311112121=-⨯⨯=-⨯⨯=⨯=⨯=⨯⨯===⨯==⨯===⨯=⨯===∴=⎰⎰⎰ππππ1-11 解:1.室内向室外每小时传出的热量为)/(33.833)/(3600103)/(10366s kJ s kJ h kJ =⨯=⨯ 2.车间各工作机器产生的热量为)/(400400s kJ kW= 3.室内电灯所产生的热量为)/(5510050s kJ kW W==⨯ 4.为使车间的温度维持不变,须供给车间的热量+室内机器和电灯产生的热量=向室外传出的热量 即:)/(10542.133.428)/(33.42833.83354006h kJ kW s kJ Q Q ⨯≈===++1-12 解:已知汽化潜热h r ∆=,根据稳定流动能量方程式 t w h q +∆=而定压过程中0=t w )/(2250kg kJh q =∆=∴ 又根据热力学第一定律的解析式)/(47.207153.178225010)001.0763.1(1013252250)()(31212kg kJ v v p q u v v p u w u q =-=⨯-⨯-=--=∆∴-+∆=+∆=- 1-19 解:设水蒸气的质量流量为水蒸气∙m 。
热工基础1-3章部分习题答案及附加例题
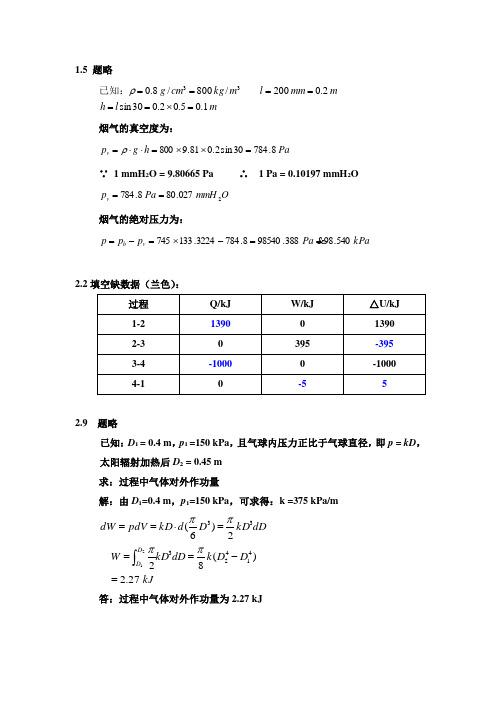
m l h mmm l m kg cm g 1.05.02.030sin 2.0200/800/8.033=⨯======ρ已知:烟气的真空度为:Pa h g p v 8.78430sin 2.081.9800=⨯⨯=⋅⋅=ρ∵ 1 mmH 2O = 9.80665 Pa ∴ 1 Pa = 0.10197 mmH 2OO mmH Pa p v 2027.808.784== 烟气的绝对压力为:kPa Pa p p p v b 540.98388.985408.7843224.133745==-⨯=-=2.2填空缺数据(兰色):2.9 题略已知:D 1 = 0.4 m ,p 1 =150 kPa ,且气球内压力正比于气球直径,即p = kD ,太阳辐射加热后D 2 = 0.45 m 求:过程中气体对外作功量解:由D 1=0.4 m ,p 1=150 kPa ,可求得:k =375 kPa/mkJD D k dD kD W dDkD D d kD pdV dW D D 27.2)(822)6(414233321=-===⋅==⎰ππππ答:过程中气体对外作功量为2.27 kJ解:由题意:△U = 0 → T 2 = T 1 = 600 K 由理想气体气体状态方程, 有:Pa p p T V p T V p T V p 512112222111100.2313⨯==== △U =△H = 03.7 题略解:(1)混合后的质量分数:ωCO 2 = 5.6 %, ωO 2 =16.32 %, ωH 2O =2 %, ωN 2 =76.08 % (2) 折合摩尔质量: M eq = 28.856 kg/kmol (3) 折合气体常数: R eq = 288.124 J/(kg ·K ) (4) 体积分数:φCO 2= 3.67 %, φO 2=14.72 %, φH 2O =3.21 %, φN 2=78.42 %(5)各组分气体分压力:p CO 2 = 0.01101 MPa , p O 2 =0.04416 MPa , p H 2O =0.00963 MPa , p N 2 =0.2353 MPa下面是附加的一些例题,供参考:一、试求在定压过程中加给理想气体的热量中有多少用来作功?有多少用来改变工质的热力学能(比热容取定值)? 解:∵ 定压过程总加热量为: q =c p △T其中用来改变热力学能的部分为:△u= c v △T 而 c p = c v +R gK J K kJ p p mR V V mR s m S g g /1426.1/101426.13ln 208.0005.0ln ln31212=⨯=⨯⨯=-==∆=∆-∴ 定压过程用来作功的部分为:w =R g △T二、2kg 某种理想气体按可逆多变过程膨胀到原有体积的3倍,稳定地从300℃降低到60℃,膨胀过程中作功418.68 kJ ,吸热83.736 kJ ,求:(1)过程的多变指数;(2)气体的c p 和c V 。
热工基础的期末总结

热工基础的期末总结一、热力学部分1. 热力学基础知识的学习热力学是研究热能与其他形式能量之间相互转化和传递的一门学科。
在学习过程中,我通过课堂的学习、书籍和网上资料的查阅,对热力学的基本概念、热力学系统和热力学性质等方面有了初步的了解。
2. 热力学基本定律热力学基本定律是热力学的核心内容,也是热工基础的重点。
本课程主要学习了热力学的三大基本定律:热力学第一定律、热力学第二定律和热力学第三定律。
通过对这些定律的学习和应用,我能够分析和计算热力学系统的能量转移和能量转化过程。
3. 热力学过程和热力学循环热力学过程是指系统在一定条件下发生的能量传递和物理性质发生变化的过程。
热力学循环是指系统在一定路径下变化,最终回到初始状态的过程。
通过学习这些内容,我能够对热力学过程和热力学循环进行分析和计算,从而了解能量转移和物理性质变化的规律。
4. 热力学性质的计算热力学性质是指描述系统热力学状态和性质的量,如温度、压力、体积等。
在学习过程中,我学习了热力学性质的计算方法,如状态方程、热容、焓、熵等。
通过对热力学性质的计算,我能够确定系统的热力学状态和性质。
二、传热学部分1. 传热学的基本概念和模型传热学是研究热量如何从高温区向低温区传递的学科。
在学习过程中,我学习了传热学的基本概念和模型,如传热方式、传热模型和传热原理等。
2. 传热方式和传热模型传热方式是指热量传递的途径,主要包括传导、对流和辐射。
传热模型是指用来描述传热过程的数学模型,如传热定律和传热方程等。
在学习过程中,我对这些内容进行了深入的学习和了解。
3. 传热计算方法在传热学中,计算方法是非常重要的,主要包括传热计算和传热换热器的计算。
传热计算是指通过传热方程和传热模型对传热过程进行计算和分析。
传热换热器的计算是指对传热器的传热性能和换热器的几何参数进行计算和设计。
通过学习和掌握这些计算方法,我能够对传热系统进行分析和设计。
三、实践操作在本学期的热工基础课程中,我还进行了一些实践操作和实验课程。
热工基础各章总结及试题

第一章小结1、平衡状态关于平衡状态的定义、实现条件、以及平衡与均匀、平衡与稳定的概念区别已在相应章节中进行了详细叙述。
平衡状态具有确定的状态参数,这是平衡状态的特点。
平衡状态概念的提出,使整个系统可用一组统一的、并具有确定数值的状态参数来描述其状态,使热力分析大为简化,这也是工程热力学只研究系统平衡状态的原因所在。
2、状态参数及其性质状态参数是定量描述工质状态的状态量。
其性质是状态参数的变化量只取决于给定的初、终状态,与变化过程的路径无关。
如果系统经历一系列状态变化又返回初态,其所有状态参数的变化量为零。
在学过第二章之后,可与过程量—功量和热量进行对比,进一步加深对状态量的理解。
3、准平衡过程准平衡过程将“平衡”与“过程”这一对矛盾统一了起来。
定义:由一系列连续的准平衡态组成的过程称为准平衡过程,又称准静态过程。
实现条件:(1)推动过程进行的势差(压差、温差)无限小;(2)驰豫时间短,即系统从不平衡到平衡的驰豫时间远小于过程进行所用的时间。
这样系统在任意时刻都无限接近于平衡态。
特点:系统内外势差足够小,过程进行得足够慢,而热力系恢复平衡的速度很快,所以工程上的大多数过程都可以作为准平衡过程进行分析。
建立准平衡过程概念的好处:(1) 可以用确定的状态参数描述过程;(2)可以在参数坐标图上用一条连续曲线表示过程。
4、可逆过程准平衡过程概念的提出只是为了描述系统的热力过程,但为了计算系统与外界交换的功量和热量,就必须引出可逆过程的概念。
定义:过程能沿原路径逆向进行,并且系统与外界同时返回原态而不留下任何变化。
实现条件:在满足准平衡过程条件下,还要求过程中无任何耗散效应(通过摩擦、电阻、磁阻等使功变为热的效应)建立可逆过程概念的好处:(1) 由于可逆过程系统内外的势差无限小,可以认为系统内部的压力、温度与外界近似相等,因此可以用系统内的参数代替复杂、未知的外界参数,从而简化问题,使实际过程的计算成为可能,即先把实际过程当作可逆过程进行分析计算,然后再用由实验得出的经验系数加以修正;(2)由于可逆过程是没有任何能量损失的理想过程,因此,它给出了热力设备和装置能量转换的理想极限,为实际过程的改善指明了方向。
热工基础11-12章部分参考答案及例题

第十一章 辐射换热补充例题: 一电炉的电功率为1kW ,炉丝温度847℃,直径为1mm ,电炉的效率(辐射功率与电功率之比)为0.96。
试确定所需炉丝的最短长度。
若炉丝的发射率为0.95,则炉丝的长度又是多少?解:∵ 96.0=W AE b ∴ W T C l r o 96.010024=⎪⎭⎫ ⎝⎛⋅⋅πm T C d W l 425.32.1167.5001.0100096.010096.04401=⨯⨯⨯⨯=⎪⎭⎫ ⎝⎛⋅=ππm 425.3=若 95.0=ε,96.0=W E A b ε;m l l 601.395.0425.395.012===11.7 用热电偶温度计测得炉膛内烟气的温度为800℃,炉墙温度为600℃。
若热电偶表面与烟气的对流换热系数h =50W/(m 2·℃),热电偶表面的发射率为0.8,试求烟气的真实温度。
已知:t 1 = 800℃,t w = 600℃, h =50 W/(m 2.℃),ε1= 0.8 求:t f =?解:本题可由热平衡法求解。
热辐射: ∵ A 1<<A 2 ∴ )(441111wb T T A -=σεφ 对流换热: )(112T T hA f -=φ 在稳态下: 21φφ=∴ 6.14756.1748)(44111==-+=K T T hT T w b f σε℃为减少测量误差,可利用以下措施:① 减少ε1(采用磨光热电偶表面的方法,但往往由于生锈和污染而降低效果);② 提高接点处的h 值(可采用抽气装置来加大流速); ③ 管外敷以绝热层,使T w ↑; ④ 加设遮热罩(遮热罩两端是空的,使废气能与接点接触)。
接点与壁面之间有辐射换热,其辐射换热量即为接点的热损失,这一损失,应通过废气对接点的对流换热进行补偿。
第十二章 传热过程和换热器热计算基础12.1 冬季室内空气温度t f 1=20℃,室外大气温度t f 2=―10℃,室内空气与壁面的对流换热系数h 1=8W/(m 2·℃),室外壁面与大气的对流换热系数h 2=20W/(m 2·℃),已知室内空气的结露温度t d =14℃,若墙壁由λ=0.6W/(m ·℃) 的红砖砌成,为了防止墙壁内表面结露,该墙的厚度至少应为多少?解:传热问题热阻网络:热流密度 2121212111h h t t R R R t t q f f C C f f ++-=++-=λδλ (1)若墙壁内壁面温度t =t d =14℃时会结露,由于串联热路中q 处处相等,所以 2212211h t t R R t t q f w C f w +-=+-=λδλ (2)(1)、(2)联立求解,可求得q 和墙的厚度δ。
热工基础试题及答案

热工基础试题及答案一、选择题1. 热力学第一定律的数学表达式是:A. ΔU = Q + WB. ΔH = Q - WC. ΔG = Q - TΔSD. ΔS = Q/T答案:A2. 在理想气体的等压过程中,气体的内能变化为:A. 零B. 正C. 负D. 不确定答案:A3. 以下哪个不是热力学基本定律?A. 第零定律B. 第一定律C. 第二定律D. 第三定律答案:A二、填空题1. 热力学系统与外界没有能量交换时,系统处于______状态。
答案:平衡2. 理想气体的内能只与______有关。
答案:温度3. 根据热力学第二定律,不可能从单一热源吸热使之完全转化为功而不引起其他变化。
答案:不可能三、简答题1. 简述热力学第二定律的开尔文表述。
答案:热力学第二定律的开尔文表述指出,不可能通过循环过程,将热量完全转化为功而不产生其他影响。
2. 解释什么是熵,并简述熵增加原理。
答案:熵是热力学系统无序度的量度,通常用来描述系统的热力学状态。
熵增加原理表明,在自发过程中,孤立系统的熵总是增加的。
四、计算题1. 假设有1 kg的理想气体,其初始温度为 300 K,压力为 1 atm。
如果气体在等压过程中加热到 600 K,求气体的最终体积。
答案:首先,使用理想气体状态方程 PV = nRT,其中 n 是摩尔数,R 是理想气体常数。
由于过程是等压的,我们可以简化为 V1/T1 =V2/T2。
代入给定的数据,我们得到 V2 = (T2/T1) * V1。
假设初始体积 V1 可以通过 P1 * V1 = n * R * T1 计算得出。
由于 n 和 R 是常数,我们可以忽略它们,简化为 V1 = P1 * V1 / (R * T1)。
最终体积 V2 可以通过 V2 = (T2/T1) * V1 计算得出。
2. 一个绝热容器中装有 2 kg 的水,初始温度为20°C。
如果向水中加入 100 kJ 的热量,求水的最终温度。
热工基础试题与参考答案

热工基础试题与参考答案一、单选题(共55题,每题1分,共55分)1.蒸汽的熵越高,则焓就()A、越高B、越低C、不变D、以上都不对正确答案:D2.热力系与外界交换的能量除了热之外,还有()A、热B、热和功C、热能D、功正确答案:D3.汽轮机对外提供的功全部来自于蒸汽的(____)。
A、焓升B、热能C、动能D、焓降正确答案:D4.朗肯循环没有汽化过程时,锅炉的工作压力一定()A、是临界压力B、高于临界压力C、低于临界压力D、以上都不对正确答案:D5.下列_组参数都不是状态参数。
()A、内能、焓、熵B、压力、温度、比容.C、质量、流量、热量D、膨胀功、技术功、推动功正确答案:D6.回热循环比朗肯循环增多的设备是(____)。
A、回热加热器B、汽轮机C、锅炉D、再热器正确答案:A7.在朗肯循环中,绝热膨胀过程的下一过程是在(____)中完成的。
A、锅炉B、给水泵C、汽轮机D、凝汽器正确答案:D8.朗肯循环中具有绝热升压作用的是(____)。
A、给水泵B、汽轮机C、锅炉D、凝汽器正确答案:A9.如果热机从热源吸收100KJ,对外做功100KJ,则()A、违反热力学第一定律B、违反热力学第二定律C、不违反第一、第二定律D、违反第一、第二定律正确答案:B10.由未饱和水加热成饱和水的过程,称为(____)阶段。
A、预热段B、汽化段C、加热段D、过热段正确答案:A11.定压过程中,工质吸收的热量全部用于增加()A、工质的内能B、工质的机械能C、工质的熵D、工质的焓正确答案:D12.热量的符号是()A、QB、qC、JD、α正确答案:A13.水蒸气的预热阶段发生在()A、空气预热器B、水冷壁C、过热器D、省煤器正确答案:D14.10Kg蒸汽的焓是10KJ,则其比焓是(____)KJ/kg。
A、1B、0C、0.5D、2正确答案:A15.对朗肯循环描述错误的是(____)。
A、将功变机械能B、将热能变成动能C、将热变功D、是一种动力循环正确答案:A16.K是(____)的单位。
(完整版)热工基础课后题答案

二零一七年,秋第一章 热力学第一定律1—1用水银压力计测量容器中的压力,在水银柱上加一段水,若水柱高1020mm ,水银柱高900mm ,当时大气压力计上的度数为b 755mmHg p =。
求容器中气体的压力. 解:查表可知:21mmH O=9.80665Pa 1mmHg=133.3224Pa 由题中条件可知2H O Hg b1020 mm 9.80665 Pa 900mm 133.3224Pa 755mm 133.3224Pa 230.651 KPa 0.231MPap p p p =++=⨯+⨯+⨯=≈容器 即容器中气体的压力为0。
231MPa 。
1-2容器中的真空度为600mmHg v p =,气压计上的高度是b 755mmHg p =,求容器中气体的绝对压力(用Pa 表示)。
如果容器中的绝对压力不变,而气压计上高度为b 770mmHg p =,求此时真空表的度数(以mmHg 表示)。
解:因为600mmHg=600mm 133.3224Pa=79993.4Pa v p =⨯ b 755mmHg=755mm 133.3224Pa=100658.4Pa p =⨯ 容器中气体的绝对压力为b v 100658.479993.420665Pa p p p =-=-= 若以mmHg 表示真空度,则2066520665Pa=mmHg 155mmHg 133.3224p ==则当气压计高度为b 770mmHg p =时,真空表的读数为770mmHg 155mmHg 615mmHg vb p p p '=-=-=1-3用斜管压力计测量锅炉烟道气的真空度,管子倾斜角30α=︒,压力计使用密度30.8g/cm ρ=的煤油,斜管中液柱长200mm l =,当地大气压力b 745mmHg p =。
求烟气的真空度(mmHg )及绝对压力。
解:压力计斜管中煤油产生的压力为33sin 0.810kg /m 9.80.2m sin30=784Pa j p gl ρα==⨯⨯⨯⨯︒当地大气压为b 745mmHg=745mm 133.3224Pa/mm=99325.2Pa p =⨯ 则烟气的绝对压力为b j 99325.2Pa 784Pa 98541.2Pa p p p =-=-=若压力计斜管中煤油产生的压力用mmH 2O 表示,则烟气的真空度为22784=784Pa=mmH O=79.95mmH O 9.80665j p1—6气体初态为3110.3MPa, 0.2m p V ==,若在等压条件下缓慢可逆地膨胀到320.8m V =,求气体膨胀所做的功。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第一章小结 1、平衡状态 关于平衡状态的定义、实现条件、以及平衡与均匀、平衡与稳定的概念区别已在相应章节中进行了详 细叙述。
平衡状态具有确定的状态参数,这是平衡状态的特点。
平衡状态概念的提出,使整个系统可用一组统一的、并具有确定数值的状态参数来描述其状态,使热力分析大为简化,这也是工程热力学只研究系 统平衡状态的原因所在。
2、状态参数及其性质 状态参数是定量描述工质状态的状态量。
其性质是状态参数的变化量只取决于给定的初、终状态,与 变化过程的路径无关。
如果系统经历一系列状态变化又返回初态,其所有状态参数的变化量为零。
在学过第二章之后,可与过程量—功量和热量进行对比,进一步加深对状态量的理解。
3、准平衡过程 准平衡过程将“平衡”与“过程”这一对矛盾统一了起来。
定义:由一系列连续的准平衡态组成的过程称为准平衡过程,又称准静态过程。
实现条件:(1)推动过程进行的势差(压差、温差)无限小;(2)驰豫时间短,即系统从不平衡到平 衡的驰豫时间远小于过程进行所用的时间。
这样系统在任意时刻都无限接近于平衡态。
特点:系统内外势差足够小,过程进行得足够慢,而热力系恢复平衡的速度很快,所以工程上的大多 数过程都可以作为准平衡过程进行分析。
建立准平衡过程概念的好处:(1) 可以用确定的状态参数描述过程;(2)可以在参数坐标图上用一条连续曲线表示过程。
4、可逆过程 准平衡过程概念的提出只是为了描述系统的热力过程,但为了计算系统与外界交换的功量和热量,就 必须引出可逆过程的概念。
定义:过程能沿原路径逆向进行,并且系统与外界同时返回原态而不留下任何变化。
实现条件:在满足准平衡过程条件下,还要求过程中无任何耗散效应(通过摩擦、电阻、磁阻等使功 变为热的效应) 建立可逆过程概念的好处:(1) 由于可逆过程系统内外的势差无限小,可以认为系统内部的压力、温 度与外界近似相等,因此可以用系统内的参数代替复杂、未知的外界参数,从而简化问题,使实际过程的 计算成为可能,即先把实际过程当作可逆过程进行分析计算,然后再用由实验得出的经验系数加以修正; (2)由于可逆过程是没有任何能量损失的理想过程,因此,它给出了热力设备和装置能量转换的理想极限, 为实际过程的改善指明了方向。
上述概念的引出体现了热力学研究问题和处理问题的方法,是热力学中重要的概念,希望深刻理解这些概 念,为后面章节的学习打好基础,同时从中学习对实际问题进行分析简化的方法。
第二章小结 1、热力学第一定律的实质 热力学第一定律的实质就是能量守恒。
表明当热能与其他形式的能量相互转换时,能的总量保持不变。
2、储存能 系统储存的能量称为储存能,包括内部储存能和外部储存能。
(1)内部储存能——热力学能 它与系统内工质粒子的微观运动和粒子的空间结构有关。
应牢牢记住热力学能是状态参数。
在简单可压缩系中,不涉及化学反应、核反应和电磁场作用,可认为工质的热力学能仅包括分子的内 动能和内位能。
分子的内动能与工质的温度有关,温度越高,分子的内动能越大;分子的内位能与工质的 比容有关,比容越大,分子的内位能越小。
理想气体远离液态点,分子间距(比容)较大,分子的内位能忽略不计,其热力学能仅包括分子的内 动能,因此,理想气体的热力学能是温度的单值函数。
(2)外部储存能 外部储存能是系统整体相对于外界参考坐标系的宏观能量,包括系统整体作宏观运动时的宏观动能和 1 相对于外界参考基准点的重力位能。
(3)系统的总储存能(简称总能) 系统的总储存能为热力学能、宏观动能和重力位能的总和。
3、转移能——功量和热量 功量和热量是系统与外界交换的能量,其大小与系统的状态无关,而是与传递能量时所经历的具体过 程有关。
所以功量和热量不是状态参数,而是与过程特征有关的过程量,称为转移能或迁移能。
4、闭口系能量方程 热力学第一定律应用于(静止的)闭口系时的能量关系式即为闭口系能量方程。
其表达式有以下几种 形式,它们的使用条件不同: (1) q = ?u + w (2) q = ?u + (3) q = c ?T + 或 Q = ?U +W (适用条件:任意工质、任意过程) (适用条件:任意工质、可逆过程) (适用条件:理想气体、可逆过程) pdV ∫pdv 或 Q = ?U +∫ pdV ∫pdv 或Q = mc ?T + ∫5、稳流系能量方程 热力学第一定律应用于稳流系时的能量关系式即为稳流系能量方程。
其表达式也有以下几种形式,它 们的使用条件也不同: (1) q = ?h + w (2) q = ?h ? vdp (3) q = c ?T ? vdp 或 Q = ?H +W (适用条件:任意工质、任意过程) (适用条件:任意工质、可逆过程) (适用条件:理想气体、可逆过程) Vdp ∫ 或 Q = ?H ?∫Vdp ∫或 Q = mc ?T ? ∫6、稳定流动过程中几种功量的关系 在稳流系中,隐含的膨胀功等于流动功和技术功之和,即 w = ?(pv) + ?? 1 ?c ? 2 + g?z + w= w + w ? ? ? 其中,技术功为出口与进口处的动能差、位能差和轴功之和,即 w = 1 ?c + g?z + w 27、焓的定义及其物理意义 焓是在研究流动能量方程时,为工程应用方便而引出的一个状态参数。
由于在流动过程中,工质必定 携带的能量除热力学能 U 外,还有推动功(推进功)pV ,所以为工程应用方便起见,把二者组合为焓 H ,所以说焓是流动工质携带的基本能量,或者说是流动工质所携带的总能量中与热力状态有关的那部分能量。
焓的定义式为 H =U + pV 或 h = u + pv 焓作为一个宏观存在的状态参数,在开口系和闭口系中都存在,但在分析开口系时的作用更大。
在分 析闭口系统时,通常使用热力学能参数,只是在分析闭口系的定压过程时,焓可以表示闭口系在定压过程 中与外界交换的热量,此时焓具有特殊作用。
不必太深究焓的物理意义,只要能熟练掌握焓的计算即可。
关于焓的计算将在第三章学习。
焓的物理意义可简单总结如下: (1)对非流动工质,焓仅是状态参数。
(2)对流动工质,焓既是状态参数,也是工质流动时携带的取决于热力状态的那部分能量(或基本能 量)。
理想气体的焓和热力学能一样,也仅是温度的单值函数。
第三章小结 2 1、理想气体的热力性质 (1)理想气体的状态方程 状态方程不是难点,但却是本章的重点。
应用理想气体状态方程时,应注意以下几点: ? 状态方程(3.1)反映的是同一平衡状态下基本状态参数之间的关系,只能用于同一平衡状态,不能用于过程计算。
注意不要把状态方程和过程方程混淆。
? ? 公式中的压力为绝对压力,温度为绝对温度 状态方程(3.1a )——(3.1d )是针对不同物量单位的表达形式,使用时注意各物理量的单位与 气体常数 R 或通用气体常数 R 协调一致。
(2)比热容 学习比热容时应注意以下几点: ? 容积比热容 c ′的单位为:J/(Nm ·K),其物量单位必须是标准立方米(Nm ),即气体在标准状 态时的体(容)积,这是因为气体在不同状态时的体积不同, 1kmol 理想气体也只是在标准状态时才具有 22.4 m 的容积。
计算时必须注意非标准状态时的容积与标准状态下容积的换算,如例 3.1。
? 在查取平均比热容表时,首先应注意是哪种比热容,如教材附表 2是平均定压质量比热容,其 他比热容可利用它们之间的换算公式计算,如例 3.2。
? 平均比热容表的自变量是摄氏温标,千万不要将 t 化为 T 。
如果所查取的温度值没有列出,如要 查 150 °C 时的平均定压质量比热容,可在附表 2中利用 100 °C 和 200 °C 的比热容用线性内插法求得。
(3)理想气体热力学能、焓和熵的计算 首先要牢记理想气体的热力学能和焓仅是温度的函数,而熵则与 2个独立的基本状态参数有关。
利用 定值比热容计算理想气体的热力学能、焓和熵是本章的重点之一,需熟练掌握。
应当注意:尽管计算公式 是利用可逆过程的公式推导得到,但由于热力学能、焓和熵都是状态参数,其计算公式适用于理想气体的 任意过程。
2、理想气体的热力过程 在本章的学习中,同学们很容易产生公式太多,难以记忆的感觉,为了便于公式的查取,各种过程的 计算公式已列于表 3.2。
但是,如何记忆和运用这些公式仍是一个难点,为此进行以下分析,以帮助大家理 解性地记忆和灵活运用这些公式。
(1)4种基本热力过程及多变过程的特点和过程方程 首先要理解过程方程描述的是过程的特点,即整个过程遵循相应的过程方程的规律变化。
4种基本热 力过程的特点是定容、定压、定温和定熵,也就是说这 4种过程中总有一个状态参数保持不变;对于多变过程,则过程中所有的状态参数都在变。
关于过程方程,应记住基本方程 pv = const ,可认为理想气体 在可逆过程中都遵循该关系式。
多变指数 n 的取值范围为从 ? ∞ → 0 → +∞之间的任一实数,所以该过 程方程适用于所有的可逆过程。
而 4种基本热力过程则是所有可逆多变过程中的几个特例,根据过程特点 分别为定容过程:n =±∞,定压过程:n=0,定温过程:n=1,定熵过程:n=κ,所以 4种基本热力过程的过 程方程不需要死记硬背就可以推出。
(2)过程中任意两状态间 p 、v 、T 参数之间的关系 由克拉贝龙方程 p v= pv pv = L = R T = T T 可以很容易地推得定容、定压和定温过程中任意两状态间 p 、v 、T 参数之间的关系式。
而对于多变过 程和定熵过程,可以利用其状态方程和过程方程联立求出,也无需死记硬背。
而且多变过程与定熵过程状 态参数之间的关系式结构相同,只是多变指数不同,所以推出一个就可得出另一个。
(3)过程中系统与外界交换的功量和热量 ○ 1 功量 ? 对于定容和定压过程,选用以下可逆过程的基本积分式计算功量很方便,即 3 2 ∫pdv 容积功: w = 1 2 技术功: w = ? t ∫vdp 1 显然,定容过程: w = 0, w = v(p ? p ) = ?v?p t 1 2 定压过程:w = p(v ? v ) = p?v , w = 0 2 1 定容过程容积功为零,定压过程技术功为零,可作为一种概念牢记,根本不必计算。
? 对于定温过程,仍可以用可逆过程的基本积分式计算功量,只需利用理想气体状态方程将 p 化为 v 的函数形式计算 w ,或将 v 化为 p 的函数形式计算 w 。
如下所示: R T dv = R T ln = R T ln p v ∫ ∫pdv = ∫ w = v v dp = R T ln p= R T ln v v p R T w = ? vdp = ?∫ p p 比较以上两式,有 w =w ,即定温过程的容积功等于技术功。
