第三节 气体等容变化 查理定律
气体三大定律及状态方程

由玻意耳定律 p1V1=p2V2,得
0 +ℎ
解得 h=2 m。
答案:2 m
=
0.1m·
。
0.12m·
例2 一定质量的气体,在体积不变时,将温度由50
℃ 加热到100 ℃,气体的压强变化情况是( D )
A.气体压强是原来的2倍
50
B.气体压强比原来增加了273
C.气体压强是原来的3倍
50
C
p
查理定律:
C
T
V
盖-吕萨克定律:
C
T
p1V1 p2V2
pV
C 或
T1
T2
T
1.(多选)对于一定质量的理想气体,可能发生的过
程是( AC )
A.气体的压强增大、温度升高,体积增大
B.气体的压强增大、温度不变,体积增大
C.气体的压强减小、温度降低,体积不变
D.气体的压强减小、温度升高,体积减小
D.气体压强比原来增加了323
例3 (多选)一定质量的某种气体自状态A经状态C
变化到状态B,这一过程在V-T图上表示如图所示,
图象的应用
是( AD )
【例 3】
A.在过程AC中,气体压强不断变大
B.在过程CB中,气体压强不断变小
C.在状态A时,气体压强最大
D.在状态B时,气体压强最大
一定质量的某种气体自状态 A 经状态 C 变
5Pa,g取10m/s2)
为p
=1.0×10
0
以根据玻意耳定律问题即可解决。
解析:确定研究对象为被封闭的那部分气体,玻璃管下潜的过程
中气体的状态变化为等温过程。
设潜入水下的深度为 h,玻璃管的横截面积为 S。气体的初末状
气体的等温、等容变化,理想气体状态方程

PV =C T
1、一定质量的理想气体,由初装态(p1,V1, T1)变化到末状态(p2,V2,T2)时,两个状 态的状态参量之间的关系为:
P1V1 P2 V2 PV = 或 =C T1 T2 T
2、任意质量的理想气体状态方程: PV=nRT (1)n为气体的摩尔数,R=8.31J/mol.k (2)该式是任意质量的理想气体装态方 程,又叫克拉帕龙方程
一、气体的等容和等压变化
1、一定质量的理想气体在体积不变时压 强随温度的变化叫等容变化
2、一定质量的理想气体在压强不变时体 积随温度的变化叫等压变化
气体的等容变化(查理定律)
1、一定质量的气体,在体积保持不变 的情况下,温度每升高(或降低)10C, 升高(或降低)的气体的压强为标准大 气压强的1/273 P=P0(1+1/273)
B.它从15℃升高到20℃,压强增量为2.0×103Pa
C.它在0℃时,压强约为1.4×105Pa 答案:C
气体的等压变化(盖-吕萨克定律)
一定质量的某种气体,在压强不变的情况 下,其体积V与热力学温度T成正比
V=CT V1 V2 或表示成 T1 T2
V
V1 T1 V2 T2
T
理想气体状态方程
小Leabharlann 结玻意耳定律:PV=C P 查理定律: =C T V 盖吕萨克定律: =C T
PV =C T
大前提:理想气体、质量一定
克拉帕龙方程: PV=nRT
P
t
气体的等容变化(查理定律)
2、查理定律:一定质量的气体,在体 积保持不变的情况下,压强P与热力学 温度成正比
问题1三大气体实验定律内容是什么

理想气体的状态方程
例题2: 一水银气压计中混进了空气,因而在27℃,外
界大气压为758mmHg时,这个水银气压计的读数为 738mmHg,此时管中水银面距管顶80mm,当温度降 至-3℃时,这个气压计的读数为743mmHg,求此时的 实际大气压值为多少毫米汞柱? (1)该题研究对象是什么? (2)画出该题两个状态的示意图:
末态:p′A=?,V′A=2V/3 根据玻意耳定律:pAVA=p′AV′A得 p′A=1.5×105 Pa.
(2)对B部分气体,其p、V、T均发生变化: 初态:pB=2.0×105 Pa,VB=V,TB=300 K 末态:p′B=2.5×105 Pa V′B=4V/3 ,T′B=? 由理想气体状态方程: pAVA / TA=p′AV′A/T′B 解得T′B=500 K.
主页
理想气体的状态方程
我的收获 1、什么是理想气体?
2、理想气体的状态方程 3、应用理想气体状态方程解题的一 般步骤
主页
山东省临沂第一中学
学以致用
(3)分别写出两个状态的状态 参量:
主页
理想气体的状态方程
解:以混进水银气压计的空气为研究对象 初状态: T1=273+27=300 K P 1 P 0 gh 1 20mmHg ,V 1 l1S 80S 末状态: P 2 P gh2 (h2 743mmHg ),V2 l2 S 75S T2=270K p1V1 p2V2 由理想气体状态方程得:
主页
理想气体的状态方程
学 以 致 用
一圆柱形汽缸直立在地面上,内有一个具有质 量、无摩擦的绝热活塞,把汽缸分成容积相同的 A、B 两部分,如图所示.两部分气体的温度相同,均为 T0 =27 ℃,A 部分气体的压强 pA=1.0×105 Pa,B 部分气 体的压强 pB=2.0×105 Pa,现对 B 部分气体加热,使活 塞上升,保持 A 部分气体的温度不变,体积减小为原来 2 的 .求此时: 3 (1)A 部分气体的压强. (2)B 部分气体的温度
高中物理:气体的等容变化和等压变化详解
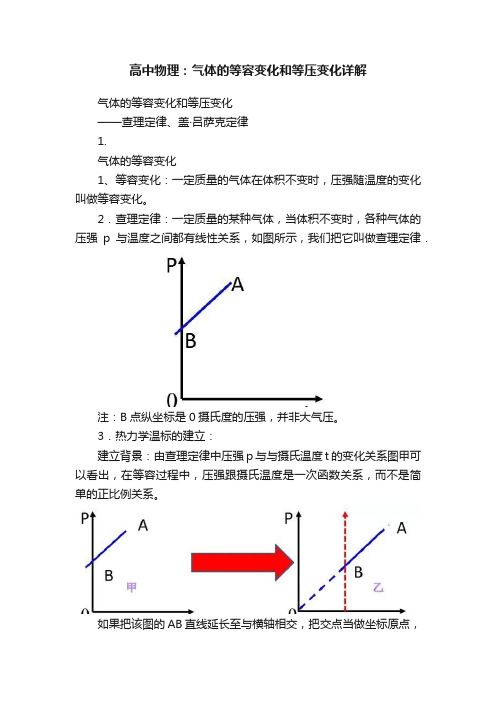
高中物理:气体的等容变化和等压变化详解气体的等容变化和等压变化——查理定律、盖·吕萨克定律1.气体的等容变化1、等容变化:一定质量的气体在体积不变时,压强随温度的变化叫做等容变化。
2.查理定律:一定质量的某种气体,当体积不变时,各种气体的压强p与温度之间都有线性关系,如图所示,我们把它叫做查理定律.注:B点纵坐标是0摄氏度的压强,并非大气压。
3.热力学温标的建立:建立背景:由查理定律中压强p与与摄氏温度t的变化关系图甲可以看出,在等容过程中,压强跟摄氏温度是一次函数关系,而不是简单的正比例关系。
如果把该图的AB直线延长至与横轴相交,把交点当做坐标原点,建立新的坐标系(图乙)此时压强与温度的关系就是正比例关系了。
图乙坐标原点的意义“气体压强为零时其温度为零”,由此可见,为了使一定质量的气体在体积不变的情况下,压强与体积成正比,只需要建立一种新的温标就可以了。
在现实中通过对大量的“压强不太大(相对标准大气压),温度不太低(相对于室温)”的各种不同气体做等容变化的实验数据可以证明“一定质量的气体压在强不太大,温度不太低时,坐标原点代表的温度就是热力学温度的零度,这就是热力学温度零点的物理意义。
由此可见:热力学的零点就规定为气体压强为零的温度。
在建立热力学温标之前,人们已经建立了华氏、摄氏温标,但这些温标都是与测温物质的热学性质有关,当采用不同的测温物质去测量同一温度时会产生一定差异,这种差异是不能克服的。
而由热力学温标的建立可知:热力学温度是在摄氏温度的基础上建立起来的,零点的确定与测温物质无关,因此热力学温标是一种更为简便科学的理论的温标,它的零度不可能达到。
又叫绝对零度。
4、查理定律的热力学温标描述:——查理定律:(1).查理定律:一定质量的某种气体,在体积不变的情况下,压强p与热力学温度T成正比。
(2).表达式:注:这里的C和玻意耳定律表达式中的C都泛指比例常数,它们并不相等。
这里的C与气体的种类、质量和压强有关。
《气体的等容变化和等压变化》 讲义

《气体的等容变化和等压变化》讲义一、引入在我们的日常生活和许多科学研究及工程应用中,气体的状态变化是一个非常重要的现象。
而气体的等容变化和等压变化,是研究气体性质时经常会遇到的两种典型情况。
二、气体的等容变化当一定质量的气体体积保持不变时,所发生的状态变化称为等容变化。
1、查理定律查理定律指出:一定质量的某种气体,在体积不变的情况下,压强p 与热力学温度 T 成正比。
数学表达式为:p/T = C(C 为常数)为了更好地理解查理定律,我们来举个例子。
假设一个密封的刚性容器中装有一定量的气体,容器的体积是固定的。
当我们给这个容器加热时,气体的温度升高,分子的热运动加剧,碰撞容器壁的频率和力度都会增加,从而导致气体的压强增大。
2、等容变化的图像图像是一条过原点的直线。
这条直线的斜率与气体的种类有关,不同的气体具有不同的斜率。
3、应用等容变化在实际中有很多应用。
比如,在汽车发动机的工作过程中,气缸内气体的燃烧会导致温度急剧升高,由于气缸的体积基本不变,所以气体压强会迅速增大,从而推动活塞做功。
三、气体的等压变化当一定质量的气体压强保持不变时,所发生的状态变化称为等压变化。
1、盖吕萨克定律盖吕萨克定律表明:一定质量的某种气体,在压强不变的情况下,体积 V 与热力学温度 T 成正比。
数学表达式为:V/T = C'(C'为常数)同样通过一个例子来理解。
想象有一个带有可移动活塞的气缸,里面充满了一定质量的气体,并且气缸与外界大气相通,保持压强不变。
当给气缸加热时,气体温度升高,分子热运动加剧,为了保持压强不变,活塞会向外移动,从而使气体的体积增大。
2、等压变化的图像出的图像也是一条过原点的直线。
这条直线的斜率同样与气体的种类有关。
3、应用等压变化在生活和工业中也十分常见。
例如,热气球的工作原理就利用了等压变化。
当对热气球内的气体加热时,气体体积膨胀,但由于外界大气压基本不变,热空气的密度变小,从而产生浮力使热气球上升。
高中物理选修3-3-气体的等容变化和等压变化

气体的等容变化和等压变化知识元气体的等容变化和等压变化知识讲解1.查理定律(等容变化):①内容:一定质量的气体,在体积不变的情况下,它的压强跟热力学温度成正比,这个规律叫做查理定律。
②数学表达式:③成立条件:a.气体的质量、体积保持不变;b.气体压强不太大,温度不太低。
④p-T图象--等容线:一定质量的某种气体在p-T图上的等容线是一条延长线过原点的倾斜直线;p-t图中的等容线在t轴的截距是-273.15℃,在下图中V1<V2。
2.盖•吕萨克定律(等压变化):①内容:一定质量的气体在压强不变的情况下,它的体积跟热力学温度成正比。
②数学表达式:③适用条件:a.气体质量不变、压强不变;b.气体温度不太低、压强不太大。
④V-T图象--等压线:一定质量的某种气体在V-T图上的等压线是一条延长线过原点的倾斜直线;V-t图中的等压线在t轴的截距是-273.15℃,在下图中p1<p2。
例题精讲气体的等容变化和等压变化例1.如图所示,气缸内装有一定质量的气体,气缸的截面积为S,其活塞为梯形,它的一个面与气缸成θ角,活塞与器壁间的摩擦忽略不计,现用一水平力F缓慢推活塞,汽缸不动,此时大气压强为P0,则气缸内气体的压强P为()A.P=P0B.P=P0C.P=P0D.P=P0例2.如图所示,活塞的质量为m,缸套的质量为M,通过弹簧吊在天花板上,汽缸内封住一定质量的气体,缸套和活塞间无摩擦,活塞面积为S,大气压强为p0,则封闭气体的压强为()A.p=p0B.p=p0C.p=p0D.p例3.如图所示,竖直放置的U形管,左端开口右端封闭,管内有a、b两段水银柱,将A、B两段空气柱封闭在管内。
已知水银柱a长h1为10cm,水银柱b两个液面间的高度差h2为5cm,大气压强为75cmHg,空气柱B的压强是____cmHg例4.把75厘米长的两端开口的细玻璃管全部插入没在水银中,封闭上端,将玻璃管缓慢地提出水管,管中留有水银柱高度是____厘米。
气体三大定律以及状态方程

A.一定不变 B.一定减小 C.一定增加 D.不能判定怎样变化
4.一定质量的气体,经历一膨胀过程,这一过程可以
用图所示 的直线ABC来表示,在A、B、C三个状态 上
,气体的温度TA、TB、TC相比较,大小关系为( C )
A.TB=TA=TC B.TA>TB>TC C.TB>TA=TC D.TB<TA=TC
=
0.1m·������ 0.12m·������
。
解得 h=2 m。
答案:2 m
例2 一定质量的气体,在体积不变时,将温度由50
℃ 加热到100 ℃,气体的压强变化情况是( D )
A.气体压强是原来的2倍 B.气体压强比原来增加了25703
C.气体压强是原来的3倍 D.气体压强比原来增加了 35203
几何性质
力学性质
热学性质
体积V
压强p 三者关系
?
温度T 控制变量法
气体的等温变化
1.玻意耳定律 一定质量的某种气体,在温度不变 的情况下,压强p与体积V成反比。
pV=C 或
p1V1= p2V2
2.气体等温变化的p-V图
P 对于一定质量的
A 气体:T1<T2
B
T2
T1
0
V
气体的等容变化
1.查理定律 一定质量的某种气体,在体积不变的 情况下,压强p与热力学温度T成正比。
V C 或
T
V1 V2 T1 T2
2.气体等压变化的V-T图
V
p
P
0
T
0
V0
T
玻意耳定律的应用
例1 【粗例细2】均匀粗细的均玻匀璃的玻管璃内管封内闭封闭一一段段长长为为1122ccmm的的空空气气柱柱。. 一一个个人人手手持持玻璃玻管璃开管口向开下口潜向入下水中潜,当入潜水到中水,下当某潜深到度时水看下到某水 深 度 为进不以入变根度.p(0点玻据,=取时玻1璃玻拨水.璃看管意:0面由×管到口耳上于定1水内大2玻0律c气璃5m气进P问,压管a求体入,题强内人g即温玻取为气潜可璃度体入1p0解0温=水管视m1决度/中.0为口s。×不的212不)变0深c5,m变度P被,a。,封求,g (取闭玻人取气1璃潜水0体管m入面的/内s2质水上气) 量体中大也温的气不度深压变视,强所为
3 第3节 气体的等压变化和等容变化

第3节气体的等压变化和等容变化学习目标核心素养形成脉络1.知道什么是等压变化,理解盖-吕萨克定律的内容和公式。
(重点)2.掌握等压变化的V-T图线、物理意义并会应用。
(重点、难点)3.知道什么是等容变化,理解查理定律的内容和公式。
(重点)4.掌握等容变化的p-T图线、物理意义并会应用。
(重点、难点)5.知道理想气体的含义,了解理想气体状态方程。
6.知道气体实验定律的微观解释。
一、气体的等压变化1.等压变化一定质量的某种气体,在压强不变的条件下,体积随温度变化的过程。
2.盖-吕萨克定律(1)文字表述:一定质量的某种气体,在压强不变的情况下,其体积V与热力学温度T成正比。
(2)公式表达:V=CT(C是常量)或V1T1=V2T2或V1V2=T1T2(V1、T1和V2、T2分别表示气体在不同状态下的体积和热力学温度)。
(3)适用条件:气体质量一定,气体压强不变。
(4)等压变化的图像:等压线是一条通过坐标原点的倾斜的直线。
二、气体的等容变化1.等容变化一定质量的某种气体,在体积不变时,压强随温度变化的过程。
2.查理定律(1)文字表述:一定质量的某种气体,在体积不变的情况下,压强p与热力学温度T成正比。
(2)公式表达:p=CT(C是常量)或p1T1=p2T2或p1p2=T1T2(p1、T1和p2、T2分别表示气体在不同状态下的压强和热力学温度)。
(3)图像:从图甲可以看出,在等容变化过程中,压强p与摄氏温度t是一次函数关系,不是简单的正比例关系。
但是,如果把图甲中的直线AB延长至与横轴相交,把交点当作坐标原点,建立新的坐标系(如图乙所示),那么这时的压强与温度的关系就是正比例关系了。
图乙坐标原点的意义为气体压强为0时,其温度为0 K。
可以证明,新坐标原点对应的温度就是0K。
(4)适用条件:气体的质量一定,气体的体积不变。
三、理想气体1.理想气体在任何温度、任何压强下都遵从气体实验定律的气体。
2.把实际气体看作理想气体的条件理想气体状态方程(1)内容:一定质量的某种理想气体,在从状态1变化到状态2时,尽管p、V、T都可能改变,但是压强跟体积的乘积与热力学温度的比值保持不变。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
问题1 :玻意耳定律的内容是什 么?其表达式的什么?
问题2、在等温曲线中, A、B、C、D四点的 温度的关系是什么?
P A
D
Bቤተ መጻሕፍቲ ባይዱ
C
O V
问题3、一定量气体,VB=VC,则PB>PC
的原因是什么?
第七章
第三节
气体
气体等容变化 查理定律
等容变化:一定量的气体,在体积 不变的情况下,所发生的状态变化 叫等容变化。
例2:密闭容器内装有一定量的气体,当 温度升高5 ℃时,气体的压强增量为原 来的1/100,气体原来的温度为多少℃?
解:设0 ℃时压强为P0,t ℃时压强为Pt, t+5 ℃时压强为P,则由查理定律得 Pt = P0(1+t/273) ① P= P0[1+(t+5)/273] ② ∵P=Pt(1+1/100) ③ ∴解方程得 t=227 ℃
查理定律的适用条件: 温度不太低,压强不太大。
用分子动理论解释查理定律: 一定质量的气体,在体积不变的情况下, 单位体积内所含有的分子数是不变的。 当温度升高时,分子的运动加剧,分子 的平均速度增大,因而,不仅单位时间 内分子撞击器壁的次数增多,而且每次 撞击器壁的冲力也增大,所以气体的压 强增大,温度降低时,情况恰好相反。
课堂小结 1、一定量的气体,在体积不变的情况 下,所发生的状态变化叫等容变化。
2、一定质量的气体,在体积不变时, 温度每升高(或减小)1℃,增加(或 减小)的压强等于它在0 ℃时压强的 1/273,这就是查理定律。即 Pt-P0 P0 t 273 或 Pt= P0(1+t/273 ℃)
3、气体的等容图象(P-t图)是一条不 过原点的直线(一次函数),与纵轴的 交点P0,与横轴的交点为-273℃,斜率 为k=tgα= P0 /273。
练习题: 1、某容器在0℃时压强为P0=1×105Pa, 求20 ℃时该容器的压强。(容器不变) 2、某容器在0℃时压强为P0=1×105Pa, 等容变化后压强为1.1 ×105Pa,求这时 气体的温度? 答案:1、1.07 ×105Pa 2、27.3 ℃
图象特点: 是一条不过原点的直线(一次函数),与 纵轴的交点P0,与横轴的交点为-273℃, 斜率为k=tgα= P0 /273。 P 甲 图象信息: 同种同量气体不同 乙 体积下的斜率、截 -273 0 t 距与体积有关: V甲<V乙,P0甲> P0乙,k甲> k乙 即:斜率大,体积小
例1:一定质量的气体,保持体积不变, 温度从1℃升高到5 ℃,压强的增量为 2×103Pa,则 A、它从5 ℃升高到10 ℃,压强增量为 2×103Pa; B、它从15 ℃升高到20℃,压强增量为 2×103Pa; C、它在0 ℃时,压强约为1.4 ×105Pa; D、它每升高1 ℃ ,压强增量为原来的 1/273。 答案:C
4、查理定律是实验定律;其适用条件 是一定质量的气体在等容变化过程中, 只要压强不太大(和大气压相比),温 度不太低(和室温相比),都符合查理 定律。
今日作业
课本第235页第⑶题、第⑸题
实验结果:一定量气体,体积不变 时,压强随温度升高而增大,随温 度降低而减小。
查理定律的内容:一定质量的气体, 在体积不变时,温度每升高(或减 小)1℃,增加(或减小)的压强 等于它在0 ℃时压强的1/273,这就 是查理定律。 查理定律的数学表达式是: Pt-P0 P0 t 273 或 Pt= P0(1+t/273 ℃)
