内部质量审核实施计划
iso13485质量管理体系内部审核方案

iso13485质量管理体系内部审核方案ISO 13485质量管理体系内部审核方案概述ISO 13485是为医疗器械行业制定的质量管理体系标准,要求医疗器械制造商建立和维护一个有效的质量管理体系以确保产品质量和安全性。
内部审核是评估质量管理体系有效性的重要步骤,通过对体系进行周期性审查,可以识别和纠正潜在的问题,持续改进体系的运行。
目标本内部审核方案的目标是确保公司的质量管理体系符合ISO 13485标准的要求,并提供持续改进的机会。
通过内部审核,可以识别并纠正体系中的问题,促进公司质量文化的建立,并增强员工对质量管理体系的意识和参与度。
审核程序1. 选拔审核员内部审核应由经过合适培训并具备相关经验的审核员来执行。
审核员的选拔应根据其专业知识、技能和适用经验进行评估。
最好是建立一个内部审核团队,确保审核的连续性和一致性。
2. 制定审核计划根据ISO 13485标准的要求,制定年度内部审核计划。
审核计划应涵盖所有相关的管理和操作程序,并对审核的频率进行评估。
根据审核计划,确定每次内部审核的审核范围、目标和时间表。
3. 实施内部审核内部审核应按照预定的计划进行。
审核员应准备相关文件和审核记录表,并与审核对象进行会议。
在审核过程中,审核员应进行文件和记录的检查,并与员工进行访谈以了解他们对质量管理体系的理解和遵守情况。
审核员还应观察工作场所和实际操作,并记录发现的任何不符合或改进机会。
4. 编写审核报告审核员应根据审核结果编写审核报告。
报告应包括审核的范围、日期、审核员名单、发现的不符合项和改进机会,以及建议的纠正措施。
报告应清晰明了,并根据不同部门或功能进行分析和总结。
5. 采取纠正措施审核报告应提交给相关部门负责人,并要求他们采取纠正措施以解决发现的不符合项和改进机会。
纠正措施应具体、可执行,并在规定的时间内得到落实。
审核员应跟踪和审查纠正措施的执行情况,并记录并报告进展情况。
6. 审核跟踪在下一次内部审核中,审核员应跟踪上一次审核报告中提出的纠正措施的执行情况。
第一次内部审核实施计划附表:日程安排
ZK-202-JL-02检查表;
管理体系文件、档案、发放/回收记录;
保密/准入制度(外来人员登记);
设备管理;样品管理;
校准证书/发布、发放。
校准人员当前工作、能力/资格证书、近期接受过哪些培训(质量要求/技术要求);学历/职称,专门授权;
技术要求为主:
如何理解要素“5.1总则”;
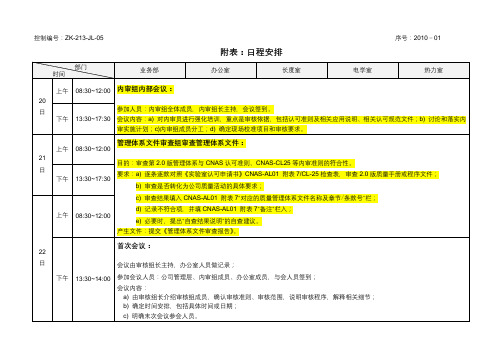
控制编号:ZK-213-JL-05序号:2010-01
附表:日程安排
部门
时间
业务部
办公室
长度室
电学室
热力室
20
日
上午
08:30~12:00
内审组内部会议:
参加人员:内审组全体成员,内审组长主持,会议签到。
会议内容:a)对内审员进行强化培训,重点是审核依据,包括认可准则及相关应用说明、相关认可规范文件;b)讨论和落实内审实施计划;c)内审组成员分工;d)确定现场校准项目和审核要求。
首次会议:
会议由审核组长主持,办公室人员做记录;
参加会议人员:公司管理层、内审组成员、办公室成员,与会人员签到;
会议内容:
a)由审核组长介绍审核组成员,确认审核准则、审核范围,说明审核程序,解释相关细节;
b)确定时间安排,包括具体时间或日期;
c)明确末次会议参会人员。
14:00~17:30
现场审核:查阅资料、记录、报告;专业室审核以提问方式为主,做好相应记录。
下午
13:30~17:30
现场试验(出校准证书)
25日
上午
08:30~12:00
现场试验(出校准证书)
现场试验(出校准证书)
下午
13:30~15:30
考核总经理(ZZZ、YYY):
管理体系内部审核计划

2:00~6:00
内审组长和小组长会,形成最终不合格报告。
6月4日
上午
末次会议
下午
备注
附2:审核日程安排表(二)
时 间
四小组
五 小 组
六小组
5月27日
上午
8:30~12:00
内审预备会
下午
2:30~3:00
首次会议
3:00~6:00
五分公司机关
机施分公司机关
四分司机关
5月28日
上午
8:30~12:00
六分司机关
一分司机关
三分司机关
下午
2:00~6:00
六分司中环岛项目
一分司光华逸家项目部
三分司枫丹中心项目
5月29日
上午
8:30~12:00
六分司名山体育馆及文化公园项目
一分公司环球时代项目
(含机施项目如塔机、施工电梯等设备管理)
三分司恒大地产大邑项目
下午
2:00~6:00
5月30日
上午
8:30~12:00
四川省第三建筑工程公司
二0一三年管理体系内部审核计划
一、审核目的:
为检验公司管理体系运行和相关管理活动结果的有效性是否符合规定要求;迎接认证机构对公司GB/T19001—2008质量管理体系、GB/T50430-2007工程建设施工企业质量管理规范、GB/T24001—2004环境管理体系的监督审核以及GB/T28001—2011职业健康安全管理体系的换版审核工作做准备;为公司管理体系改进提供实施依据。
六、审核日程安排
二0一三年五月二十七日至六月四日(详见附2:审核日程安排表,如有调整另行通知)。
上海、内蒙分公司的内审时间预计6月中旬,审核员及具体日程另行安排通知。
内部审核的策划和实施步骤

内部审核的策划和实施步骤概述内部审核在企业管理中起着至关重要的作用,它可以帮助企业发现问题、改进流程,并确保企业在法律、道德和质量等方面符合要求。
本文将介绍内部审核的策划和实施步骤,帮助企业进行有效的内部审核。
策划步骤1.确定内部审核的目的和范围:在策划内部审核之前,需要明确内部审核的目的和范围。
目的可能包括发现问题、改进流程、确保合规等等。
范围可能包括某个部门、某个项目或者整个企业。
2.确定内部审核的周期:根据企业的情况和需要,确定内部审核的周期。
内部审核的周期可以是每月、每季度或每年一次。
周期的确定应该考虑到企业的资源和需求。
3.确定内部审核的团队:选取适当的团队成员参与内部审核。
内部审核团队应该由具有相关经验和知识的人员组成,以确保审核的准确性和有效性。
4.制定内部审核计划:根据目的、范围和周期,制定详细的内部审核计划。
计划应包括审核的时间表、流程和所需资源。
实施步骤1.筹备工作:在内部审核之前,需要做一些筹备工作。
首先,向相关部门通知内部审核的时间和范围。
其次,收集和整理有关文件和记录,以供审核使用。
最后,准备内部审核所需的表格、模板和工具。
2.进行审核:在内部审核过程中,按照计划进行审核工作。
具体步骤如下:–开始会议:在内部审核开始前,召集内部审核团队成员和需要审核的部门的代表开会,介绍内部审核的目的和流程。
–访谈:与相关人员进行面谈,了解他们对相关流程和政策的了解和遵守情况。
这可以通过提问、观察和检查记录等方式进行。
–检查记录和文件:检查相关记录和文件,确保其符合规定要求,并遵守内部政策和相关法律法规。
–检查实际操作:观察实际操作,确保其符合流程和要求,并纠正任何不符合的行为。
–提出建议和改进建议:根据审核结果,提出改进建议,并与相关部门一起讨论并制定改进计划。
3.撰写内部审核报告:在内部审核完成后,整理审核过程中收集的信息和结果,撰写内部审核报告。
报告应该包括审核的目的和范围、发现的问题和建议的改进措施。
IATF16949内部审核方案

IATF16949内部审核方案第1步:准备内部审核计划在开始内部审核前,需要制定一个详细的计划。
该计划应包括以下内容:-内部审核的范围和周期,以确定需要审核的区域和时间段。
-内部审核的团队成员,包括审核员和审核领导者。
-内部审核的资源需求,如审核员培训、文件和记录等。
-内部审核的流程和时间表,包括准备阶段、实地审核和报告编写等步骤。
第2步:准备审核程序和文件在内部审核开始前,需要准备相关的程序和文件,以便审核团队使用。
这些文件包括:-组织的质量相关文件和记录,如工作指导书、工艺流程图和质量检验报告等。
-内部审核的文件和表格,如审核计划、审核报告和问题记录表等。
第3步:实地审核在实施内部审核时,应按照方案中规定的范围和时间表进行。
以下是内部审核的一般步骤和要点:-开始会议:由审核领导者主持,介绍审核目的、过程和时间表。
-拉开帷幕:审核团队用于形容开放性的问题或发现,以引导受审人员讨论和解决问题。
-实地检查:审核团队需参观实地,检查质量管理体系的实施情况,并与工作人员进行交流。
-记录问题:审核团队需记录发现的问题、缺陷和矛盾,以便后续报告和改进。
第4步:问题报告和改进在内部审核结束后,审核团队应编写一份内部审核报告,汇总审核结果和问题建议。
以下是内部审核报告的主要内容:-审核目标和范围的总结。
-审核过程中发现的问题和缺陷。
-对组织质量管理体系的评估和改进建议。
-内部审核团队的反馈和建议。
第5步:内部审核跟踪内部审核结束后,组织应跟踪并落实内部审核报告中的问题和建议。
以下是内部审核跟踪的一些步骤:-制定行动计划:组织应根据内部审核报告中的问题和建议,制定相应的行动计划。
-跟踪行动计划的实施:组织应确保行动计划的实施,并根据需要进行内部审核的跟踪与检查。
-审核成果的验证:组织应通过再次进行内部审核或使用其他验证方法,确保问题解决和改进措施的有效性。
化妆品年度全套内部审核检查计划、内审记录表及内审报告

化妆品年度全套内部审核检查计划、内审记录表及内审报告
年度内部审核检查计划
1、内部检查目的:
为了使公司化妆品生产质量体系体系能满足国家法律法规、规章制度、化妆品生产许可工作规范要求以及相关国家标准要求,审查公司体系及体系的运行情况,及时发现问题并加以纠正及预防,使公司体系持续有效、不断改进、不断完善。
2、内部检查组长任命:
为使审核工作计划得以按时按标实施,任命xxx 为内部检查审核组长,负责内部检查工作的计划、实施及指导等工作。
3、审核组成员:
4、内部检查依据:
《化妆品卫生监条例》、《化妆品卫生监督条例实施细则》、《化妆品生产许可工作规范》、《广东省化妆品安全条例》、《化妆品安全技术规范》、《质量手册》等。
5、内部检查计划表:
6、首次会议:
7、内审检查表(人事行政部):
7、内审检查表(品管部):
7、内审检查表(设备部):
7、内审检查表(供销部):
7、内审检查表(生产技术部):
8、不符合项报告:
9、末次会议:
10、化妆品生产质量体系内部检查报告:
内部检查报告。
内部审核(ISO9001四级文件)

xx有限公司
内审年度计划(Q)
备注:▲表示计划进行
制定:审核(管代):制定日期:2020年05月05日内审日期:2020年05月09日
1/ 6
内审实施计划(Q)
首、末次会议记录表(Q)
不符合报告(Q)
依据:GB/T19001-2016/ISO9001:2015版标准
受审核部门品质部内审编号1/1
审核员: xxx 审核日期2020年05月09日不合格描述:
品质部检查未见4月的质量目标完成情况统计,不符合ISO9001:2015标准9.1.3条款要求
●不符合标准/文件: 9.1.3
●不符合类型:体系性不合格实施性不合格效果性不合格
●不符合程度:轻微严重不合格
审核员:xxx 部门负责人:xxx
不合格原因分析:
品质部负责人责任心不足,以及对相关标准的理解和执行的不到位,造成漏统计4月质量目标完成情况。
分析人:xxx 建议采取的纠正措施:
1. 立即进行GB/T19001-2016/ISO9001:2015 9.1.3条款培训,加强对相关标准的理解。
2. 立即对4月目标完成情况进行统计。
批准:xxx
纠正措施已完成:2020年05月10日开始已经按照要求进行改善。
部门负责人:xxx
跟踪验证:已经整改完成。
审核员:xxx
体系审核报告(Q)。
医疗器械内部审核工作计划

医疗器械内部审核工作计划
以下是一份医疗器械内部审核工作计划的示例:
1. 审核目标确定:
确定本次审核的目标,例如审核医疗器械质量管理体系是否符合相关法规和标准要求。
2. 审核范围确定:
确定需要审核的医疗器械质量管理体系的相关文件和记录,包括质量手册、程序文件、作业指导书等。
3. 审核计划制定:
制定详细的审核计划,包括审核时间、地点、参与人员、审核方式等。
4. 审核准备:
针对审核目标和范围,收集必要的信息和文件。
对参与审核的人员进行培训,提供相关背景和知识。
准备审核所需的工具和设备,如电脑、审核表、文件夹等。
5. 实施审核:
按照审核计划进行审核。
使用审核表记录审核结果和问题。
进行现场观察和访谈,了解实际操作情况。
6. 问题整理和分析:
将审核过程中发现的问题整理成问题清单。
对问题进行分类和分析,找出根本原因。
7. 编写审核报告:
根据审核结果和问题分析,撰写审核报告,包括问题汇总、原因分析和改进措施建议。
8. 提交审核报告:
将审核报告提交给相关部门和管理层,给予必要的解释和建议。
9. 跟踪改进措施:
跟踪和监督所提出的改进措施的执行情况。
定期评估改进措施的有效性和可行性,并进行必要的调整和改进。
10. 审核结果评估:
对整个审核过程进行评估,包括审核的有效性、及时性和可行性。
提出改进建议,用于提升的审核工作质量。
以上是一份医疗器械内部审核工作计划的示例,具体的工作计划可以根据实际情况进行调整和完善。
