2019年-吉林大学《分析化学实验》分析化学实验2019实验四-精品文档-PPT精选文档
大学分析化学实验:试验四EDTA的配制和标定

100.09 VEDTA
mol L-1
七、思考题
p61 1、以CaCO3为基准物标定EDTA溶液时,加 入镁溶液的目的是什么? 2、以CaCO3为基准物,以钙指示剂为指示 剂标定EDTA溶液时,应控制溶液的酸度为多 少?为什么?怎样控制? 3、用移液管移取标准钙溶液25mL时,数据 记录上记录的标准钙溶液体积数应记为几位 有效数字?
八、下次试验
P58页
实验13 天然水硬度测定
实验4 EDTA标准溶液的配 制和标定
东南大学化学化工学院 周少红
实验四:p56EDTA标准溶液的配制和标定
一、实验目的:
1.学习EDTA标准溶液的配制和标定方 法。 2.掌握配位滴定的原理,了解配位滴 定的特点 。 3. 熟悉钙指示剂的使用。
二、实多种金属离子生成很稳定的络合 物,所以广泛用来滴定金属离子。EDTA 难溶于水,实验用的是它的二钠盐 (Na2EDTA)。
五、数据记录
项目
次数
Ⅰ
CaCO3称量
标定
质量m
(CaCO3 )/g
V ED TA终读数
/mL
VEDTA 初读数
/mL
VEDTA 净体积
/mL
cEDTA /mol•L-1
数据处理
cEDTA / mol•L-1
相对平均偏差 /%
ⅡⅢ
六、数据处理
cEDTA
mCaCO3
1000
25.00 250.0
标定EDTA溶液常用的基准物有金属 Zn、ZnO、CaCO3等,为求标定与滴定条 件一致,可减少系统误差。本实验配制 的EDTA标准溶液,用来测定水硬,所以 选用CaCO3作为基准物。
二、实验原理
标定EDTA溶液用“钙指示剂”作为指示剂。
分析化学实验实验报告

分析化学实验实验报告
实验目的:
本次实验旨在通过分析化学的方法确定一种未知的物质X的化学成分和含量。
实验原理:
本实验采用了气相色谱-质谱联用仪(GC-MS)对未知物质X 进行了分析。
GC-MS是通过将物质分离并检测其各组分的不同质荷比来确定其化学成分和含量的一种分析方法。
实验步骤:
1. 首先,准备样品并将其加入分析管中。
样品是在实验室中制备的一种未知有机物。
2. 紧接着,将分析管插入气相色谱仪中。
在这里,样品会被注入到一条柱子中并被分离。
3. 接着,样品分子会被单独进入质谱仪中,这里的质谱仪会将不同的分子离子化。
4. 最后,该离子将会经历物质的加速器,并被定向到一个测量器中,该测量器会测量质荷比(m/z)。
通过质谱仪测量这些m/z 可以判断样品的化学成分和含量。
实验结果:
经过GC-MS的分析,我们确定了未知物质X的化学成分和含量。
我们发现未知物质X主要含有乙酸乙酯和二氯甲烷两种有机物,各自的含量分别为75.4%和24.6%。
讨论和结论:
本次实验通过GC-MS的分析方法成功地确定了未知物质X的化学成分和含量。
同时,我们由此也可以判断出该有机物是一种较为简单的有机物。
未来的研究可以通过更多的分析方法来进一步验证我们的结论,从而达到更加准确的测量结果。
《分析化学实验》电子教案

根据实验数据,分析实验结果,得出结论,并与预期结果进 行比较。
误差分析
误差来源
识别和分析实验过程中可能产生的误差来源,如仪器误差、操作误差等。
误差控制
采取有效措施控制误差,提高实验结果的准确性和可靠性。
结果讨论与改进
结果讨论
对实验结果进行深入讨论,探讨可能 影响实验结果的因素,并提出改进措 施。
实验数据处理与分析
1 2
数据记录与整理
学会正确记录实验数据,对实验结果进行整理和 归纳,为后续的数据分析提供基础。
误差分析与处理
了解误差的来源和传递规律,掌握误差的减小和 消除方法,提高实验ห้องสมุดไป่ตู้果的准确性和可靠性。
3
统计分析方法
掌握常用的统计分析方法,如平均值、标准差、 相对标准偏差等,能够根据数据特点选择合适的 分析方法。
实验中遇到的问题及解决方案
问题一
实验操作不规范:部分学生在实验操作过程中存在不规范的行为,如试剂用量不准确、仪器使用不当等。解决方案: 加强实验操作技能的培训和指导,强调操作的规范性和准确性,确保学生们能够熟练掌握正确的操作方法。
问题二
实验数据异常:在实验过程中,有时会出现实验数据异常或误差较大的情况。解决方案:引导学生们对实验数据进行 仔细的检查和分析,找出可能的原因并采取相应的措施进行纠正,以确保数据的准确性和可靠性。
实验设计和探究性学习
本部分将介绍实验基本操作、实验数 据处理和分析方面的基本知识和技能 ,包括称量、滴定、光谱分析等方面 的内容。
本部分将通过实验设计和探究性学习 ,培养学生的实验思维和创新能力, 让学生自己设计实验方案、进行实验 操作并分析实验结果。
常见分析方法
吉林大学分析化学实验.doc

2实验步骤,这一部分可用箭头加文字来简明表达。
3实验的原始记录,可计在报告本的左页上,尽量整齐,可列竖式,钢笔记录,防止涂改。特别要注意有效数字的运用和计算规则,量的符号、表达、书写方式、单位使用,均要规范化。
4数据处理,数据表格使用三线格,表序、表头、表中内容、标注要清楚完整、齐全。计算公式要写在注解中。
2.实验时要严格按照操作规范进行,仔细观察试验现象,并及时记录。要善于思考,学会运用所学理论知识解释试验现象,研究试验中的问题。保持试验台和实验室的整洁。
3.要认真写好实验报告。实验报告一般包括题目、日期、试验目的、简单原理、原始记录、结果(附计算公式)和讨论。上述内容的繁简取舍,应根据各个试验的具体情况而定,以清楚、简练、整洁为原则。实验报告中的有些内容,如原理、表格、计算公式等,要求在实验预习时准备好,其他内容则可在实验过程中以及试验完成后记录、计算和撰写。具体要求如下:
重点:引导学生将学过的知识用于实际之中。理论设计与实验技术并重。
难点:理论设计中有关计算。
学生领取本学期所用仪器、清洗、换锁、清扫卫生。
教学目的
及要求
1.让学生了解分析化学实验课的教学目的、教学内容、教学要求等内容;
2.介绍如何上好分析化学实验课,教师如何教,学生如何学;
3.对如何撰写预习报告和实验报告提出具体要求;
1.《基础化学实验》上册.徐家宁,门瑞芝,张寒琦主编,高等教育出版社,2006
2.《分析化学实验》吉林大学主编吉林大学出版社出版
3.《分析化学实验》武汉大学主编第四版2001年5月高教出版社出版
课后小结
让学生明确分析化学实验课程的:“教”与“学”的目标,了解每一教学层次的重点,做到心中有数,师生互动,相互配合,提高教学质量。
《分析化学实验》教学大纲

《分析化学实验》教学大纲一、课程简介分析化学实验是化学专业中的核心课程之一,旨在培养学生分析化学实验技能和分析思维能力。
通过课堂授课和实验操作,学生将学习分析化学基本理论、仪器设备的使用和实验操作技巧,在实验中培养科学实验的观察、记录和分析能力。
二、教学目标1.理论目标(1)理解分析化学的基本理论和原理;(2)掌握常见的分析方法和技术;(3)理解实验操作中的原理和要点。
2.实践目标(1)学习使用常见的分析仪器设备,如pH计、天平、分光光度计等;(2)掌握溶液制备、分离和测定的基本操作;(3)培养良好的实验记录和数据处理能力。
三、教学内容1.分析化学基本理论和原理(1)分析化学概述(2)分析化学基本方程式(3)分析化学的误差和精密度2.常见的分析方法和技术(1)酸碱滴定法(2)氧化还原滴定法(3)浊度法(4)物质定量法(5)光度法(6)原子吸收光谱法(7)色谱法3.实验操作技巧(1)实验室安全和操作规范(2)实验设备的正确使用(3)实验前的准备工作(4)实验过程中的注意事项(5)实验记录和数据处理四、教学方法1.理论教学通过课堂讲授分析化学的基本理论和原理,解释实验中的操作步骤和原理。
引导学生理解和掌握相关知识。
2.实验操作安排实验课程,让学生亲自操作常见的分析实验,并指导学生掌握实验操作的方法和技巧。
3.实验数据分析指导学生分析实验结果,进行数据处理和误差分析,并解释实验现象和规律。
五、教学评估1.实验报告学生每次实验完成后需提交实验报告,报告内容包括实验目的、原理、操作步骤、数据处理和结论等。
2.实验技能考核对学生的实验操作技能进行考核,包括仪器的正确使用、实验操作的规范性和实验数据的准确性等。
3.理论知识考试对学生的分析化学理论知识进行考核,包括基本理论、常见方法和技术的原理等。
六、教学资源1.教材2.实验室设备包括各种分析仪器设备,如pH计、天平、分光光度计等。
3.实验试剂和样品提供各种常见的化学试剂和样品,用于学生进行实验操作。
《大学化学实验分析化学实验》课程教学大纲

《大学化学实验-分析化学实验》课程教学大纲一、课程说明(一)课程名称、所属专业、课程性质、学分课程名称:《大学化学实验-分析化学实验》所属专业:材料化学课程性质:专业基础课学分:2学分(72学时)(二)课程简介、目标与任务、先修课与后续相关课程课程简介:本课程是为材料化学专业本科生学生开设的专业基础课,目的在于传授分析化学知识和分析化学实验技能、训练科学的思想和实验方法、培养科学的精神和工作能力。
本课程设置注重科学性、基础性和综合性。
目标与任务:化学是一门实践性很强的学科,基础化学实验在培养未来化学工作者的化学学科大学本科教育中,具有特别重要的作用。
分析化学实验课程通过基本操作、经典实验、研究式实验、设计实验和综合性实验等形式的训练,使学生规范和熟练地掌握化学实验的定量基本操作,学习分析化学实验的基本知识,使学生加深对“量”和“误差”等化学基础理论的理解和掌握,培养学生独立思考和独立工作的能力,培养细致观察和规范记录现象的能力,培养正确归纳和综合处理数据的能力,培养用语言表达实验结果的能力以及一定的组织实验、研究实验的能力,培养学生实事求是、细致严谨的科学态度,使学生形成良好的科学习惯及科学的思维方法,从而逐步掌握科学研究的方法。
先修课程与后续相关课程:先修课程:分析化学等后续相关课程:仪器分析、仪器分析实验、有机化学、结构化学、高分子基础、物理化学、物理化学实验等。
(三)教材与主要参考书教材:《大学化学实验—基础化学实验I》(上、下册),兰州大学化学化工学院大学化学实验中心编著,兰州大学出版社,2011年。
先修课程与后续相关课程:主要参考书:1.理科化学专业和应用化学专业教学基本内容,教育部理科化学教学指导委员会,《大学化学》,1999,14(2):9。
2.《分析化学实验》(第三版),武汉大学主编,高等教育出版社,1994年。
3.《有机化学实验》,王清廉、沈凤嘉编,高等教育出版社,1994年。
吉林大学《分析化学实验》分析化学实验1-生科

9/14/2019
分析化学实验
55
滴定操作
(2)酸管的操作 使用酸管时, 左手握滴定管,其无名指和小指 向手心弯曲,轻轻地贴着出口部 分,用其余三指控制旋塞的转动。 但应注意,不要向外用力,以免 推出旋塞造成漏水,应使旋塞稍 有一点向手心的回力。当然,也 不要过分往里用太大的回力,以 免造成旋塞转动困难。
项
目
1、试漏,操作液润洗正确
2、装液,倾斜30到45度,不外流
3、不漏液
4、管内无气泡
5、初读数在零刻度左右、读数方式正确、记录正确
6、滴定操作握姿正确
7、锥形瓶摇姿正确
8、滴定速度适中
9、指示剂加入(种类、量)正确
10、终点前后半滴控制到位
11、记录正确
12、用后废液倒入水槽,洗涤器皿,滴定管装上水放 好
分析化学实验
63
9/14/2019
(7)半滴的控制和吹洗 快到 滴定终点时,要一边摇动,一 边逐滴地滴入,甚至是半滴半 滴地滴入。学生应该扎扎实实 地练好加入半滴溶液的方法。 用酸管时,可轻轻转动旋塞, 使溶液悬挂在出口管嘴上,形 成半滴,用锥瓶内壁将其沾落 ,再用洗瓶吹洗。对碱管,加 半滴溶液时,应先松开拇指与 食指,将悬挂的半滴溶液沾在 锥瓶内壁上,再放开无名指和 小指,这样可避免出口管尖出 现气泡。
分析化学实验
滴定管的洗涤——关上旋塞,检验旋塞的密闭性
9/14/2019
分析化学实验
33
9/14/2019
分析化学实验
34
滴定管旋塞涂凡士林方法:1、退下旋塞,用滤纸吸干
9/14/2019
分析化学实验 35
滴定管旋塞涂凡士林方法:1、退下旋塞,用滤纸吸干
9/14/2019
《分析化学实验》(一)课程实验教学大纲(工科).
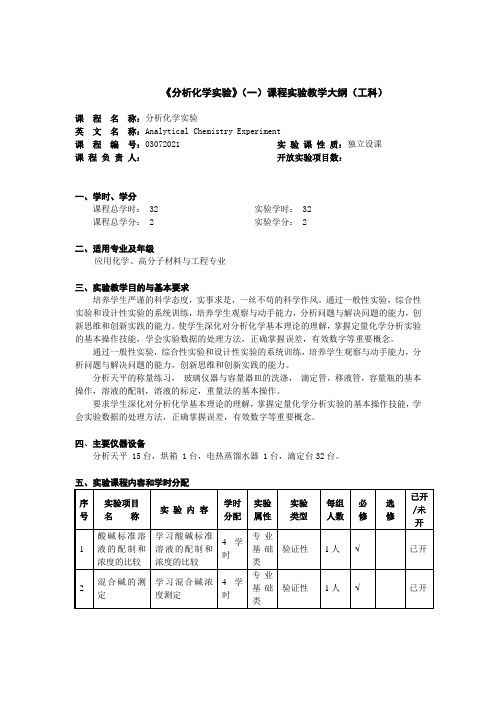
《分析化学实验》(一)课程实验教学大纲(工科)课程名称:分析化学实验英文名称:Analytical Chemistry Experiment课程编号:03072021实验课性质:独立设课课程负责人:开放实验项目数:一、学时、学分课程总学时: 32 实验学时: 32 课程总学分: 2 实验学分: 2二、适用专业及年级应用化学、高分子材料与工程专业三、实验教学目的与基本要求培养学生严谨的科学态度,实事求是,一丝不苟的科学作风。
通过一般性实验,综合性实验和设计性实验的系统训练,培养学生观察与动手能力,分析问题与解决问题的能力,创新思维和创新实践的能力。
使学生深化对分析化学基本理论的理解,掌握定量化学分析实验的基本操作技能,学会实验数据的处理方法,正确掌握误差,有效数字等重要概念。
通过一般性实验,综合性实验和设计性实验的系统训练,培养学生观察与动手能力,分析问题与解决问题的能力,创新思维和创新实践的能力。
分析天平的称量练习,玻璃仪器与容量器皿的洗涤,滴定管,移液管,容量瓶的基本操作,溶液的配制,溶液的标定,重量法的基本操作。
要求学生深化对分析化学基本理论的理解,掌握定量化学分析实验的基本操作技能,学会实验数据的处理方法,正确掌握误差,有效数字等重要概念。
四、主要仪器设备分析天平 15台,烘箱 1台,电热蒸馏水器 1台,滴定台32台。
五、实验课程内容和学时分配六、考核方式实验操作考核七、实验教材(讲义、指导书)、参考书(一)实验教材《分析化学实验》(第三版),四川大学化工学院浙江大学化学系编,北京:高等教育出版社、2003年(二)参考书1.同上2.同上修(制)订人:石慕尔审核人:陈慧娟 2006年 07 月(备注:表中选择“必修”、“选修”栏请用“√”表示)。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
:: ::
HOOCH2C
CH2COO-
·· ··
NH+ C C NH+
H2 H2
-OOCH2C
CH2COO2C O
N
Ca O
O
H2 C CH2
N CH2
O
C
CH2 O
C
O
EDTA为氨羧类络合剂,以N、O为键合原子,
与金属离子配位时形成环状结构的内配位化合物。
可以同大多数金属离子形成1∶1的可溶于水的螯合
分析化学实验之四
LOGO
EDTA的标定与水硬度的测定
Text Text
2019/4/30
Text
Te
xt
化学教学与研究中心
1
分析化学实验
已做实验的总结
器皿洗涤
烧杯、锥形瓶、试剂瓶、量筒等 移液管、滴定管、容量瓶等
天平称量:
动作要轻、缓,关天平门读数 保持天平内外的整洁,及时将撒出的样品(试剂)清扫到中间台上的大烧 杯中。
物。根据这种定量关系,进行配位滴定。
2019/4/30
分析化学实验
4
本次实验的原理
EDTA与常见金属离子的稳定常数:
lgK Na+ 1.7
lgK
Mg2+ 8.7 Ca2+ 10.7
lgK
Fe2+ 14.3 La3+ 15.4 Al3+ 16.1 Zn2+ 16.5 Cd2+ 16.5 Pb2+ 18.0 Cu2+ 18.8
2019/4/30
分析化学实验
14
下次实验的布置
配位滴定实验之二 — Bi3+ -Pb2+混合液的测定
2.混合液中测定 Pb2+
在滴定Bi3+后的溶液中,加2滴二甲酚橙, 加入六次甲基四胺溶20ml,溶液呈现稳定的紫 红色,用EDTA标准溶液滴定Pb2+,当溶液由紫红 色恰变成黄色,即为Pb2+的终点。根据EDTA消 耗的体积,计算混合液中Pb2+的含量(mol/L表 示)。
2019/4/30
分析化学实验
15
下次实验的布置
环境科学专业:下周五(19日)停课一次 预习: 1 Na2S2O3标准溶液的配制与标定 P46-48 2 维生素C的含量测定 P48-50
10-13 蓝 红
Ca2+
2019/4/30
分析化学实验
6
本次实验的原理
M+ Y
OH-
A
H+
N
MOH MA HY NY
●
●
●
●
●
●
● ● ●
M(OH)p MAq H6Y
M
Y
→
MY (主反应)
H+
OH-
MHY MOHY 副 反 应
(MY)
2019/4/30
分析化学实验
7
本次实验的原理
滴定反应 H2Y+M = MY + 2H+
lgK
Hg2+ 21.8 Th4+ 23.2 Fe3+ 25.1 Bi3+ 27.9 ZrO2+ 29.9
2019/4/30
分析化学实验
5
本次实验的原理
常用金属指示剂
指示剂
铬黑T (EBT) 二甲酚橙 (XO)
(6元酸)
钙指示剂
使用 pH 范围
7-10 <6
In MIn 直接滴定M
蓝红 黄红
Mg2+ Zn2+ Bi3+ Pb2+ Zn2+
定容: 试样(试剂)要完全溶解,小烧杯润洗6次。 分取: 原液润洗三次; 食指?拇指? 滴定: 原液润洗三次;读数的方法:提起滴定管读数。记录:初读数、
终读数。
数字修改:应规范。
实验室环境:时时保持台面、地面和水槽整洁,用过毛巾要及时用洗涤液
洗干净。实验结束要将器皿用自来水洗干净并放好,包括公共器皿(只要你 用过的都要洗),滴定管要倒挂放好。每个人和值日生都是参与者。
分析化学实验
10
本次实验的实验步骤
2. EDTA标准溶液的标定
吸取钙标准溶液25.00mL于250mL锥形瓶中, 加入蒸馏水50mL摇匀,加20% NaOH 5mL 摇匀,钙指示剂一勺,此时溶液呈紫红色, 摇匀后用EDTA标准溶液滴定至溶液变为纯 蓝色。重复五次,根据消耗的EDTA标准溶 液的体积,计算EDTA标准溶液的浓度(c mol/L)。
c = 硬度计算: CaO
c V EDTA EDTA V水样
2019/4/30
分析化学实验
9
本次实验的实验步骤
1减准.量 物0.0法 质2 于准mo小确l/L烧称C杯量a2中0+标.4:准—W溶10-.液5Wg的2=C配maC制O3基
少量水湿润 2ml1:1HCl 纯净水30ml
少量多次
2019/4/30
2019/4/30
分析化学实验
12
本次实验的注意事项
1、称量要精确 2、定容、滴定要准确。 3、分取溶液要定量:分取标准溶液EDTA时,要直
接用干净的移液管在试剂瓶中直接吸取,注意润 洗操作和擦拭移液管。 4、指示剂使用:加一份指示剂,滴定一份,不可5 份(3份)一次性都加指示剂。 5、终点颜色可能略有不同
2019/4/30
分析化学实验
13
下次实验的布置
配位滴定实验之二 — Bi3+ -Pb2+混合液的测定
1.混合液中测定 Bi3+-
用移液管移取25mL Bi3+-Pb2+混合液3份 于250 mL锥形瓶中,加1-2滴二甲酚橙指示 剂,用EDTA标准溶液滴定,当溶液由紫红色 恰变成黄色,即为Bi3+的终点。根据EDTA消 耗的体积,计算混合液中Bi3+的含量 (mol/L表示)。
溶液的酸度增加使螯合物条件稳定常数变小; 条件稳定常数变小,滴定突跃变小。
金属指示剂的变色需要固定溶液的pH在一 定的范围
结论:配位滴定需要缓冲溶液支持溶液的 pH在一定的范围
2019/4/30
分析化学实验
8
本次实验的原理
3、计算: 1°=10mg/L
EDTA浓度:cEDTAm 10C0aC.O 13215000.00V 25ED .0TA 0
2019/4/30
分析化学实验
11
本次实验的实验步骤
3.水样中钙镁总量的测定
用移液管移取25.00mL模拟水样于250mL锥 形瓶中,加入蒸馏水50mL摇匀,加10mL 氨缓冲溶液摇匀,加铬黑T指示剂一勺,用 EDTA标准溶液滴定至溶液由紫红色恰变为 纯蓝色为终点。平行测定3份,根据消耗的 EDTA标准溶液的体积,计算水样的钙镁总 量,以mol/L表示结果。
2019/4/30
分析化学实验
2
EDTA标定与水硬度测定
了解配位滴定基
本原理和测定方法
目标 要求
了解常见金属指示剂
的使用和变色原理。
掌握EDTA标准溶 液的配制与标定方 法
进一步掌握基本操
作并熟悉化学分析的 一般步骤。
2019/4/30
分析化学实验
3
本次实验的原理
1、滴定原理 (cV)标 = (cV)样
