第四章 传质及曝气
水处理系统曝气工艺介绍

水处理系统曝气工艺介绍一、曝气器在污水处理中的应用生物处理法根据参与作用的微生物的需氧情况,可分为好氧法和厌氧法两大类。
一般情况,好氧法比较适用于较低浓度污水,如乙烯厂污水;而厌氧法较适用于处理污泥和较高浓度的污水。
好氧生物处理法可分为活性污泥法和生物膜法两大类。
活性污泥法是水体自净的人工强化方法,是一种依靠活性污泥工作主体的去除污水中有机物的方法。
存在于活性污泥中的好氧微生物必须在有氧气存在的条件下才能起作用。
在污水处理生化系统的曝气池中,充氧效率与好氧微生物生长量成正相关性。
溶解氧的供给量要根据好氧微生物的数量、生理特性、基质性质及浓度来综合考虑。
这样,活性污泥才能处在最佳的降解有机物的状态。
根据试验表明,曝气池中溶解氧维持在3~4mg/L为宜,若供氧不足,活性污泥性能差,导致废水处理效果下降。
为保证有充足的供氧,必须依靠一种设备来完成,例如曝气器。
二、曝气的原理曝气是使空气与水强烈接触的一种手段,其目的在于将空气中的氧溶解于水中,或者将水中不需要的气体和挥发性物质放逐到空气中。
换言之,它是促进气体与液体之间物质交换的一种手段。
它还有其他一些重要作用,如混合和搅拌。
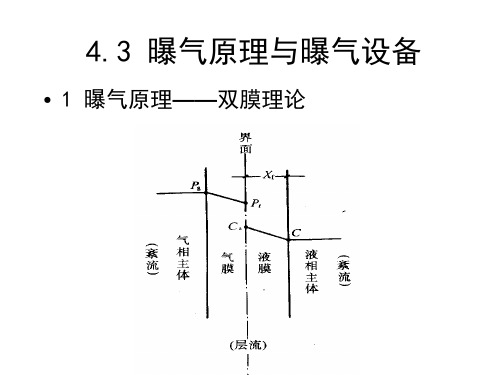
空气中的氧通过曝气传递到水中,氧由气相向液相进行传质转移,这种传质扩散的理论,目前应用较多的是刘易斯和惠特曼提出的双膜理论。
双膜理论认为,在“气-水”界面上存在着气膜和液膜,气膜外和液膜外有空气和液体流动,属紊流状态;气膜和液膜间属层流状态,不存在对流,在一定条件下会出现气压梯度和浓度梯度。
如果液膜中氧的浓度低于水中氧的饱和浓度,空气中的氧继续向内扩散透过液膜进入水体,因而液膜和气膜将成为氧传递的障碍。
这就是双膜理论。
显然,克服液膜障碍最有效的方法是快速变换“气-液”界面。
曝气搅拌正是如此,具体的做法就是:(1)减少气泡的大小,增加气泡的数量,提高液体的紊流程度,加大曝气器的安装深度,延长气泡与液体的接触时间。
(2)曝气设备正是基于这种做法而在污水处理中被广泛采用的。
激波传质器、曝气管的安装

激波传质器、曝气管的安装1、安装前的准备工作(1)检查设备的规格、性能是否符合图纸及标书要求,检查设备说明书、合格证和设备试验报告是否齐全。
(2)检查设备外表如激波传质器曝气管、管路等是否受损变形,零部件是否齐全完好。
(3)复测土建工程的标高是否满足设计图纸要求,以及检查所有的埋件留孔是否符合安装条件。
2、安装步骤:(1)系统在安装时,要确保:曝气器在一条直线上、同时在同一水平面、系统要防漏。
(2)在安装之前,池底必须保持干净。
划好钻孔位置并钻孔,将水平调节器固定在适当的位置。
而管径大于DN100的空气分配干管,则用不锈钢抱箍,将管子安放之后,利用抱箍调节干管水平。
(3)当水平调节器高度调节好后,即可安装空气分配干管、布气支管和环通边管。
安装顺序:布气支管→分配干管→环通边管。
3、曝气系统的现场检查与调试:(1)安装后按《污水处理用微孔曝气器》CT/3015.4-96 标准进行检验,保证其实测值符合规定允许值。
(2)在无水状态下,所有配气支管在加载100kg情况下无弯曲变形。
(3)系统检漏:在安装完毕后,不能立刻进行检漏。
应先将清扫口法兰一个个打开,并用压缩空气对整个曝气管网进行一次彻底的吹扫。
吹干净后,关闭清扫口法兰并全面清理一次池底。
最后在池中注入清水并超过曝气器以上至少20㎝进行检漏。
通过对曝气器部位所冒气部位来检测判断是否有漏气,分如下三个阶段进行:阶段1:池中清水上表面与曝气器上表面处于同一平面。
阶段2:池中清水上表面高出曝气器上表面2cm。
阶段3:池中清水上表面高出曝气器上表面20cm。
检漏完毕并确认无漏点后,即可投入正式运行。
当代给水与废水处理原理(第二版)第4章b

如公式4-79
KLdb D
0.33
db
ND
0.6
D
0.5
4-8 水膜的传质性能
1.水膜的厚度
在废水的生物膜处理方法中,水膜的厚度是一个影响传递氧的重要 因素。
2.沿光滑板下落的水膜传质系数k1
从光滑板上下落的水膜传质系数k1受流态,倾斜角与水质的影响。 在雷诺数较高的层流表面出现小波浪,这种波浪使水膜吸收气体的速率比没 有波浪的层流水膜约大2~3.5倍波浪使水表面积的增加不过百分之几。所以, 使用k1值增大数倍的原因是由于波浪体内流体的循环作用,而不是表面积增加的作 的影图响,4以-及2表3面综活合性了剂一对些k水1的膜影吸响收。CO2的k1的数据,它表示出Re数和倾斜角Ø 表面活性剂水面发生波浪,因此,起了降低k1值的作用。
功率数NP的物理涵义可以通过量纲分析来理解:
2.淹没式曝气器
淹没式叶轮曝气器主要是从曝气池底部的空气分布系统引入的空气 中吸收氧气。
淹没式曝气器一般在产生气泡的同时,对气泡进行搅拌,这是一种 搅拌型鼓泡系统。
由于搅拌使气泡的传质效率提高,故在传质系数KL的相关公式中, 必然要反映出搅拌这个因素来。
当气泡淹没水中时,其界面浓度由于同时受到温度,水中溶质浓度 和压力三个因素变化的影响,其数值与表4-8所列的必然不同。
其中压力的情况较复杂,这包括三个方面: (1)当地的大气压力不是0.1MPa (2)空气气泡中含有饱和蒸汽的分压 (3)淹没水深所产生的水柱压力
2.气泡在水中的上升速度 气泡在水中的上升速度大致可以分3个区:
的趋向。 下面以平均气泡来进行分析:
平均气泡的直径为db。db 与曝气中单位容积液体中所含气泡表面积a 的关系可以推导如下: 如图所示:
气液传质与曝气

气-液传质与曝气污水好氧生物处理过程中,需要消耗大量的氧气以供微生物(主要是细菌)的生命活动需要。
向水中充入氧气通过曝气工艺实现。
曝气工艺属于越过两相(气相和液相)界面的相间传质现象。
传质是自然界中极为普遍的现象,但是这一术语却只是在近三十多年来才被普遍地使用。
传质是质量传递(mass transfer)的简称。
凡是由于某种推动力(driving force)所引起的物质分子或流体微元的运动都称为传质[1]。
传质包括了分子扩散,也包括了由于对流现象甚至简单的混合作用所产生的物质迁移(transport),但它不同于物质的输送,如用管道输送流体,则不能称为传质。
污水的好氧生物处理方法中,氧气吸收的重要作用尤为突出。
好氧生物处理可分为悬浮培养体和生物膜两大类方法。
前者可用活性污泥法(activated sludge process)为代表,曝气池中吹入空气(或氧气)泡,氧气分子先从气泡内传递进水内,在从水内传递进生物絮体内,才能发生生物氧化作用。
滴滤池(trickling filter)是生物膜法的典型代表。
氧气从空气中传递到水膜内,在从水膜内传递到水膜与生物膜的表面及内部,才能发生生物氧化作用。
1. 菲克(Fick)第一扩散定律[2]物质通过它们的分子活动而互相渗透的现象称为分子扩散。
分子扩散可以藉四种推动力而产生:浓度梯度、压力梯度、作用力差及温度梯度。
它们分别称为常扩散、压力扩散、强制扩散及温度扩散。
菲克(Fick)第一扩散定律是关于稳定状态下的分子扩散的定律。
所谓稳定状态下的分子扩散,是指浓度梯度不随时间而变化的分子扩散过程,且所有气液传质简化模型,都只考虑垂直于界面方向的单向传质,即一维扩散模型。
假定由A 和B 两组分组成的流体中,流体是静止的(即无主体流动),在整个垂直扩散方向(先考虑一个方向,z 方向)的平面上其浓度是均一的。
实验表明分子扩散速率与扩散方向上的浓度梯度成正比,即dzdc D N AABAB -= (1) 式中,AB N -组分A 在B 中的分子扩散速率,即单位时间内通过垂直于扩散方向的单位截面积的组分A 的摩尔数;AB D -组分A 在B 中的扩散系数。
曝气技术中氧传质影响因素的实验研究的开题报告

曝气技术中氧传质影响因素的实验研究的开题报告
一、研究目的
曝气技术是污水处理中常用的一种废水处理技术,其过程中气体与水之间的氧传质过程对于曝气效果及水体处理效果至关重要。
本实验旨在探究曝气技术中氧传质的影响因素,为提高污水处理的效率提供理论支持。
二、研究内容
1.研究不同溶氧度、不同温度对氧传质的影响。
2.研究气泡大小、速度、密度以及水流状态对氧传质的影响。
3.分析水体化学成分和表面张力、溶解氧、粘度等参数对氧传质的影响。
三、研究方法
1.实验设备:曝气釜、溶氧仪、温度计、氧气瓶、水循环系统等。
2.实验流程:将具有不同化学成分、温度、气泡大小、密度,水流状态的水样,放入曝气釜中进行曝气处理。
实验过程中测量溶氧度,记录气泡大小、速度、密度等参数。
3.数据处理:对实验数据进行统计分析,绘制出氧传质的影响因素与氧传质速率的关系图。
四、预期成果
通过对曝气过程中氧传质影响因素的研究,本实验将得出影响氧传质速率的主要因素和它们之间的相互关系。
与目前主流的模型相比,本实验结果更加丰富、更具针对性,可以帮助工程师更好地设计新的曝气设备,提高曝气效率以及水体处理效果。
五、可能的研究难点
实验过程中需要控制不同变量,使得实验结果更加准确。
同时,曝气设备的设计和构造也需要经验丰富的工程师参与并保障设备稳定运行。
因此,实验难度较大,需要充分的准备和保障。
4-3a曝气原理
∵ R=rV, R=rV,
∴
R为传递到曝气池的总氧量[㎏O2/h]
R0= RCs(20)/α(βρCs(T)-CL)·1.024(T-20) 1.024(T-
• 而EA= (R0 /S) ·100%, S=Gs·21%·(32/22.4)=0.3 Gs S—供氧量[㎏/h]; Gs —供气量[m3/h];
R—传递到曝气池的总氧量 [㎏O2/h]
S—供氧量[㎏/h];
• 由于R受污水水质、水温、气压等因素影响, 难以比较各种曝气装置的性能,故引入“标准 脱氧清水”的概念, EA =R0/S • 标准脱氧清水—1atm、20℃、CL=0的清水,设标 准脱氧清水的氧转移量为R0 ,则: R0= KLa(20)(Cs(20)-CL)·V
• 式中:Csb-鼓风曝气池内混合液溶解氧饱和度的 平均值mg/L; Cs-在大气压力条件下,氧的饱和度,mg/L; Pb-空气扩散装置出口处的绝对压力Pa,其值 等于下式:
Pb=P+9.8×103H
• H-空气扩散装置的安装深度,m; • P—大气压力,P=1.013×105Pa
• 气泡在离开池面时,氧的百分比按 上式求定: 式中 EA—空气扩散装置的氧利用 率,一般在5%一10%之间。
2.水温
• 水温对溶解氧饱和度Cs值也产生影响, Cs 值因温度上升而降低,KLa 值因温度上 升而增大,但液相中氧的浓度梯度却有 所降低。因此,水温对氧转移有两种相 反的影响,但并不能两相抵消。总之, 水温降低有利于氧的转移。 • 在运行正常的曝气池内,当混合液 在15~30℃范围内时,混合液溶解氧浓 度C能够保持在1.5~2.0mg/L左右。最 不利的情况将出现在温度为30~35℃的 盛夏。
• (3) 在气膜中存在氧的分压梯 度,在液膜中存在着氧的浓度梯 度,它们是氧转移的推动力。 • (4) 氧难溶于水,因此,氧 转移决定性的阻力又集中在液膜 上,因此,氧分子通过液膜是氧 转移过程的控制步骤,通过液膜 的转移速度是氧转移过程的控制 速度。
水污染控制工程-第三版-部分要点整理

水污染控制工程-第三版-部分要点整理第十二章第一节基本概念活性污泥法本质上与天然水体自净过程类似,都是好氧生物过程,只是活性污泥法净化强度大,有人工的因素在里面。
污泥泥龄:污泥泥龄是指曝气池中微生物细胞的平均停留时间。
活性污泥的组成:有活性的微生物(Ma);微生物自身氧化残留物(Me);媳妇在活性污泥上不能被微生物所降解的有机物(Mi);无机悬浮固体(Mii)。
活性污泥性状:活性污泥是粒径在200~1000μm的类似矾花状不定性的絮状物。
混合液悬浮固体浓度(MLSS):指曝气中池中单位体积混合液中活性污泥悬浮固体的质量,也称之为污泥浓度,它包括(Ma、Me、Mi、Mii)。
混合液挥发性悬浮固体浓度(MLVSS):是指混合液悬浮固体中有机物的质量,它包括(Ma、Me、Mi)。
一般污水处理厂曝气池混合液的MLVSS/MLSS在0.7~0.8.污泥沉降比:污泥沉降比是指曝气池混合液静止30min后沉淀污泥的体积分数,通常采用1L的两桶测定污泥沉降比。
污泥体积指数(SVI):是指曝气池混合液沉淀30min后,单位之恋干泥形成的是污泥体积,常用单位也mL/g。
SVI=沉淀污泥的体积/MLSS。
SVI在100~150时,污泥沉降性能能娘好活性污泥法基本流程:主线是进水——曝气池——沉淀池——出水。
分线沉淀池污泥回流至进水处,同时剩余污泥量排出。
活性污泥降解有机物的过程分为:吸附阶段和稳定阶段。
吸附阶段:主要是污水中的有机物转移到活性污泥上。
稳定阶段:主要是转移到活性污泥上的有机物被微生物所利用。
耗氧量可以反映污水中有机物的浓度,耗氧量的下降就是有机物浓度的降低。
耗氧量和BOD5下降量相同时说明污水中取出的有机物已经全部被微生物所利用。
如果不相等,则两者之差就绪昂党羽尚未被微生物所利用的那部分有机物。
第二节活性污泥的发展曝气池实质是一个反应器,他的池型与所需的水力特征级反映要求密切相关,主要分为推流式、完全混合式、封闭环流式和序批式四大类。
曝气的原理; 曝气系统的计算方法; 主要的曝气设备

C ——物质浓度; y ——扩散过程的长度 dC/dy ——浓度梯度,即单位长度上的浓度变化值。 物质的扩散速率与浓度梯度呈正比关系。
Fick定律
如果以 M 表示在单位时间 t 内通过界面扩散的物质数 量,以A表示界面面积,则有:
dM vd = ( )/ A dt
dM dC = −DL A dt dy
曝气的原理与过程:
实际供氧量=?× 标准供氧量
标准供氧量即曝气设备的技术指标:标准状态下测定,即: 1atm,20°C,清水
实际供氧量即曝气池实际运行时所需的供氧量:实际状态下, 即:实际大气压与曝气头安装水深, 实际水温, 实际的废水水质
空气 O221% N279%
压 力、 气量
曝气的原理与过程(1)
dC A = K L (Cs − CL ) dt V
式中: dC/dt ——液相主体溶解氧浓度变化速率(或氧转移速率),kgO2/m3.h; KL——液膜中氧分子传质系数,m/h。
KL = DL / yL
双膜理论
由于气液界面的面积难于计量,一般以氧总转移系数 A K (KLa)代替 L V :
dC = KLa ⋅ (Cs −CL) dt
第四节
曝气的原理、方法与设备
曝气的原理; 曝气系统的计算方法; 主要的曝气设备
有关曝气、供氧的基本概念
曝气的作用:供氧、搅拌 曝气的方式:鼓风曝气、机械表面曝气♠ 曝气的原理与过程:需氧、供氧、(供)曝气; 标准供氧量与实际供氧量
压力、 气量
空气 O221% N279%
曝气的原理与过程:
O2<21% N2>79% DO=1~2mg/L CO2/H2O
式中: dM/dt ——氧传递速率,kgO2/h; DL——氧分子在液膜中的扩散系数,m2/h; A ——气、液两相接触界面面积,m2; (Cs−CL)/yL——在液膜内溶解氧的浓度梯度,kgO2/m3.m;
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
本章重点: (1)亨利定律;(2)气一液传质过程中的液膜与气膜的阻力问题、相似准数; (3)吹脱塔设计。
第四章 传质及曝气1.传质的定义:传质是质量传递的简称。
凡是由于某种推动力(driving force )所引起的物质分子或流体微元(fluid element )的运动都称为传质。
区别于物质的输送,其包括了分子扩散和物质迁移。
2.传质的条件:化学反应的发生都包含了传质过程,两种反应物质必须运动到相接触才能发生反应。
3.传质的内容:(1)在静止介质中的分子扩散,(2)在层流流体中的分子扩散,(3)在自由紊动液流中的漩涡扩散,(4)在两相间的传质。
4.传质的应用:越过相间传质更具重要性。
如水处理的曝气工艺。
5.曝气的目的:(1)在水中加入氧气等一类气体,即气体吸收。
(2)去除水中所溶解的挥发性气体,即空气吹脱。
§4.1 亨利定律1.水溶液的亨利定律一般物理化学的亨利定律是 P A =k A x A 。
(4-1) 对水溶液则变换为:c A =H A p A (4-2)式中:H A 为亨利常数的另一形式,单位为mol/L·Pa , 其表达式为H A =Ak 49.55 (4-3);c A 代表气体A 的物质量的浓度;p A 代表气体A 在气相总压力p 中所占的分压,以Pa 计。
水处理中可能遇到的气体的k A 和H A 值见表4-1。
氧气和氮气的亨利常数k A 随分压的变化数值见表4-2。
表4-1 亨利常数表4-2 亨利常数随分压的变化其中表1与2中的k和H的单位分别为atm和mol/L∙atm,一般计算中按1atm=0.1Mpa表4-3 常见的挥发性化合物的亨利常数△H ○一与K 值当污染物在水中溶解所产生的焓变化不受温度的影响时,亨利常数K A 与温度间的关系可表示为下列公式:lgk A =RTH Θ∆-+K (4-4)R —摩尔气体常数,T —热力学温度,△H ○一—A 溶于水中产生的焓变化,J/mol,K —常数。
表4-3列出了一些水中的挥发性化合物的亨利常数和相应的△H ○一与K 值。
§4.2 气—液传质模型用数学模型来描述传质过程,常用有:(1)1926年由Whitman 提出的双膜理论,(2)1935年由Higbie 提出的浅渗理论,(3)1951年由Danckwerts 提出的表面更换理论。
图4-1是Nernst 的单膜模型,在膜内,由于浓度差,物质由界面的浓度c i 传递到主体浓度c b ,则出现了阻力问题。
传质的阻力可类比于电阻来理解。
在浓度差相等的情况下,膜越薄阻力也就越大。
1.双膜理论气体向液体内传递的双膜理论概念如图4-2,以氧气和水做气液体为例。
氧气在气相内的分压p b ,在界面上的分压为p i.。
在界面的气相一侧有一层厚度为δg 的气膜。
界面上氧浓度为c i ,相应于p b 的 氧气浓度为c *(c *=Hp b )。
在界面的另一侧存在一层厚度为δt 的水膜。
水内氧气的主体浓度为c b ,相应的氧气分压为P *(c b *=Hp *)。
由于膜很薄,膜内浓度及压力的变化都按直线关系表示。
双膜模型做了三个假定:A.在气—水交界面的两边各有一层不动的膜;B.氧的传递过程是稳定的,即通过气膜通量与通过水膜的通量是相等的;C.在交界面上,气与水立即达到平衡状态。
由气膜一侧来表示氧的通量N O 为N O =k g (P b -P i ) (4-5)式中k g —推动力(p b -p i )与通量No 间的比例常数,即气膜的传质系数,量纲为摩尔/面积·时间·大气压。
式4-5可改成下列形式:gi 0)K H P P H N b -=( (4-6)式中H —亨利定律常数。
由式4-6知Hp b =c *, Hp i =c i , 即分子项代表了一个浓度差,因此分母H/k g 相当于一个阻力,称为气膜的阻力。
在水膜内,氧的通量仍为N O ,但用水膜的参数可表示为N 0=k 1(c i -c k ) (4-7)式中k 1—水膜的传质系数,量纲为长/时间。
同样得知1/k 1表示液膜内的阻力。
当N 0用mol/cm 2·s 表示,浓度用mol/cm 3表示时,k 1的单位为cm/s 。
由亨利定律关系进一步推导得出N 0=K L (c *-c b ) (4-8)式中 gg L k H k k K +=11k (4-9)K L 为总传质系数,量纲为长度/时间。
由式4-9得 11k 1k k k H K g g L +==11k k H g + (4-10) 式中,l/K L 代表总阻力,H/k g 及1/k 1分别代表气膜及水膜的阻力,即总阻力为两者之和,这是双膜理论的基本点。
按分压差写通量可得 N 0=k 1 (Hp i -HP *)=k g ( p b - p i ) 得出 :P 1=gPb g k H k H k P k ++1*1代入4-4得 N O =K g (p b -p *) (4-11) 式中:K g =gk Hk k H +11g k (4-12)K g 也称总传质系数,单位为摩尔/面积·时间·大气压,与k g 的单位一样。
比较式(4-12)与式(4-9)可得K L =HK g (4-13)从式(4 – l0)可k g 看出,当k g 很大,使式(4- l0)中气膜的阻力项H/k g 可以忽略时,式(4-8)的右边变成k 1(c *一c b ),即水膜的阻力控制了整个传递过程,氧气在水中的传递即属于这种情形。
2.浅渗理论此理论的基本点是在气液相重复短暂的接触中不可能达到稳态。
图4-3所示即为浅渗模型。
如图中假定有一宽度为W 的水膜沿固体表面向下流动,流速v z 的分布也示于图中(注意这里指的是流动的水膜,不是传质阻力的水膜)。
水膜外面气体的浓度为恒量c *,气体在水膜内只扩散一个很浅的距离,使水膜内的主体浓度为c b 。
仍然用氧气来做气体的例子。
在y 方向只有由于浓度差所产生的扩散通量No,y 。
在z 方向扩散通量为零,只有由于水流所产生的对流通量No,z 。
写体积微元W △y △z 的物料衡算方程得tzW W N y W N ro z W W N y W N y y z O O ∂∂∆∆+∆+∆=∙∆∆+∆+∆∆+∆+cy z ,y z 0z ,y ,0z , (4-14) 在图4-3所表示的概念中,氧气是在传递到固体表面后才由于反应而消耗掉的,在水膜内氧气不发生反应,式(4 - 14)中的r o 应为零。
在z 方向的对流通量是由于流速v z 所产生的,但v z 在z 方向无变化,因此式(4- 14)中的N 0,z 与N o,z+△z 应该相等。
把这些关系代人式(4 - 14)后,以W △y △z 除两边,并令△y→0得0cy ,=∂∂+∂∂tyN O (4-15) 由Fick 定律的式(2-15),并略去x A 得 N O ,y = - Dyc∂∂ 代入上式得 22ycD t c ∂∂=∂∂ (4-16) 微分方程的边界条件为: (a)当t=0、y>0时,c=c b(b)当t>0时,y=0,c=c *,y =∞.c=c b(4-16)微分方程以用拉式变换求解比较方便,也可用变数组合的方法解,解如下为Dtyerf Dt y erfc c c c c b b 212*-==-- (4-17) 式中erf[y/(2)Dt ]称为误差函数,erfc[y/(2Dt )]称为补余误差函数,表达式是erf⎰-=Dtd e Dty 21222ξπξ (4-18)利用式(4-17)、(4-18)及上式可得y=0时的浓厚梯度:t])21(!21)t 2121[2)(|*04523*0y D c c y Dt y D Dt c c y c b y b ππ--=⋯+-+--=∂∂==(因此得气体的通量为N O = - D()()b *0c c t D y c cy -=∂∂=π (4-19) 浅渗模型认为传质是一个瞬变过程,应求在极短时间t c 内的平均通量0N :)(t 2)(t 1**0cb cb t Oc c D dt c c t D N c-=-=⎰ππ (4-20) 扩散距离y 与浓度c 随时间t 变化的关系可由式(4- 17)得出(因此产生阻力的水膜厚度也是时间t 的函数,并在时间t c 达到最大值),如以D=1.0×l0-5 cm 2/s (空气在水中的扩散系数为2.5 x l0-5 cm 2/s )代入计算,则得图4-4。
从圈4-4可看出,在气水接触时间t 极短的情况下。
扩散进水膜中的距离y 也是极小的。
当t =0.l s 时,y=.0.0035 cm ,如果水膜厚lmm ,扩散的深度只有它的3.5%。
这就是把英语penetration theory 译称浅渗理论的原因。
如果把式4-20与4-7比较,可得下列关系:tDk t 12π= (4-21)3.表面更换理论它是浅渗理论的一个发展,认为因水膜中的水存在一种紊动混合状态,传递物质的表面不可能是固定不变的(以气泡为例,同时也因为它是不断向上运动的,接触表面当然要不断改变),应该是由无数的接触时间不同(0→∞)的面积微元组成的,这些面积微元在相应的接触时间内所传递的质量总和,才是真正的传质量。
通量应按这个概念来计算。
图4-5按表面更换理论表示出通过1 cm 2所传递的气体量,即画出了通量No 的计算方法。
如果每个面积微元的传质量分别为n l ,n 2,n 3,…,n ∞,则得这个1 cm 2的传质量(即通量)N 0等于n 1+n 2+…+n ∞=∑n,如图中所示。
表面更换理论进一步假设这些面积微元的表面龄(surface age )分布函数Φ(t )为:t r s se r t -=)(φ (4-22)故得:⎰∞φ(t)dt=10s =⎰∞-dt e r t r s(4-23)分布函数中的r s 为一常数。
若计算时间增加△t 后,传递面积的增加量△a n 与原来面积a n 的比值就得:t r er te r t t t t t t t t t t t t t t a a s t r s t r s n n s s ∆-=∆-=∆=-∆+=∆∆-∆∆+=∆--2)()(')()()()()()(φφφφφφφφ(4-24) 式中:r s 为一常数,故在选定△t 后,r s △t 也是常数,它是传递面积随时间增量△t 而减少的分数,即时间每增加-△t ,面积就减少100r s △t%。
式4-24又可写成常数=-=∆∆s nr ta /a n (4-25) 此式相当于常数)(=-=∆∆s r tt )t (/φφ (4-26)上式的几何意义如图4-6可知是一个一级反应的公式,r s 相当于速率常数,量纲为时间-1。
