符合Amsterdam-I标准的遗传性非息肉病性结直肠癌家
在我们身边的林奇综合征

在我们身边的林奇综合征家族史是结直肠癌患病风险的最重要影响因素之一,大约1/3的结直肠癌患者有家族史.一个家族中出现多个结直肠癌患者,可能是因为存在共同的环境和或遗传易感因素。
林奇综合征(LS)是一种常染色体显性遗传疾病,患者易患各种类型的癌症,包括结直肠癌(患病风险70%~80%)、子宫内膜癌(EC)(50%~60%)、胃癌(13%~19%)、卵巢癌(9%~14%)、小肠癌、肝癌、胆道癌、输尿管癌以及肾盂移行细胞癌等等。
林奇综合征的致癌倾向源于一组错配修复蛋白的基因结构的改变,失活的错配修复蛋白导致基因组中的微卫星高度不稳定性,随着时间的推移,微卫星以及基因组其他部位突变的积累可以影响细胞内重要功能蛋白的数量或活性,从而引起肿瘤的发生。
林奇综合征相关的癌症与散发性癌症相比,具有不同的病理及临床特征,因此治疗与管理也与散发性癌症有所不同,所以对林奇综合征的鉴别诊断也就显得非常重要。
既往该病的诊断主要依赖于家族史,但由于现在的家庭逐渐趋于小型化、家系成员居住分散化、癌前病变接受内镜治疗增加等相关因素导致该病容易漏诊。
据估计,全世界每279个人就有1人患林奇综合征,但是有95%的林奇综合征患者不知道他们的诊断。
因此,最为重要的是,我们应尽一切可能来诊断林奇综合征患者。
为了将林奇综合征筛选出来,国内外的学者们先后提出了多个筛查标准。
(1)阿姆斯特丹Ⅰ(AmsterdamⅠ)标准:这是第一个林奇综合征的筛查标准,它于1990首次提出,需要同时满足以下 4 项:(1)家系中至少有3个人确诊结直肠癌,其中一个为另外两个的一级亲属;(2)至少累及2代;(3)其中1个发病年龄<50岁;(4)排除家族性息肉病。
(2)阿姆斯特丹Ⅱ(AmsterdamⅡ)标准:与阿姆斯特丹Ⅰ标准的区别就在于把结直肠癌换成了林奇综合征相关肿瘤,所有林奇综合征相关肿瘤都可用于筛查林奇综合征。
与阿姆斯特丹Ⅰ标准相比,Ⅱ的漏诊率降低了很多,但是仍然高达62.5%~68%;特异性也只有约50%。
遗传性非息肉病性结直肠癌诊断试验Meta分析研究

【 关键词 】 遗传性非息 肉病性结直肠癌
பைடு நூலகம்
Me 分析 t a
错 配修 复
免疫组 织化学
微 卫星不稳定
行数 据整 理 与绘 图 , P≤0 0 . 5表 示 有 统 计 学 意义 。采
用诊 断 试验 的 描述 性 分 析 、R C 分 析 , SO z检 验 , 以及 诊断 试验 对数优 势 比估计 等 。
结 果
(灵敏度与特异度被报道或者能够被计算出来 ; 1 )
() 试验 的金标 准是 gr iemuao ; ) 2诊断 eml ttn ( 能够获 取 n i 3
占所 有大肠 癌 的 5 ~1 % H P C 与一 般 散 发 % 5 。 ; N C
tt n分 析 显示 h H1 h H ai o ML 、MS 2蛋 白 , I 测 中所 MS 检
包 含 的 5个标 志物 ( AT 5 B T 6 D S 4 , 2 1 3 B 2 , A 2 , 5 36 D S 2 , D1 S 5 ) I G— N C 组 织 所 推 荐 的。 当 上 述 标 720 为 C H P C 准 不满 足或者 条 件不清 楚 的文献 , 于剔除 。 予 3 绘 制 S OC曲线及 准确性 、 算对 数优势 比 . R 计 将 敏感度 ( P 和 1特 异 性 ( P 作 线 性 变换 , T R) . F R) 建立 S O R C线性 回归 模 型 】D= : A+B× , 中 D 为 S其
据 =1 一l ( 尺 [ ^ +
遗传性非息肉病性结直肠癌一大家系报告
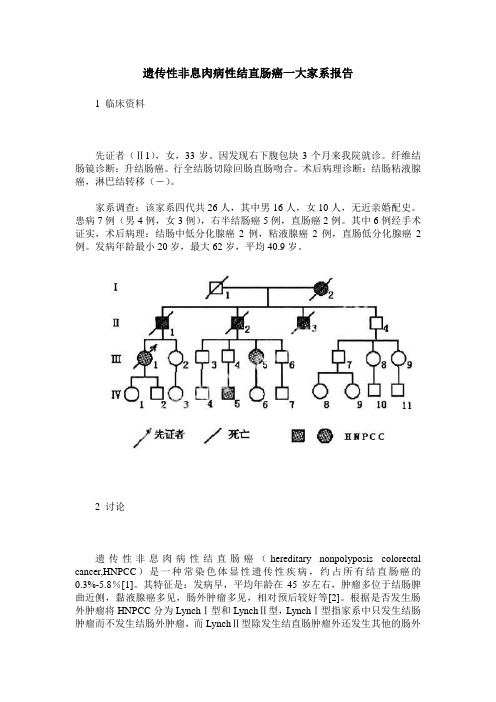
遗传性非息肉病性结直肠癌一大家系报告1 临床资料先证者(Ⅱ1),女,33岁。
因发现右下腹包块3个月来我院就诊。
纤维结肠镜诊断:升结肠癌。
行全结肠切除回肠直肠吻合。
术后病理诊断:结肠粘液腺癌,淋巴结转移(-)。
家系调查:该家系四代共26人,其中男16人,女10人,无近亲婚配史。
患病7例(男4例,女3例),右半结肠癌5例,直肠癌2例。
其中6例经手术证实,术后病理:结肠中低分化腺癌2例,粘液腺癌2例,直肠低分化腺癌2例。
发病年龄最小20岁,最大62岁,平均40.9岁。
2 讨论遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer,HNPCC)是一种常染色体显性遗传性疾病,约占所有结直肠癌的0.3%-5.8%[1]。
其特征是:发病早,平均年龄在45岁左右,肿瘤多位于结肠脾曲近侧,黏液腺癌多见,肠外肿瘤多见,相对预后较好等[2]。
根据是否发生肠外肿瘤将HNPCC分为LynchⅠ型和LynchⅡ型,LynchⅠ型指家系中只发生结肠肿瘤而不发生结肠外肿瘤,而LynchⅡ型除发生结直肠肿瘤外还发生其他的肠外肿瘤如子宫内膜癌、胃癌、卵巢癌、膀胱癌等。
1991年成立的HNPCC国际合作组织(ICG-HNPCC)制定了HNPCC诊断标准,即所谓的AmstendamⅠ标准[3]。
HNPCC-ICG于1999年修订了Amsterdam标准,称为Amsterdam标准Ⅱ[4]。
目前已经确认HNPCC的遗传学基础是错配修复基因(mismatch repair genes,MMR)突变,已经克隆出的错配修复基因有hMLH1、hMSH2、hMSH6、hPSM1、hPSM2、hMSH3 和hMSH5,其表达产物为错配修复蛋白,是一种核酸水解蛋白,可以水解DNA复制过程中错配的碱基,从而保证DNA的精确复制。
如果该基因突变,DNA复制错误增加,出现微卫星(MSI)不稳定而导致大肠癌和其他肠外肿瘤的增加。
遗传性结直肠癌的基因诊断及治疗进展

等[1引就提出,预防性结直肠切除适用于确定携带 万方数据
表2不同肿瘤部位Lynch综合征患者的治疗及预后
等¨叫通过对患者的脑胶质瘤病灶与结肠癌病灶检
癌的发病年龄(约55岁)晚于CFAP的发病年龄(约 39岁)…1,AFAP肠外肿瘤的发病风险低于CFAP。
Turcot综合征和Gardner综合征为FAP的2个特殊 类型,有其特殊的临床表现(表1)。FAP为常染色
测,结果显示,二者具有相对应的MSH:和MSH。突
分子水平对HNPCC的理解,Amsterdam标准已不能 适应HNPCC的筛选和诊断。以后又制订了 Bethesda标准,将肠外肿瘤也列入了HNPCC的范畴,
遗传性结直肠癌的分类方法繁多,美国国家综 合癌症网(National
Comprehensive Cancer Network,
NCCN)结直肠癌筛查指南认为主要包括:遗传性非 息肉病性结直肠癌(hereditary non—polyposis eoloreetal cancer,HNPCC)、经典型家族性腺瘤性息
肉病(classical
familial adenomatous polyposis,
但该标准还不能包括所有I-INPCC患者。2003年中国 抗癌协会结直肠癌专业委员会针对我国具体国情, 提出了中国人HNPCC家系筛查标准口J。 三、基因遗传学
1.HNPCC:HNPCC的基因遗传为常染色体显
CFAP)、衰减型家族性腺瘤性息肉病(attenuated
familial adenomatous
polyposis,AFAP)、MUTYH相关
性息肉病(MUTYH—associated polyposis,MAP)、P—J
综合征(Peutz—Jeghers syndrome,PJS)、幼年息肉综 合征(juvenile
遗传性非息肉性结直肠癌诊疗进展

遗传性非息肉性结直肠癌诊疗进展【关键词】遗传性非息肉性结直肠癌诊疗进展遗传性结直肠癌在所有结直肠癌患者中大约占5%~10%,其中遗传性非息肉性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)也称Lynch综合征,是最常见的一种遗传性结直肠癌综合征,约占全部结直肠癌的1%~5%。
HNPCC在我国并未引起足够的重视,常常漏诊。
随着科学技术的进步以及分子遗传学的快速发展,我国的结直肠癌专家们也开始注意到HNPCC,正确认识HNPCC的发病特点、遗传学特征以及临床治疗方法对有效防治结直肠癌有十分重要的意义。
在发现和处理结直肠癌患者的同时,应该想到如何鉴别散发性结直肠癌和HNPCC,因为此病的临床表现及处理与一般的大肠癌有所不同,而且有利于发现患者家族中的现症患者和即将发生的患者,及时采取积极的防治措施,降低结直肠癌的发病率。
1 病因及发病机制HNPCC在西方国家报道较多,据文献统计,约占结直肠癌的0.3%~5.8%[1],国内有关HNPCC的报道较少,约占同期收治结直肠癌的2.4%。
综合世界各地报道,HNPCC约占所有结直肠癌的1%~5%[2]。
目前认为HNPCC的产生和多种因素所导致的错配修复基因(mismatch match repair genes,MMR)基因突变有关。
由于HNPCC家族的前几代人患胃癌较多,而胃癌的发生被认为是与饮食习惯关系最密切的恶性肿瘤,所以有人认为:HNPCC和饮食习惯关系最为密切。
MMR基因突变使得MMR蛋白表达缺失并造成了DNA重复序列(也称微卫星位点,microsatellites site)的修复错误,从而导致患者DNA出现微卫星不稳定(microsatellites instability,MSI),MSI是HNPCC的基因标志[3]。
文献报道含有MMR基因突变的患者较未突变者更容易发生结肠腺瘤,并且发现年龄提前,腺瘤多位于近侧结肠且较大,多为绒毛状或伴有高度不典型增生等癌前病变表现[4],而结肠腺瘤恶变是HNPCC家族患者患结肠癌的主要途径。
lynch综合征诊断标准

Lynch综合征,也被称为遗传性非息肉性结直肠癌综合征(HNPCC),是一种遗传性的癌症综合征,主要与结直肠癌和其他消化道癌症的发生相关。
Lynch综合征是由一些基因突变引起的,主要是MLH1、MSH2、MSH6和PMS2等DNA错配修复基因的突变。
诊断Lynch综合征通常需要满足一系列的标准。
根据Amsterdam I和Amsterdam II标准以及Bethesda指南,以下是Lynch综合征的主要诊断标准:
1、个人层面标准:
●早发结直肠癌:患者应为50岁以前发生结直肠癌。
●家族病史:患者的一级或二级亲属中,应有3代中至少有2例结
直肠癌或其他相关肿瘤(如子宫内膜癌、卵巢癌、胃癌、小肠癌、上尿路癌等)。
2、分子遗传学标准:
●检测错配修复基因:对患者进行MLH1、MSH2、MSH6、PMS2等
错配修复基因的遗传检测,确认是否存在突变。
如果患者符合上述个人层面和分子遗传学标准,且排除了遗传性息肉病(如FAP),则可以被诊断为Lynch综合征。
遗传性非息肉病性大肠癌3家系15例分析

[关键词] 遗传性非息肉病性大肠癌;预防性结肠次全切除术;全结直肠切除术;错配修复基因;筛查
[中图分类号] R735.3+4
[文献标志码] B
遗传性非息肉病性大肠癌(hereditary nonpolypo- sis colorectal cancer,HNPCC)是一种常染色体显性遗 传综合征,又称 Lynch 综合征[1],其发生率至少占结 直肠癌 (colorectal cancer,CRC)的 5%~10%。根据有 无肠外肿瘤分为无肠外肿瘤型(Lynch I 型)和有肠 外肿瘤型(Lynch II 型)。HNPCC 家系中的遗传受累 者体细胞中的错配修复基因发生杂合性缺失 , 导致 细胞的错配修复基因功能下降或缺失, 最终导致肿 瘤的发生[2-3]。为研究 HNPCC 特征,从 2003 年~2012 年收集 3 个典型家系共 15 例病例,现结合文献对其 病病因、临床特征、诊断治疗及预后分析如下。
1 资料与方法
1.1 一 般 资 料 收治遗传性非息肉病性大肠癌 3 个家系 15 例患者,以同期住院手术、无家族史的原 发性大肠癌 60 例作为对照。搜集全部病例的临床和 病理资料,对所有大肠癌患者进行随访 40~60 个月。 诊断标准如下:1990 年国际 HNPCC 协作组 Ams- terdam 标准[4]规定,患者需同时具备 3 个条件:(1)家 族中至少有 3 例组织病理学证实大肠癌患者,其中 1 例必须是另外 2 例的一级亲属,须除外家族性腺 瘤病。(2)大肠癌必须是累及连续的两代人。(3)至少 有 1 例大肠癌患者发病早于 50 岁。1993 年日本提 出新的修改标准[5]:符合以下二组标准之一者皆可诊 断为本病。(1)家族中一级亲属中有 3 个或 3 个以上 大肠癌患者。(2)家族中有 2 个大肠癌者伴有以下情
遗传性非息肉病性结直肠癌中COX-2的表达及与MMR基因表达的分析

toewt MM oiv xr s n wt s ttays n cn df ecs ( =7 5, . 9 P<0 5 Cr li hs i R p si epe i , i t ii l i i at i rne X h te so h asc l g f f i e 2 . 7 5 3, 3 0 . ) o e tn 0 . r ao
An l sso ay i fCOX- x r si n a d M M R e e e p e so n h r d t r o 2 e p e so n g n x r s i n i e e ia y n n-
p l po i o o e t lc nc r o y ssc l r c a a e
遗 传 性 非 息 肉病 性 结 直 肠 癌 (ee i r o plp s hrdty n n oy oi a s clrca a crHN C 是常 染 色 体显 性 遗 传 综 合 征 , ooet c n e , P C) l 与错
情 况及 两者 的关 系 , 探讨遗 传性 非 息 肉病 性 结直 肠 癌 的发 为
e pes nrt f O 2( =11 6 P<00 ) C n lso h NP C w sl e a es oa i clrca c ne x rsi e0 X一 r . , o a C 7 . . o cu inT eH C a w rt nt p rdc ooetl a cri 5 o h h n
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
随访
基因治疗(Gene therapy ) :指应用DNA 重组技术,将外源正常基因导入靶细胞, 以纠正或补偿因基因缺陷和异常引起的疾 病,以达到治疗的目的。
免疫基因治疗 自杀基因治疗 针对原癌基因及抑癌基因的治疗 反义基因治疗 抗肿瘤血管形成基因治疗 RNA 干扰技术 联合基因治疗
中国医科大学附属第四医院 胃肠外科 李晓霞
遗传性非息肉病性结直肠癌(hereditary nonpolyposis colorectal cancer, HNPCC)是一 种显性遗传综合征,具有结直肠癌(CRC)发病风 险增高、外显率接近80%、确诊年龄早等特征。 HNPCC占全部CRC的5-10%。 HNPCC也引起子宫内膜癌、胃癌、卵巢癌、肾癌、 输尿管癌、小肠癌以及肝胆管癌的发病风险增高。
Ⅰ Ⅱ
1 2 3
1 CC
2
4 CC78
5 CC50
CC
CC48
1
Ⅲ
2
肺心病 66
3
4
5
6 CC25
7
8
9
10
11 EndC CC49 宫颈癌53 40
12
13 EndC 40
14
15
16
17
18
RC53
CC60
RC53
CC26
CC
Ⅳ
CC 41 CC 40 CC 48 CC 55 CC52 22 2 23 24 25 26 3 27 28 29
肿瘤Gene治疗是人们十分关注的问题,进行了 广泛的探索。研究发现,肿瘤浸润淋巴细胞— —TIL,它积聚肿瘤部位,并在该处持续存在而 无副作用,利用此特点协助治疗肿瘤。
①IL-2 Gene ②TNF-Gene (白介2) (肿瘤坏死因子) 逆转录病毒载体 导入 TIL(体外培养的自体细胞) 回植患者体内 TIL进入自体肿瘤部位,提高细胞因子杀伤肿瘤细胞的作用。
为选择和确定合适的家族进行分子研究,近年来先 后推出了不同的指南。 Amsterdam标准-I(AC-I)
◦ 亲属中≥3个患有组织学证实的CRC,其中1人必须是另2 人的1级亲属; ◦ 肿瘤必须累及连续2代人; ◦ 必须至少1人确诊年龄<50岁; ◦ 除外家族性腺瘤性息肉病。
Amsterdam标准-II(AC-II)
1
2
3
4
5 2 2
6 2
7
8
9
10 2
11
12
13
14
15 2
16
17
18 2
19
20 3
21
RC 20
CC48 CC48
注: CC:结肠癌; RC:直肠癌 ; GC:胃癌 ; EC:食管癌 ;SC:皮肤癌; EndC:子宫癌 ; LivM: 肝转移; OC:卵巢癌 ; BT:脑瘤 ; LC:肺癌 ; GbC:胆囊癌 ; HC:肝癌; PC:胰腺癌; BT (bladder carcinoma)膀胱癌; cervix子宫颈; Death:死亡 ; AH:急性肝炎
①MLH1-Gene
②MSH2-Gene
逆转录病毒载体 导入 TIL(体外培养的自体细胞)
回植患者体内
TIL进入自体肿瘤部位,产生错配修复蛋白,从而 发挥错配修复的功能,防止肿瘤的发生。
先证者
检 测 治疗流 程
采集家系
符合 Amsterdam 标准
免疫组化及 PCR方法 检测MMR Gene MSH2 MSH6 MLH1 PMS2
基因治疗的研究与实践中存在若干重 要问题,所以更多的是处于研究阶段, 临床应用还有待深入。
体细胞Gene治疗符合伦理道德,没有争议。 生殖细胞Gene治疗可能改变正常人的遗传特征,存在 某些争议。然而生殖细胞的基因治疗又是一个不容回 避的课题,因为它比体细胞基因治疗更为彻底。所以, 随着分子生物学技术的发展,Gene治疗技术的成熟,
DNA水平
蛋白水平
分子水平
确定突变基因
测序
预防性手术
基因治疗
遗传门诊咨询
在FAP患者,APC基因的失活启动了结直肠癌沿正 常黏膜-增生-腺瘤-癌的多阶段多步骤发生模式发 展,Ki-ras、TP53、MCC等重要癌基因和肿瘤抑 制基因先后变异。 舒林酸(sulindac),一种非甾体类抗炎药 (nonsteroidal antiinflammatory drugs, NSAIDs)和结肠息肉消退有关 。
XR ,患者凝血因子Ⅸ缺乏,Ⅸ因子基因定位在
Xq26.3~q27.2。临床表现,易出血,凝血时间
长,轻伤、小手术后常出血不止。发病率为
1/30000。
例如:我国学者薛京伦实施的FⅨ的基因治疗。
逆转录病毒载体 +FⅨcDNA
重组体 5` LTR FⅨ neo SV PSO LTR 3`
①导入仓鼠细胞(CHO )→FⅨ表达; ②导入乙型血友病患者皮肤成纤维细胞(体外培养)→FⅨ表 达; ③91年,导入乙型血友病患者皮肤成纤维细胞(体外培养) →回植病人皮下→FⅨ基因表达,FⅨ基表达水平达正常人 的5%。 是我国基因治疗成功的例子。
MLHl MSH2
MSH6
PSM2
1、直接基因治疗:纠正突变基因
在原位修复缺陷的基因,以达到治疗目的。为较理
想的基因治疗策略,由于存在某些问题,目前正在努 力之中。(未实现)
2、间接疗法: 以正常的基因替代致病基因。 导入外源正常基因,代替有缺陷的基因。而对 靶细胞而言,没有去除或修复有缺陷的基因。 用DNA重组技术设法修复患者细胞中有缺陷的 错配修复基因,使细胞恢复正常功能而达到治疗 HNPCC的目的。
MSI检测
◦ 检测5个微卫星位点:BAT-26、BAT-25、D2S123、 D5S346和D17S250
MMR蛋白表达检测
◦ 检测4个MMR蛋白表达:MLH1,MSH2,MSH6,PMS2
甲基化检测
◦ MLH1启动子甲基化检测
基因突变检测
◦ 点突变检测 ◦ 大片中的直肠癌建议行全结直肠切除回肠储袋肛管 吻合术(IPAA); ◦ HNPCC家系中结肠癌和结肠进展期腺瘤建议行全结肠切除 回直吻合术(IRA); ◦ 不建议对HNPCC家族的遗传受累者进行预防性全结直肠切 除。 ◦ 20~25岁开始,每2年1次结肠镜检测; ◦ 30~35岁开始1~2年1次女性生殖器官检查检查,,而且 1~2年应进行1次胃及十二指肠镜检查、腹部超声检查和 尿细胞学检查。
研究更有效 ,更安全的载体将是下一阶段的研究 重点。 RNAi 技术能够同时抑制多个不同基因而且抑制 效果互不干扰 ,这将使肿瘤基因治疗的效果更理 想。
家族中至少有3例以上患HNPCC相关癌(结直肠癌、子宫内 膜癌、胃癌、卵巢癌、小肠癌、输尿管和肾盂癌、脑癌、胆 管癌、皮肤癌 )
目前为止已经确定与HNPCC相关的MMR基因有 MLHl、MSH2、MSH6、PSM2。 MMR基因的产物是错配修复蛋白,通过在DNA复 制过程中修复错配的碱基使DNA能精确复制,保证 人类遗传的保守性和稳定性。 当MMR基因发生突变,错配修复蛋白的表达量下降、 不表达或出现截短,对DNA复制过程中发生的缺失 和插入不能校正或纠错,引起基因组DNA不稳定, 从而导致DNA重复序列长度的改变,即所谓的微卫 星不稳定性(MSI)。
1、复合免疫缺陷综合征的基因治疗
(人类Gene治疗成功例子) ADA缺乏症-——致死性疾病,患者由于腺苷酸脱
氨酶(ADA)缺乏。
ADA-Gene + vector (逆转录病毒) 重组分子 患者T Ly C 导入 细胞生长分裂 10天 IL-2刺激C分裂
Gene表达
回输患儿体内 1~2月治疗一次, 10个月 患儿体内ADA水平达正常人的25%
将回答伦理道德方面的问题,相信生殖细胞的基因治
疗将会被人们接受。
针对患者个体情况 ,采用联合基因治疗结合传统 的手术、 放疗或化疗的综合治疗措施。 将抗血管生成基因治疗在大肠癌早期阶段得到及 时应用。 运用基因抑制预防性治疗大肠癌高危人群(如家族 性非息肉病性结直肠癌) ,将成为预防大肠癌发生 发展的重要手段。
