2、经典名方制剂政策解读
基于玉屏风散相关专利分析的经典名方中药复方制剂知识产权保护策略思考

Strategic Thinking on Intellecteal Property Rights Protection of Classical Representative Famous Prescrinhont Based on Patene Analysis of Yupingfeeg Powder DAI Wei, WANGJi-yog"
China Natiooal cf Traditiooal Chinese Medine Co. , Lti. , Beijing 100195 , China
+ AbstraC:] Classical representative famous prescriptions" CRFP) is a kind of traditional prescription, which is widely app.ied, haMobeiouMtusaeieeeeeteand setosded in TCM C.aMitM.In ehipapes, ehepaeeneapp.itaeionMoeYupingeengPowdes weeeMoeted and eeained in oedeetoana.oaetheapp.itation teend, .ega.MtatuM, app.itant and agent , and thetontent.Take YupingaengPowdeeaoeeaamp.e, thepapeeana.oaed thepeeMentMituation and peob.emMoaCRFPpatentpeotettion.On thibaMi , tombined with tu eentpo.itieMand eegu.ationM, theinte.ettua.peopeetoeightpeotettion MteategooatheCRFPtombiningpatent, teadeMeteetand Mtandaed ipeopoMed, whith peoeideMaeeaeeenteaoetheinte.ettua.peopeetoeightpeotettion oatheCRFP.
中药经典名方复方制剂的申报资料要求

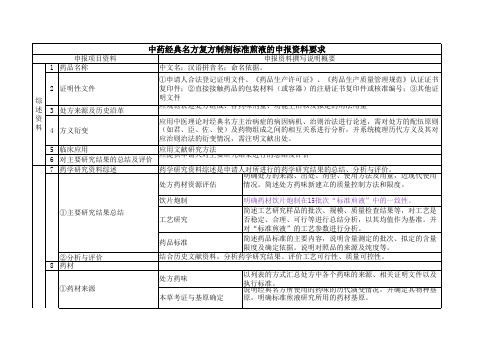
附件3中药经典名方复方制剂的申报资料要求(征求意见稿)一、申报资料工程(一)综述资料1. 药品名称2. 证明性文件3. 处方来源及历史沿革4. 方义衍变5. 临床应用6. 对主要研究结果的归纳总结及评价7. 药品说明书样稿、起草说明及参考文献8. 包装、标签设计样稿(二)药学研究资料9. 药学研究资料综述9.1 主要研究结果归纳总结9.2 分析与评价9.3 “规范煎液”规范10. 药材10.1 处方药味10.2 药材资源评估10.3 药材的质量评价10.4 药材的检验报告书10.5 参考文献11. 饮片炮制11.1 药材产地加工11.2 炮制方法及参数的确定11.3 质量评价11.4 参考文献12. 工艺研究12.1 处方12.2 制法12.3 剂型及产品组成12.4 生产工艺研究资料12.5 工艺验证12.6 参考文献13. 非临床安全性实验用样品14. 药品规范研究14.1 药品规范概述14.2 药品规范工程14.3 关注事项14.4 化学成分研究14.5 质量研究14.6 样品检验报告书14.7 参考文献15. 稳定性研究15.1 稳定性归纳总结15.2 稳定性研究数据15.3 包装材料的选择15.4 上市后的稳定性研究15.5 参考文献(三)非临床安全性研究资料16. 非临床安全性研究资料综述17. 安全药理学实验资料及文献资料18. 单次给药毒性实验资料及文献资料19. 重复给药毒性实验资料及文献资料20. 过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性、依赖性等主要与局部、全身给药相关的特殊安全性实验资料和文献资料21. 遗传毒性实验资料及文献资料22. 生殖毒性实验资料及文献资料23. 致癌实验资料及文献资料24. 依赖性实验资料及文献资料二、申报资料撰写说明(一)综述1. 药品名称药品名称包括:①中文名;②汉语拼音名;③命名依据。
来源于古代经典名方的中药复方(以下简称“经典名方”)制剂的药品名称原则上应与古代医籍中的方剂名称相同。
中药经典名方复方制剂标准煎液的申报资料要求
③质量研究
④标准正文
⑤样品检验报告书 ⑥参考文献
②饮片炮制质量评价
质量评价指标
标准 ③参考文献 药 学 研 究 10 “标准煎液”的制备 资 料
提供饮片的检验报告书。 提供引用文献和文件的出处 经典名方制剂“标准煎液”的制备,原则上以古籍中记载的制备方法为依据制备。应固定 方法、设备、工艺参数和操作规程,建立相应过程控制方法,通过出膏率、含量测定、指 纹图谱或特征图谱等确保“标准煎液”批间质量基本一致及可追溯。经典名方中所有药学 研究均需须与“标准煎液”取得一致,由不少于15批原料饮片,经煎煮、浓缩(干燥)等 过程分别制得15批“标准煎液”,以其均值作为基准。 煎煮 每煎使用的饮片为日用生药量。研究固定饮片前处理方法、饮 片的破碎程度、煎煮次数、加水量、煎煮时间等相关参数的参 考值,且实验报告和申报材料中应当注明研究过程。 加强研究浓缩、干燥方法对物料关键质量属性的影响,在确定 方法的基础上研究各工艺参数对物料化学属性、物理属性的影 响,固定各项工艺参数,最终确定方法、设备、工艺参数和操 作规程。
开展药材、饮片以及“标准煎液”的质量概貌研究,从出膏率、含量测定、指纹图谱或特 征图谱等综合考虑药材-饮片-“标准煎液”的相关性,确定该药材的关键质量属性,据此 建立相应的质量评价指标和评价方法,确定科学合理的药材质量标准。 饮片的质量评价指标通常包括定性指标(如药材来源、基原、 性状、有效/指标成分等)和定量指标(如有效/指标成分含 量,水分、杂质、农残、重金属和有害元素、真菌霉毒等外源 污染限量等);与炮制工艺相关相关的质量评价内容包括建立 饮片质量一致性评价方法,以表征饮片批间一致性高低和建立 工艺关键过程参数、过程质控指标体系,对工艺流程、炮制设 备、生产设施以及原辅料等实施控制。 经典名方制剂使用饮片应根据原方出处记载的炮制方法进行炮 制,并应符合现行版《中国药典》炮制通则的有关规定。
古代经典名方中药复方制剂的申报资料要求(征求意见稿)

古代经典名方中药复方制剂的申报资料要求(征求意见稿)一、申报资料项目(一)综述资料1. 药品名称2. 证明性文件3. 沟通交流及研究者信息4. 研究结果综述5. 药品说明书样稿及起草说明6. 包装、标签设计样稿(二)药学研究资料7. 药学研究综述8. 药材9. 饮片10. 对应实物11. 经典名方制剂12. 药品标准13. 稳定性14. 检验报告15. 其他资料16. 参考文献(三)非临床安全性研究资料二、申报资料正文及撰写要求(一)综述资料1. 药品名称古代经典名方中药复方制剂(以下简称经典名方制剂)的名称包括:中文名、汉语拼音名。
制剂的药品名称原则上应当与已公布的《古代经典名方目录》中对应的方剂名称相同。
2. 证明性文件证明性文件包括:申请人合法登记证明文件复印件;所用辅料及直接接触药品的包装材料(或容器)的注册证书复印件或登记号;国家相关法律法规要求提交的其他证明性文件复印件。
3. 沟通交流及研究者信息3.1 沟通交流信息申请前若与审评机构进行过沟通交流,应提供沟通意见建议以及相关情况说明。
3.2 研究者信息提供主要研究人员(包括负责工艺、药品标准等研究的专家及项目负责人)的信息,包括姓名、工作单位、在相关研究中的作用等。
若申请人独立研制,应说明。
4. 研究结果综述对主要研究结果进行总结,综合评价所申报经典名方制剂的安全性、有效性及质量的可控性。
5. 药品说明书样稿及起草说明5.1 说明书样稿提供拟定的药品说明书样稿。
申请人应按照确定的经典名方物质基准及经典名方说明书撰写要求,结合经典名方制剂的非临床安全性研究资料及其他相关研究完善说明书有关内容。
5.2 起草说明提供药品说明书的起草说明。
应根据品种的特点、经典名方制剂非临床安全性等相关研究整理完善说明书相关信息。
6. 包装、标签设计样稿应提供按有关规定起草的包装、标签设计样稿。
(二)药学研究资料7. 药学研究综述总结制剂用药材的产地、采收期、产地初加工、生产方式及质量要求,简述药材资源评估情况。
关于古代经典名方中“粗末”的考证

关于古代经典名方中“粗末”的考证姜云耀 '刘楠2(1.清华大学药学院中药研究院北京100084; 2.北京盈科瑞药物安全有效性研究有限公司北京102206)摘要:经典名方是我国中药方剂的瑰宝,是历代医家临床实践经验的汇总,凝聚了中医药几千年的智 慧。
为了更好的发掘和使用这些资源,国家不断出台相关政策,促进古代经典名方的发展:,由于古代医籍 中对方剂细节记栽的缺乏,在开展古代经典名方的研究中会遇到各种细小而又没有明确答案的问题,“粗 末”就是其中之一。
本研究以散剂中的药物状态“粗末”为研究对象,通过查阅和研究古今相关文献资料,分 析粗末的最佳粒径范围,为中药散剂和经典名方的研究工作提供理论依据和参考。
通过研究发现,2 ~ 4 m m 的粒径范围符合大多数研究者对粗末的定义,现代研究结果也证实了这一粒径范围中药的优势。
因此,可 将2 ~ 4 mm的粒径范围作为古代经典名方中“粗末”的标准。
关键词:经典名方煮散粗末粒径范围粉碎doi: 10.11842/wst.20190705008 中图分类号:R289 文献标识码:A2018年4月,国家中医药管理局发布了《古代经典 名方目录(第一批)》。
古代经典名方是我国中药方剂 的瑰宝,是历代医家临床实践经验的汇总,凝聚了中 医药人几千年的智慧。
关于古代经典名方的解释,最 早见于国家食品药品监督管理局发布的《中药注册管 理补充规定》,文中提出“来源于古代经典名方的中药 复方制剂,是指目前仍广泛应用、疗效确切、具有明显 特色与优势的清代及清代以前医籍所记载的方剂。
”《中华人民共和国中医药法》对古代经典名方作出明 确定义:“是指至今仍广泛应用、疗效确切、具有明显 特色与优势的古代中医典籍所记载的方剂。
”《中医药 法》同时明确,生产符合国家规定条件的来源于古代 经典名方的中药复方制剂,在申请药品批准文号时,可以仅提供非临床安全性研究资料。
2018年发布的 《古代经典名方中药复方制剂简化注册审批管理规 定》再次提出,符合要求的经典名方制剂申请上市,可 仅提供药学及非临床安全性研究资料,免报药效学研 究及临床试验资料。
中药注册管理专门规定

中药注册管理专门规定第一章总则第一条为促进中医药传承创新发展,遵循中医药研究规律,加强中药新药研制与注册管理,根据《中华人民共和国药品管理法》《中华人民共和国中医药法》《中华人民共和国药品管理法实施条例》《药品注册管理办法》等法律、法规和规章,制定本规定。
第二条中药新药研制应当注重体现中医药原创思维及整体观,鼓励运用传统中药研究方法和现代科学技术研究、开发中药。
支持研制基于古代经典名方、名老中医经验方、医疗机构配制的中药制剂(以下简称医疗机构中药制剂)等具有丰富中医临床实践经验的中药新药;支持研制对人体具有系统性调节干预功能等的中药新药,鼓励应用新兴科学和技术研究阐释中药的作用机理。
第三条中药新药研制应当坚持以临床价值为导向,重视临床获益与风险评估,发挥中医药防病治病的独特优势和作用,注重满足尚未满足的临床需求。
第四条中药新药研制应当符合中医药理论,在中医药理论指导下合理组方,拟定功能、主治病证、适用人群、剂量、疗程、疗效特点和服药宜忌。
鼓励在中医临床实践中观察疾病进展、证候转化、症状变化、药后反应等规律,为中药新药研制提供中医药理论的支持证据。
第五条来源于中医临床实践的中药新药,应当在总结个体用药经验的基础上,经临床实践逐步明确功能主治、适用人群、给药方案和临床获益,形成固定处方,在此基础上研制成适合群体用药的中药新药。
鼓励在中医临床实践过程中开展高质量的人用经验研究,明确中药临床定位和临床价值,基于科学方法不断分析总结,获得支持注册的充分证据。
第六条中药注册审评,采用中医药理论、人用经验和临床试验相结合的审评证据体系,综合评价中药的安全性、有效性和质量可控性。
第七条中药的疗效评价应当结合中医药临床治疗特点,确定与中药临床定位相适应、体现其作用特点和优势的疗效结局指标。
对疾病痊愈或者延缓发展、病情或者症状改善、患者与疾病相关的机体功能或者生存质量改善、与化学药品等合用增效减毒或者减少毒副作用明显的化学药品使用剂量等情形的评价,均可用于中药的疗效评价。
中药的经典名方复方制剂的申报
附件3中药经典名方复方制剂的申报资料要求(征求意见稿)一、申报资料项目(一)综述资料1. 药品名称2. 证明性文件3. 处方来源及历史沿革4. 方义衍变5. 临床应用6. 对主要研究结果的总结及评价7. 药品说明书样稿、起草说明及参考文献8. 包装、标签设计样稿(二)药学研究资料9. 药学研究资料综述9.1 主要研究结果总结9.2 分析与评价9.3 “标准煎液”标准10. 药材10.1 处方药味10.2 药材资源评估10.3 药材的质量评价10.4 药材的检验报告书10.5 参考文献11. 饮片炮制11.1 药材产地加工11.2 炮制方法及参数的确定11.3 质量评价11.4 参考文献12. 工艺研究12.1 处方12.2 制法12.3 剂型及产品组成12.4 生产工艺研究资料12.5 工艺验证12.6 参考文献13. 非临床安全性试验用样品14. 药品标准研究14.1 药品标准概述14.2 药品标准项目14.3 关注事项14.4 化学成分研究14.5 质量研究14.6 样品检验报告书14.7 参考文献15. 稳定性研究15.1 稳定性总结15.2 稳定性研究数据15.3 包装材料的选择15.4 上市后的稳定性研究15.5 参考文献(三)非临床安全性研究资料16. 非临床安全性研究资料综述17. 安全药理学试验资料及文献资料18. 单次给药毒性试验资料及文献资料19. 重复给药毒性试验资料及文献资料20. 过敏性(局部、全身和光敏毒性)、溶血性和局部(血管、皮肤、粘膜、肌肉等)刺激性、依赖性等主要与局部、全身给药相关的特殊安全性试验资料和文献资料21. 遗传毒性试验资料及文献资料22. 生殖毒性试验资料及文献资料23. 致癌试验资料及文献资料24. 依赖性试验资料及文献资料二、申报资料撰写说明(一)综述1. 药品名称药品名称包括:①中文名;②汉语拼音名;③命名依据。
来源于古代经典名方的中药复方(以下简称“经典名方”)制剂的药品名称原则上应与古代医籍中的方剂名称相同。
古代经典名方中药复方制剂申报资料要求
古代经典名⽅中药复⽅制剂申报资料要求附件2古代经典名⽅中药复⽅制剂的申报资料要求(征求意见稿)⼀、申报资料项⽬(⼀)综述资料1. 药品名称2. 证明性⽂件3. 沟通交流及研究者信息4. 研究结果综述5. 药品说明书样稿及起草说明6. 包装、标签设计样稿(⼆)药学研究资料7. 药学研究综述8. 药材9. 饮⽚10. 对应实物11. 经典名⽅制剂12. 药品标准13. 稳定性14. 检验报告15. 其他资料16. 参考⽂献(三)⾮临床安全性研究资料⼆、申报资料正⽂及撰写要求(⼀)综述资料1. 药品名称古代经典名⽅中药复⽅制剂(以下简称经典名⽅制剂)的名称包括:中⽂名、汉语拼⾳名。
制剂的药品名称原则上应当与已公布的《古代经典名⽅⽬录》中对应的⽅剂名称相同。
2. 证明性⽂件证明性⽂件包括:申请⼈合法登记证明⽂件复印件;所⽤辅料及直接接触药品的包装材料(或容器)的注册证书复印件或登记号;国家相关法律法规要求提交的其他证明性⽂件复印件。
3. 沟通交流及研究者信息3.1 沟通交流信息申请前若与审评机构进⾏过沟通交流,应提供沟通意见建议以及相关情况说明。
3.2 研究者信息提供主要研究⼈员(包括负责⼯艺、药品标准等研究的专家及项⽬负责⼈)的信息,包括姓名、⼯作单位、在相关研究中的作⽤等。
若申请⼈独⽴研制,应说明。
4. 研究结果综述对主要研究结果进⾏总结,综合评价所申报经典名⽅制剂的安全性、有效性及质量的可控性。
5. 药品说明书样稿及起草说明5.1 说明书样稿提供拟定的药品说明书样稿。
申请⼈应按照确定的经典名⽅—2 —物质基准及经典名⽅说明书撰写要求,结合经典名⽅制剂的⾮临床安全性研究资料及其他相关研究完善说明书有关内容。
5.2 起草说明提供药品说明书的起草说明。
应根据品种的特点、经典名⽅制剂⾮临床安全性等相关研究整理完善说明书相关信息。
6. 包装、标签设计样稿应提供按有关规定起草的包装、标签设计样稿。
(⼆)药学研究资料7. 药学研究综述总结制剂⽤药材的产地、采收期、产地初加⼯、⽣产⽅式及质量要求,简述药材资源评估情况。
古代经典名方中药复方制剂申报资料要求
附件2古代经典名方中药复方制剂的申报资料要求(征求意见稿)一、申报资料项目(一)综述资料1. 药品名称2. 证明性文件3. 沟通交流及研究者信息4. 研究结果综述5. 药品说明书样稿及起草说明6. 包装、标签设计样稿(二)药学研究资料7. 药学研究综述8. 药材9. 饮片10. 对应实物11. 经典名方制剂12. 药品标准13. 稳定性14. 检验报告15. 其他资料16. 参考文献(三)非临床安全性研究资料二、申报资料正文及撰写要求(一)综述资料1. 药品名称古代经典名方中药复方制剂(以下简称经典名方制剂)的名称包括:中文名、汉语拼音名。
制剂的药品名称原则上应当与已公布的《古代经典名方目录》中对应的方剂名称相同。
2. 证明性文件证明性文件包括:申请人合法登记证明文件复印件;所用辅料及直接接触药品的包装材料(或容器)的注册证书复印件或登记号;国家相关法律法规要求提交的其他证明性文件复印件。
3. 沟通交流及研究者信息3.1 沟通交流信息申请前若与审评机构进行过沟通交流,应提供沟通意见建议以及相关情况说明。
3.2 研究者信息提供主要研究人员(包括负责工艺、药品标准等研究的专家及项目负责人)的信息,包括姓名、工作单位、在相关研究中的作用等。
若申请人独立研制,应说明。
4. 研究结果综述对主要研究结果进行总结,综合评价所申报经典名方制剂的安全性、有效性及质量的可控性。
5. 药品说明书样稿及起草说明5.1 说明书样稿提供拟定的药品说明书样稿。
申请人应按照确定的经典名方—2 —物质基准及经典名方说明书撰写要求,结合经典名方制剂的非临床安全性研究资料及其他相关研究完善说明书有关内容。
5.2 起草说明提供药品说明书的起草说明。
应根据品种的特点、经典名方制剂非临床安全性等相关研究整理完善说明书相关信息。
6. 包装、标签设计样稿应提供按有关规定起草的包装、标签设计样稿。
(二)药学研究资料7. 药学研究综述总结制剂用药材的产地、采收期、产地初加工、生产方式及质量要求,简述药材资源评估情况。
医药行业中药经典名方研发方案
医药行业中药经典名方研发方案第一章研发背景与目标 (2)1.1 研发背景 (2)1.2 研发目标 (2)第二章中药经典名方筛选与评估 (3)2.1 名方筛选标准 (3)2.2 名方评估方法 (3)2.3 名方筛选与评估流程 (4)第三章研发团队与资源配置 (4)3.1 研发团队组建 (4)3.1.1 团队定位与目标 (4)3.1.2 团队成员选拔与配置 (4)3.2 资源配置规划 (5)3.2.1 人力资源配置 (5)3.2.2 设备资源配置 (5)3.2.3 资金资源配置 (5)3.3 研发团队培训与管理 (5)3.3.1 团队培训 (5)3.3.2 团队管理 (5)第四章中药提取与制备工艺 (6)4.1 原材料选择与处理 (6)4.2 中药提取工艺优化 (6)4.3 制剂制备工艺研究 (6)第五章药效学研究 (7)5.1 药效评价模型建立 (7)5.2 药效指标筛选与分析 (7)5.3 药效学研究方法 (7)第六章安全性评价 (8)6.1 急性毒性试验 (8)6.2 慢性毒性试验 (8)6.3 药物相互作用研究 (9)第七章药效物质基础研究 (9)7.1 药效物质筛选与鉴定 (9)7.1.1 药材来源与质量评价 (9)7.1.2 药效物质提取与分离 (9)7.1.3 药效物质鉴定 (9)7.2 药效物质含量测定 (10)7.2.1 标准曲线制备 (10)7.2.2 样品处理与测定 (10)7.3 药效物质作用机制研究 (10)7.3.1 药效物质对靶点的作用 (10)7.3.2 药效物质在体内的代谢过程 (10)7.3.3 药效物质与生物体的相互作用 (10)7.3.4 药效物质的综合评价 (10)第八章药品注册与审批 (10)8.1 注册申请资料准备 (10)8.2 审批流程与要求 (11)8.3 注册申请策略 (12)第九章市场前景分析与营销策略 (12)9.1 市场需求分析 (12)9.2 市场竞争分析 (13)9.3 营销策略制定 (13)第十章项目管理与风险控制 (13)10.1 项目进度管理 (13)10.1.1 进度计划制定 (13)10.1.2 进度监控与调整 (14)10.2 风险识别与评估 (14)10.2.1 风险识别 (14)10.2.2 风险评估 (14)10.3 风险控制与应对措施 (15)10.3.1 风险控制 (15)10.3.2 风险应对措施 (15)第一章研发背景与目标1.1 研发背景现代医学的快速发展,中医药在预防和治疗疾病方面的重要性逐渐被重视。
