北大有机化学课件15-缩合反应
guareschi-thorpe缩合反应

一、概述在有机化学领域,缩合反应是一类重要的反应类型,它可以使两个或更多的化合物结合在一起形成一个更大的分子。
在缩合反应中,通常会伴随着水等小分子的生成,因此与加成反应形成鲜明对比。
本文将详细介绍guareschi-thorpe缩合反应的基本原理、机理和应用。
二、guareschi-thorpe缩合反应的基本原理guareschi-thorpe缩合反应是一种由Italian chemistathanasius Giovanni Guareschi和British chemistReginald W. Thorpe于1979年首次提出的缩合反应。
该反应可以使酰胺、醇和卤代烷烃等化合物在酸性条件下发生缩合,生成脂肪酰胺。
guareschi-thorpe缩合反应的基本原理是通过酸催化使酰胺和醇发生亲核加成反应,然后再通过质子转移和脱水作用将生成的中间体转化为脂肪酰胺。
三、guareschi-thorpe缩合反应的机理guareschi-thorpe缩合反应的机理主要包括以下几个步骤:1.酸催化的亲核加成:在酸性条件下,酰胺中的羰基与醇中的羟基发生亲核加成反应,形成过渡态。
2.质子转移:过渡态中的负离子被质子转移,形成更稳定的中间体。
3.脱水:经过质子转移后的中间体失去一个水分子,生成最终的脂肪酰胺产物。
四、guareschi-thorpe缩合反应的应用guareschi-thorpe缩合反应在有机合成中具有广泛的应用价值,主要体现在以下几个方面:1.合成脂肪酰胺:guareschi-thorpe缩合反应可以高效地合成脂肪酰胺,这对于生物医药领域中的化合物合成具有重要意义。
2.合成聚合物:guareschi-thorpe缩合反应可以作为聚合物的合成方法之一,通过引入脂肪酰胺单体来构建具有特定结构和性能的聚合物。
3.合成功能性化合物:guareschi-thorpe缩合反应还可以用于合成具有功能性的有机化合物,如具有生物活性的分子和功能性材料等。
第三章缩合反应CondensationReaction课件

(2) 酸催化的反应机理: (酸催化应用不多)
O RH2C C R' + HA
RH2C
OH C R'
OH RH2C C R' + A
OH -H
RH2C C R'
OH RHC C R'
OH RHC C R'
RH2C
OH C R' + RHC
限速步骤
OH C R'
OH
OH
RH2C C HC C R'
O
慢
C H + OH
O
O
CH CH2 C H
O
CH2 C H
快
+O
CH3 C H
+ 快
H2O
OH
O
CH3 CH CH2 C H + OH
H2O
O
CH3CH CH2 CH
3
4
5
对于活性醛,反应温度 较高或催化剂的碱性较 强,有利于进行消除脱
水得α, β-不饱和醛
NaOH 25℃
OH CHO
CHO
H3CO
H3CO OCH3
Ph OCH3
OCH3 OCH3
30
二、不饱和烃的α-羟烷基化反应(Prins反应)
1、定义与反应过程
在酸催化下,甲醛(等其它醛)和烯烃加成得到1,3-二醇 或进一步和甲醛反应生成环状缩醛(1,3-二氧六环)的反应称 为Prins(甲醛-烯加成)反应。
CH2O + H
CH2OH
13
CH3CH2CHO + (CH3)2CHCHO
NaOH 25 oC
CH3 H3CH2CHC C CHO
【基础有机化学】第15章 碳负离子缩合反应

Na2CO3
O -H2O
OH O
2 醛和酮的交叉缩合 两种不同的醛、酮之间发生的羟醛缩合 反应称为交叉的羟醛缩合反应。
有两种情况 (1)一种醛或酮有-H,另一种醛或酮无-H。 (2)两种醛酮都有-H。(在定向缩 合反应中讨论。)
HCHO +
K2CO3 (CH3)2CHCH2CHO
(CH3)2CHCHCHO
R CH -CO 2
O C CH3
α烃基化反应时宜采用伯卤代烃。因叔卤烃在碱性 条件下易发生消除反应,仲卤烃也因伴随有消除 反应而产率低,芳卤代烃则由于很不活泼而难反 应。
• 在合成中常利用乙酰乙酸乙酯的酮式分解制备
甲基酮:
O
O
OO
(1)C2H5ONa
H
H3C C
CH2
C OC2H5 (2)n-C4H9Br
OH C CH(R) 烯醇式
O H-B C CH(R)
OH C CH(R) 烯醇式
缩合反应
15.3 缩合反应简述 将分子间或分子内不相连的两个碳原子连接 起来的反应通称为缩合反应
无机酸、碱、盐或醇钠、醇钾是常用的缩合剂 缩合往往需要经过加成、消除、取代等过程。
15.4、羟醛缩合反应
(1)定义: 有-H的醛或酮在酸或碱的作用下,缩合生成-
O
O
O
O
OO
C2H5ONa H3C C CH2 C OC2H5
H3C C CH
C OC2H5 R-X
H H3C C C
C OC2H5
R
O
(1)OH /H2O
(2)H+/ -CO2 R CH2 C CH3
R
C2H5ONa R-X
OR O
有机化学缩合反应175页PPT

谢谢!
61、奢侈是舒适的,否则就不是奢侈 。——CocoCha nel 62、少而好学,如日出之阳;壮而好学 ,如日 中之光 ;志而 好学, 如炳烛 之光。 ——刘 向 63、三军可夺帅也,匹夫不可夺志也。 ——孔 丘 64、人生就是学校。在那里,与其说好 的教师 是幸福 ,不如 说好的 教师是 不幸。 ——海 贝尔 65、接受挑战,就可以享受胜利的喜悦 。——杰纳勒 尔·乔治·S·巴顿
有机化学缩合反应
1、合法而稳定的权力在使用得当时很 少遇到 抵抗。 ——塞 ·约翰 逊 2、权力会使人渐渐失去温厚善良的美 德。— —伯克
3、最大限度地行使权力总是令人反感 ;权力 不易确 定之处 始终存 在着危 险。— —塞·约翰逊 4、权力会奴化一切。——塔西佗
5、虽然权力是一头固执的熊,可是金 子可以 拉着它 的鼻子 走。— —莎士 比
有机化学缩合反应

反应不可逆
O
C
H
RO
C
酯
强碱
O CC
RO
R' X
O
C
R'
RO
C
缩合反应
应予以考虑的问题: ➢ 反应的活性问题(一般酮和酯类化合物 α 氢的酸性不够强,
须强碱作用,反应条件较为苛刻) 。 ➢ 反应的区位选择性问题(不对称酮有两种反应位置)。 ➢ 酮或酯的自身缩合问题(醇醛缩合和Claisen缩合)
例1: O
否则会发生酯 交换而开环.
(2)草酸酯
OO
O
H5C2O C C OC2H5 + H CH2COC2H5 EtONa H2O
缩合反应
OO
O
HO- H+
H5C2O C C CH2COC2H5
175 oC
O
O
H5C2O C CH2COC2H5
丙二酸酯
OO HO C C CH2COOH
OO HO C C CH3
缩合反应
第十五章 缩合反应(1)
主要内容
▪ 酯的缩合反应(Claisen缩合,Dieckmann缩合,交叉 酯缩合),酯缩合反应机理
▪ 酮的酰基化 ▪ 酮或酯的酰基化反应在合成中的应用 ▪ b - 二羰基化合物的互变异构现象 ▪ 酮和酯类化合物 a 位的烷基化
一.复习:烯醇负离子及其部分反应
O
R' C CHR
CH2CH2CH3
例 2 (反合成分析)
a
a CO2C2H5
bO
b
缩合反应
a
原料易得
2 CH3(CH2)3CO2C2H5 合成方便
O
O
b
有机合成化学:第六章 缩合反应
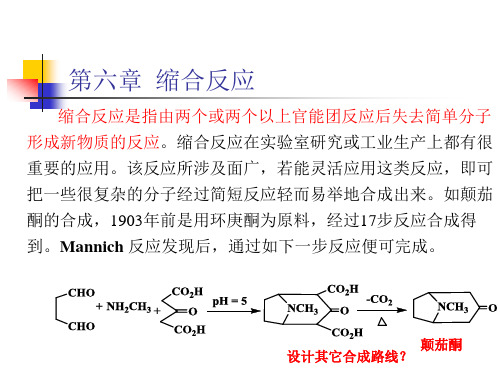
第六章 缩合反应
上例是由于选择不同的起始原料,而选择不同的合成路线,使 产品成本大大降低。如果没有很好的路线选择时,可以通过优化 反应条件,提高产物的收率,降低成本。从产品收率上讲,能提 高1-5%。我们可能认为没什么意义,可对企业讲,产品成本会降 低2-8%左右。如果一个产品产值上亿时,可估算一下其价值了。 所以,一个化工产品刚上市时价格较高,随着生产时间延长,价 格逐渐降低,很大可能是由于生产工艺和生产条件的改变所致。
-CO2
CH3CH CH2CO2H
H3C
O O O
60~76%
CH3NO2 + H3CCH
C H
CO2C2H5
NaOC2H5 CH3CH CH2CO2C2H5
55%
CH2NO2
第六章 缩合反应 CH3
CN
PhCH CO2C2H5 + H2C
C H
CN
KOH 83%
CN
PhC CH2CH2CN CO2C2H5
LDA
H3C
CH3
第六章 缩合反应
羰基化合物烷基化最大负反应是O-烷基化产物。如:
副产物
第六章 缩合反应
LDA CH3(CH2)3CO2CH3 BrCH2CH
CH2
CH3CH2CH2CH CO2CH3 CH2CH CH2
LDA
CH2CH3
C2H5Br CH3CH2Байду номын сангаас CO2CH3
可以分步引入
90%
5. Knoevenagel反应:
这类反应的特点是一个亚甲基上连接两个吸电子基团,使
得其氢活性明显提高,反应较易进行。一般使用弱碱 (有机胺)
《北京大学有机化学》ppt课件

醇的化学性质
醇分子中的羟基具有亲核 性,可发生氧化反应、酯 化反应等。
酚
酚的分类与命名
根据羟基所连苯环的不同,酚可 分为一元酚和多元酚等。
酚的物理性质
多数酚为无色或淡黄色晶体,具有 特殊气味,微溶于水,易溶于有机 溶剂。
酚的化学性质
酚分子中的羟基和苯环相互影响, 使得酚具有一些特殊的化学性质, 如酸性、氧化反应等。
硝基化合物
硝基化合物是一类含有硝基(-NO2)的有机化合 物,具有爆炸性、氧化性和毒性等性质。硝基化合 物在炸药、染料和药物等领域具有广泛的应用。
酰胺类化合物
酰胺类化合物是一类含有酰胺基(-CONH2)的有 机化合物,具有较高的稳定性和广泛的应用。酰胺 可以通过羧酸和胺的缩合反应制备。
重氮化合物
重氮化合物是一类含有重氮基(-N=N-)的有机化 合物,具有较高的反应活性和广泛的应用。重氮化 合物可以通过重氮化反应制备,并可用于合成染料、 药物和农药等。
《北京大学有机化学》 ppt课件
目 录
• 课程介绍与教学目标 • 烃类化合物 • 卤代烃与醇酚醚类化合物 • 醛酮醌类化合物及其衍生物 • 羧酸及其衍生物和含氮化合物 • 周环反应与有机合成策略 • 实验技能培养与实验操作规范
01
课程介绍与教学目标
有机化学概述
有机化学定义
研究有机化合物结构、性质、合成、 反应机理及应用的科学。
06
周环反应与有机合成策略
周环反应概述
周环反应定义
分子内共价键重排导致的环状过渡态的形成和断 裂,实现原子或基团的迁移。
周环反应类型
包括电环化反应、环加成反应、σ键迁移反应等。
周环反应特点
反应过程中,原子或基团的迁移是通过环状过渡 态实现的,不涉及自由基或离子中间体。
缩合反应的定义

缩合反应的定义缩合反应的定义缩合反应是一种化学反应,通过将两个或多个分子结合成一个更大的分子来形成新的化学物质。
这种化学反应通常涉及到碳-碳键或碳-氮键的形成。
缩合反应在有机化学中非常常见,可以用于制备各种重要的有机分子,例如药物、天然产物和高分子材料。
一、缩合反应的分类1. 羧酸缩合反应:羧酸缩合反应是一种通过羧酸官能团之间的反应来形成酰亚胺键和酯键的缩合反应。
这种反应通常需要催化剂存在,并且需要在适当条件下进行。
2. 醛和酮缩合反应:醛和酮缩合反应是一种通过亲核加成来形成新的碳-碳键或碳-氧键的方式。
这种类型的缩合反应通常需要在弱碱性条件下进行,并且还需要催化剂存在。
3. 亚胺和亚胺盐缩合反应:亚胺和亚胺盐缩合反应是一种通过亲核加成来形成新的碳-氮键或双键的方式。
这种类型的缩合反应通常需要在弱酸性或弱碱性条件下进行,并且还需要催化剂存在。
二、缩合反应的机理缩合反应的机理通常涉及到两种或多种官能团之间的反应。
这些官能团可以是羧酸、醛、酮、亚胺和亚胺盐等。
在反应过程中,亲核试剂通常会攻击一个电子不足的中心,例如羰基碳或芳香环上的亚硝基。
这种攻击会导致一个新的化学键的形成,从而形成一个更大的分子。
三、缩合反应在有机合成中的应用缩合反应在有机合成中非常重要,可以用于制备各种重要有机分子。
例如:1. 醛和酮缩合反应可以用于制备α,β-不饱和酮。
2. 羧酸缩合反应可以用于制备β-内酰胺。
3. 亚胺和亚胺盐缩合反应可以用于制备各种各样的含氮杂环化合物。
4. 缩合反应还可以用于制备高分子材料,例如聚乙烯醇。
四、总结综上所述,缩合反应是一种化学反应,通过将两个或多个分子结合成一个更大的分子来形成新的化学物质。
这种化学反应在有机合成中非常重要,可以用于制备各种重要有机分子和高分子材料。
缩合反应的分类包括羧酸缩合反应、醛和酮缩合反应、亚胺和亚胺盐缩合反应等。
在进行缩合反应时,需要考虑催化剂和适当的条件。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
-
OH形成四级铵碱
O CH3CCH2CH2N(CH3)3OH -
霍夫曼消除
O CH3CCH=CH2
2 醇醛缩合法 3 由α-卤代酮制备
O
O
Br2
Br HO OH
OO Br
H+
H+
KOH C2H5OH
OO
H+
O
4 由α- 卤代烯制备
hv Br2
Br NaOH
OH
CrO3 吡啶
O
5 通过烯烃和酰卤的反应制备
O
OH
O H2C H O
CH2-N(CH3)2
N(CH3)2 O
CH3I
O O
OH
+
CH2-N(CH3)3
NaHCO3
O
OH
H2C H O
O
N+ (CH3)3 O
HO O
第二节 麦克尔加成反应
一 定义
一个能提供亲核碳负离子的化合物(给体) 与一个能提 供亲电共轭体系(受体)的化合物,在碱性催化剂作用下,发 生亲核1,4-共轭加成反应,此类反应称为麦克尔加成 (Michael, A.)反应。(反应产物为1,5-二官能团化合物,尤以 1,5-二羰基化合物为多)。
反应式
OO CH3CCH2CCH3 + CH2=CH-CH=O
EtOEtOH
给体
受体
O (CH3C5 )2C4 H
Cβ3H2Cα2 H2C1HO
1,5-二羰基化合物
常用碱性催化剂:
N , Et3N, KOH, EtONa, (CH3)3COK, R4N+OH-
H
二 反应机制
O (CH3C)2CH2
eg 5 CH2 CH CH2 NCH3 C=O CH2 CH CH2
eg 6 CH3 N
O
4 制α,β-不饱和酮、α,β-不饱和酯
O R-C-CH2CH2NMe2 △ ,蒸馏
O R-C-CH=CH2
CH3I
O R-C-CH2CH2NMe3
OH △
O R-C-CH=CH2
实例
O
OH
O HO O
H2C=N+(CH3)2 ILDA
1,6加 成 的 反 应 机 理 如 下
CH=CH-CH=CH-C=O
(C2H5OOC)2CH2 碱 (C2H5OOC)2CH CH3
CH3
(C2H5OOC)2CHCH-CH=CH-CH=C-O-
CH3
CH3
EtOH
互变异构
(C2H5OOC)2CH-CH-CH=CH-CH=C-OH
CH3
CH3
O (C2H5OOC)2CH-CH-CH=CH-CH2CCH3
CH3
四 制备α,β-不饱和醛酮的方法
α,β-不饱和醛酮是麦克尔加成反应的重要原料, 下面归纳了制备α,β-不饱和醛酮的几种方法。
1 曼尼希碱热消除法
O
O
CH3CCH3 + CH2O + Me2NH HCl 曼尼希反应 CH3CCH2CH2N(CH3)2 HCl
CH3I
胺的甲基化反应
O
+
CH3CCH2CH2N(CH3)3I
O + RCCl
AlCl3
Cl CR Na2CO3, H2O
O CR
O
6 通过魏悌息反应来制备
O R-CHO + Ph3P-CHCPh
O R-CH=CH-CPh
第三节 鲁宾逊增环反应
一 定义
环己酮及其衍生物在碱(如氨基钠、醇钠等)存在下, 与曼尼期碱的季铵盐反应产生二并六元环的产物,该反 应称为鲁宾逊(Robinson, R.)增环反应.
HCl, H2O
O
O
CH3
+ (CH3)2NCH2
CH3
CH2N(CH3)2
67 %
33 %
2 在芳、杂环上引入氨甲基 eg 3
OH
O + CH2O + N
H+
H
CH2 N OH
eg 4:
N
N
+ CH2O + HN(CH3)2
H
H2O
CH2N(CH3)2
HAc
N H 95 %
草绿碱
3 制备杂环化合物
R CH2=N
R'
O CH3-C-CH2-CH2-N
R + H+
R'
三 氨甲基化反应实例
1 用来制备β-氨基酮
eg 1
O CH3CCH2CH3 + CH2O + Me2NH HCl
O
αβ
CH3CCHCH2NMe2 HCl CH3
不对称酮反应时,亚甲基比甲基优先反应。
eg 2:
O CH3 + CH2O + (CH3)2NH
第一节 曼尼期反应——氨甲基化反应 一 定义
具有活泼氢的化合物、甲醛、胺同时缩合,活 泼氢被氨甲基或取代氨甲基取代的反应,称为曼尼 期 (Mannich, C.)反应,生成的产物称为曼氏碱。
O
R H+
CH3-C-CH2-H + CH2O + HN
R'
O
R
CH3-C-CH2-CH2N R'
取代的氨甲基
使用原料的范围
1. 具有α-H的醛、酮、酸、酯、硝基化合物、腈、末端炔烃、含 有活泼氢的芳香环系化合物。
2. 二级胺。
二 反应机制
R
H+
CH2=O
CH2=OH
NH R'
R
H+转移
R' N-CH2OH
H
R R'
N-CH2-OH2
-H2O
R R' N=CH2
活化的C=N
O CH3C-CH2
H
OH CH3-C=CH2
EtO-
O
+ O
64 %
O
O
36 %
2 用β-卤代乙烯酮或β-卤代乙烯酸酯作为麦克尔 反应的受体时,反应后,双键保持原来的构型。
O CH3 C2H5O-
OCH3
Cl Cβ αC H
H
COCH3
O
O CH3
CH-CH=C-OCH3
Cl
O-
O
H
CC
H
COCH3
O
95 %
3 若受体的共轭体系进一步扩大,也可以制备1,7官能团化合物。
exit
本章提纲
第一节 曼尼期反应--氨甲基化反应 第二节 麦克尔加成反应 第三节 鲁宾逊缩环反应 第四节 魏悌息反应和魏悌息--霍纳尔反应 第五节 浦尔金反应和脑文格反应 第六节 达参反应 第七节 安息香缩合反应和二苯乙醇酮重排
缩合反应
分子间或分子内不相连接的两个 碳原子连接起来形成新的碳碳键,成 为新的化合物,同时往往有比较简单 的无机或有机小分子化合物生成。这 样的反应统称为缩合反应。
EtO-(CH3CO)2CH
CH2=CH-CH=O
O (CH3C)2CH-CH2-CH=CH-O-
EtOH
O
互变异构
(CH3C)2CH-CH2-CH=CH-OH
O (CH3C)2CHCH2CH2CHO
三 麦克尔加成反应的规律
1 不对称酮进行麦克尔加成时,反应总是在多取代的 -C上发生。
O
CH3
O + CH2=CH-C-CH3
O CH3CH=CH-CH=CH-COCH3 + CH2(COOC2H5)2 碱
54 32 1
CH3-CH-CH=CH-CH 2COOCH 3
+
CH(COOC
67
2H5)2
1,6-加成产物 (72 %)
21
3 CH2COOCH3 CH3CH=CH-CH
C4 H(C5OOC2H5)2
1,4-加成产物 (8 %)
