免疫组织化学技术标准化及常见问题的处理
免疫组化技术要点与常见问题

免疫组化技术要点与常见问题在免疫组化过程中,为了更好的说明问题和查找原因,最好设置阳性对照片(已知的高表达相应抗原的组织)和阴性对照组织片(不加一抗但是加二抗系统/不加任何抗体两组),所有操作过程应完全一致。
染色弱或者没有染色(按照先后顺序,先排除一些简单的原因):可能原因解决办法试剂使用顺序错误或者漏加试剂重复实验,保证每一步均正确二抗和一抗不匹配选择匹配的二抗底物和酶不匹配选用匹配的底物酶失活换用新的酶(将酶和底物混合,看是否显色?)组织中没有待测抗原表达或者表达水平低使用阳性对照片抗体浓度太低增加抗体浓度.最好使用不同浓度的抗体,决定最佳浓度抗体孵育时间不充分延长抗体孵育时间底物孵育不充分延长底物孵育时间抗体储存不当,导致失效将抗体分装,低温保存 (-20 to -70 C) ,避免反复冻溶。
稀释抗体在4保存1-2周,避免时间过长。
或者根据说明书进行恰当的保存一抗失效换用新的一抗二抗失效换用新的抗体(能否成功与其它一抗配合?)脱石腊不充分延长脱腊时间或者换用新的二甲苯组织固定不充分或者不当增加固定时间或者改用不同的固定方法组织固定过度减少固定时间。
若已固定过度,则需使用正确的或者推荐的抗原修复方法复染试剂与底物系统不匹配选择正确的复染试剂(不加复染剂,看是否有组织染色?)封片剂不正确选择正确的封片剂染色背景高:可能原因解决办法洗片不充分每步之间至少洗片3次组织含有内源性的酶,如HRP/AP 在加入一抗之前使用3%的H2O2甲醇封闭内源性HRP 活性,使用左旋咪唑(levamisole)溶液阻断内源性AP活性。
或者换用葡萄糖氧化酶系统组织含有内源性生物素(尤其是肾脏、肝和脾)在加入一抗之前,血清封闭之后使用avidin/biot in阻断试剂。
或者避免使用biotin-avidin系统或改用IF方法(直接将酶和底物加到组织片上,看是否显色?)一抗的非特异性结合或者抗体浓度过高增加一抗的稀释度二抗和组织非特异性结合使用与二抗来源相同的正常动物血清(一般是1 0%)封闭,必要时可以将血清浓度加大组织固定不充分,抗原扩散Increase duration of postfixation使用小鼠来源的二抗检测小鼠组织在加一抗之前使用MouseOnMouse封闭试剂干片染色过程中避免出现干片现象染色强度过大:可能原因解决办法一抗或者二抗浓度过高降低抗体浓度。
免疫组化技术常见问题及处理方法ppt课件

10分钟,以阻断内源性过氧化物酶的活性。PBS冲洗3次,每次3分 钟。 4. 除去PBS液,每张切片加1滴或50μl正常非免疫动物血清(试剂B), 室温下孵育10分钟。 5. 除去血清,每张切片加1滴或50μl的第一抗体(用户自选),室温 下孵育60分钟或4℃过夜,建议参见每种抗体的说明书。 4度过夜和从冰箱拿出后37度复温45min, PBS冲洗3次,每次3分 钟。
原决定簇的暴露,产生阴性结果 4、固定液的量要超过组织体积5倍以上
如果组织固定不及时或不完全固定,HE染色细胞 核发灰模糊,对比不鲜明;免疫组化染色结果不 理想,通常组织离体2h后抗原完全丢失
.
固定不充分
.
.
.
.
.
.
.
.
标本的取材、脱水、浸蜡
• 标本的取材厚度以2mm为宜 • 梯度酒精脱水尽量彻底充分 • 二甲苯透明时间不宜长,1~3h为佳,透明过度会导致组
免疫组化技术
常见问题及处理方法
.
免疫组织化学的定义
用标记的特异性抗体对组织切片或细胞标本中某些 化学成分的分布和含量进行组织和细胞原位定性、定 位或定量研究,这种技术称为免疫组织化学技术或免 疫细胞化学技术
.
免疫组织化学的原理
• 根据抗原抗体反应和化学显色原理 • 组织切片或细胞标本中的抗原和一抗结合 • 利用一抗与标记生物素(HRP、 AKP ) 、荧光
.
6. 除去PBS液,每张切片加1滴或50μl生物素标记的第二抗体(试剂 C),室温下孵育10分钟。PBS冲洗3次,每次3分钟。
免疫组化实验常见问题及解决方案

解决办法
通透作用破坏了膜
去除缓冲液中的通透剂
固定的方法对抗原不合适
尝试不同的固定剂,关于固定剂的使用选择见补充材料
没有及时固定引起抗原扩散
取材后立即固定
可能原因
解决办法
缺乏抗原
做Western blot检测目标蛋白是否有表达或原位杂交检测mRNA是否有表达
抗体无效
避免反复冻融;用阳性片子进行检测
抗原修复无效
改进抗原修复方法
抗原-抗体结合不足
加大一抗浓度,增加孵育时间
抗体不能穿过细胞
加Triton x-100到封闭液中,通透组织
2,高背景
下图样本是小鼠皮下移植瘤组织,目标蛋白LYVE1,A图是我们想得到的结果,B图是做出来的实验结果,与A图相比,B图背景高。
可能原因
解决办法
脱蜡不足
适当延长二甲苯浸泡次数和时间
干片,组织过于干燥
避免干片
抗原修复过度
减少修复时间
内源性酶干扰
添加淬灭操作
Fc受体干扰
用二抗来源的血清取代BSA封闭
抗体浓度过高
适当增加稀释比例
染色时间过长
镜检观察显色,合膜组织,目标蛋白IL-10,A图是我们想得到的结果,B图是做出来的实验结果,在与A图相同位置的B图中没有检测到抗原,反而在组织边缘检测到组织表达。
下图样本是人小肠粘膜组织目标蛋白il10a图是我们想得到的结果b图是做出来的实验结果在与a图相同位置的b图中没有检测到抗原反而在组织边缘检测到组织表达
免疫组化实验常见问题及解决方案
1,缺乏染色
下图样本是正常人肝血管组织,目标蛋白是α-平滑机动蛋白,A图是我们想得到的结果,B图是做出来的实验结果,与A图相比,在红圈处并没有检测到抗原。
免疫组化常见问题的处理

免疫组化常见问题的处理当免疫组化染色没有出现预期结果时,应系统地查找原因,而每一次只能排除一种可能的原因。
对照/标本无染色①确认是否忽略了应该加的某种试剂,包括一抗、二抗、三抗及底物等。
②确认所有的试剂是否按正确的顺序加入,是否孵育了足够的时间。
③对照抗体的标签确认是否使用了正确的抗体,以及所用的检测系统是否和一抗匹配,这一点是非常重要的。
比如,如果一抗是兔来源的抗体,二抗一定要用抗兔的二抗来匹配;或一抗是小鼠的IgM一抗,二抗必须是山羊/兔抗小鼠的IgM(不是IgG)二抗。
④检查抗体所使用的稀释度及稀释溶液。
⑤检查抗体的有效期和保存条件,尤其是标记了酶或荧光素的抗体,现在大多数试剂公司的抗体均要求在4~8℃条件下保存,应避免反复冻融,试剂保存时一定要避免与挥发性有机溶剂同放一室,以免降低抗体的效价。
⑥检查标本的储存条件,最好用已知阳性的标本来同时做阳性对照。
⑦检查色原/底物溶液,最简单的检测方法是将一滴标记有酶的抗体加入到制备好的底物溶液中,如果底物发生预期的颜色变化,则可排除底物的因素。
需要注意的是,有些底物在制成工作液后应在一定时间内用完,否则会失效。
⑧检查冲洗液是否和反应试剂匹配,溶液的pH值很重要,与过氧化物酶底物匹配的溶液中不应含有叠氮钠。
⑨检查复染剂和封片剂是否和所使用的色原匹配。
弱阳性如果阴性对照没有染色而阳性对照标本弱阳性,除了考虑上述因素外,还应考虑:①标本的固定方式,不当的固定方式或固定时温度过高,都会影响到所检测的抗原的数量和质量。
②不适当的抗原修复方式,由于石蜡切片在制作的过程中固定剂对抗原的封闭作用,必须用抗原热修复或酶消化或两种同时使用的抗原双暴露法,至于使用哪一种方法,应参照生产厂家的说明,同时结合标本的具体情况而定。
③抗体的稀释度是否过高或者孵育的温度/时间是否正确。
一般试剂生产厂家都会对试剂给出一定的使用范围,但是由于使用者的标本来自各种组织,处理过程也不尽相同,所以应参照使用范围,对所使用的一抗进行梯度测试,找出最佳的使用浓度。
免疫组化技术常见问题及处理方法课件

36
修复过度的实验组
37
修复过度的实验组
38
修复过度的对照组
39
修复过度的对照组
40
酶消化修复
41
缩短修复时间
42
热抗原修复的问题:内源性生物素
热修复抗原会导致内源性生物素反应增强,应用 卵白素抗生物素系统会产生假阳性
富含内源性生物素的组织: — 肝细胞 — 线抗体丰富的组织如肾脏、甲状腺、嗜酸细胞等 — 胞浆丰富的肿瘤细胞
SP法
1. 石蜡切片脱蜡和水化后,用PBS(pH7.4)冲洗3次,每次3分钟。 2. 根据每一种抗体的要求,对组织抗原进行相应的修复。 3. 每张切片加1滴或50μl过氧化酶阻断溶液(试剂A),室温下孵育10
分钟,以阻断内源性过氧化物酶的活性。PBS冲洗3次,每次3分 钟。 4. 除去PBS液,每张切片加1滴或50μl正常非免疫动物血清(试剂B), 室温下孵育10分钟。 5. 除去血清,每张切片加1滴或50μl的第一抗体(用户自选),室温下 孵育60分钟或4℃过夜,建议参见每种抗体的说明书。 4度过夜和从冰箱拿出后37度复温45min, PBS冲洗3次,每次3 分钟。
52
免疫组化对照和质量控制
• 阳性对照 • 阴性对照 • 免疫组化的标准化 • 外部质量控制体系
53
54
55
56
57
58
脱水、透明、封片、拍照
• 脱水、透明要彻底 • 封片时尽量避免留有气泡 • 拍照尽量在两周内 • 拍照尽量选择干净、清晰的视野,无杂质无破碎
组织 • 所拍照片尽量在同一种状态下,使背景保持一致 • 照片标识清楚
行确定----通常在2-4分钟
免疫组化操作方法、原理、步骤以及常见问题处理大总结

免疫组化操作方法、原理、步骤以及常见问题处理大总结1、方法操作不难,最大的难处是出现异常结果时如何解决?这就需要掌握免疫组化实验原理,每一步知道为什么这样做,这样你才敢大胆地改革先前的不对的方法步骤。
如抗体孵育条件主要是抗体浓度、温度、时间,这三者一般是相互成反比的(相对),其中浓度是最重要的先决条件,温度决定反应的速度、时间决定反应的量。
就拿温度来说,可以有4度、室温、37度,我推荐4度最佳,反应最温和,背景较浅;而37度反应速度较快,时间较短;室温我不太提倡,除非你每次都把环境温度控制在一定的范围,否则,尽量选择前两者。
2、免疫组化最大的优势是定位和定性。
相比于其他蛋白检测方法,免疫组化具有定性灵敏度高、定位较直接准确,是定位检测分析首选方法。
尤其对于有些因子的转位研究十分有用。
3、免疫组化结果定量分析的前提是高质量的染色切片。
免疫组化结果也能定量分析,但必须是背景染色浅而特异性染色较深的情况下,分析最为准确,这种原则可能也是我们日常审稿时判定研究结果的必备条件。
4、免疫组化实验一定要设置阳性对照和阴性对照。
阳性对照一般是用肯定表达这种抗原的切片来做;阴性对照一般是用PBS或非一抗替代一抗来进行反应,其余步骤均一致。
前者是排除方法和实验系统有无问题;后者是排除有无一抗外的非特异性染色。
5、免疫组化的应用广泛,是当前实验研究的最重要方法之一。
如今发SCI论文时,明显感觉仅靠量化的数据来发文章很难,加一些形态学数据或图片,老外十分欢迎,可能是怕你学术造假吧。
当然也不能做假阳性或假阴性结果。
6、免疫组化技术掌握与否的鉴定标准是同一切片或不同切片中不同抗原均从摸索浓度或条件而做出优良的染色切片。
我在平时带教中就发现许多研究生把我已经摸索很成熟的反应条件、浓度、方法步骤,重复运用于同一性质的切片和同一种抗体,做出来后就觉得自己已经掌握了免疫组化方法,更换一种抗体后,居然连二抗的种属来源都拿错了。
失败往往促进你去思考试验原理和过程,成功有时也加快你自傲。
免疫组织化学常见问题和解决方法
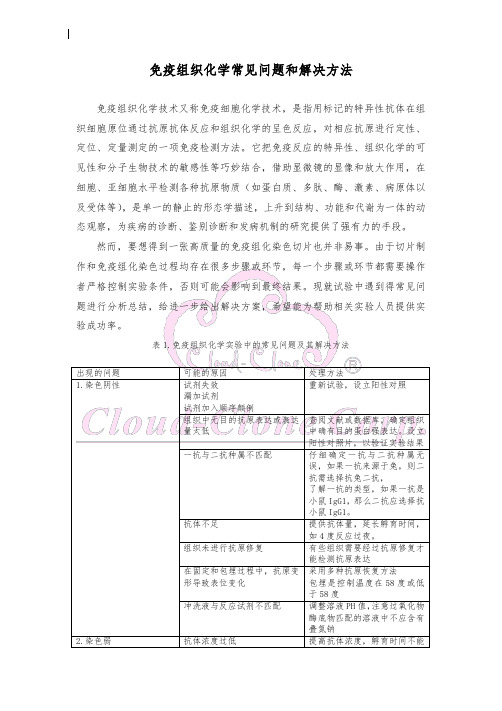
巨噬细胞吞噬各种抗原物质或 Fc 片断而出现胞浆着色 内源性生物素的着色
组织在缓冲液(如二甲苯)中 浸泡时间太长 组织变干 不适当的修复方式
较多的切片 如果制片过程中,因丙酮逐渐 挥发而胶变浓时可适当加入一 些丙酮。 加一抗前的血清封闭避免非特 异型的结合
将抗体分装在小管中,冻存于 -20 度,每次使用取一管,避 免抗体反复冻融及交叉污染。 可用过氧化氢封闭去除内源酶 导致的非特异性着色 通过形态学辨认出巨噬细胞
余的缓冲液(但防止切片干燥)
孵育时切片未放平,导致抗体 孵育时,注意切片应水平放置
流失
蛋白封闭过度
封闭时间不要超过 10 分钟
不适当的标本固定方式
选择合适的固定方法
不适当的抗原修复方式
延长抗原修复时间,或者调整
抗原修复体系,建议参照生产
厂家的说明,同时结合标本的
具体情况来确定
抗体浓度过高
降低抗体滴度(一般只浓缩性
3. 非 特异 性背 景染 色
全片着色
切片边缘着色
“阴阳脸”着色 灶片状着色
少于 60 分钟
抗体孵育时间过短
抗体孵育时间不能少于 60 分
钟
标本中目的蛋白表达量低
查阅文献或数据库,确定组织
中确有目的蛋白强表达。设立
阳性对照片,以验证实验结果
操作中,切片遗留太多冲洗液, 每步滴加试剂前沥干切片中多
导致试剂稀释
免疫组织化学常见问题和解决方法
免疫组织化学技术又称免疫细胞化学技术,是指用标记的特异性抗体在组 织细胞原位通过抗原抗体反应和组织化学的呈色反应,对相应抗原进行定性、 定位、定量测定的一项免疫检测方法。它把免疫反应的特异性、组织化学的可 见性和分子生物技术的敏感性等巧妙结合,借助显微镜的显像和放大作用,在 细胞、亚细胞水平检测各种抗原物质(如蛋白质、多肽、酶、激素、病原体以 及受体等),是单一的静止的形态学描述,上升到结构、功能和代谢为一体的动 态观察,为疾病的诊断、鉴别诊断和发病机制的研究提供了强有力的手段。
免疫组化经验总结第一部分步骤及常见问题

免疫组化经验总结第⼀部分步骤及常见问题免疫组化技术流程及常见问题解析(修改版)说明:加粗的字体部分是我认为要注意的地⽅和提出的问题,⽽红⾊字体部分表⽰还不太确定的第⼀部分载玻⽚与盖玻⽚的处理:载玻⽚与盖玻⽚重铬酸钾浸泡1-2天,⽔清洗直到没有颜⾊为⽌,放⼊⽆⽔⼄醇中,⽤纱布擦⼲(如需开展原位杂交,还需将玻⽚240℃烤2h),载玻⽚涂上多聚赖氨酸,37度烘⼲,备⽤第⼆部分冰冻切⽚前期处理1冰冻切⽚组织处理。
肿瘤组织从体内取出后,迅速放于液氮中冰冻,然后放于-80度保存,切⽚时先⽤OCT 固定(尽量减少⽓泡⽣成),-20度20-30分钟固定好后即可切⽚(最好时间长⼀点,时间太短容易使切⽚卷起,也使切⽚不均匀)。
2切⽚,切⽚时要慢,稳⼀点,切好后⽤涂有多聚赖氨酸的载玻⽚粘取切下的组织⽚,粘的时候有⼀个向内拉伸的动作,这样可以使组织⽚充分展开。
⽚⼦的厚度⼀般为10um,也有的要切30um(根据需求调整)。
切好的⽚⼦⽴即放⼊4﹪的新配的多聚甲醛中处理8-10分钟(或在丙酮中固定10S,具体⽤什么固定要看⼀抗的要求)3 PBS中洗⼀下(约2分钟)去掉残留的多聚甲醛。
(丙酮切⽚的话省去本步骤)(从冰箱中取出的⽚⼦最好在PBS中浸泡2分钟,再往下做。
如果打孔不充分,可以在PBS 中加⼊triton x-100洗三次。
再⽤PBS洗⼏次,除去triton x-100)4 ⽚⼦切好后可放于37度烘⼲,但是时间不要太长,2-3⼩时即可,或者室温风⼲,然后放于-20度或-80度冰箱可长期储存。
但是⽤丙酮或有机溶剂固定的⽚⼦上如果还有其他有机溶性的染料的话建议尽快做掉,因为有机溶剂在长期储存中(⼀个⽉)缓慢作⽤的话,也会使染料变得模糊。
第三部分加抗体5 10%正常⼭⽺⾎清(PBS稀释,可加少量的triton x-100打孔),封闭(依⼆抗的来源⽽定),室温孵育30分钟。
6倾去⾎清,擦⼲各组织之间的⽔滴,防⽌有⽔滴粘连。
滴加适当⽐例稀释的⼀抗1:100左右或⼀抗⼯作液,37℃孵育1~2⼩时或4℃过夜,4℃过夜后需在37℃或室温复温30分钟。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
11 染 色前 的处理 .
正确 的取 材 、 脱水 、 浸蜡 十 分 重
1 2 1 内源性 过氧 化 物 酶 的灭 活 如 果 采用 过 氧化 . . 物酶 检测 系统 , 则必 须 对 内源 性 过 氧化 物 酶 进行 封 闭
要, 组织 材料处 理是 获得 良好结果 的前 提 , 须保证 要 必 检测 的细胞 或 组 织 取 材 新 鲜 、 固定 及 时 , 态 保 存 良 形
免疫 组织化 学 技术 标 准化及 常见 问题 的处理
黄世琪 宋 芳 郝 奋 韩 秀雁
( 包头 医学院组 织学与胚胎 学教研 室, 内蒙古 包头 0 4 6 ) 10 0
随着单克 隆抗 体技 术 的 迅速 发 展 , 疫组 织 化 学 免 染色 已成为广 泛应用 的实 验手段 , 尽管 其理 论很简单 , 但在实 际操作 中还存 在 着许 多有 待 商讨 的 问题 , 多 诸
选 择酶消 化 法 。加 热 抗 原 修 复 法是 19 9 1年 S i h 等 报 道 的 , 理后使 免疫组 化染 色 的敏 感度 大大提高 , 处 其 机 制还不 十分清楚 , 推测 可 能是 加 热 打开 了组织 抗 原
因福尔马林 固定 引起 的抗原 决定簇 的交联 。常用 的加
为保证实 验 的顺 利进 行 , 般需 采 用 黏 附剂 对 已清 洗 一 的载玻 片进行 处理 , 常用 的 有 A E 、oy—L—Ls 、 P S Pl yi n H s gi 。 。切 片 的厚 度应在 4~ m, 厚 的切片 ior 等 t pM 5 过 不仅 容易脱 片 , 还影 响免 疫反 应 和观察 效 果 。高 温烤
[ ] 葛友华 , 3 袁健. 课堂教学手段合理运用 的探索 [ ]黑龙江 J. 教育( 高教研究 与评估 ) 20 ,7—8 :3 ,07 ( ) 16—17 3.
( 收稿 日期 :00 1-9 2 1-00 )
教学内容、 教学方式的改革是一个任重道远 的过 程, 也是一个 循序 渐 进 的过 程 。 以创 新 思 维 带 动多 角 度、 多层次 的教学 , 断探 索 教 与学 中 的新 方 法 , 设 不 建
参考 文献
[ ] 王心如. 1 毒理学实验 方法与技术 [ . M] 2版. 北京 : 民卫 人
生 出 版 社 ,07 1 2 20 : — .
[ ] 栾加双 , 2 王亚君. 绪论教学在大学 授课过程 中的重要性探
讨 []职业教育 , 0 , (2 )5 — 8 J. 2 81 19 : 5 . 0 0 7
性福 尔马林 , 固定 时 间不 易 过 长 。福尔 马林 固定 引 但
起组织抗原决定簇 的封闭与交联可以通过抗原修复的 方 法来修 正 】但 我 们 根据 经 验 认 为 采 用 B un固定 , oi
液 可 以避 免交联 键 的形 成 , 于新 鲜 组织 可 不 做抗 原 对 修复。 由于在免疫组 化 操 作过 程 中极 易 出现 脱 片现 象 ,
好 。 目前许 多实验 室公认 组织 脱片 的原 因之一是取 材
处理 , 一般 用 3% H O , 染色 结 果 和组 织 细胞 的抗 : 对
原性 均无 明显影 响 。
过厚 以及脱水 、 浸蜡 处理 不 当所致 , 想 的取 材厚度 是 理
2c 。 m
122 抗原 修复 目前所 进 行 的常规 石 蜡 切片 均用 .. 甲醛 固定 , 由于形成 醛 键 或蛋 白之 间发 生 交 联而 使抗 原决 定簇 隐蔽 , 因此 有 些抗 原 需 要 先进 行 抗 原修 复 或
因素可 以影 响免疫 组化 的染 色结 果 , 因此 将免 疫 组 化 技术标 准化成 为 目前 的焦 点 。
1 免疫 组 织化 学标 准化 的染 色方法
片对 抗原有 破坏 , 我们 建议 5 O℃左 右 烤 片过 夜 , 既保 持 了抗原活 性又避 免 了脱 片现 象 的发 生 。切 片 的脱蜡 步骤 与常规 H E染 色 的脱 蜡 步 骤相 同 , 免 疫 组 化要 但 求脱 蜡彻底 、 干净 , 因此 最 好 与 常 规 H E脱 蜡 分开 , 以 达 到更好 的染色效 果 。
14 2
包
头
医
学
院
学
报
第2 6卷
取 、 胃技 术 、 灌 性别 鉴 定 、 色标 记 、 颈椎 处 死 等 , 染 断 并
素质过硬 、 结构合 理 的师资 队伍 , 将对 培养合 格 的预防 医学毕业 生 和 未 来 的毒 理 学专 业 人 才 打 下 坚 实 的 基
础。
把这 5项基 本技能 作为实验 考试 的 内容 。训练 中 以小 鼠为实验对 象 , 训练 学生 如何正确 抓取 动物 , 求每个 要 学生 必须独 立 、 正规 、 准确 的操作 。对 于少部 分对实验 动物有 畏惧 心理 的学生 , 课 教 师耐 心 反 复地 讲 解 和 授 示 范 , 学生克 服胆怯 心理 ; 使 通过多 看多练 、 循序 渐进 , 使 每个学 生掌握 最基本 的技 能 , 在这 个基础 上 , 种染 各 毒 方法 、 材方法 都 能很 好地 被学生 掌握 , 实验课 的 取 使 基 本技 fil 到预期 目的。 i J练达  ̄ a
暴 露 。常用 的有酶 消 化 法 和加 热抗 原 两 种 修 复方 法 。 酶 消化法是 最早 的抗原 修复方 法 , 用 的酶 有 : 蛋 白 常 胰 酶、 胃蛋 白酶等 , 已很少 应 用 , 现 只有少 数 的 抗体 可 以
要 针对 组织渗 透性及 保持 组织结 构 的完 整性 和抗 原 活性选择 固定 液
热方法有水浴法、 微波法和高压法, 高压法优于其它两 种 方法 。加 热 抗 原 修 复 液 有 柠 檬 酸 盐 缓 冲 液 、 f 、 r s i
ET D A等 , 目前 首选 柠檬 酸盐 缓 冲液 , 优点 是 染色 背 其 景 清晰 , 合于 大多数抗 体 , 两种对 部分抗 原修 复效 适 后
