高中化学双向细目
合集下载
高中化学必修二双向细目表

√
3.常见有机反应类型
√
4.甲烷、乙烯、苯等有机化合物的主要性质及应用
√
5.氯乙烯、苯的衍生物等在化工生产中的重要作用
√
6.乙醇、乙酸的结构和主要性质及重要应用
√
7.糖类、油脂、蛋白质的组成和主要性质及重要应用
√
8.常见高分子材料的合成及重要应用
√
9.以上各部分的综合应用
√
第四章化学与自然资源的开发利用
√
6.能量变化、放热吸热反应,键能计算
√
第二章化学反应与能量
1.原电池的原理(构成条件、电极判断、电极反应式书写、阴阳离子流向)
√
2.设计原电池、燃料电池
√
3.化学反应速率(计算、影响因素)
√
4.化学平衡的判断标志(三段式计算)
√
第三章有机化合物
1.有机化合物中碳的成键特征
√
2.有机化合物的同分异构现象,简单有机化合物同分异构体的书写(碳链异构、位置异构)
高中化学必修二双向细目表
理解
应用
第一章物质结构元素周期律
1.元素周期表的结构以及周期、族、质量数,元素、核素、同位素等概念
√
2.同主族、同周期元素的相似性和递变性
√
3.核外电子排布,原子(离子)半径,主要化合价
√
4.金属性非金属性的比较规律并解释这些递变规律或设计实验。
√
5.化学键、离子键、共价键、离子化合物和共价化合物概念电子式书写、形成过程
1.金属冶炼原理,常见金属的冶炼方法
√
2.海水提溴、提碘、提镁、提纯食盐的流程及基本操作
√
3.煤、石油组成、开发(干馏、分馏、裂化裂解)
√
4.加聚反应
√
5.绿色化学
√
3.常见有机反应类型
√
4.甲烷、乙烯、苯等有机化合物的主要性质及应用
√
5.氯乙烯、苯的衍生物等在化工生产中的重要作用
√
6.乙醇、乙酸的结构和主要性质及重要应用
√
7.糖类、油脂、蛋白质的组成和主要性质及重要应用
√
8.常见高分子材料的合成及重要应用
√
9.以上各部分的综合应用
√
第四章化学与自然资源的开发利用
√
6.能量变化、放热吸热反应,键能计算
√
第二章化学反应与能量
1.原电池的原理(构成条件、电极判断、电极反应式书写、阴阳离子流向)
√
2.设计原电池、燃料电池
√
3.化学反应速率(计算、影响因素)
√
4.化学平衡的判断标志(三段式计算)
√
第三章有机化合物
1.有机化合物中碳的成键特征
√
2.有机化合物的同分异构现象,简单有机化合物同分异构体的书写(碳链异构、位置异构)
高中化学必修二双向细目表
理解
应用
第一章物质结构元素周期律
1.元素周期表的结构以及周期、族、质量数,元素、核素、同位素等概念
√
2.同主族、同周期元素的相似性和递变性
√
3.核外电子排布,原子(离子)半径,主要化合价
√
4.金属性非金属性的比较规律并解释这些递变规律或设计实验。
√
5.化学键、离子键、共价键、离子化合物和共价化合物概念电子式书写、形成过程
1.金属冶炼原理,常见金属的冶炼方法
√
2.海水提溴、提碘、提镁、提纯食盐的流程及基本操作
√
3.煤、石油组成、开发(干馏、分馏、裂化裂解)
√
4.加聚反应
√
5.绿色化学
√
双向细目表化学

高三化学期中考试双向细目表
蔡进勇
题目序号
题型
分值
考察知识点
难度
备注
1
选择题
3
化学基本用语考察
易
2
选择题
3
溶液配制的实验考察
易
3
选择题
3
物质的分类考察
易
4
选择题
3
化学基本概念的考察
易
5
选择题
3
金属的基本性质考察易Biblioteka 6选择题3
金属的冶炼考察
易
7
选择题
3
物质的基本性质考察
易
8
选择题
3
NA的考察
易
9
选择题
3
离子共存问题考察
20分
及格率
65%
中
10
选择题
3
离子方程式的考察
中
11
选择题
3
离子检验的考察
易
12
选择题
3
物质的保存方法考察
易
13
选择题
3
基本实验的考察
中
14
选择题
3
氧化还原反应原理
中
15
选择题
3
氧化还原反应计算
中
16
选择题
3
基本实验装置考察
中
17
选择题
3
简单流程题考察
中
18
选择题
3
海水的综合利用
难
19
选择题
3
物质的转化考察
难
20
选择题
3
物质转化的推导
难
21
综合题
6
蔡进勇
题目序号
题型
分值
考察知识点
难度
备注
1
选择题
3
化学基本用语考察
易
2
选择题
3
溶液配制的实验考察
易
3
选择题
3
物质的分类考察
易
4
选择题
3
化学基本概念的考察
易
5
选择题
3
金属的基本性质考察易Biblioteka 6选择题3
金属的冶炼考察
易
7
选择题
3
物质的基本性质考察
易
8
选择题
3
NA的考察
易
9
选择题
3
离子共存问题考察
20分
及格率
65%
中
10
选择题
3
离子方程式的考察
中
11
选择题
3
离子检验的考察
易
12
选择题
3
物质的保存方法考察
易
13
选择题
3
基本实验的考察
中
14
选择题
3
氧化还原反应原理
中
15
选择题
3
氧化还原反应计算
中
16
选择题
3
基本实验装置考察
中
17
选择题
3
简单流程题考察
中
18
选择题
3
海水的综合利用
难
19
选择题
3
物质的转化考察
难
20
选择题
3
物质转化的推导
难
21
综合题
6
2023届高考化学知识点双向细目表——物质结构与性质模块
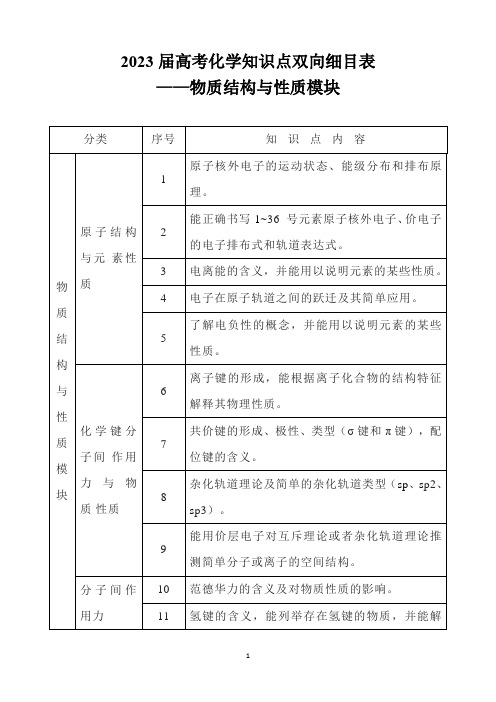
分子间作用力
与物质的性质
10
范德华力的含义及对物质性质的影响。
11
氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
5
了解电负性的概念,并能用以说明元素的某些性质。
化学键分子间作用力与物质性质
6
离子键的形成,能根据离子化合物的结构特征解释其物理性质。
7
共价键的形成、极性、类型(σ键和π键),配位键的含义。
8
杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。
9
能用价层电子对互斥理论或者杂化轨道理论推测简单分子构与性质模块
分类
序号
知识点内容
物
质
结
构
与
性
质
模
块
原子结构与元素性质
1
原子核外电子的运动状态、能级分布和排布原理。
2
能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。
3
电离能的含义,并能用以说明元素的某些性质。
4
电子在原子轨道之间的跃迁及其简单应用。
与物质的性质
10
范德华力的含义及对物质性质的影响。
11
氢键的含义,能列举存在氢键的物质,并能解释氢键对物质性质的影响。
5
了解电负性的概念,并能用以说明元素的某些性质。
化学键分子间作用力与物质性质
6
离子键的形成,能根据离子化合物的结构特征解释其物理性质。
7
共价键的形成、极性、类型(σ键和π键),配位键的含义。
8
杂化轨道理论及简单的杂化轨道类型(sp、sp2、sp3)。
9
能用价层电子对互斥理论或者杂化轨道理论推测简单分子构与性质模块
分类
序号
知识点内容
物
质
结
构
与
性
质
模
块
原子结构与元素性质
1
原子核外电子的运动状态、能级分布和排布原理。
2
能正确书写1~36号元素原子核外电子、价电子的电子排布式和轨道表达式。
3
电离能的含义,并能用以说明元素的某些性质。
4
电子在原子轨道之间的跃迁及其简单应用。
高中化学双向细目表
√
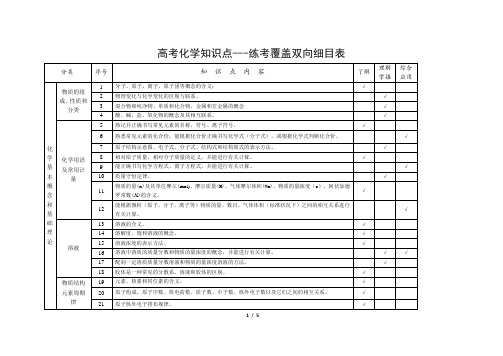
化学反应速率和化学平衡
41
化学反应速率的概念、反应速率的定量表示方法。
√
42
能正确计算化学反应的转化率(α)。
√
43
反应活化能的概念,催化剂的重要作用。
√
44
化学反应的可逆性及化学平衡的建立。
√
45
化学平衡的特征。
√
46
化学平衡常数的含义,能够用化学平衡常数进行简单计算。
√
√
47
外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
√
81
常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
√
82
常见物质进行检验、分离和提纯的方法。
√
83
溶液配制方法。
√
84
根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。
√
10
质量守恒定律。
√
11
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
√
12
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
√
溶液
13
溶液的含义。
√
14
溶解度、饱和溶液的概念。
合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
√
物质结构与性质模块
原子结构与元素性质
102
原子核外电子的运动状态、能级分布和排布原理。
化学反应速率和化学平衡
41
化学反应速率的概念、反应速率的定量表示方法。
√
42
能正确计算化学反应的转化率(α)。
√
43
反应活化能的概念,催化剂的重要作用。
√
44
化学反应的可逆性及化学平衡的建立。
√
45
化学平衡的特征。
√
46
化学平衡常数的含义,能够用化学平衡常数进行简单计算。
√
√
47
外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,能用相关理论解释其一般规律。
√
81
常见气体的实验室制法(包括所用试剂、仪器、反应原理和收集方法)。
√
82
常见物质进行检验、分离和提纯的方法。
√
83
溶液配制方法。
√
84
根据化学实验的目的和要求,能做到:设计实验方案;正确选用实验装置;掌握控制实验条件的方法;预测或描述实验现象、分析或处理实验数据,得出合理结论;评价或改进实验方案。
√
10
质量守恒定律。
√
11
物质的量(n)及其单位摩尔(mol)、摩尔质量(M)、气体摩尔体积(Vm)、物质的量浓度(c)、阿伏加德罗常数(NA)的含义。
√
12
能根据微粒(原子、分子、离子等)物质的量、数目、气体体积(标准状况下)之间的相互关系进行有关计算。
√
溶液
13
溶液的含义。
√
14
溶解度、饱和溶液的概念。
合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
√
物质结构与性质模块
原子结构与元素性质
102
原子核外电子的运动状态、能级分布和排布原理。
2023届高考化学知识点双向细目表——有机化学基础模块
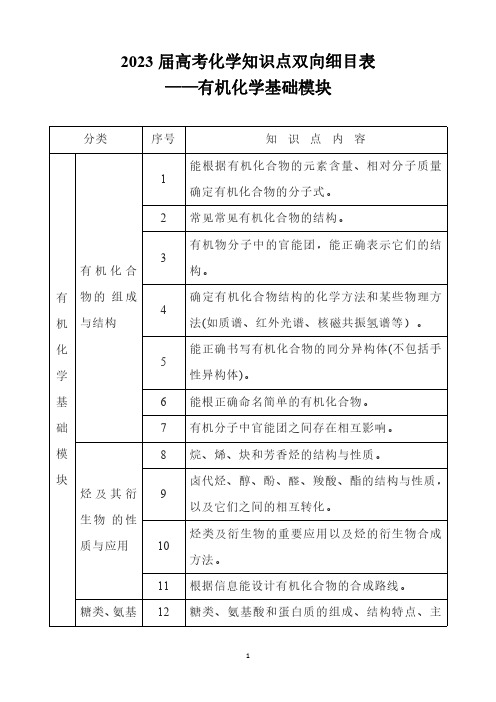
质与应用 10
方法。
11 根据信息能设计有机化合物的合成路线。
糖类、氨基 12 糖类、氨基酸和蛋白质的组成、结构特点、主
1
酸
要化学性质及应用。
和蛋白质 13 糖类、氨基酸和蛋白质在生命过程中的作用。
合成高分子的组成与结构特点。能依据简单合
14 成高分子的结构分析其链节和单体。
合成高分 15 加聚反应和缩聚反应的含义。
2023 届高考化学知识点双向细目表 ——有机化学基础模块
分类
序号
知识点内容
能根据有机化合物的元素含量、相对分子质量
1 确定有机化合物的分子式。
2 常见常见有机化合物的结构。
有机物分子中的官能团,能正确表示它们的结
3
有机化合
构。
有 物的 组成
确定有机化合物结构的化学方法和某些物理方
4
机 与结构
法(如质谱、红外光谱、核磁共振氢谱等)。
化
能正确书写有机化合物Байду номын сангаас同分异构体(不包括手
5
学
性异构体)。
基
6 能根正确命名简单的有机化合物。
础
7 有机分子中官能团之间存在相互影响。
模
8 烷、烯、炔和芳香烃的结构与性质。
块
卤代烃、醇、酚、醛、羧酸、酯的结构与性质,
烃及其衍 9
以及它们之间的相互转化。
生物 的性
烃类及衍生物的重要应用以及烃的衍生物合成
子
合成高分子在高新技术领域的应用以及在发展 16
经济、提高生活质量方面中的贡献。
2
高中化学模块学业考试命题双向细目表
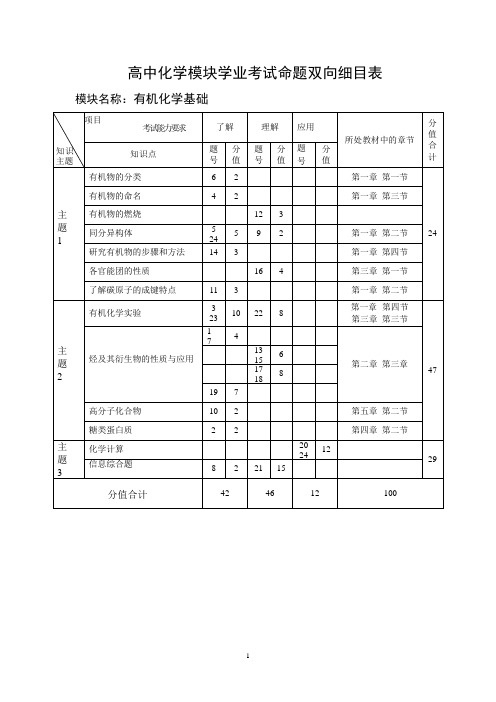
第一章 第二节 24 第一章 第四节
各官能团的性质
16 4
第三章 第一节
了解碳原子的成键特点
11 3
有机化学实验
3 23
10
22
8
1
4
7
主
题
烃及其衍生物的性质与应用 11
13 6 15
2
17 8 18
高分子化合物
19 7 12 10 2
第一章 第二节 第一章 第四节 第三章 第三节
第二章 第三章 47
高中化学模块学业考试命题双向细目表
模块名称:有机化学基础
项目
考试能力要求
知识 主题
知 知识 识点 点 有机物的分类
了解
理解 应用
分
题 分 题 分题
分
所处教材中的章节
值 合
号 值 号 值号 值
计
62
第一章 第一节
有机物的命名
42
第一章 第三节
主 有机物的燃烧
题
同分异构体
1
研究有节
糖类蛋白质
主 化学计算
题
信息综合题
3
22
第四章 第二节
20 12
24
29
8 2 21 15
分值合计
42
46
12
100
1
新高考化学命题双向细目表

新高考化学命题双向细目表
题号
题型
分值
试题内容
难度
备注
7
选择题
6
化学与生活、生产、环保、科技(STSE)等
0.80
原创
8
选择题
6
物质的类型及其变化、胶体等
0.80
原创
9
选择题
6
有机化合物等
0.75
原创
10
选择题
6
化学综合实验等
0.70
原创
11
选择题
6
元素推断(元素周期、元素周期律)、电解质溶液等
0.65
原创
12
选择题
6
电化学、氧化还原反应及相关计算等
0.70
原创
13
选择题
6
离子反应、电解质溶液等
0.65
原创
26
实验题
14
元素化合物的性质、化学实验探究方法等
0.80
原创
27
化工流程题
15
元素化合物的性质、化学实验的基本操作等
0.65
改编
28
化学反应原理题
14
化学反应与热能、化学平衡的移动、化学反应适宜条件的选择、化学平衡常数及其应用等
0.65
改编
35
二选一:结构
15
选择性必修3:物质结构与性质
0.70
改编
36
二选一:有机
15
选择性必修5:有机化学基础
0.70原创Biblioteka 命题思想达成
目标
优良率
及格率
平均分
20%
65%
65~75
本卷基于本届高三化学学科的复习进度和学生现有的知识、能力水平命制。侧重考查已经复习过的元素化合物知识、化学基本理论,考虑到知识、能力考查的覆盖面并与高考试卷逐步接轨,试卷中也有相当未复习的知识内容。全卷编写力求以学生为本,关注学生知识、能力水平,注意保护学生学习积极性;立意新颖,有思想性和时代特色;内容实在,重点考查重点和主干;形式多样,信息给予有文字、表格、图示、图像等,力求图文茂。
题号
题型
分值
试题内容
难度
备注
7
选择题
6
化学与生活、生产、环保、科技(STSE)等
0.80
原创
8
选择题
6
物质的类型及其变化、胶体等
0.80
原创
9
选择题
6
有机化合物等
0.75
原创
10
选择题
6
化学综合实验等
0.70
原创
11
选择题
6
元素推断(元素周期、元素周期律)、电解质溶液等
0.65
原创
12
选择题
6
电化学、氧化还原反应及相关计算等
0.70
原创
13
选择题
6
离子反应、电解质溶液等
0.65
原创
26
实验题
14
元素化合物的性质、化学实验探究方法等
0.80
原创
27
化工流程题
15
元素化合物的性质、化学实验的基本操作等
0.65
改编
28
化学反应原理题
14
化学反应与热能、化学平衡的移动、化学反应适宜条件的选择、化学平衡常数及其应用等
0.65
改编
35
二选一:结构
15
选择性必修3:物质结构与性质
0.70
改编
36
二选一:有机
15
选择性必修5:有机化学基础
0.70原创Biblioteka 命题思想达成
目标
优良率
及格率
平均分
20%
65%
65~75
本卷基于本届高三化学学科的复习进度和学生现有的知识、能力水平命制。侧重考查已经复习过的元素化合物知识、化学基本理论,考虑到知识、能力考查的覆盖面并与高考试卷逐步接轨,试卷中也有相当未复习的知识内容。全卷编写力求以学生为本,关注学生知识、能力水平,注意保护学生学习积极性;立意新颖,有思想性和时代特色;内容实在,重点考查重点和主干;形式多样,信息给予有文字、表格、图示、图像等,力求图文茂。
高中化学必修1双向细目表

√
22.硅、二氧化硅、硅酸盐
√
23、N2.NO2.HNO3
√
24.氨气、氨水、铵盐
√
25.次氯酸,浓硫酸,浓硝酸的强氧化性
√
必修1命题细目表
章
考点
认知能力
题号
题型
分值
预计
难度
实测难度
知道
了解理解Βιβλιοθήκη 应用必修1第一章1.化学实验安全
√
2.常见离子检验(Cl-、SO42-、CO32-、Al3+、Fe3+、NH4+)
√
3.分离提纯的方法(过滤、蒸发、蒸馏、萃取)
√
4.物质的量、阿伏伽德罗常数
√
5.配制一定物质的量浓度的溶液
√
6.物质的质量、摩尔质量、物质的微粒数、物质的量、气体摩尔体积、物质的量浓度等之间的关系
√
必修1第二章
7、物质的分类方法
√
8、胶体、丁达尔效应
√
9、离子反应
√
10、离子共存
√
11.氧化还原反应
√
12.举例说明生产、生活中常见的氧化还原反应
√
必修1第三章
13.钠、铝、铁、铜等金属及其重要化合物的物理性质
√
14.钠、铝、铁、铜等金属与氧气、水、酸、碱、盐溶液反应的共性和个性
√
15.氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物与水、酸、碱溶液的反应
√
16.氢氧化铝、氢氧化铁、氢氧化亚铁的制备
√
17、碳酸钠、碳酸氢钠在水中的溶解性、热稳定性、与酸的反应,及它们的鉴别方法
√
18、Fe3+的氧化性;Fe3+和Fe2+之间的相互转化
√
必修1第四章
19、氯、氮、硫、硅等非金属及其重要化合物的物理性质
22.硅、二氧化硅、硅酸盐
√
23、N2.NO2.HNO3
√
24.氨气、氨水、铵盐
√
25.次氯酸,浓硫酸,浓硝酸的强氧化性
√
必修1命题细目表
章
考点
认知能力
题号
题型
分值
预计
难度
实测难度
知道
了解理解Βιβλιοθήκη 应用必修1第一章1.化学实验安全
√
2.常见离子检验(Cl-、SO42-、CO32-、Al3+、Fe3+、NH4+)
√
3.分离提纯的方法(过滤、蒸发、蒸馏、萃取)
√
4.物质的量、阿伏伽德罗常数
√
5.配制一定物质的量浓度的溶液
√
6.物质的质量、摩尔质量、物质的微粒数、物质的量、气体摩尔体积、物质的量浓度等之间的关系
√
必修1第二章
7、物质的分类方法
√
8、胶体、丁达尔效应
√
9、离子反应
√
10、离子共存
√
11.氧化还原反应
√
12.举例说明生产、生活中常见的氧化还原反应
√
必修1第三章
13.钠、铝、铁、铜等金属及其重要化合物的物理性质
√
14.钠、铝、铁、铜等金属与氧气、水、酸、碱、盐溶液反应的共性和个性
√
15.氧化钠、氧化铝、氧化铁、氧化铜等金属氧化物与水、酸、碱溶液的反应
√
16.氢氧化铝、氢氧化铁、氢氧化亚铁的制备
√
17、碳酸钠、碳酸氢钠在水中的溶解性、热稳定性、与酸的反应,及它们的鉴别方法
√
18、Fe3+的氧化性;Fe3+和Fe2+之间的相互转化
√
必修1第四章
19、氯、氮、硫、硅等非金属及其重要化合物的物理性质
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
√
7、掌握乙酸的分子结构和化学性质,了解乙酸的用途、制法等
√
第四节
基本营养物质
1、油脂的组成、结构、重要性质和用途,酯和油脂的联系和区别
√
2、油脂的应用,肥皂和硝化甘油等日常生活中的知识
√
3、掌握糖类的主要代表物的组成和性质,了解淀粉、纤维素的组成和性质
√
4、掌握蛋白质的基本性质,认识蛋白质是生命现象最基本的物质基础
√
2、甲烷的组成和物理性质,掌握甲烷的正四面体结构和化学性质
√
3、烷烃的物理性质及其性质的变化规律,烷烃的结构、性质和烷烃的命名方法
√
4、取代反应,同分异构现象和同分异构体
√
第二节
来自石油和煤的两种基本化工原料
1、石油的分馏及其产品和用途,石油的裂化和裂解
√
2、煤的干馏和综合利用
√
3、煤、石油的组成和石油产品、煤干馏产品的广泛用途
√
4、掌握蒸馏法淡化海水的原理及操作,通过对海水中提取溴、碘等知识的学习,进一步学习卤族单质和其化合物的性质,同时学会应用氧化还原原理设计实验探究物质氧化性或还原相对强弱的方法
√
第二节
化学与资源综合利用、环境保护
1、了解煤的组成及煤包含的元素种类,了解煤的综合利用的途径
√
2、了解煤干馏的原理和煤干馏的产物极其主要用途
√
4、原子核结构,理解质量数的含义,构成原子的微粒间的关系,元素、核素、同位素的涵义
√
第二节
元素周期律
1、原子核外电子的排布规律,1~20号元素的原子结构示意图;原子最外层电子排布与元素的原子得失电子能力和化合价的关系
√
2、元素原子核外电子排布,原子半径,主要化合价的周期性变化。
√
3、第三元素和ⅰA族,ⅶA族元素为例,掌握同周期,同主族元素性质的递变规律,并能运用原子结构理论初步解释这些递变规律
√
第二节
化学能与电能
1、火力发电中的能量转化
√
2、原电池的原理
√
3、氧化还原反应是使化学能转换为电能的关键
√
4、通过对原电池装置的分析,掌握原电池正、负极判断方法
√
5、通过原电池装置来判断金属的活动性顺序
√
6、几种发展中的化学电源
√
7、学会自己设计原电池
√
第三节
化学反应的速率和限度
1、化学反应速率的涵义及表示方法,并能进行化学反应速率的简单计算
√
3、理解乙醇的结构,通过分析乙醇的结构式掌握乙醇在发生化学反应时的断键位置,从而推断乙醇所具有的化学性质
√
4、乙酸的物理性质以及它与人们生活的关系
√
5、通过分析乙醇和乙酸的结构式,掌握它们发生脂化反应的原理以及实验的操作方法,分析实验现象,会熟练地书写该化学方程式
√
6、了解乙酸的通性,并通过设计实验来验证次氯酸、碳酸和乙酸的酸性强弱顺序
高中化学必修2双向细目表序 号Βιβλιοθήκη 内 容知道了解
理解
应用
第一章
物质结构元素周期律
第一节
元素周期表
1、元素周期表的结构以及周期、族等概念
√
2、原子结构与元素在周期表中位置间的关系
√
3、通过对碱金属、卤族元素性质的探究,理解元素性质与原子结构以及元素在周期表中的位置的相互关系,掌握碱金属和卤族元素的相似性和递变性
√
4、原子结构、元素性质及该元素在周期表中的位置三者间的关系,学会运用周期表
√
第三节
化学键
1、化学键的含义及离子键和共价键的形成,进一步认识物质的构成
√
2、离子化合物和共价化合物的概念,能区分离子化合物和共价化合物
√
3、书写常见简单化合物、单质的电子式;能用电子式表示简单物质的形成过程
√
第二章
化学反应与能量
√
2、浓度、温度、固体的表面积、催化剂等条件对化学反应速率的影响
√
3、建立化学平衡的观点
√
4、理解化学平衡的特征
√
5、几种化学反应进行限度的因素
√
6、区分某条件对化学反应速率和可逆反应的方向性。
√
第三章有机化合物
第一节
最简单的有机化合物——甲烷
1、明确什么是有机化合物,理解有机化合物种类繁多、数量巨大的原因,体会到有机物对人们的生产、生活的影响
√
第四章
化学与可持续发展
第一节
开发利用金属矿物和海水资源
1、了解金属冶炼的一般原理,理解金属冶炼方法的选择同金属活动性的关系,了解常见金属的冶炼方法
√
2、了解金属回收的重要意义,树立资源保护,环境保护的意识
√
3、海水中微量元素的存在和应用,以及对工业生产和高科技领域的潜在价值,认识综合开发利用海水资源的重要意义
√
4、乙烯、苯的组成和结构特征,和它们的主要性质
√
5、乙烯的物理性质和主要用途,和实验室制法
√
6、掌握苯的结构式及其重要的化学性质,了解苯及其同系物在组成、结构、性质上的异同
√
7、初步学会烃的有关简单计算
√
第三节
生活中两种常见的有机物
1、乙醇的物理性质,乙酸和乙酸乙脂的物理性质
√
2、乙醇的生理作用和工业制法
√
3、认识石油的成分,石油分馏、裂化和裂解的基本原理,石油分馏和裂解的产品和用途,乙烯的加聚反应
√
4、理解加聚反应的概念和原理,能够书写常见的加聚反应方程式
√
5、造成环境污染的主要原因,常见污染物及治理措施。绿色化学的原理和意义,认识环境和人类生存发展的密切关系,增强环保意识,树立可持续发展意识
√
第一节
化学能与热能
1、断裂化学键要吸收能量,生成化学键要放出能量
√
2、化学能和热能是相互转化的,并且符合能量守恒
√
3、什么是吸热反应和放热反应,并通过实验亲身体验放热反应和吸热反应,记住常接触的化学反应中哪些是放热反应,哪些是吸热反应。
√
4、物质变化和能量变化是普遍存在的,它们符合质量守恒和能量守恒定律
7、掌握乙酸的分子结构和化学性质,了解乙酸的用途、制法等
√
第四节
基本营养物质
1、油脂的组成、结构、重要性质和用途,酯和油脂的联系和区别
√
2、油脂的应用,肥皂和硝化甘油等日常生活中的知识
√
3、掌握糖类的主要代表物的组成和性质,了解淀粉、纤维素的组成和性质
√
4、掌握蛋白质的基本性质,认识蛋白质是生命现象最基本的物质基础
√
2、甲烷的组成和物理性质,掌握甲烷的正四面体结构和化学性质
√
3、烷烃的物理性质及其性质的变化规律,烷烃的结构、性质和烷烃的命名方法
√
4、取代反应,同分异构现象和同分异构体
√
第二节
来自石油和煤的两种基本化工原料
1、石油的分馏及其产品和用途,石油的裂化和裂解
√
2、煤的干馏和综合利用
√
3、煤、石油的组成和石油产品、煤干馏产品的广泛用途
√
4、掌握蒸馏法淡化海水的原理及操作,通过对海水中提取溴、碘等知识的学习,进一步学习卤族单质和其化合物的性质,同时学会应用氧化还原原理设计实验探究物质氧化性或还原相对强弱的方法
√
第二节
化学与资源综合利用、环境保护
1、了解煤的组成及煤包含的元素种类,了解煤的综合利用的途径
√
2、了解煤干馏的原理和煤干馏的产物极其主要用途
√
4、原子核结构,理解质量数的含义,构成原子的微粒间的关系,元素、核素、同位素的涵义
√
第二节
元素周期律
1、原子核外电子的排布规律,1~20号元素的原子结构示意图;原子最外层电子排布与元素的原子得失电子能力和化合价的关系
√
2、元素原子核外电子排布,原子半径,主要化合价的周期性变化。
√
3、第三元素和ⅰA族,ⅶA族元素为例,掌握同周期,同主族元素性质的递变规律,并能运用原子结构理论初步解释这些递变规律
√
第二节
化学能与电能
1、火力发电中的能量转化
√
2、原电池的原理
√
3、氧化还原反应是使化学能转换为电能的关键
√
4、通过对原电池装置的分析,掌握原电池正、负极判断方法
√
5、通过原电池装置来判断金属的活动性顺序
√
6、几种发展中的化学电源
√
7、学会自己设计原电池
√
第三节
化学反应的速率和限度
1、化学反应速率的涵义及表示方法,并能进行化学反应速率的简单计算
√
3、理解乙醇的结构,通过分析乙醇的结构式掌握乙醇在发生化学反应时的断键位置,从而推断乙醇所具有的化学性质
√
4、乙酸的物理性质以及它与人们生活的关系
√
5、通过分析乙醇和乙酸的结构式,掌握它们发生脂化反应的原理以及实验的操作方法,分析实验现象,会熟练地书写该化学方程式
√
6、了解乙酸的通性,并通过设计实验来验证次氯酸、碳酸和乙酸的酸性强弱顺序
高中化学必修2双向细目表序 号Βιβλιοθήκη 内 容知道了解
理解
应用
第一章
物质结构元素周期律
第一节
元素周期表
1、元素周期表的结构以及周期、族等概念
√
2、原子结构与元素在周期表中位置间的关系
√
3、通过对碱金属、卤族元素性质的探究,理解元素性质与原子结构以及元素在周期表中的位置的相互关系,掌握碱金属和卤族元素的相似性和递变性
√
4、原子结构、元素性质及该元素在周期表中的位置三者间的关系,学会运用周期表
√
第三节
化学键
1、化学键的含义及离子键和共价键的形成,进一步认识物质的构成
√
2、离子化合物和共价化合物的概念,能区分离子化合物和共价化合物
√
3、书写常见简单化合物、单质的电子式;能用电子式表示简单物质的形成过程
√
第二章
化学反应与能量
√
2、浓度、温度、固体的表面积、催化剂等条件对化学反应速率的影响
√
3、建立化学平衡的观点
√
4、理解化学平衡的特征
√
5、几种化学反应进行限度的因素
√
6、区分某条件对化学反应速率和可逆反应的方向性。
√
第三章有机化合物
第一节
最简单的有机化合物——甲烷
1、明确什么是有机化合物,理解有机化合物种类繁多、数量巨大的原因,体会到有机物对人们的生产、生活的影响
√
第四章
化学与可持续发展
第一节
开发利用金属矿物和海水资源
1、了解金属冶炼的一般原理,理解金属冶炼方法的选择同金属活动性的关系,了解常见金属的冶炼方法
√
2、了解金属回收的重要意义,树立资源保护,环境保护的意识
√
3、海水中微量元素的存在和应用,以及对工业生产和高科技领域的潜在价值,认识综合开发利用海水资源的重要意义
√
4、乙烯、苯的组成和结构特征,和它们的主要性质
√
5、乙烯的物理性质和主要用途,和实验室制法
√
6、掌握苯的结构式及其重要的化学性质,了解苯及其同系物在组成、结构、性质上的异同
√
7、初步学会烃的有关简单计算
√
第三节
生活中两种常见的有机物
1、乙醇的物理性质,乙酸和乙酸乙脂的物理性质
√
2、乙醇的生理作用和工业制法
√
3、认识石油的成分,石油分馏、裂化和裂解的基本原理,石油分馏和裂解的产品和用途,乙烯的加聚反应
√
4、理解加聚反应的概念和原理,能够书写常见的加聚反应方程式
√
5、造成环境污染的主要原因,常见污染物及治理措施。绿色化学的原理和意义,认识环境和人类生存发展的密切关系,增强环保意识,树立可持续发展意识
√
第一节
化学能与热能
1、断裂化学键要吸收能量,生成化学键要放出能量
√
2、化学能和热能是相互转化的,并且符合能量守恒
√
3、什么是吸热反应和放热反应,并通过实验亲身体验放热反应和吸热反应,记住常接触的化学反应中哪些是放热反应,哪些是吸热反应。
√
4、物质变化和能量变化是普遍存在的,它们符合质量守恒和能量守恒定律
