实验二 熔点测定
实验二:重结晶及熔点的测定

实验二:重结晶及熔点的测定实验目的:1. 掌握选择溶剂方法进行固体物质的重新结晶。
2. 掌握熔点测定法。
3. 培养实验操作技能,培养实验观察能力。
实验原理:1. 重新结晶重新结晶是将一种晶体溶解后再结晶,以获得高纯度的单晶或结晶。
它的理论基础是相溶度,根据溶质在溶液中的溶解度,选择适当的溶剂,制备饱和溶液,在适当条件下,使溶剂缓慢蒸发,使得溶质由高浓度慢慢地重新结晶出来。
熔点是指某一物质在物理变化中从固态到液态的温度。
熔点可作为固体物质的一种鉴定方法,因为相同的纯物质的熔点是确定的,而不同的固体物质的熔点则不同。
熔点的测定方法可分为资料法和观察法。
观察法是指用仪器检测物质从固态到液态的温度。
常用的仪器有熔点仪和微量差热分析仪。
另一种资料法即为间接法,是先了解物质的物理性质,再运用此性质推断出熔点的范围。
实验步骤:(1)将粗品加入适量的溶剂中,配置成饱和溶液,如无法溶解,可以加热。
(2)用玻璃棒搅拌,以使晶体更好地溶解。
(3)将溶液放入三角瓶中,利用冷水或冰水浴进行室温或低温结晶。
(4)将晶体过滤出来,用蒸馏水或无水乙醇将晶体洗涤干净,放入滤纸筒中,在60℃左右的烘箱中烘干,称重并计算收率。
(1)取少量已结晶的晶体样品放到熔点管中,用玻璃针把管口堵住。
(2)将熔点管放在熔点仪中,用汞温度计观察到初始温度,同时旋转熔点管。
(3)温度到达一定高度时,观察到样品时从固态变成液态,同时熔点仪中的电路自动断开,熔点仪指示灯熄灭,这时刻度盘上的读数就是样品的熔点。
注意事项:1. 操作时要注意个人安全,注意化学品的危险性并遵守实验室安全规定。
2. 溶剂选择要根据溶质的溶解度和化学性质来选择。
3. 重新结晶时要注意沉淀的样品颗粒度要一致,否则熔点测定结果将受到影响。
4. 在熔点测定时要注意不能超载,否则会有熔点范围偏宽或者熔点不准确的情况发生。
实验结果:(1)已知需要重新结晶的复盐合物。
(2)通过比较不同溶剂的溶解度,选择出合适的溶剂进行再结晶。
实验二 熔点的测定

实验二熔点的测定一、实验目的1.了解熔点测定的意义。
2.掌握熔点测定的操作方法。
3.了解利用对纯粹有机化合物的熔点测定校正温度计的方法。
4.掌握热浴间接加热技术。
二、实验原理晶体化合物的固液两态在大气压力下成平衡时的温度称为该化合物的熔点。
纯粹的固体有机化合物一般都有固定的熔点,即在一定的压力下,固液两态之间的变化是非常敏锐的,自初熔至全熔(熔点范围称为熔程),温度不超过0.5-1℃。
如果该物质含有杂质,则其熔点往往较纯粹者为低,且熔程较长。
故测定熔点对于鉴定纯粹有机物和定性判断固体化合物的纯度具有很大的价值。
蒸气压(1)(2)蒸气压(3)物质的温度与蒸气压曲线图T M蒸气压T MT M1(4)杂质的影响1如果在一定的温度和压力下,将某物质的固液两相置于同一容器中,将可能发生三种情况:固相迅速转化为液相;液相迅速转化为固相;固相液相同时并存。
上图(1)表示该物质固体的蒸气压随温度升高而增大的曲线;上图(2)表示该物质液体的蒸气压随温度升高而增大的曲线;上图(3)表示(1)与(2)的加合,由于固相的蒸气压随温度变化的速率较相应的液相大,最后两曲线相交于M处(只能在此温度时),此时固液两相同时并存,它所对应的温度TM即为该物质的熔点。
上图(4)当含杂质时(假定两者不形成固溶体),根据拉乌耳(Raoult)定律可知,在一定的压力和温度条件下,在溶剂中增加溶质,导致溶剂蒸气分压降低(图中M1L’1),固液两相交点M1即代表含有杂质化合物达到熔点时的固液相平衡共存点,TM1为含杂质时的熔点,显然,此时的熔点较纯粹者低。
三、课堂内容1.通过提问检查学生预习情况(CAI课件预习及实验书预习),提问内容如下:(1)什么是熔点? 测定熔点有何意义?(2)什么是熔程?纯净的固体有机化合物的熔程是多少?物质不纯时熔点及熔程有何变化?(3)测熔点时样品为什么要研细,装实?(4)油浴温度下降多少时再换另一根样品管?(5)熔点管中装样品多少?(6)当接近熔点时加热速度为多少?(7)做本实验时应注意什么?2.让学生演示安装及操作并讲解。
实验2 熔点的测定技术

实验2 熔点的测定技术实验二熔点的测定技术一、实验目的1、了解熔点测定的意义2、掌握测定熔点的操作技术二、预习要求理解熔点的定义;了解熔点测定的意义;了解毛细管现象;了解尿素的物理性质;了解浓硫酸烧伤的急救办法;思考在本实验中如何防止浓硫酸烧伤、烫伤、火灾等实验事故的发生。
三、实验原理固、液两态在大气压力下达到平衡状态时的温度,叫做熔点。
也可以简单理解为固体化合物受热达到一定的温度时,即由固态转变为液态时的温度就是该化合物的熔点。
一般说来,纯有机物有固定的熔点。
即在一定压力下,固、液两相之间的变化都是非常灵敏的,固体开始熔化(即初熔)至固体开始熔化(即全熔)的温度差不超过0.5~1℃,这个温度差叫做熔点范围(或称熔距、熔程)。
如果混有杂质则其熔点下降,熔距也较长,由此可以鉴定纯净的固体有机化合物。
由于根据熔距的长短还可以定性地估计出该化合物的纯度,所以此法具有很大的实用价值。
在一定温度和压力下,若某一化合物的固、液两相处于同一容器,这时可能发生三种情况:①固体熔化即固相迅速转化为液相;②液体固化即液相迅速转化为固相;③固液共存即固液两相同时存在。
如何决定在某一温度时哪一种情况占优势,可以从该化合物的蒸气压与温度的曲线图来理解,如图2-1所示。
图2-1(1)中曲线SM表示的是固态物质的蒸气压随温度升高而增大的曲线。
图2-1 (2)中曲线L’L表示的是液态物质的蒸气压随温度升高而增大的曲线。
如将曲线(1)、(2)加合,即得图2-1(3)曲线。
(1)(2)(3)图2-1 化合物的蒸气压与温度曲线由(3)可以看出:固相的蒸气压随温度的变化速率比相应的液相大,两曲线相交于M处,说明此时固、液两相的蒸气压是一致的。
此时对应的温度TM即为该化合物的熔点。
当温度高于TM时,固相的蒸气压比液相的蒸气压大,使得所有的固相全部转化为液相;反之,若低于TM时,则由液相转变为固相;只有当温度为TM时,固、液两相才能同时存在(即两相动态平衡,也就是说此时固相熔化的量等于液相固化的量)。
实验二 熔点测定

实验二熔点测定【实验目的】1.了解Thiele管法测定熔点的基本原理和熔点测定的意义——识别物质及定性检验物质的相对纯度。
2.掌握Thiele法测定熔点的操作方法。
【实验原理】纯粹的晶体有机物,在大气压下,固态与液态成平衡状态时(共存)的温度,称为该物质的熔点(melting point,记作m.p.)。
这是晶体有机物的一个十分重要的物理常数。
纯净的固体有机物一般都有固定的熔点,熔程不超过0.5-1℃。
由下图可见固相蒸气压随温度的变化速率比相应的液相大,两曲线相交,交点所对应的温度即熔点。
交点处固液两相共存,这是纯粹固体有机物有敏锐熔点的原因。
杂质对熔点的影响:熔点下降,熔程变长。
根据拉乌尔(Raoult)定律可知,在一定压力和温度下,增加溶质的量导致溶剂蒸汽压的降低(见下图),从而导致熔点下降【实验的准备】仪器:Thiele熔点测定管(又称提勒管、b形管);水银温度计(250℃);酒精灯;熔点管:内Φ1mm,L=6-7cm药品:尿素、肉桂酸、混合物。
液体石蜡(导热液)。
(苯甲酸、α-萘胺、β-萘酚、水杨酸可供备用)。
【物理常数】化合物名称熔点(℃)文献值实测值尿素134-135 133~134(A.R.) 132~134(C.P.)肉桂酸131-132130~132(C.P.) 苯甲酸122.4121~123(A.R.)120~123(C.P.) α-萘胺50 48~50(C.P.) β-萘酚122~123 120~122(C.P.) 水杨酸158.3 158~160(A.R.)【仪器安装要点】1.装好试料的熔点管用橡皮圈套附在温度计上,试料部分位于温度计水银球的中部。
2.温度计用一个刻有沟槽的单孔塞固定在Thiele管的中心轴线上,水银球的高度位于Thiele管上、下两叉口中间。
导热液的液位略低于Thiele管上叉口。
太少不能保证导热液的循环;太多导热液膨胀使橡皮圈浸入溶液中而逐渐溶胀、溶解甚至碳化。
实验二:重结晶及熔点的测定

实验二:重结晶及熔点的测定
实验目的:通过重结晶和测定熔点,从混合物中分离纯净的化合物。
实验原理:
重结晶是一种将溶液中的化合物通过结晶来分离纯净物质的方法。
在重结晶过程中,主要有两个步骤:先将混合物溶解在合适的溶剂中,形成稳定的溶液;然后控制溶剂的挥发,让化合物结晶出来。
结晶的纯度和得率取决于溶液中的化合物溶解度和结晶的条件。
熔点是物质的重要物理性质之一,它是指物质在固体和液体之间转变时的温度。
通过测量熔点,可以判断物质的纯度。
实验步骤:
1. 将待结晶的化合物与适量的溶剂混合加热,使之溶解。
2. 过滤溶液,去除杂质。
3. 将滤液缓慢冷却,以便化合物结晶。
可以通过搅拌、振荡或加冷水浴等方法加速结晶。
4. 将结晶物用滤纸过滤并用冷溶剂洗涤,以去除残留的溶剂或杂质。
5. 将结晶物放在干燥器中,使其完全干燥。
6. 测量纯净结晶物的熔点,记录下来。
注意事项:
1. 选择合适的溶剂,要求化合物在高温时能够溶解,而在低温时结晶出来。
2. 振荡或搅拌溶液可以加快结晶过程,但需要注意不要引入空气。
3. 熔点测定时,要使用特定的装置,如熔点计。
同时,确保准确地记录下熔点。
4. 实验过程中要注意安全,避免溶剂溅出或热伤害等意外情况的发生。
实验结果分析:
根据实验结果,可以判断出化合物的纯度和结晶条件的适用性。
如果结晶物的纯度高,熔点与理论值相符,则表明重结晶和熔点测定的方法有效;如果结晶物的纯度低,熔点偏离理论值,则需要重新考虑溶剂的选择或结晶条件的优化。
熔点测定第二法

熔点测定第二法熔点测定第二法是一种常用的实验方法,用于确定物质的熔点。
通过测量物质在升温过程中的温度变化,可以确定其熔点。
本文将介绍熔点测定第二法的原理、实验步骤和注意事项。
熔点是指物质从固态转变为液态的温度。
不同物质的熔点各不相同,是物质的重要性质之一。
熔点的测定对于物质的鉴定和纯度的检验具有重要意义。
熔点测定第二法的原理是利用物质在熔点附近的温度变化特性。
在熔点前后,物质的温度会发生明显的变化。
通过精确测量温度变化,可以确定物质的熔点。
实验步骤如下:1. 准备样品:将待测物质准确称取,一般取量在1-2毫克之间。
样品应尽量纯净,以确保测定结果的准确性。
2. 准备熔点仪器:将熔点仪器校准至所需温度范围。
熔点仪器通常由加热装置和温度控制装置组成。
3. 安装样品:将样品放置在熔点仪器的试管中。
试管应干燥洁净,以避免杂质对测定结果的影响。
4. 开始测量:启动熔点仪器,开始升温。
在升温过程中,记录样品的温度变化。
5. 观察熔点:当样品开始熔化时,温度会出现明显的变化。
记录样品熔化的温度范围,即为其熔点。
注意事项:1. 样品准备应尽量避免杂质的干扰,以保证测定结果的准确性。
2. 在测定过程中,应注意温度的均匀升高,避免温度变化过快或过慢。
3. 在观察熔点时,应注意样品是否完全熔化,以及熔化的温度范围。
4. 测定结果的准确性和可靠性与实验仪器的精度和操作者的经验有关。
在进行熔点测定时,应尽量选择准确的熔点仪器,并由经验丰富的操作者进行操作。
熔点测定第二法是一种简便、快速的测定方法,广泛应用于化学、药学等领域。
通过测定物质的熔点,可以确定其纯度和鉴定其身份。
同时,熔点的测定还可以用于确定物质的相变温度和热稳定性。
熔点测定第二法是一种重要的实验方法,可用于确定物质的熔点。
通过精确测量物质在升温过程中的温度变化,可以准确确定物质的熔点。
在进行熔点测定时,应注意样品的准备和仪器的选择,以确保测定结果的准确性和可靠性。
有机化学实验二熔点的测定
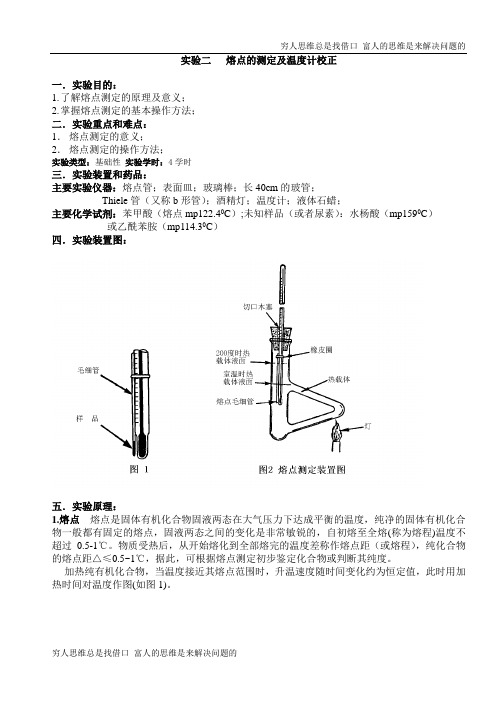
实验二熔点的测定及温度计校正一.实验目的:1.了解熔点测定的原理及意义;2.掌握熔点测定的基本操作方法;二.实验重点和难点:1.熔点测定的意义;2.熔点测定的操作方法;实验类型:基础性实验学时:4学时三.实验装置和药品:主要实验仪器:熔点管;表面皿;玻璃棒;长40cm的玻管;Thiele管(又称b形管);酒精灯;温度计;液体石蜡;主要化学试剂:苯甲酸(熔点mp122.40C);未知样品(或者尿素):水杨酸(mp1590C)或乙酰苯胺(mp114.30C)四.实验装置图:五.实验原理:1.熔点熔点是固体有机化合物固液两态在大气压力下达成平衡的温度,纯净的固体有机化合物一般都有固定的熔点,固液两态之间的变化是非常敏锐的,自初熔至全熔(称为熔程)温度不超过0.5-1℃。
物质受热后,从开始熔化到全部熔完的温度差称作熔点距(或熔程),纯化合物的熔点距△≤0.5~1℃,据此,可根据熔点测定初步鉴定化合物或判断其纯度。
加热纯有机化合物,当温度接近其熔点范围时,升温速度随时间变化约为恒定值,此时用加热时间对温度作图(如图1)。
图1 相随时间和温度的变化图2 物质蒸气压随温度变化曲线化合物温度不到熔点时以固相存在,加热使温度上升,达到熔点.开始有少量液体出现,而后固液相平衡.继续加热,温度不再变化,此时加热所提供的热量使固相不断转变为液相,两相间仍为平衡,最后的固体熔化后,继续加热则温度线性上升。
因此在接近熔点时,加热速度一定要慢,每分钟温度升高不能超过2℃,只有这样,才能使整个熔化过程尽可能接近于两相平衡条件,测得的熔点也越精确。
当含杂质时(假定两者不形成固溶体),根据拉乌耳定律可知,在一定的压力和温度条件下,在溶剂中增加溶质,导致溶剂蒸气分压降低(图2中M´L´),固液两相交点M´即代表含有杂质化合物达到熔点时的固液相平衡共存点,TM´为含杂质时的熔点,显然,此时的熔点较纯粹者低。
实验二熔点沸点的测定

1.规格及主要技术参数
• 熔点测定范围
室温~300℃
• “起始温度”设定速率 50℃-300℃ 不不小于3min
300℃一50℃ 不不小于5min
• 数字温度显示最小读数 0.1℃
• 线性升温速率℃/min 0.2、0.5、1、1.5、
2、3、4、5八档
• 测定熔点旳精度 不不小于200℃范围内: ± 0.5℃
3. 一般用蒸馏或分馏旳措施来测定液体旳 沸点,称为常量法;但若仅有少许试样 时,则用微量法测定能够得到满意旳成 果。
三、试验环节
(一)毛细管法测定熔点 1.样品旳填装:将毛细管旳一端封口, 把待测物研成粉末,将毛细管未封口旳一 端插入粉末中,使粉末进入毛细管,再将 其开口向上旳从大玻璃管中滑落,使粉末 进入毛细管旳底部。反复以上操作,直至 有2~3mm粉末紧密装于毛细管底部。
200℃~300℃范围内:±0.8℃
2.工作原理
仪器旳工作原理基于如下事实:物 质在结晶状态时反射光线,在熔融状态 时透射光线。所以,物质在熔化过程中 伴随温度旳升高会产生透光度旳跃变。
本仪器采用光电方式自动检测熔化 曲线旳变化。
• A点所相应旳温度ta称 为初熔点。
• B点所相应旳温度出称 为终熔点 (或全熔点)。
熔点
固体
固体和液体
液体
时间 图2 固体熔化相随着时间和温度而变化
加热纯固体化合物旳过程 中,有一段时间温度不变, 即固体开始熔化直至固体全 部转化为液体时,固体全部 转化为液体之后继续加热温 度就会线性上升。以上阐明 纯粹旳有机化合物有固定而 又敏锐旳熔点,同步要想精 确测定熔点,则在接近熔点 时升温旳速度不能太快,必 须严格控制加热速度,以每 分钟升高1~2℃为宜。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
实验二熔点测定
【实验目的】
1.了解Thiele管法测定熔点的基本原理和熔点测定的意义——识别物质及定性检验物质的相对纯度。
2.掌握Thiele法测定熔点的操作方法。
【实验原理】
纯粹的晶体有机物,在大气压下,固态与液态成平衡状态时(共存)的温度,称为该物质的熔点(melting point,记作 m.p.)。
这是晶体有机物的一个十分重要的物理常数。
纯净的固体有机物一般都有固定的熔点,熔程不超过0.5-1℃。
由下图可见固相蒸气压随温度的变化速率比相应的液相大,两曲线相交,交点所对应的温度即熔点。
交点处固液两相共存,这是纯粹固体有机物有敏锐熔点的原因。
杂质对熔点的影响:熔点下降,熔程变长。
根据拉乌尔(Raoult)定律可知,在一定压力和温度下,增加溶质的量导致溶剂蒸汽压的降低(见下图),从而导致熔点下降
【实验的准备】
仪器:Thiele熔点测定管(又称提勒管、b形管);水银温度计(250℃);酒精灯;熔点管:内Φ1mm,L=6-7cm
药品:尿素、肉桂酸、混合物。
液体石蜡(导热液)。
(苯甲酸、α-萘胺、β-萘酚、水杨酸可供备用)。
【物理常数】
注:A.R.为分析纯; C.P.为化学纯。
【仪器安装要点】
1.装好试料的熔点管用橡皮圈套附在温度计上,试料部分位于温度计水银球的中部。
2.温度计用一个刻有沟槽的单孔塞固定在Thiele管的中心轴线上,水银球的高度位于Thiele管上、下两叉口中间。
导热液的液位略低于Thiele管上叉口。
太少不能保证导热液的循环;太多导热液膨胀使橡皮圈浸入溶液中而逐渐溶胀、溶解甚至碳化。
附:导热液的选择参考(导热液的选择视所需温度而定)
1.< 140℃可用液体石蜡或甘油(药用液体石蜡可加热至220℃仍不变色)。
2.>140℃可用浓硫酸(温度超过250℃,浓硫酸发生白烟,防碍温度的读数)。
注意:(1)用浓硫酸作导热液时要戴护目镜。
(2)浓硫酸变黑后可加一些硝酸钾晶体。
3.>250℃可用浓H2SO4和K2SO4的饱和溶液:
浓H2SO4:K2SO4=7:3(重量)可加热到325℃;
浓H2SO4:K2SO4=3:2(重量)可加热到365℃;
还可用H3PO4(可加热到300℃)、硅油(可加热到365℃),但硅油价格较贵。
【操作要点】
1.熔点管的准备:
准备3支熔点管,Φ=1.0 mm,L=60~70 mm (管壁均匀)。
2.试料及其填充:
试料要研细(受潮的试料应事先干燥),填充装的要均匀、结实。
装料高度为2~3 mm。
3.加热速度:
升温速度是测得的熔点数据准确与否的关键。
(1)已知样:
开始升温速度可快些(5-8℃/min),距熔点约10~15℃时,升温速度1~2℃/min,愈接近熔点,升温速度愈慢,以0.5~1℃/min为宜。
(2)未知样:
至少要测两次。
第一次以5℃/min左右的升温速度粗测,可得到一个近似的熔点;第二次开始时升温速度可快些,待达到比近似熔点低10℃时,改用小火,使温度以0.5-1℃/min的速度缓慢而均匀地上升。
4.熔点的记录:
应记录熔点管中刚有小滴液体出现(即初熔温度t1)和试料恰好完全熔融(即全熔温度t2)这两个温度点的读数。
以及计算熔程(t2-t1),每个样品测定两次,取平均值。
注意:
(1)记录时不能取初熔温度到全熔温度的平均值,即熔程为123℃-125℃,不可记录为124℃。
(2)若物质120℃时开始收缩(坍塌),121℃开始出现液滴,122℃全部液化,熔程的记录
应该是121-122℃,且不可把120℃收缩时的温度作为初熔温度。
因为化合物在熔融前的瞬间会发生正常地软化和收缩,这种行为仅代表晶体结构的一种改变;某些物质在熔融前有“出汗”或者说是放出结晶溶剂的倾向,这种改变也不是熔融的开始。
熔融的开始仍然以看到第一滴液体为准。
(3)有些化合物在熔融的同时发生分解, 这种分解通常显示为样品变色。
该分解点
经常作为一个可信赖的物理性质来代替实际的熔点。
【思考题】
一、测定熔点时,遇到下列情况将产生什么结果?
(1) 熔点管壁太厚;(2) 熔点管不洁净;(3) 试料研的不细或装得不实;(4)加热太快;
(5) 第一次熔点测定后,热浴液不冷却立即做第二次;(6)温度计歪斜或熔点管与温度
计不附贴。
答:(1) 熔点管壁太厚,影响传热,其结果是测得的初熔温度偏高。
(2) 熔点管不洁净,相当于在试料中掺入杂质,其结果将导致测得的熔点偏低。
(3) 试料研得不细或装得不实,这样试料颗粒之间空隙较大其空隙之间为空气所占据,
而空气导热系数较小,结果导致熔程加大,测得的熔点数值偏高。
(4) 加热太快,则热浴体温度大于热量转移到待测样品中的转移能力,而导致测得的
熔点偏高,熔程加大。
(5) 若连续测几次时,当第一次完成后需将溶液冷却至原熔点温度的二分之一以下,才
可测第二次,不冷却马上做第二次测量,测得的熔点偏高。
(6) Thiele熔点测定的缺点就是温度分布不均匀,若温度计歪斜
或熔点管与温度计不附贴,这样所测数值会有不同程度的偏差。
二、是否可以使用第一次测定熔点时已经熔化了的试料使其固化后做第二次测定?
答:不可以。
因为有时某些物质会发生部分分解,有些物质则可能转变为具有不同熔点的其它结晶体。
三、测得A、B两种样品的熔点相同,将它们研细,并以等量混合(1) 测得混合物的熔点有下降现象且熔程增宽;(2)测得混合物的熔点与纯A、纯B的熔点均相同。
试分析以上情况各说明什么?
答:(1)说明A、B两个样品不是同一种物质,一种物质在此充当了另一种物质的杂质,故混合物的熔点降低,熔程增宽。
(2)除少数情况(如形成固熔体)外,一般可认为这两个样品为同一化合物。
