胶体
胶体

紧密层
0热力学电势差:
固体表面与溶液本体间的电势差
x
双 电 层 的 Stern 模 型
当溶胶相对静止时,整个溶胶体系是电中性的,但 当分散相粒子和液体介质相对运动时,就会产生电位差, 这种电位差叫电动电势。 胶粒是带电的,由于静电引力使反粒子在表面周围,
又由于分子热运动,使反粒子在表面附近呈扩散分布。
离表面近的一层——紧密层(内层),厚度(约几
1869年,发现了Tyndall效应,可区别溶胶及溶液;
1903年,德国科学家Zsigmondy发明了超显微镜, 肯定溶胶的一个根本问题—体系的多相性,从而明确了 胶体化学是界面化学。
1907年,德国化学家Ostwald创办《胶体化学和工
业杂志》—胶体化学正式成为一门独立的学科。 1941年,前苏联的德查金(Derjaguin B V)和朗道 (Landau L D)以及1948年荷兰的维韦(Werwey E J W)和 奥佛比克(Overbeek J T G)胶体稳定性的DLWO理论。从 70年代起,对高分子稳定胶体的研究逐渐成为热点,其中
φ0
+ + + + + + + + + + + +
δ
φ0
+ + + + + + + + + + + + +
-
A B x -
平板双电层模型
扩散双电层模型
质 点 表面+ + + + + + + + + +
胶体

四、胶体的性质
胶体的性质1、 丁达尔现象
当一束强光透过胶体时,可以看到一条光 亮的通路,这种现象叫做丁达尔现象。
胶体的性质2: 布朗运动
在超显微镜下观察胶体溶液可以看到胶体颗粒 不断地作无规则的运动。
普遍存在 的现象
胶体的性质3、 渗析
利用溶液与胶体的 这一区别,把混有 离子或分子杂质的 胶体装入半透膜袋, 并且浸入溶剂中, 使离子或分子从胶 体中分离出去,这 样的操作叫做渗析
水 水
水
分散质直径
溶液
1nm > d 1nm < d <100nm 100nm < d
分散系
胶体 浊液
二、胶体的定义
分散质微粒的直径大小在1nm—100nm 之间的分散系叫胶体
( 10-9m~10-7m) 生活中常见的胶体:墨汁,淀粉溶液,豆浆,血 液,空气
三、胶体的制备
制备原理:使分散质粒子大小在1nm ~ 100nm 之间 (1)高分子形成的溶液,如: 蛋白质溶液,淀粉溶液 (2)物理分散法,如 墨汁,炭素墨水 (3)化学方法(结合法),如: Fe(OH)3胶体,AL(OH)3胶体,AgI胶体
胶体的应用
血液透析
豆腐的制作
指甲花与明矾捣碎
自来水的净化
四、胶体的分类
根据分散质 微粒的构成
粒子胶体:Fe(OH)3胶体、AgI胶体 分子胶体:淀粉溶液、蛋白质溶液
气溶胶:烟、云、雾
据分散剂 状态分类 液溶胶:AgI胶体、Fe(OH)3胶体 固溶胶:有色玻璃、烟水晶
不同分散系的比较
分散系 溶液 <1nm 悬浊液 >100nm 乳浊液 >100nm 很多分子集 合体 胶体 1nm— 100nm
常见胶体举例

常见胶体举例
(最新版)
目录
1.引言
2.常见胶体举例
2.1 空气
2.2 海洋
2.3 土壤
2.4 生物体
3.结论
正文
【引言】
胶体是一种特殊的物质形态,由两种或两种以上的物质组成,其中一种物质呈胶状分散于另一种物质中。
在我们生活中,胶体无处不在,下面我们来看看一些常见的胶体例子。
【常见胶体举例】
2.1 空气
空气是一种典型的胶体,由氮气、氧气和少量的其他气体组成。
在空气中,氮气和氧气以胶状分散于空气中,使我们能够呼吸到新鲜的空气。
2.2 海洋
海洋中的海水也是一种胶体,主要由水和溶解其中的盐类组成。
此外,海洋中还存在着大量的生物,这些生物和海水共同构成了一个庞大的生态系统。
2.3 土壤
土壤是陆地上最重要的胶体,由固体颗粒、水分和空气组成。
土壤中的固体颗粒包括了各种矿物质和有机物质,它们是植物生长的基础。
2.4 生物体
生物体也是一种特殊的胶体,由细胞和细胞间质组成。
细胞是生物体的基本单位,通过细胞间质的连接,形成各种组织和器官,构成完整的生物体。
【结论】
胶体在我们生活中无处不在,从空气到海洋,从土壤到生物体,都存在着各种形态的胶体。
胶体
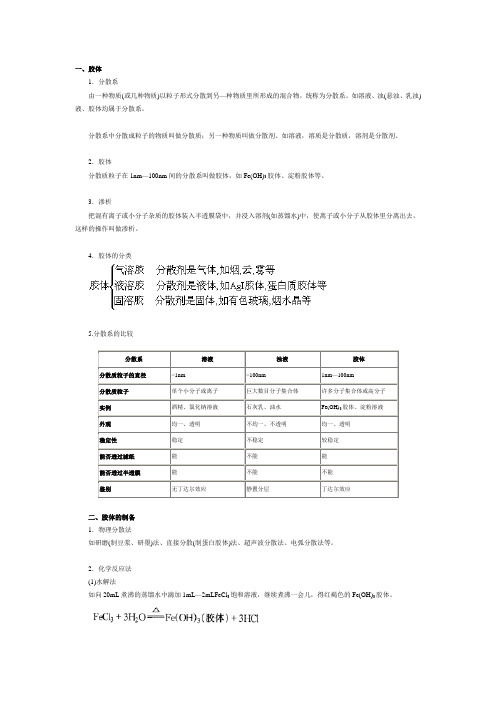
一、胶体1.分散系由一种物质(或几种物质)以粒子形式分散到另—种物质里所形成的混合物,统称为分散系。
如溶液、浊(悬浊、乳浊)液、胶体均属于分散系。
分散系中分散成粒子的物质叫做分散质;另一种物质叫做分散剂。
如溶液,溶质是分散质,溶剂是分散剂。
2.胶体分散质粒子在1nm—100nm间的分散系叫做胶体,如Fe(OH)3胶体、淀粉胶体等。
3.渗析把混有离子或小分子杂质的胶体装入半透膜袋中,并浸入溶剂(如蒸馏水)中,使离子或小分子从胶体里分离出去,这样的操作叫做渗析。
4.胶体的分类5.分散系的比较二、胶体的制备1.物理分散法如研磨(制豆浆、研墨)法、直接分散(制蛋白胶体)法、超声波分散法、电弧分散法等。
2.化学反应法(1)水解法如向20mL煮沸的蒸馏水中滴加1mL—2mLFeCl3饱和溶液,继续煮沸一会儿,得红褐色的Fe(OH)3胶体。
(2)复分解法①向盛有10mL 0.01mol/LKI的试管中,滴加8—10滴0.01mol/LAgNO3溶液,边滴边振荡,得浅黄色AgI胶体。
AgNO3十KI=AgI(胶体)十KNO3②在一支大试管里装入5mL—10mL1mol/LHCl,加入1mL水玻璃,然后用力振荡即可制得硅酸溶胶。
Na2SiO3十2HCl十H2O=2NaCl十H4SiO4(胶体)除上述重要胶体的制备外,还有:①肥皂水(胶体):它是由C17H35COONa水解而成的。
②淀粉溶液(胶体):可溶性淀粉溶于热水制得。
③蛋白质溶液(胶体):鸡蛋白溶于水制得。
三、胶体的提纯——渗析法将胶体放入半透膜袋中,再将此袋放入蒸馏水中,由于胶粒直径大于半透膜的微孔,不能透过半透膜,而小分子或离子可以透过半透膜,使杂质分子或离子进入水中而除去。
如果一次渗析达不到纯度要求,可以把蒸馏水更换后重新进行渗析,直至达到要求为止。
半透膜的材料:蛋壳内膜,动物的肠衣、膀胱等。
1.渗析与渗透的区别渗析:分子、离子通过半透膜,而胶体粒子不能通过半透膜的过程。
高一化学必修一知识点:化学胶体

高一化学必修一知识点:化学胶体1、胶体的定义:分散质粒子直径大小在10-9~10-7m之间的分散系。
2、胶体的分类:①.根据分散质微粒组成的状况分类:如:胶体胶粒是由许多等小分子聚集一起形成的微粒,其直径在1nm~100nm之间,这样的胶体叫粒子胶体。
又如:淀粉属高分子化合物,其单个分子的直径在1nm~100nm 范围之内,这样的胶体叫分子胶体。
②.根据分散剂的状态划分:如:烟、云、雾等的分散剂为气体,这样的胶体叫做气溶胶;AgI溶胶、溶胶、溶胶,其分散剂为水,分散剂为液体的胶体叫做液溶胶;有色玻璃、烟水晶均以固体为分散剂,这样的胶体叫做固溶胶。
3、胶体的制备A.物理方法①机械法:利用机械磨碎法将固体颗粒直接磨成胶粒的大小②溶解法:利用高分子化合物分散在合适的溶剂中形成胶体,如蛋白质溶于水,淀粉溶于水、聚乙烯熔于某有机溶剂等。
B.化学方法①水解促进法:FeCl3+3H2O(沸)=(胶体)+3HCl②复分解反应法:KI+AgNO3=AgI(胶体)+KNO3Na2SiO3+2HCl=H2SiO3(胶体)+2NaCl思考:若上述两种反应物的量均为大量,则可观察到什么现象?如何表达对应的两个反应方程式?提示:KI+AgNO3=AgI↓+KNO3(黄色↓)Na2SiO3+2HCl=H2SiO3↓+2NaCl(白色↓)4、胶体的性质:①丁达尔效应——丁达尔效应是粒子对光散射作用的结果,是一种物理现象。
丁达尔现象产生的原因,是因为胶体微粒直径大小恰当,当光照射胶粒上时,胶粒将光从各个方面全部反射,胶粒即成一小光源(这一现象叫光的散射),故可明显地看到由无数小光源形成的光亮“通路”。
当光照在比较大或小的颗粒或微粒上则无此现象,只发生反射或将光全部吸收的现象,而以溶液和浊液无丁达尔现象,所以丁达尔效应常用于鉴别胶体和其他分散系。
②布朗运动——在胶体中,由于胶粒在各个方向所受的力不能相互平衡而产生的无规则的运动,称为布朗运动。
胶体

1、定义:由一种或几种物质分散Leabharlann 另一种物质中得到的体系,即分散系。
分散质 分散剂
溶液
分散质微粒直径 < 1nm
2、分类:
胶体
1nm<分散质微粒直径 < 100nm
浊液
分散质微粒直径 > 100nm
悬浊液 乳浊液
胶体
1、定义:分散质微粒直径介于1nm-100nm之间的分散系,即胶体。
2、分类
聚沉
聚沉
小结: 三种分散系的比较
分散系
分散质粒 子的直径
溶液
<1nm
均一、透明 分子、离子
胶体
1nm~100nm
较均一 透明 粒子/高分子
浊液
>100nm
不均一 不透明 大量粒子
外观
分散质微粒 能否透过滤纸 能否透过 半透膜
能
能
不能
能
稳定
不能
较稳定
不能
不稳定
稳定性
⑶聚沉:
使分散质聚集成较大的微粒,在重力作用下形成沉淀析出。
能使胶体聚沉的方法:
1、加入电解质(中和)
2、加入带相反电荷的胶体 3、加热 4、搅拌
6.胶体的用途:
电泳 (1)静电除尘 聚沉 (2)硝酸铵肥效较差 聚沉 (3)明矾净水 (4)FeCl3溶液用于伤口止血 (5)黄河入海口形成三角洲 聚沉 (6)微波手术刀止血
气溶胶 液溶胶 固溶胶
云、烟、雾
豆浆、牛奶、墨水、肥皂水 果冻、有色玻璃、豆腐
按分散剂状态
粒子胶体 按胶粒组成 分子胶体
Fe(OH)3胶体、AgI胶体 淀粉溶液
3、胶体的制备:
物理法:分子胶体,可直接溶解,如淀粉溶液。 化学法: 粒子胶体
胶体

胶体溶液中,逐滴加入HCL 在Fe(OH)3胶体溶液中,逐滴加入 稀溶液,会出现一系列变化。 稀溶液,会出现一系列变化。 (1)先出现红褐色沉淀,原因是 先出现红褐色沉淀, 先出现红褐色沉淀 HCL为电解质,可使 为电解质, 为电解质 可使Fe(OH)3溶胶发生聚沉 _____________________________ (2)随后沉淀溶解,溶液呈黄色,写 随后沉淀溶解, 随后沉淀溶解 溶液呈黄色, 出此反应的离子方程式 Fe(OH)3十3H+=Fe3+十3H2O _____________________________。
4.电泳电镀 利用电泳将油漆、乳胶、 电泳电镀:利用电泳将油漆 乳胶、 电泳电镀 利用电泳将油漆、 橡胶等粒子均匀地沉积在镀件上。 橡胶等粒子均匀地沉积在镀件上。 5.医学上利用血清的纸上电泳进行某些 医学上利用血清的纸上电泳进行某些 医学上 疾病的诊断。 疾病的诊断。
胶体为什么能够稳定存在? 胶体为什么能够稳定存在?
二.胶体的性质
4. 胶体的聚沉:使胶体粒 子聚集成 较大的颗粒,形成沉淀,从分散剂里 较大的颗粒,形成沉淀, 析出的过程。 析出的过程。
1.分析MgSO 溶液加入Fe(OH) 胶体中后,发生凝聚的原因。 1.分析MgSO4溶液加入Fe(OH)3胶体中后,发生凝聚的原因。 分析 已知NaCl NaCl使 胶体凝聚的效果不如等浓度的MgSO 2.已知NaCl使Fe(OH)3胶体凝聚的效果不如等浓度的MgSO4? 卤水点豆腐”是把CaSO 3.“卤水点豆腐”是把CaSO4(或MgCl2)加入豆浆中发生凝聚 制得豆腐。但如用Na 等盐效果却不如前者, 制得豆腐。但如用Na2SO4、 K2SO4等盐效果却不如前者, 说明豆浆胶体带什么电? 说明豆浆胶体带什么电?
胶体的性质及其应用

胶体具有介稳性的原因
主要是因为胶体粒子表面积大,可以通 过吸附而带电荷。同种胶体粒子的电性相 同,在通常情况下,它们之间的相互排斥 阻碍了胶体粒子变大,使它们不容易聚集。 胶体粒子所作的布朗运动也使得它们不容 易聚集成质量较大的颗粒而沉降下来。
3、胶体的电泳:在外加电场的作用下,胶 粒定向地向阴极或阳极运动。 原因:胶粒吸附离子而带同种电荷。 带正电:金属氧化物、金属氢氧化物胶体 如Fe2O3 、 Al(OH)3胶体等 带负电:非金属氧化物、金属硫化物胶体 如H2SiO3(SiO2) 、 Sb2S3胶体等 应用:⑴ 静电除尘 ⑵ 精制粘土 ⑶ 血清电泳用于诊断疾病
3、已知土壤胶体粒子带负电,在土壤里施用含 氮量相等的下列肥料,肥效较差的是 ( C ) A.(NH4)2SO4 B.NH4HCO3 C.NH4NO3 D.NH4Cl 4、下列事实与胶体知识有关的是 ( D) ①用卤水点豆腐 ②工厂烟窗用电极除尘 ③河 海交接处易沉积形成沙洲 ④向25ml沸腾的蒸馏 水中加入5-6滴饱和FeCl3溶液所得液体. A.①②③ B.②③④ C.①③④ D.全部都是
凝胶的形成: 胶体在聚沉的过程中由于某种原因使分散 剂一起聚沉成的一种不流动的胶冻状物质。 如:豆腐脑、果冻等
三、胶体的制备方法 1、分散法:大→小 ⑴ 、研磨法:把固体磨成直径大小为1nm~ 100nm之间的微粒,再分散到适当 的分散剂中, 并加入稳定剂。
如:工业制石墨胶体、有色玻璃、碳素墨水、 涂料、颜料、炸药、塑料、橡胶等。 ⑵ 、胶溶法 2 、凝聚法:小→大 AgNO3 + KI = AgI(胶体) + KNO3 注意:⑴溶液浓度足够稀(0.001mol/L)。 ⑵有一种反应物必须过量。 四、胶体的精制—渗析
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
二、胶体的制备
实验:沸水中滴加饱和氯化铁溶液
D
FeCl 3+ 3H2O Fe(OH)3(胶体) + 3HCl
渗析:使离子、分子从胶体中分离出去 (净化胶体)
胶体与溶液的分离、提纯: ---渗析 ⑴原理:胶粒直径较大不能透过半透膜 ⑵定义:把混有离子或分子杂质的胶体装入半透 膜袋,并浸入溶剂中,使离子或分子从 胶体里分离出去,这样的操作叫做渗析。
> 10 0n m
胶体
水
氢氧化铁
大分子或 1- 100nm 均一稳定 分子离子 的集合体
澄 清 透 明 分 子 、 <1nm 均一稳定 离子
溶液
水
硝酸钾
一、胶体
胶体:分散质微粒直径在1~100nm之 间的分散系。
胶体的分类:
按照分散剂的状态不同可分为 液溶胶 分散剂为液体 气溶胶 分散剂为气体(云、雾、烟) 固溶胶 分散剂为固体(有色玻璃、烟水晶)
• 胶体微粒(胶粒)具有吸附能力,
能吸附溶液中的离子使胶粒带电。
例如:氢氧化物、金属氧化物胶粒
易吸附阳离子——带正电; 硅酸、
硫化物、非金属氧泳
原因:带电的胶体微粒在电场作用下 发生了定向移动。
4、胶体的凝聚
原因:当破坏胶体微粒原来带有相同电 荷的特点时,就会使它从不容易 凝聚的状态变成聚集状态而沉淀 胶体凝聚的方法: ⑴加电解质溶液 (2)加带相反电荷的胶体 (3)加热
胶 体
分散系:由一种(或几种)物质的微粒
分散于另一种物质里形成的混
合物。
分散质:分散系中分散成微粒的物质。 分散剂:分散系中微粒分散在其中的物质。
分散系
悬浊液
分散剂
水
分散质
沙子
特征
浑浊,静 置后分层
分散质微 分散质微 粒 粒直径
固体 小颗粒 > 100nm
乳浊液
水
油
浑 浊 , 静 小液滴 置后分层
四、胶体的应用
* 豆腐的制作 * 盐碱地保肥能力差
* 三角洲的形成
思考题:
在氢氧化铁胶体中逐滴加入稀硫酸, 会产生什么现象?
布朗运动
1、微观解释
2、微粒路径
布朗运动
微粒路径
注 ⑴胶体提纯时要多次渗析。 意
⑵通过验证溶剂中是否有含有杂质离子或分子 检验胶体是否提纯完全。
---过滤
胶体与悬浊液的分离
渗析示意图
三、胶体的重要性质
1、丁达尔现象
原因:胶体粒子较大(1~100nm),对 光具有 散射作用,光在胶体的通路中出现 一条明亮的光带。
2、布朗运动
原因:胶体微粒受分散剂分子不停的、无 规则的撞击,形成不停的、无秩序的 运动。
