第九章 配位化合物
普通化学 第九章 配位化合物与配位平衡

配合物的稳定性及配位平衡
2 中心离子的水解效应 若溶液酸度太小,金属离子易发生水解,金属离子 浓度减小,使配离子发生解离。
Fe3+ + 3C2O42- = Fe(C2O4)33+ 3OH– 3Fe(OH)3
Fe(C2O4)33- + 3OH– = 3Fe(OH)3 ↓ + 3C2O42-
配合物的稳定性及配位平衡
习惯上沿用
K3[Fe(CN)6] K4[Fe(CN)6]
铁氰化钾
亚铁氰化钾
配位化合物的基本概念
无机化合物 分子式 H 2 SO 4 NaOH KBr 名称 硫酸 氢氧化钠 溴化钾 分子式 H 2 [PtCl 6 ] [Cu(NH 3 ) 4 ](OH) 2 [Ag(NH 3 ) 2 ]Br [Cr(NH 3 ) 4 (H 2 O) 2 ]Cl 3 K 2 [HgI 4 ] K[Co(NO 2 ) 4 (NH 3 ) 2 ] K 2 SO 4 硫酸钾 [Cu(NH 3 ) 4 ]SO 4 [Co(NH 3 ) 2 (en) 2 ](NO 3 ) 3 [Pt(py) 4 ][PtCl 4 ]
配位化合物 名称 六氯合铂 (IV) 酸 氢氧化四氨合铜 (II) 溴化二氨合银 (I) 氯化四氨· 二水合铬 (III) 四碘合汞 (II) 酸钾 四硝基· 二氨合钴 (III) 酸钾 硫酸四氨合铜 (II) 硝酸二氨·二(乙二胺)合钴(III) 四氯合铂 (II) 酸四吡啶合铂 (II)
第二节
1 K = K fθ Kθ sp
θ
影响水解效应大小的因素: (1) KfӨ越小,配合物越易解离, (2)介质酸度越小,pH越高,
配位化合物的基本概念
配合物形成的原因
(1)内外界之间为离子键,配合物可解离。
无机及分析化学第九章 配位滴定法

第六章
配位化合物
二、指示剂应具备的条件
1)MIn与In颜色明显不同,显色迅速,变色 可逆性好 2)MIn的稳定性要适当:KMY / KMIn >102 a. KMIn太小→置换速度太快→终点提前 b. KMIn 太大→置换难以进行→终点拖后或 无终点 3) In本身性质稳定,便于储藏使用 4)MIn易溶于水,不应形成胶体或沉淀
第六章
配位化合物
表观稳定常数K’稳越大,突跃范围越大。
cM=0.01mol· -1, L K’稳<108,无突跃。
第六章
配位化合物
溶液酸度
lgK’稳= lgK稳 – lgα
pH↑→酸效应系数α ↓ →K’稳↑ →突跃范围↑
第六章
配位化合物
金属离子被准确滴定的条件
lgcMK'稳≥6 若cM=0.01mol/L, lg(0.01×K'稳)≥6 则:lgK’稳≥8
CNK’NY稳<106
第六章
配位化合物
几种离子共存——M,N( N为干扰离子)
a. MY的允许最低 pH比NY的低:
N M
控制酸度, 减小K’NY
使 CNK’NY<106 ; CMK’MY>106
b. MY的允许最低 pH比NY的高:
第六章
配位化合物
3.钙指示剂(简称NN或钙红): 紫黑色粉末
终点:酒红→纯蓝
适宜pH:12.0~13.0(碱性区) pKa1=9.26 pKa2=13.67
H2In2pH<8
HIn3-+H+
pH=8~13
In4-+2H+
pH>13
酒红色
无机化学-配合物

此外,还有其它类型的配体,如两个原子与中心 原子形成一个配键(含π电子的烯烃)、一个原 子同时与两个中心原子配位的桥连配体等。
3.配位数与配体数
配合物中与中心原子相连的配体的数目称为配体 数,而与中心原子相连的配位原子的总数称为 配位数。很显然,对于单齿配体,配位数与配 体数相同,而对于多齿配体来说,二者则不相 同。例如[Fe(CN)6]3+中Fe3+的配体数和配位数都 为6;[Cu(cn)2]2+中Cu2+的配体数为2,配位数为 4。
Ag+
杂化 成键
4d10 4d10 4d10
5s
5p
sp杂化轨道
5p
spsp3
5p
2个电子对由
NH3分子中N 原子提供
[Ag(NH3)2]+ 配离子的空间构型为直线形; 为外轨型配合物;配位数为2;由于没有单电 子,所以[Ag(NH3)2]+配离子为抗磁性。
其它如[Ag(CN)2]-、[Cu(NH3)2]2+等,情况也 都类似。
天蓝色
深蓝色
[Cu(NH3)4]2++4OH-(少量)
深蓝色
在水溶液中SO42-是自由的,能独立地显示其 化学性质(如与BaCl2生成白色沉淀)。但 这时化合物中的Cu2+和NH3已经结合为 Cu(NH3)42+离子了,从而在一定程度上丧失 了Cu2+和NH3各自独立存在时的化学性质, 实际上它们形成了稳定性很高的新的结构,
H3N H3N
Cl NH3
Co NH3
Cl
第二节 配合物的化学键理论
• 有关配合物的结构问题,实质是中心原子 与配体之间靠什么结合在一起以及配合物 的空间构型问题。这个问题有不少科学家 提出了各种各样的理论,其中1893年维尔 纳提出的主、副价说最有代表性,维尔纳 也被称为近代配合物化学的创始者。他认 为在配离子如PtCl62-中,Pt4+除了以主价 (符合经典化合价理论的价)与4个Cl-结合 以外,还能以副价同额外的两个Cl-结合成 PtCl62-。
张祖德《无机化学》修订版辅导用书-章节题库-第9章 配位化合物【圣才出品】

正四面体结构;D 项,为 dsp2 杂化,具有平面正方形结构。
6.关于配合物[Cu(NH3)4][PtCl4],下列判断正确的是( )。 A.正负离子都是配离子 B.二者都是外界 C.前者是外界 D.后者是外界 【答案】A 【解析】[Cu(NH3)4][PtCl4]中[Cu(NH3)4]2+和[PtCl4]2-互为内外界。配合物可以无外 界,如 Ni(CO)4 和[Cu(NH2CH2COO)2]。
11.下列叙述正确的是( )。 A.配合物由正、负离子组成 B.配合物由中心离子(或原子)与配位体以配位键结合而成 C.配位数是中心原子结合的配位体个数 D.配合物中的配位体是含有未成键的孤对电子的离子 【答案】B
5 / 51
圣才电子书
十万种考研考证电子书、题库视频学习平 台
6 / 51
圣才电子书
十万种考研考证电子书、题库视频学习平
台
13.下列物质中能够在强酸中稳定存在的是( )。
A.[Ag(S2O3)2]3-
B.[Ni(NH3)6]2+
C.[Fe(C2O4)3]3-
D.[HgCl4]2-
【答案】D
【解析】在水溶液中,四种配离子均会发生解离,由于 S2O32-、NH3 和 C2O42-都是
的标准电极电势 EΘ 。
4 / 51
圣才电子书
十万种考研考证电子书、题库视频学习平 台
10.下列离子分别与强配体和弱配体形成八面体配合物,其中磁矩相差最小的是( )。
A.Mn2+ B.Fe2+ C.Co2+ D.Cu2+ 【答案】D 【解析】A 项,Mn2+在八面体弱场中单电子数为 5,在八面体强场中单电子数为 1;B 项,Fe2+在八面体弱场中电子数为 4,在八面体强场中单电子数为 0;C 项,Co2+ 在八面体弱场中单电子数为 3,在八面体强场中单电子数为 1;D 项,Cu2+在八面体强场 中和弱场中单电子数均为 1。
配位化合物
配位数
2 3 4 4 5 5 6 6
中心 杂化方式
构型
实例
sp sp2 sp3 dsp2 dsp3 sp3d sp3d2 d2sp3
直线形 [ Ag( NH3)2 ]+ 三角形 [ Cu(CN)3 ]2- 四面体 [ Zn(NH3)4 ]2+ 正方形 [ N(i CN)4 ]2-
三角双锥 [ F(e CO)5 ] 三角双锥 [ Fe(SCN)5 ]2-
2 溶剂合异构
当溶剂分子取代配位基团而进入配离子的内界所
产生的溶剂合异构现象。与电离异构极为相似, 最熟悉 的例子是:
[Cr(H2O)6]Cl3 [Cr(H2O)5Cl]Cl2·H2O [Cr(H2O)4Cl2]Cl·2H2O 在配合物的内界,各含有6、5、4个配位水分子 和0、1、2个配位氯离子, 在配合物的外界各含有0、1 、2个溶剂合水分子和3、2、1个可电离的氯离子。这 些异构体在物理和化学性质上有显著的差异,如它们的 颜色分别为绿、蓝绿、蓝紫。
4p 4s
dsp2杂化
Ni(CN)24
八面体构型
对于F-,H2O等配体而言,配位原子F,O的电负性大, 不易给出孤对电子对,所以对中心体的3d轨道上的 电子不发生明显的影响,因此3d轨道上的电子排布 情况不发生改变 ,形成外轨型配合物。
对于CN-,CO等配位体而言,配位原子C的电负性小, 较易给出孤对电子对,对中心体的3d轨道发生重大 影响,从而使3d发生了电子重排,腾出能量较低的 内层(n-1)d轨道与ns,np轨道杂化,形成内轨型配合 物。
en
en
AACoe Nhomakorabea enCo
en
en
[Co(en)3])
A M
配位化合物

配位化合物一、配位化合物的定义往CuSO4的稀溶液滴加6mol/L的氨水不断振摇,开始时有天蓝色Cu(OH)2沉淀,继续再加氨水时,沉淀消失。
在溶液中检查不到Cu2+却只能检测到SO42-,推测生成了一种新物质,用酒精沉淀,再经结构分析:该物质为[Cu(NH3)4]SO4·H2O。
物质[Ag(NH2)]NO3,K2[HgI4]……,在水溶液中形成离子[Cu(NH3)4]2+,[Ag(NH2)]+,[HgI4]2-。
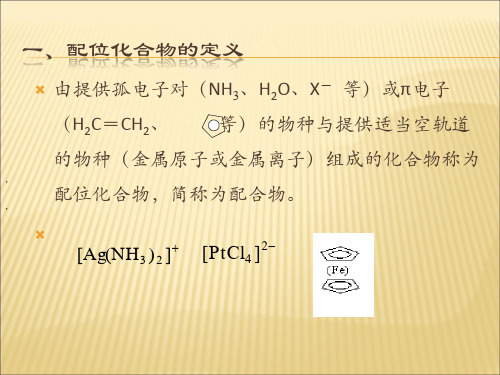
金属离子(或原子)与一定数目的中性分子或负离子结合成不易离解的复杂离子称为配离子。
含有配离子及配位分子的化合物统称为配合物。
配合物与复盐如明矾[KAl(SO4)2]12H2O不一样,不能相混。
二、配合物的组成以[Cu(NH3)4] SO4为例其组成可表示配位离子1.中心原子:一般为金属阳离子(原子),特别是过渡金属离子,Fe、Co、Ni、Cu、Ag、Au等。
2.配体:中心原子周围的分子或离子(可以是阴离子,也可以是中性分子)。
3.配位原子:配体中能向中心原子提供孤对电子的原子如NH3中的N原子,H2O中的O原子,CN-中的C原子,以N、P、O、S、C等原子居多。
配体又分:4.配位数:直接与中心原子相结合的配位原子总数。
以2、4、6较为多见。
在[Pt(en)2]Cl其配位数为4。
5.配离子电荷:中心原子和配位体电荷的代数和。
如[Cu(NH3)4]2+、[Fe(CN)6]4-。
三、配位化合物的类型1.简单配位化合物单齿配位体与单个中心离子(或原子)所形成的配合物K2[PtCl6][Fe(H2O)6]Cl5[Cr(H2O)6]Cl3Na[AlF6]2.螯合物由中心离子和多齿配体结合而成的环状配合物。
思考题:在制剂中作为金属离子络合剂使用的是A.NaHCO3B.NaClC.焦亚硫酸钠D.NaOHE.依地酸二钠【正确答案】E四、配位平衡Ks(K稳)称为配离子的稳定常数,Ks越大,说明生成配离子的倾向越大,配合物越稳定。
配位化合物的基本概念

如: Pt2+ + 2Cl + 2NH3 [Pt [Co(NH3)3(H2O)3] ③、定义配合物 配合分子和含有配离子的化合物统称配合物。 配合分子和含有配离子的化合物统称配合物。 如:[Cu( NH3)4]SO4、K2[HgI4]……
4
二、配合物的组成: 配合物的组成:
K2[HgI4]
返回3 返回3
15
例2: :
阴离子配体 ①按所带电荷分: 按所带电荷分: 配体分类: 配体分类: 单基( 单基(齿) ②按所能提供配位原子数目分: 按所能提供配位原子数目分: 多基(齿) 多基( 中性分子配体
返回6 返回6
16
11
[Cr(OH)3(H2O)(en )] 三羟基· 乙二胺合铬(III) 三羟基·水·乙二胺合铬(III) [CoCl 2•H2O• (NH3) 3]Cl 氯化二氯• 一水•三氨合钴( 氯化二氯• 一水•三氨合钴(Ⅲ) K[FeCl 2(C2O4)(en)] 二氯•草酸根•乙二胺合铁( 二氯•草酸根•乙二胺合铁(Ⅲ)酸钾 写出下列配合物的化学式 氯化一氯•硝基一水• 一氨• 胺合钴( ①、氯化一氯•硝基一水• 一氨•乙二 胺合钴(Ⅲ) 六氟合铝( 酸二氨合银( ②、六氟合铝(Ⅲ)酸二氨合银(Ⅰ) 答案: 答案:[CoCl •NO2•H2O•NH3•(en) ]Cl [Ag(NH3)2]3•[AlF6]
2
9-1 配位化合物的基本概念
一、配合物的定义和组成 1、定义:(又称为络合物) 定义: 又称为络合物)
[实验 : 实验]: 实验
①、定义配离子:由一个简单正离子与一定数 定义配离子: 目的中性分子或( 目的中性分子或(和)负离子以配位键键合而 成的复杂离子称为配离子。 成的复杂离子称为配离子。 ②、定义配合分子:由一个简单正离子(或原 定义配合分子:由一个简单正离子( 与一定数目的中性分子或( 负离子, 子)与一定数目的中性分子或(和)负离子, 以配位键结合形成的电中性的复杂分子称为配 3 合分子。 合分子。
无机化学-第9章配位化合物与配位平衡

[Fe(CN)5]2-
5
[Cu(en)2]2+
4 (2×2)
[CuCl3]2-
3
[Fe(CN)6]3-
6
[Fe(o-phen)3]2+
6 (2×3)
[Cu(NH3)4]2+
4
[La(H2O)8]3+
8
[Ca(EDTA)]2-
6
*
(三)配位数(Coordination number, C.N.) 1. 定义:配合物分子中,直接与同一中心离子(原子) 成键 的配位原子的数目, 称为中心离子(原子)的配位数。
例2: 三氯•氨合铂(Ⅱ)酸钾
3.同类配体: 按配位原子元素符号的英文字母顺序:
例3:NH3前,H2O后 :
三氯化五氨•水合钴(Ⅲ)
*
中山大学无机化学
(三)配体顺序
1.先无机,后有机 : 例1: 顺-二氯•二三苯基膦合铂(Ⅱ) 读作”顺式二氯两个三苯基膦合铂(Ⅱ)” 2. 无机配体: 先阴离子、后中性分子,最后阳离子 :
中山大学无机化学
第9章 配位化合物与配位平衡
点击此处添加副标题
9.1 配合物的基本概念 9.2 配合物的同分异构现象 9.3 配合物的化学键理论 9.4 配位平衡
202X
中山大学无机化学
例: NH3(aq) NH3(aq) CuSO4 (aq) 蓝色 深蓝色溶液(1) (1) + NaOH (aq) 无 Qi < Ksp [Cu(OH)2] (1) + BaCl2 (aq) 白色 (BaSO4) (1) 浓缩、冷却 深蓝色晶体 [Cu (NH3)4]SO4(c) [Cu (H2O)4]2+ + 4 NH3 = [Cu (NH3)4]2+ + 4 H2O
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
② 空间效应 • 中心原子体积大,配体的体积小,则有利于生成配位 数大的配离子。 [AlF6]3-, [AlCl4]-, [BF4]-
配合物的组成
• 决定配位数大小的因素: ③ 静电作用 • 中心原子的电荷愈多,愈有利于形成配位数大的配离 子 [PtCl4]2-, [PtCl6]2• 配体所带的电荷愈多,配体间的斥力就愈大,配位数 相应变小 [Ni(NH3)6]2+, [Ni(CN)4]2-。
I
2 螯合物
NH2 H2C Cu H 2C NH2 H2N
II
H 2N CH2
HC
C
O
C CH C CH3
CH2
O
3 特殊配合物
金属羰基配合物 Ni(CO)4 Na[Co(CO)4] Mn(CO)5Br
簇状配合物 含有至少两个金属并生成 C-M 金属键
18-冠-6-醚
血 红 素
9.2.2 配位化合物的命名
1. 配位化合物的命名:阴离子在前、阳离子在后 配阳离子: “某化某”、 “氢氧化某”、“某酸某” 配阴离子: “某酸”、 “某酸某” 2. 配离子及配位分子的命名: 配体数-配体名称-“合”-中心原子名称(氧化值) 配体名称在前用二、三、四等数字表示数目 复杂的配体名称写在圆括号中,以免混淆 不同配体之间以中圆点“·”分开
配合物的组成
3. 配体(ligand)和配位原子(ligating atom) • 与中心原子以配位键结合的阴离子或中性分子称为配 体 [Ag(NH3)2]+中NH3 、[Ni(CO)4]中CO 、 [SiF6]2-中F• 配体中直接向中心原子提供孤对电子形成配位键的原 子称为配位原子 NH3中的N、CO中的C、F-中的F • 配位原子的最外电子层都有孤对电子,常见的是电负 性较大的非金属的原子 N、O、C、S、F、Cl、Br、I
配合物的组成
2. 中心原子(central atom) • 配合物中,接受孤对电子的阳离子或原子统称为中心 原子。 • 中心原子一般是金属离子,大多为过渡元素,特别是 第ⅧB族元素以及与它们相邻近的一些副族元素。 • 某些副族元素的原子和高氧化值的非金属元素的原子 也是比较常见的中心原子,如[Ag(NH3)]+、[Ni(CO)4] 和[SiF6]2-中的Ag+、Ni(0)和Si(Ⅳ)都是中心原子。
配合物的组成
1. 配合物的内层(inner sphere)和外层(outer sphere)
[Cu ( NH3 )4 ] SO4 Central Ligands atom Inner sphere Outer sphere
Coordination compound
电中性的配位分子只有内层,没有外层。
配合物的组成 3. 配体(ligand)和配位原子(ligating atom) 单齿配体(monodentate ligand) 多齿配体(multidentate ligand) • 单齿配体 NH3、H2O、F-、Cl少数配体虽有两个配位原子,由于两个 配位原子靠得太近,只能选择其中一个与中 心原子成键,故仍属单齿配体 如CN-、 NC-、 NO2-、ONO-、SCN-、NCS-
(1)金属与碳直接以 键键合的配合物
CH CAg
(CH3)6Al2
(2)金属与碳形成不定域配键的配合物
Fe
大环配合物
N
O O O
O O O O O N
穴醚
CH 3
O O O
H 3C N Fe 2+ N H 3C CH 2 CH 2 CO 2 H N CH 3 CH 2 CH 2 CO 2 H N
第九章
配位化合物
Coordination Compounds
9.1 配位化合物的组成和定义
9.1.1 配位化合物的定义
2+ 配合物是以能接受电子 Cu(OH)2 Cu + 2OH 对的离子或原子(统称中 + adding NaOH ammonia 平衡移动方向 4NH 3 心原子)为中心,与一组 可以给出电子对的离子或 分子(统称配体),以一 定的空间排列方式结合在 [Cu(NH 3)4]2+ 中心原子周围所形成的化 [Ag(NH3)2]+; [HgI4]2-; [Cu(NH3)24]SO4 Cu(OH) 合物(配离子或配分子)。 CuSO4 Complex Precipitation Solution [Fe(NCS)4]-; [Pt(NH3)2Cl2]
1 解离异构
[Co(NH3) 5Br]SO 4 [Co(NH3) 5Br] 2+ + SO 42-
紫色
[Co(NH3) 5SO 4]Br [Co(NH3) 5SO 4]+ + Br-
红色 2 水合异构
[Cr(H2O)6]Cl 3
紫色
[Cr(H2O)5Cl]Cl 2.H2O 绿色
[Cr(H2O)4Cl2]Cl .2H2O
9.3 配位化合物的异构现象
9.3.1 立体异构现象
1 几何异构 配位数为4的平面正方形配合物的几何异构现象 MA2B2 型
B A B A
M
B A A
M
B
顺式
反式
H 3N
Cl
H 3N
Cl
Pt
H 3N Cl Cl
Pt
NH3
顺式 顺铂
反式
MA2BC型
C A B A
M
B A A
M
C
MABCD型
C A
5 配位异构
[Co(NH3)6][Cr(CN)6] [Cr(NH3)6][Co(CN)6]
[Pt(II)(NH3)4][Pt(IV)Cl6]
[Pt(IV)(NH3)4][Pt(II)Cl6]
9.4 配位化合物的化学键本性
9.4.1 价键理论
1. 价健理论的基本要点 ① 配位原子提供孤对电子,填入中心原子的价电子层 空轨道形成配位键。 ② 中心原子所提供的空轨道首先进行杂化,形成数目 相等、能量相同、具有一定空间伸展方向的杂化轨 道,中心原子的杂化轨道与配位原子的孤对电子轨 道在键轴方向重叠成键。 ③ 配合物的空间构型,取决于中心原子所提供杂化轨 道的数目和类型。
绿色
3 配体异构 配体互为异构体,配合物称为配体异构体
H 2N CH 2 CH(NH 2) CH3 H 2N CH 2 CH2 CH2(NH 2)
L
L`
[CoCl2L2]Cl 4 键合异构
[Co(NH3) 5NO2] 2+
Co[Cl2L′2]Cl
[Co(NH3) 5ONO]2+
内为硝基
内为亚硝酸根
O O Cr O O O O O O
O O Cr O O
[Cr(C2O4)2-3] 的对映异构体
旋光异构体的特点
1 可以使平面偏振光旋转一定的角度,一对对映异 构体使偏振光旋转的角度相同,单方向正好相反
2 一对对映异构体,它们的物理性质和化学性质完 全相同,但生理学活性有很大的差别
9.3.2 结构异构现象
例2. [HgI4]2-中,配离子的电荷数=1×(+2)+4×(-1)=-2。 • 配位化合物的命名中,中心原子的氧化值用大写罗马 数字表示于括号内,例如上二例中,分别为 铜(II) 和 汞(II)
9.2 配位化合物的类型和命名
9.2.1 配位化合物的类型
1 简单配合物 [Cu(NH3)4]2+ [HgI4]2H3C CH3 O Cu C H3C O
9.1.2 配合物的组成
• 多数配合物由配离子与带相反电荷的离子组成, • 带正电荷的配离子称为配阳离子,带负电荷的配离子 称为配阴离子,配合物也可以是电中性的配位分子, • 含配离子的化合物和配位分子统称为配合物, • 习惯上把配离子也称为配合物。
[Ag(NH3)2]+; [HgI4]2-; [Fe(NCS)4]-; Pt(NH3)2Cl2
中心原子的杂化轨道类型和配合物的空间构型 配位数 2 4 杂化轨道 sp sp3 空间构型 直线 四面体 实 例
[Ag(NH3)2]+、[AgCl2]- 、[Au(CN)2][Ni(CO)4] 、[Cd(CN)4]2- 、[ZnCl4]2- 、 [Ni(NH3)4]2+
dsp2 6 sp3d2
平面四方形 八面体
配合物的命名
3. ① ② ③ ④ 配体命名顺序: 先无机配体,后有机配体; 先离子,后分子; 按配位原子元素符号字母序; 配位原子相同,原子数目少的配体在前(先简单,后 复杂); ⑤ 配位原子、配体原子数目相同,按配位原子连接的原 子的元素符号字母序; ⑥ 配体化学式相同,按配位原子元素符号字母序。
金属离子的配位数 配位数 2 4 金属离子 Ag+、Cu+ 、Au+ 实 例 [Ag(NH3)2]+、[Cu(CN)2]-
Cu2+、 2+、 2+、 2+、 3+、 2+、 [HgI4]2- 、 [Zn(CN)4]2- 、 Zn Cd Hg Al Sn Pb2+、Co2+、Ni2+、Pt2+、Fe3+、Fe2+ [Pt(NH3)2Cl2]
配合物的组成
3. 配体(ligand)和配位原子(ligating atom)
• 多齿配体 双齿配体:H2N-CH2-CH2-NH2(乙二胺,简写为en) 三齿配体:H2NCH2CH2NHCH2CH2NH2(二亚乙基三胺,简 写为DEN) 六齿配体:乙二胺四乙酸根
O H 2 O C C N
四氨合铜(II)离子 二氯· 四氨合钴(III)离子 三氯化三(乙二胺)合铁(III) 氢氧化二氨合银(I) 六氯合铂(IV)酸 硫酸亚硝酸根· 五氨合钴(III) 硫酸五氨· 水合钴(III) 三氯化二氨· (乙二胺)合钴 二 (III) 四硝基· 二氨合钴(III)酸铵 四羰基合镍(0) 四(异硫氰酸根) · 氨合铬 二 (III)酸铵 氨基· 硝基· 二氨合铂(II)
