无机化学第十章++配位化合物
无机化学中的重要离子与配位化合物

无机化学中的重要离子与配位化合物无机化学是研究无机物质的性质、合成方法和应用的领域。
在无机化学中,重要离子和配位化合物发挥着关键作用,它们在化学反应和实际应用中具有广泛的影响。
本文将探讨无机化学中的重要离子和配位化合物的特性和应用。
一、重要离子1. 钠离子(Na+)钠离子是一种常见的阳离子,在化合物中通常以Na+的形式存在。
它在生物体内维持体液平衡、神经传导和细胞功能中起着重要作用。
此外,钠离子还可以用于制备玻璃、肥皂和某些药物。
2. 铁离子(Fe)铁离子在生物体中是必需的,它参与体内的氧运输、呼吸和能量代谢过程。
在无机化学中,铁离子常见的氧化态有Fe2+和Fe3+,它们在多种配位化合物和催化剂中扮演着重要角色。
3. 锌离子(Zn2+)锌离子作为微量元素存在于人体中,并参与多种酶的催化反应。
在无机化学中,锌离子广泛应用于配位化合物、染料和催化剂的合成和应用中。
4. 铜离子(Cu2+)铜离子在生物体和无机化学中都具有重要的应用价值。
在生物体内,铜离子参与催化反应和电子传递。
在无机化学中,铜离子可用于制备催化剂、染料和超导材料等。
二、配位化合物1. 配位基配位基是能够通过配位键与中心金属离子形成配位化合物的分子或离子。
常见的配位基包括水、氨和氯等。
在配位化合物中,配位基通过共价键或配位键与中心金属离子结合。
2. 配位数配位数是指配位化合物中通过配位键与中心金属离子结合的配位基的个数。
常见的配位数包括2、4和6等。
配位数取决于中心金属离子的电子排布和配位基的性质。
3. 配位化合物的性质配位化合物具有多种特殊的性质。
例如,一些配位化合物具有特定的颜色,这是由于配体的能级分裂引起的。
此外,许多配位化合物在电子传递、磁性和催化反应等方面发挥重要作用。
4. 应用领域配位化合物在多个领域具有广泛的应用。
例如,在医药领域,一些铂配合物被用作铂类抗肿瘤药物,具有抑制癌细胞生长的能力。
在工业中,一些配位化合物被用作催化剂,促进化学反应的进行。
大学无机化学配位化合物PPT课件

通常是电负性较大的原子,如C、N、O、X和S。
③ 单齿配体:配体中只含一个配位原子。
如:X--、S2--、H2O、NH3、CO、CN--等。
④ 多齿配体:配体中含两个或更多的配位原子。如
C2O42-、氨基乙酸根、乙二胺、乙二胺四乙酸根(edta)。
N**H2-CH2-COO-*, N*H2-CH2-CH2-NH2 (en)
第11页/共38页
二、配键和配位化合物分类
1. 外轨型配合物
中心原子是用最外层的ns、np或ns、np、nd组成
的杂化空轨道接受电子,与配体形成配位键.
例:[FeF6]3--中Fe3+:3d5
↑↑↑↑↑ _ _ _ _ _ _ __ _
3d
4s 4p
4d
sp3d2杂化,八面体构型
第12页/共38页
d2sp3
6
Fe (CN)63-,Co(NH3)6
第18页9.3.1 配合物的稳定常数 9.3.2 影响配合物稳定性的因素
(自学) 9.3.3 配位平衡的移动
第19页/共38页
9.3.1 配合物的稳定常数
一、配合物的稳定常数 (K稳)
Cu2+ + 4NH3 = Cu(NH3)42+ K稳
3d
d2 sp3 杂化轨道
内轨型配合物,低自旋 µ = 0 第16页/共38页
CoF63– , Co3+: 3d6
4d 4p 4s 3d
sp3d2杂化 3d
sp3d2 杂化轨道
外轨型配合物,高自旋 µB.M. 正八面体构型
第17页/共38页
三、 杂化轨道形式与配合物的空间构型
大学无机化学试题

第十章配位化合物本章总目标:1:掌握配合物的基本概念和配位键的本质2:掌握配合物的价键理论的主要论点,并能用此解释一些实例3:配离子稳定常数的意义和应用4:配合物形成时性质的变化。
各小节目标:第一节:配位化合物的基本概念1:掌握中心原子、配体、配位原子、配位键、配位数、螯合物等概念,配位单元:由中心原子(或离子)和几个配位分子(或离子)以配位键向结合而形成的复杂分子或离子。
配位化合物:含有配位单元的化合物。
配位原子:配体中给出孤电子对与中心直接形成配位键的原子。
配位数:配位单元中与中心直接成键的配位原子的个数。
2:学会命名部分配合物,重点掌握命名配体的先后顺序:(1)先无机配体后有机配体(2)先阴离子配体,后分子类配体(3)同类配体中,先后顺序按配位原子的元素符号在英文字母表中的次序(4)配位原子相同时,配体中原子个数少的在前(5)配体中原子个数相同,则按和配位原子直接相连的其它原子的元素符号的英文字母表次序;3:了解配合物的结构异构和立体异构现象第二节:配位化合物的价键理论1:熟悉直线形、三角形、正方形、四面体、三角双锥、正八面体构型的中心杂化类型。
2:会分辨内轨型和外轨型配合物。
可以通过测定物质的磁矩来计算单电子数。
3:通过学习羰基配合物、氰配合物以及烯烃配合物的配键来熟悉价键理论中的能量问题。
第三节:配合物的晶体场理论1:掌握配合物的分裂能、稳定化能概念2:掌握配合物的晶体场理论。
3;了解影响分裂能大小的因素)晶体场的对称性中心离子的电荷数,中心离子的电荷高,与配体作用强,大。
中心原子所在的周期数,对于相同的配体,作为中心的过渡元素所在的周期数大,相对大些。
(4)配体的影响,配体中配位原子的电负性越小,给电子能力强,配体的配位能力强,分裂能大。
4:重点掌握(1)配合物颜色的原因之一——d-d跃迁以及颜色与分裂能大小的关系;(2)高自旋与低自旋以及与磁矩的大小的关系。
第五节:配位化合物的稳定性1:熟悉影响配位化合物稳定性的因素(1)中心与配体的关系(2)螯合效应(3)中心的影响(4)配体的影响(5)反位效应(6)18电子规则。
配位化学知识点总结

配位化学知识点总结配位化学是无机化学的一个重要分支,它研究的是金属离子或原子与配体之间通过配位键形成的配合物的结构、性质和反应。
以下是对配位化学知识点的总结。
一、配位化合物的定义与组成配位化合物,简称配合物,是由中心原子(或离子)和围绕它的配体通过配位键结合而成的化合物。
中心原子通常是金属离子或原子,具有空的价电子轨道,能够接受配体提供的电子对。
常见的中心原子有过渡金属离子,如铜离子(Cu²⁺)、铁离子(Fe³⁺)等。
配体是能够提供孤对电子的分子或离子。
配体可以分为单齿配体和多齿配体。
单齿配体只有一个配位原子,如氨(NH₃);多齿配体则有两个或两个以上的配位原子,如乙二胺(H₂NCH₂CH₂NH₂)。
在配合物中,中心原子和配体组成内界,内界通常用方括号括起来。
方括号外的离子则称为外界。
例如,Cu(NH₃)₄SO₄中,Cu(NH₃)₄²⁺是内界,SO₄²⁻是外界。
二、配位键的形成配位键是一种特殊的共价键,是由配体提供孤对电子进入中心原子的空轨道形成的。
配位键的形成条件是中心原子有空轨道,配体有孤对电子。
例如,在 Cu(NH₃)₄²⁺中,氨分子中的氮原子有一对孤对电子,铜离子的价电子层有空轨道,氮原子的孤对电子进入铜离子的空轨道,形成配位键。
三、配合物的命名配合物的命名遵循一定的规则。
对于内界,先列出中心原子的名称,然后依次列出配体的名称。
配体的命名顺序是先阴离子,后中性分子;先简单配体,后复杂配体。
在配体名称之间用“·”隔开,配体的个数用一、二、三等数字表示。
如果有多种配体,用罗马数字表示其价态。
例如,Co(NH₃)₅ClCl₂命名为氯化一氯·五氨合钴(Ⅲ)。
四、配合物的空间结构配合物的空间结构取决于中心原子的杂化轨道类型和配体的空间排列。
常见的杂化轨道类型有 sp、sp²、sp³、dsp²、d²sp³等。
第十章配合物
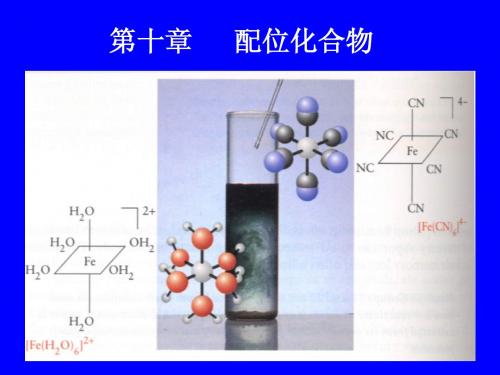
根据配位体对3d电子排斥作用的大小,可将配 位体为强场配体和弱场配体。根据光谱实验测得, 配位体场强弱顺序排列如下:
I- < Br- <S2- <S CN- (硫氰酸 根)~Cl- <F- <OH-<ONO(亚硝酸根)<C2O42-<H2O< NCS- (异硫氰酸根)< EDTA<NH3<en<-NO2 (硝基) <CN-<CO
(3)内轨型磁性小,外轨型配磁性大。
Ni(CN)42– 的µ = 0 , 而 Ni(NH3)62+ 的 µ = 2.82 µ 。 B
4.价键理论的应用和局限性 价键理论可用来: (1)解释配合物的几何构型。 (2)说明含有离城键的配合物特别稳定。 (3)可以解释配离子的某些性质,如 [Fe(CN)6]3-比[FeF6]3-稳定性大,磁性小。
(一)晶体场理论的基本要点
1.在配合物中,中心离子Байду номын сангаас配位体之间的相 互作用,完全是静电排斥和吸引,不形成共价键。 2.中心离子的d轨道,由于受周围配位体负电 场(称为晶体场)不同程度的排斥作用,能级发 生分裂。
3.由于d轨道能级分裂,d轨道上的电子将重 新分布,体系能量降低,给配合物带来额外的稳 定化能。
手性特征
旋光异构体有左旋、右旋之分。
左旋符号:(–)或 L 右旋符号:(+)或 D
旋光异构体之间性质往往有很大差异。截至 1963年,在世界各地由 于服用反应停而诞生了 12000多名形状 如海豹一样的可 怜的婴儿。
第二节 配合物的化学键理论
关于配位键的性质,目前主要有以下
几种理论:
•价键理论
•晶体场理论
配位化合物简介

摘要配位化合物是一类广泛存在、组成较为复杂、在理论和应用上都十分重要的化合物。
目前对配位化合物的研究已远远超出了无机化学的范畴。
它涉及有机化学、分析化学、生物化学、催化动力学、电化学、量子化学等一系列学科。
随着科学的发展,在生物学和无机化学的边缘已形成了一门新兴的学科——生物无机化学。
新学科的发展表明,配位化合物在生命过程中起着重要的作用。
生物体内需要一定量的金属元素。
对于人来说,这些“生命金属”是一系列酶和蛋白质的活性中心的组成部分。
当生命金属过量或缺少、或污染金属元素在人体大量积累均将引起生理功能的紊乱而导致疾病,甚至死亡。
故配位化学在医学和药学领域有着重要的应用和广阔的前景。
本文从配合物作为药物、金属解毒剂、抗凝血剂和抑菌剂以及配合物在临床检验和生化实验中的应用等四个方面分别来阐述配位化学在医药工业中的应用。
关键词:配合物,解毒剂,抑菌剂,药物一、配位化合物配位化合物(coordination compound)简称配合物,也叫错合物、络合物,为一类具有特征化学结构的化合物,由中心原子或离子(统称中心原子)和围绕它的称为配位体(简称配体)的分子或离子,完全或部分由配位键结合形成。
如:K4[Fe(CN)6] [Cu(NH3)4]SO4[Ni(CO)4] [CoCl(NH3)3]按配位体分类,可有:①水合配合物。
为金属离子与水分子形成的配合物,几乎所有金属离子在水溶液中都可形成水合配合物,如〔Cu(H2O)4〕2+、〔Cr(H2O)6〕3+。
②卤合配合物。
金属离子与卤素(氟、氯、溴、碘)离子形成的配合物,绝大多数金属都可生成卤合配合物,如K2〔PtCl4〕、Na3〔AlF6〕。
③氨合配合物。
金属离子与氨分子形成的配合物,如〔Cu(NH3)4〕SO4。
④氰合配合物。
金属离子与氰离子形成的配合物,如K4〔Fe(CN)6〕。
⑤金属羰基合物。
金属与羰基(CO)形成的配合物。
如〔Ni(CO)4〕。
二、对人体生命活动的重要意义生物体中几乎所有的金属都是以配合物的形式存在的,现已证明对人体有特殊生理功能的微量元素有Mn,Fe,Co,Mo,Zn,Mg,V,Cr,Si,Cu,Sn,Se等,他们均以配合物的形式存在于人体中,并且有特殊的生理功能。
无机化学配位化合物.

28
例 已知 [Mn(CN)6]4- 的磁矩 实测=1.57 B.M.,请推测这 个配合物的空间构型和稳定性。 解 由配位数为 6 可知,需要 6 个空杂化轨道,杂化方式 可能为 d 2s p 3 或 s p 3d 2 已知 Mn2+ 3d 5 根据表 实测=1.57 B.M.,与 1 个单电子相当
10
二、配合物的命名 (一)中心原子与配体 1. 中心原子与配体之间用“合”连接,表示配位键;中心 原子的氧化数可由配离子电荷、配体电荷和配体数目算出, 用罗马字母在 ( ) 中标明;没有外界的配合物,中心原子的 氧化数不必标明。 其命名方式为: 配体数-配体名称-“合”-中心原子(氧化数) 例如 [Co(NH3)6]3+ [PtCl2(NH3)2] 六氨合钴(Ⅲ)离子 二氯· 二氨合铂
磁性
=√n(n+2)
—磁矩,单位为波尔磁子,符号 B.M.,
1 B.M. ≈9.27×10-24 J· T-1。 n—未成对电子数。
25
稳定性
实验表明,内轨型配合物比相应的外轨型配合物更稳定。 例如: [Fe(H2O)6]2++6 CN- = [Fe(CN)6]4+ + 6 H2O [FeF6]3杂化 轨道 sp3d2 外轨型 [Fe(CN)6]3 d2sp3 内轨型 [Ni(NH3)4]2+ sp3 外轨型 [Ni(CN)4]2 dsp2 内轨型
氢氧化一羟基五水合铬(Ⅲ)
四羟基合铝 (Ⅲ)酸钾 三氯化五氨一水合钴(III) 四氯合铂(II)酸六氨合铂(II)
中性分 子
[Ni(CO)4]
[PtCl2(NH3)2]
四羰基合镍
二氯二氨合铂(II)
15
三、配合物的异构现象 具有相同化学组成的化合物,却具有不同的结构,这种 现象称为异构,这些化合物互称异构体。 (一)键合异构
无机化学中的配位化合物

无机化学中的配位化合物无机化学是化学的一个重要分支,主要研究非有机化合物或元素的结构、性质及其间的相互作用。
而其中一个重要且常被人们忽略的分支,就是配位化学。
配位化学研究的是金属离子与一定数量的配体结合成的配位化合物,而这些化合物则在许多领域有着重要应用。
在本篇文章中,我们将进一步探讨无机化学中的配位化合物。
一、配位体的分子结构及分类在配位化学中,有机分子或无机离子集体被称为配位体。
它们的分子结构是由原子或原子团组成的。
根据杂化状态的不同,它们可以分为配位体I(线型)和配位体II(平面)。
此外,它们也可以由下列形式的单原子离子(如NO+、NH4+、SO4^-2等)、小分子(如CO、SO2、NH3、H2O等)或多原子离子(如[Fe(CN)6]^-4、[Co(NH3)6]3+、[CuCl4]^-2等)组成。
二、配位化合物的性质由于其特殊的结构,配位化合物表现出了一些独特的性质。
其中最重要的特征就是其对化学反应的影响。
例如,在生化学领域中,许多酶(大分子催化剂)都是由一定数量的金属离子(如Fe、Cu、Mg等)与配体结合而成,这些金属离子可以在催化反应中参与,并极大地影响反应动力学。
除了对生化学反应的影响外,配位化合物还有一些其他的性质。
例如,它们显示出的光学性质一直是该领域研究的一个热点。
有些金属离子和其所组成的配位体能发射出特定的荧光,因此在化学的分析和监测中得到了广泛应用。
此外,很多配位化合物也有着重要的电子学性质,如电导、磁性等等。
三、配位化合物在实际生活中的应用由于其独特性质,配位化合物已经广泛应用在现实生活中,例如:1.医学在医学领域中,针对疾病的药物中许多都是由一定数量的金属离子与配体结合而成。
这些化合物通常和受体相互作用,从而达到治疗目的。
同时,它们还有助于分析分子结构,并赋予了医学领域一些其他的创新。
2.钢铁产业铁氧体是一种常见的铁矿石,其结构由铁离子和氧离子相互作用形成晶体而成。
由于其结构相对稳定,这种矿石是制造钢铁的重要原料之一。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
● 多齿配体: 含有多个配位原子的配体
螯合剂和螯合化合物
叶绿素是镁的大环
配合物,作为配位体的 卟 啉 环 与 Mg2+ 离 子 的 配 位是通过4个环氮原子实 现的。叶绿素分子中涉 及 包 括 Mg 原 子 在 内 的 4 个六元螯环。
血红素是铁卟啉化合物,是血
红蛋白的组成部分。 Fe原子从血红 素分子的下方键合了蛋白质链上的1 个N原子,圆盘上方键合的O2分子 则来自空气。
● 含络离子的配合物:阴离子名称在前,阳离子名称在 后,阴、阳离子名称之间加“化”字或“酸”字。例如 [Ag(NH3)2](OH) 和 [CrCl2(H2O)4]Cl 分 别 叫 氢 氧 化 二 氨 合 银 (I) 和一氯化二氯·四水合铬(III); 而[Cu(NH3)4]SO4叫硫酸四氨合 铜(II), 加“酸”字。
等量左旋异构体与右旋异构体混合后不具旋光性,这样的 混合物叫外消旋混合物。
三、配合物化学式的书写和命名原则
配位化合物的命名,显然离不开配体:
F- 氟, Cl- 氯, Br- 溴, I- 碘, O2- 氧, N3- 氮,
S2- 硫, OH- 羟基, C N- 氰, - NO2- 硝基,
பைடு நூலகம்
- ONO-
指导药物设计 Hard and soft acids and bases
除Ag+之外, 其他软酸金属离子的毒性都很强。例如, 汞中 毒可能是由于Hg2+(软酸)与蛋白质分子中的S2-(软碱)结合, 从而 改变了蛋白质分子的结构。由于Se是比S更软的原子(留意它们 在周期表中的位置), 从而对Hg显示出更强的结合力。根据这一 原理, 药物化学家有可能设计出含Se药物, 从汞中毒患者的蛋白 质S原子上除去Hg2+离子。这就是说, 尽管Se2-是个毒性很大的 软碱,但一定条件下却能产生有益的效应。
旋光异构体的熔点相同,但光学性质不同: 互为旋光异构体的两种物质,使偏振光偏转的方 向不同。
20_446
Polarizing filter
Unpolarized light
Tube
containing
sample
Polarized light
Rotated polarized light
互为旋光异构体的两种物质,使偏振光偏转的方向不同: 按一系列的规定,分别定义为左旋(L-)和右旋(D-)。
负离子 配体
中性分子
X− H2O
SCN− NH3
C2O42− CO
CN− en
配体又因含有的配位原子数目不同分为: 单齿配体 (Monodentate ligand) 多齿配体 (Polydentate ligand) 。
● 单齿配体: 只含有一个配位原子的配体 X− OH−(羟基) CN− SCN−(硫氰根) CO(羰基) NO2−(硝基) H2O NH3 NCS−(异硫氰根)
[Co(NH3)6] [Cr(CN)6]
中心金属原子(离子):电子对接受体 — Lewis 酸 配体 :电子对给予体— Lewis 碱
(一)配位化合物的组成
(二)配体与配位原子
能够提供孤电子对的分子或离子叫做 配体;配体中给 出孤电子对与中心原子直接形成配位键的原子叫配位原子 (如配体NH3中的N原子,配体CN-和CO中C原子)。
1价金属离子
Cu+ 2,4 Ag+ 2 Au+ 2,4
2价金属离子
Ca2+ 6 Mg2+ 6 Fe2+ 6 Co2+ 4,6 Cu2+ 4,6 Zn2+ 4,6
3价金属离子
Al3+ 4,6
Cr3+ 6
Fe3+
6
Co3+ 6
Au3+ 4
二、配位化合物的异构现象
异构体(isomers):分子式相同,结构和性质不同 配位化合物的异构现象是指配位单元的异构现象
软碱: 电负性小(易给出电子);易变形
I-,S2-,CN-,SCN-,CO,C6H6,S2O32- 等。
acid
base
经验表明,软硬程度相似的酸碱相结合形成的物质 稳定。这一规律通常称之为“软亲软、硬亲硬”原则。 配位单元的中心是路易斯酸,而配体是路易斯碱, 二者以配位键结合成酸碱配合物。中心与配体之间结 合得牢固与否,与酸碱的软硬性质有关。
四、配位化合物的稳定性
(一)软硬酸碱原则:The Hard Soft Acid Base Principle (HSAB)
硬酸: 半径小;电荷高;电子云变形性小
① I A,II A 族阳离子; ② B3+,Al3+,Si4+ 等 III A,IV A 族阳离子; ③ La3+,Ce4+,Ti4 + 等 8e 高电荷小半径的阳离子; ④ Cr3+,Mn2+,Fe3+,Co3+ 等 (8 ~ 18)e 的阳离子。
例:H2[SiF6],[Ag(NH3)]Cl ② 在配位单元中如既有无机配体,又有有机配体,
则无机配体排在有机配体之前。
例:cis-[PtCl2(Ph3P)2], [Pt(CO3)(en)] ③ 无机配体和有机配体中,先列出阴离子,后列出
中性分子。 例:K[PtCl3NH3],[Co(N3)(NH3)5]SO4
配位单元:是由中心原子(或离子)与配体(阴离子或 分子)以配位键的形式结合而成的复杂离子或分子;
配合物:凡是含有配位单元的化合物都称配合物。
配位单元: [Co(NH3)6]3+,[Cr(CN)6 ]3-,Ni(CO)4 配阳离子 配阴离子 配分子
配位化合物: [Co(NH3)6]Cl3,K3[Cr(CN)6],Ni(CO)4
顺-二氯二氨合铂(Ⅱ) 棕黄色
反-二氯二氨合铂(Ⅱ) 淡黄色
S = 0.2523 g/100g H2O S = 0.0366 g/100g H2O 具抗癌活性(干扰DNA复制) 不具抗癌活性
MA2B2, MABC2 型正方形配位单元有顺反异构, 而 MA3B 型正方形配位单元则没有顺反异构;
例:配位数为 6 的 MA2B4 型配单元有两种几何异构体, 如二氯四氨合钴(Ⅲ)
顺式
配位数为 6 的 MA2B4 型配单元
面式
经式
配位数为 6 的 MA3B3 型配位单元
反式
顺式
一反二顺 3 种
配位数为 6 的 MA2B2C2 型配位单元
一般来说,配体数目越多,种类越多,异构现 象则越复杂。
旋光异构(对映异构):配体的相互位置一致,但在中
心周围的排列取向不同时,两个配位单元也可能不重合。若两 个配位单元互为镜像但又不能重合的,则互为旋光异构体。
第十章 配位化合物
本章主要内容
一、配位化学的基本概念和术语 二、配位化合物的异构现象 三、配位化合物的书写与命名 四、配位化合物的稳定性 五、配位化合物的价键理论 六、配位化合物的晶体场理论
一、配位化学的基本概念和术语
早在1798, 法国化学家塔赦特 (B.M. Tassaert) 观察到钴盐在 氯化铵和氨水溶液中转变为CoCl3∙6NH3,但不明白为什么 CoCl3,NH4Cl 这样原子价饱和的无机物还会进一步结合形成新 的化合物。
旋光异构
[Co(NH3)5(NO2)]Cl2
Pentaamminenitrocobalt(III)
chloride
[Co(NH3)5(ONO)]Cl2
Pentaamminenitritocobalt(III)
chloride
顺反异构体(几何异构):配体相互位置不同 例:配位数为4的平面四边形的二氯二氨合铂(II)
软酸: 半径大;电荷低;电子云变形性大
Cu+,Ag+,Au+,Cd2+,Hg2+,Hg22+,Tl+,Pt2+ 等。
硬碱: 电负性大(不易给出电子); 不易变形
H2O,OH-,O2-,F-,Cl-, SO42-, NO3-, ClO4-, CO32-, Ac -, NH3, RNH2, N2H4 等。
④ 对多种配体同为负离子或同为中性分子的,按配 位原子元素符号的英文字母顺序排列。
例:[Co(NH3)5(H2O)]3+ ⑤ 同类配体中若配位原子相同,则将含较少原子数
的配体排在前面,较多原子数的配体列后。
例:[PtNO2NH3NH2OH(py)]Cl
关于命名原则
IUPAC的规则是按配体的英文名称词头字母的英文字母 顺序命名。我国采取与化学式一致的方法来命名:
直到1893年维尔纳(A.Werner) 创立配位学说才逐步弄清其本 质。
化学组成为 CoCl3·6NH3 的化合物: ① 六个NH3和Co3+ 以配位键结合,形成
[Co(NH3)6]3+(配位单元) ② 而整个分子为 Co(NH3)6]Cl3(配位化合物)
Alfred Werner (1866—1919 )
Fe(CO)5
Co(NO2 )3 (NH3 )3 Ca(EDTA)2
硫酸四氨合铜(Ⅱ) 六异硫氰根合铁(Ⅲ)酸钾
六氯合铂(Ⅳ)酸 氢氧化四氨合铜(Ⅱ) 五氯•氨合铂(Ⅳ)酸钾 硝酸羟基•三水合锌(Ⅱ) (三)氯化五氨•水合钴(Ⅲ)
五羰(基)合铁 三硝基•三氨合钴(Ⅲ) 乙二胺四乙酸根合钙(Ⅱ)
