浙江大学研究生入学考试2001 物理化学
浙江工业大学考研物化试卷资料及答案

浙江工业大学2001年攻读硕士学位研究生入学试题试题科目:物理化学适用学科、专业__________________一、选择题(40%)(在以下的每小题后面均有A 、B 、C 、D 4个答案供选择,请选择其中一个您认为是正确的答案,并将相应的字母写在题号前面的括号内。
注意:只选一个答案,多选不得分)1、 在373.15kPa 时,1mol H 2O (l )经可逆相变完全汽化为同温同压的H 2O (g )则下列结论正确的是(A )W =- RT ln(g l V V ) (B )W = - RT (C )21.T v m T U C ∆=⎰dT=0 (D ) 21.0T p m T H C dT ∆==⎰ 2、 对任意一化学反应,等压热效应与等容热效应的关系为()p V B g Q Q RT ν=+∑故(A )p Q >v Q ( B) p Q <v Q(C ) p Q =v Q (D) p Q 不一定大于v Q(式中()B g ν为反应中气体的计量系数)3.298K 时,1.10287g 的苯甲酸(M=122.1)在弹式量热计中燃烧,反应完全后温度升高2.234K ,体系的热容为1.217⨯104J ⋅K 1-,则苯甲酸的c H ∆为(A) c H ∆=3227kJ ⋅mol 1- ( B)c H ∆=-3227 kJ ⋅mol 1-(C ) c H ∆=-3228 kJ ⋅mol 1- (D)c H ∆=3228 kJ ⋅mol 1-4.等温等压下,体系对外所作非体积功W '的绝对值(A)可以大于体系G 降低的绝对值 (B) 等于体系G 降低的绝对值(C)可以大于体系A 降低的绝对值 (D).不能大于体系G 降低的绝对值5.已知298K ,反应H 2(g )+ 21 O 2(g )→H 2O (l )的r m G ∆=-237.19 kJ ⋅mol 1-, r m S ∆=-163.2 J ⋅K -1⋅mol 1-,假设,0r p m C ∆=,则398K 时,反应的r m G ∆等于(A )-237.19 kJ.mol1- (B )-253.51 kJ.mol 1- (C )-220.87 kJ.mol 1- (D )253.51 kJ.mol 1- 6.理想气体混合物中任一组分B 的化学势与压力的关系是 (A),()B T n p μ∂∂=RT (B) ,()B T n pμ∂∂=p B(C ),()B T n p μ∂∂=B RT p (D) ,()B T n pμ∂∂= p (体系的总压)7.对N 2,O 2混合气体(视为理想气体)进行绝热可逆压缩,则(A)S ∆=0 (B) ∆G =0 (C)∆U =0 (D)∆H =08.某晶体的两种晶形,在转换温度附近的蒸气压随温度变化的关系分别为lg p 1= -5082/T +11.364和lg p 2= -5555/T +12.564,则两晶体的转换温度为(A)375.2K (B)392.2K (C )394.2K (D)494.2K9.H 2O (l ,373K, p )−−−→向真空蒸发H 2O (g,373K, p ),判断该过程能否发生,可用的判据是 (A)∆A (B) ∆G (C) ∆U (D) ∆S (体系)+ ∆S (环境)10.设有下列各状态1.373.2K ,101.325kPa 的液态水2. 373.2K ,202.650kPa 的液态水3.373.2K ,101.325kPa 的水蒸气4.373.2K ,55.660kPa 的水蒸气请指出上述各状态化学势的大小顺序是(A)2134μμμμ>=> (B)2134μμμμ<=<(C)2143μμμμ>=> (D)4321μμμμ>=<11.关于电解质溶液电导率的概念下列说法正确的是(A) 1m 3导体的电导 (B)1mol 电解质溶液的电导(C)面积为1m 2相距1m 的两平行电极之间的电导(D)两相距1m 的平行电极之间导体的电导12.Na (汞齐,0.206%)|NaI (在酒精中)|Na (s )的电动势E 是(A)正值 (B)负值 (C)零 (D)与NaI 的活度有关13.对于(1)电解池的阴极;(2)原电池的正极;(3)电解池的阳极;(4)原电池的负极;由于极化而使电极电势负移的电极是其中的(A)(1)和(2) ( B)(1)和(4)(C)(2)和(3) ( D)(3)和(4)14.微小晶体与普通晶体相比较,下列性质不正确的是(A)微小晶体的蒸气压较大 (B)微小晶体的溶解度较大(C)微小晶体的溶解度较小 (D)微小晶体的熔点较低15.若需研究电解质对某一溶液的稳定性的影响,最好的方法是测定(A) 电泳速度 (B) 电渗速度(C) 电解质的聚沉淀 (D) 沉降速度16.丁达尔现象的本质是光的散射,下列说法中错误的是(A)大分子溶液中大分子的大小与胶粒相近,两者丁达尔效应的强弱也相近(B)小分子溶液中溶质粒子小,故丁达尔效应不明显(C)散射现象仅是光传播方向发生变化其波长不变(D)在超显微镜下观察到的光点不是胶粒的真实形象17.能润湿毛细管的液体,在管内的蒸气压为p r ,同一液体在大烧杯中蒸气压为p o ,则(A) p r >p o (B) p r <p o(C) p r =0 (D) p r =p o18.反应A (g )+B (g )→G (g )+R (g ),在350K 时r m S ≠∆ = -85 J ⋅mol -1⋅K -1,r m G ≠∆=150kJ ⋅mol -1, r m H ≠∆应为(A) 179.75 kJ ⋅mol 1- (B) 120.25 kJ ⋅mol 1-(C) 29.9kJ ⋅mol 1- (D) 29.6 kJ ⋅mol 1-19.一基元反应,正反应的活化能是逆反应活化能的2倍,反应时吸热120 kJ ⋅mol 1-,正反应的活化能是(A) 120 kJ ⋅mol 1- (B) 240 kJ ⋅mol 1-(C) 360 kJ ⋅mol 1- (D) 60 kJ ⋅mol 1-20.某反应在一定条件下的平衡转化率为25%,当有催化剂存在时,其最高转化率(A) 大于25% (B) 小于25%(C) 等于25% (D) 有无改变不能确定二.(15分)1mol 单原子理想气体始态为273K ,p ,分别经历下列可逆变化:(a )恒温下压力加倍;(b )恒压下体积加倍;(c )恒容下压力加倍和(d )绝热不可逆反抗恒外压0.5⨯ p 膨胀至平衡。
中国科技大学2001年考研物理化学试题及答案(文字版)

p1, H2 ( p ○ ) NaOH(a = 1) HgO(s) + Hg(l)
(2) 298.15K, p ○ 时,
H2
(
p
○
)
+
1 2
O2
(
p
○
)
=
H2O(l
)
∆
r
H
○ m
=
−285.84
kJimol-1
(3) 298.15K,下列各物质的摩尔熵值( Sm○ )为
-1-
考研——物理化学——2001
8. 已知某复杂反应历程为 2A k1 B ,A+C ⎯k⎯2 → D 。则 A 的浓度随时间的变化率为: k−1 ()
[A] k1[A] − k−1[B] + k2[A][C]
[B] −k1[A] + k−1[B] − k2[A][C]
[C] −k1[A]2 + k−1[B] − k2[A][C] [D] k1[A]2 − k−1[B] + k2[A][C]
9. 对弯曲液面(非平面)所产生的附加压力( )
[A]一定等于零 [B]一定不等于零
[C]一定大于零
[D]一定小于零
10. 对于电动电位(即 ζ 电位)的描述,哪一点是不正确的?( ) [A] ζ 电位表示胶粒溶剂化层界面到均匀液相内的电位 [B] ζ 电位的绝对值总是大于热力学电位 φ [C] ζ 电位的值易随少量外加电解质而变化 [D]当双电层被压缩到与溶剂化层叠合时,ζ 电位以零为极限
为电位梯度,则有
γ H+
=
U
H
+
i
dE dl
浙江大学大化P物理化学实验理论考试资料

实验基础知识相关问题1.两个孔的插座是两相电,三个孔的插座是三相电。
( ×)2..为了节约使用药品,氧气钢瓶应尽量使用至表压为零。
( ×)3.获得不同的真空度需要用不同的真空泵,要取得高真空度常用:( C )A.水循环泵;B.分子泵;C.扩散泵与机械泵连用;D.高效机械泵。
4.水银温度计是根据(液体热涨冷缩)原理设计的。
在精密测定时,通常需要作露茎校正,为了校正(露出段不处于系统温度)产生的误差。
热电偶温度计是根据(热电势大小与温度有关)原理设计的。
热敏电阻温度计是根据(电阻大小与温度有关)原理设计的。
而作为标准温度计的是(铂电阻温度计)。
5.福廷式气压计用来读取(大气压力)数据。
其读数需要温度、纬度和海拔高度校正,其中温度校正是因为(水银密度和标尺刻度随温度变化);纬度和海拔高度校正是因为(重力加速度和纬度、海拔高度有关)。
6.氧气钢瓶的颜色是:( C )A.黑色;B.黄色;C.蓝色;D.灰色。
7.作为标准温度计的是(铂电阻)温度计;如果需要测量系统的微笑温度改变,可用的温度计有(举2种)(贝克曼温度计、铂电阻温度计、半导体热敏电阻温度计等);对于测量300℃以上的高温系统温度,通常用(热电偶)温度计。
(6分)8.对于垂直放置、仪器误差可忽略的福廷式气压计,正确的读数操作方法是:1)(调节汞槽内的汞面高度,使得尖针顶端刚好和水银面接触);2)(调节游标尺高度,至游标前后金属片下边正好和水银柱凸液面顶端相切);3)(读取汞柱高度。
用游标下缘对应标尺上的刻度读取气压整数部分数据,用游标上正好和标尺上某一刻度线相吻合的刻度线,读取小数部分数据。
取4位有效数值)读数的主要校正有:1)(温度影响的校正),原因是(温度改变导致水银密度的改变因此引起水银柱高度的改变,以及温度改变引起标尺刻度的改变);2)(海拔高度及纬度的校正),原因是(重力加速度随海拔高度和纬度变化,致使水银重量受到影响,导致气压计读数误差)。
浙江大学《物理化学(甲)》考研大纲

内容:涵盖物理化学(占左右)和结构化学(占左右).二、物理化学大纲1. 气体地关系基本内容:理想气体状态方程;分压定律和分体积定律;理想气体地微观模型;气体地液化;范德华方程与维里方程;临界性质;对应状态原理;压缩因子图.文档来自于网络搜索2. 热力学第一定律基本概念:重要热力学概念;热力学第一定律;热、功;内能;焓;热容;可逆体积功;相变焓;反应焓;节流膨胀.文档来自于网络搜索基本内容:热力学基本概念及术语;热力学第一定律地表述与数学表达式;ΔΔ及地定义;过程热地计算;与地关系;由计算和Δ;理想气体地等温可逆过程与绝热可逆过程功地计算;其他常见过程功地计算;相变焓、相变过程、相变热地计算;化学变化过程、化学反应热效应地计算;化学反应进度;标准热力学函数地计算.文档来自于网络搜索3.热力学第二定律基本概念:卡诺循环,过程可能性判据,热力学第二定律,熵及熵变,第三定律,吉布斯自由能,亥姆霍兹自由能,热力学基本方程及麦克斯韦关系式,特性函数,克-克方程.文档来自于网络搜索基本内容:卡诺循环;自发过程地共同特征;卡诺定理与热力学第二定律,熵增原理;熵函数,熵判据;各种典型过程熵变地计算;热力学第三定律,规定熵与标准熵;亥姆霍兹函数与吉布斯函数;Δ与Δ判据;一些基本过程Δ地计算与应用;热力学基本方程与麦克斯韦关系式;吉布斯—亥姆霍兹方程;克拉贝龙方程及其应用.文档来自于网络搜索4.多组分系统热力学基本概念:偏摩尔量,化学势,化学势判据,拉乌尔定律,亨利定律,理想液态混合物,理想稀溶液,稀溶液地依数性,逸度与逸度因子,活度与活度因子,热力学标准态.文档来自于网络搜索基本内容:偏摩尔量与摩尔量;偏摩尔量地集合公式;方程;化学势地定义与各类系统化学势地表示式;化学势判据;拉乌尔定律与享利定律;理想液态混合物地定义及其特征;稀溶液地定义及其依数性;逸度与逸度因子地计算;活度和活度因子地计算;标准态选择与活度地关系;简单汽液平衡计算.文档来自于网络搜索.相平衡基本概念:相律,相数、组分数和自由度数,单组分体系相图,二组分体系相图,步冷曲线,杠杆规则,三组分系统相图文档来自于网络搜索基本内容:相律;常见单组分系统相图;一级相变与二级相变;二组分气液平衡相图及杠杆规则;二组分理想液态混合物地气液平衡相图;二组分真实液态混合物地气液平衡相图;水蒸汽蒸馏、精馏原理;二组分液态部分互溶系统及完全不互溶系统地气液平衡相图;二组分系统液—固平衡相图;二组分固态不互溶凝聚系统相图;相图分析;热分析法制相图及溶解度法制相图;重结晶原理;二组固态互溶系统相图;固态完全互溶系统相图;固态部分互溶系统相图;生成稳定化合物与不稳定化合物凝聚系统相图.文档来自于网络搜索.化学平衡基本概念:摩尔反应函数,化学反应等温方程,标准平衡常数,经验平衡常数,化学平衡,平衡转化率,范特霍夫方程,平衡移动.文档来自于网络搜索基本内容:反应等温方程式地表达与应用;有关标准平衡常数地计算与应用;标准平衡常数地实验测定法;各种平衡常数之间地关系;平衡组成地计算;复相反应地平衡问题;温度对化学平衡地影响;压力对化学平衡地影响;惰性组分对平衡转化率地影响;反应物配比对平衡转化率地影响;同时平衡组成地计算;反应地耦合;实际气体反应及溶液中反应地热力学处理方法.文档来自于网络搜索7.电化学基本概念:电解质溶液,电导,电导率,摩尔电导率,迁移数,离子电迁移率,离子独立运动定律,平均离子活度,平均离子活度因子,离子强度,离子互吸理论,可逆电池,电动势,原电池热力学,电池反应,电极反应,能斯特方程,电极电势,浓差电池,液体接界电势,分解电压,极化,超电势,极化曲线.文档来自于网络搜索基本内容:电解池、原电池和法拉第定律;正极负极和阴极阳极地定义;离子地电迁移及迁移数;电解质溶液地电导率与摩尔电导率;离子独立运动定律;电导率、摩尔电导率与浓度地关系;离子地摩尔电导率与离子地迁移率;电导测定地应用;平均离子活度、平均离子活度因子地定义及其与离子强度地关系;极限公式;可逆电池;电池电动势和电极电势地能斯特方程;原电池设计;原电池热力学计算;电动势测定地应用;电极上地竞争反应.文档来自于网络搜索. 统计热力学初步基本概念:能级,简并度,定域子系统,离域子系统,独立子系统,相依子系统,能级分布,状态分布,微态数,最概然分布,平衡分布,玻尔兹曼分布,配分函数,统计熵,系综.文档来自于网络搜索基本内容:统计分布,统计平均,玻尔兹曼统计,熵地本质及玻尔兹曼公式,配分函数及其意义,配分函数地相关计算,热力学函数地统计计算,系综原理,统计热力学初步应用.文档来自于网络搜索.化学动力学基础基本概念:化学反应速率,基元反应,非基元反应,速率方程,反应级数,速率常数,阿伦尼乌斯方程,活化能,对行反应,平行反应,连串反应,链反应,爆炸极限,平衡近似,稳态近似,决速步近似,碰撞理论,过渡状态理论,势能面,活化络合物,单分子反应,分子反应动态学,笼效应,原盐效应,光化学反应,量子产率,催化反应动力学.文档来自于网络搜索基本内容:反应速率地定义及其实验测定;反应物浓度对反应速率地影响;反应速率方程;速率常数地意义;反应分子数与反应级数地区别与联系;简单反应动力学方程地积分形式及有关计算;温度对反应速度地影响;活化能计算和阿累尼乌斯公式地应用;对峙反应、平行反应、连串反应地动力学分析;复合反应地近似处理法;根据反应机理拟定速率方程;单分子反应机理;链反应地特征;动力学理论地要点;光化学反应动力学;各类催化反应动力学地基本特征.文档来自于网络搜索.界面化学及胶体化学基本概念:表面自由能,表面张力,界面张力,弯曲液面,附加压力,亚稳状态,物理吸附,化学吸附,吸附,吸附,接触角,润湿,铺展,表面过剩,单分子膜,表面活性剂,胶体,胶团,电泳,电渗,乳状液,溶胶,凝胶,高分子溶液.文档来自于网络搜索基本内容:界面张力、界面功与界面吉布斯函数;弯曲液面地附加压力;蒸气压与表面曲率地关系;亚稳状态与新相地生成;杨氏方程和润湿现象;固体表面上地吸附作用及等温吸附公式;吸附公式及其应用;吸附地特征;吸附热力学;溶液表面地吸附作用及吉布斯吸附公式;表面活性物质地结构及其应用;胶体化学;高分子溶液.文档来自于网络搜索三、结构化学大纲. 量子理论旧量子论;氢原子光谱;理论;波粒二象性;波函数;薛定谔方程;算符;算符地本征值问题及平均值公式;量子力学原理在简单体系中地应用.文档来自于网络搜索. 原子结构单电子原子地结构;定态薛定谔方程;能级表达式及几个量子数值之间地关系;波函数及电子云地图形表示及其物理意义;轨道角度分布图;多电子体系波函数地原理以及反对称波函数地行列式;双电子体系地波函数;规则;多电子原子地组态和电子填充原则;根据电子壳层结构解释元素化学性质地周期性变化,及一些元素地性质;原子地整体状态和光谱项.文档来自于网络搜索. 双原子分子线性变分法及其对地处理;双原子分子中地电子运动;共价键本质;简单分子轨道理论;双原子分子地轨道类型;双原子分子电子组态;双原子分子性质地解释(键地强度、键长、键型及键地种类);分子轨道与化学键联系和区别;价键理论.文档来自于网络搜索. 对称性与点群对称操作和对称元素;分子对称操作;分子点群;典型分子地点群结构;分子点群地乘法表;群地表示;群地性质;点群地性质;点群地特征标表;点群地特征标表地应用;点群与分子地旋光性地关系;点群与分子地偶极矩地关系.文档来自于网络搜索. 多原子分子杂化轨道理论;等性杂化与不等性杂化;多原子分子构型;多原子分子中非定域分子轨道地离域化;杂化轨道理论与分子轨道理论地比较;分子结构与性质地关系.文档来自于网络搜索. 共轭分子近似方法;久期行列式;轨道能、总能量和离域键键能,离域能地计算;分子图各项含义及其计算;缺电子分子和多中心键;共轭分子地书写及分类;分子轨道对称守恒原理;前线轨道理论;分子轨道能级相关图;电环合反应立体专一性及其他简单典型反应机理地解释.文档来自于网络搜索. 过渡金属化合物晶体场理论和配位场理论;配位化合物地结构及在水中地颜色地解释;应用晶体场理论对过渡金属化合物进行解释;稳定化能地求解;配位化合物地结构畸变;高自旋和低自旋化合物地区别与联系;不同配位化合物地结构与性质;分子轨道理论在配合物中地应用.文档来自于网络搜索. 簇合物和团簇轨道分裂;分裂能地概念及应用;分子轨道理论;羰基络合物及不饱和烃络合物地结构性质;原子簇化合物地成键规则;分子磁性及磁共振谱;磁化率及应用;核磁共振谱;顺磁共振;射线光电子能谱及紫外光电子能谱.文档来自于网络搜索固体晶体地点阵结构、结构基元;空间点阵地划分、点阵单位,晶面指标;晶体结构地描述,晶胞,晶胞参数,原子分数座标;晶体地宏观对称性;晶体地对称操作,对称元素及符号,七个晶系及各晶系地特征对称元素;个晶体点群;晶体地微观对称性;螺旋轴;各类晶体地典型结构;金属晶体地能带理论;离子键地本质,晶格能地计算;典型共价晶体,分子晶体及氢键晶体地结构特点;混合键型晶体;硅酸盐结构;晶体缺陷.文档来自于网络搜索。
(NEW)浙江大学《726物理化学(甲)》(含结构化学)历年考研真题汇编(含部分答案)

,且:
为什么上述机理中出现 。
为什么上述机理中出现
,而不出现
,而不出现
或
。
9.(本题10分)
对于电池:
假设氢气H2服从如下状态方程: 。
,其中常数
9-1 写出电极反应和电池反应;
9-2 当
时,计算电池在20℃时的电动势;
9-3 此条件下,当电池可逆放电时是吸热还是放热,为什么?
10.(本题10分)
2012年浙江大学726物理化学(甲)考研真 题及详解
浙江大学
二〇一二年攻读硕士学位研究生入学考试试题
考试科目:物理化学(甲)
编号:726
注意:答案必须写在答题纸上,写在试卷或草稿纸上均无效。
(可能用到的常数:玻尔兹曼常数 ,阿伏加德罗常数 )
,普朗克常数 ,法拉第常数
1.简答(每小题5分,共20分)
有三种配合物A、B、C,它们是硝基氨合钴(III)八面体配合物的 氯化物,其化学通式表示为[Co(III)(NH3)x(NO2)y]Clz,其中有 一个配合物y=0,三种配合物分别为1-1.1-2或1-3价型电解质之一。试 根据摩尔电导率测定值推测A、B、C三种配合物的分子式。
0.00391 0.00781
A 128.7 123.1
11.(本题20分)
B 155.7 147.9
C 106.8 102.9
据报道,苯并[18]冠-6(以X表示,图1)与铯离子可形成一种夹心 型的超分子阳离子,它与镍的配合物[Ni(dmit)2]-(以Y表示,图2) 结合后可形成复合物并产生独特的晶体结构,具有优越的磁学性能。
3.(20分) 在一密闭真空容器内放置一小玻璃泡,内封有1.802 g的液态水,整 个容器置于105℃的恒温箱中,设法将玻璃泡击碎后,在容器内产生 105℃、0.05MPa的水蒸气。已知,水在正常沸点下的蒸发焓为
【精品】浙江大学硕士入学物理化学1998及2000年试题乙和答案

浙江大学一九九八年攻读硕士学位研究生入学考试试题 一、简答题:(40分)1.理想气体模型的基本假设是什么?什么情况下真实气体和理想气体性质接近?2.增加压力,真实气体就可以液化。
这种说法对吗?为什么?3.不论孤立(隔离)体系内部发生什么变化,体系内能和熵总是不变。
对不对?4.NH 4Cl 在真空容器中达到解离平衡。
体系的独立组分数,相数和自由度各是多少?5.化学反应的级数是不是一定是正整数?为什么?6.如果反应1的活化能大于反应2的活化能,降低温度对哪个反应有利?为什么?7.BET 吸附理论和Langmuir 吸附理论的最基本不同是什么?8.0。
5法拉第的电量在电解时可以从CuSO 4溶液中沉淀多少克铜?原子量:Cu=64,S=32,O=16二、0.5摩尔的乙醇在78℃和101。
325kPa 下向真空蒸发成同温同压的气体,汽化热42。
4kJ ⋅mol -1。
求过程的U ∆,H ∆,A ∆,∆G ,以及体系和环境的总熵变∆S 。
(10) 三、27℃时密闭容器中充入60kPa 的COCl 2。
加热到527℃,COCl 2分解, COCl 2(g )CO(g)⇔+Cl 2(g),平衡压力为200kPa 。
试求:(15分)1.COCl 2的离解度α2.527℃时的平衡常数K p3。
该分解反应在527℃时的标准摩尔反应吉布斯函数r m G ∆四、(15分)0℃时水的摩尔体积是18.018ml ,冰的摩尔体积是19.625ml,为使冰点下降0。
1度,需加外压13。
3大气压。
(1大气压=1.013510⨯Pa )1.求冰在0℃时的溶解热H ∆ 2。
求水的的凝固点降低常数K f3.将少量蔗糖溶于水,在一大气压下,冰点下降为—0。
40℃.求该溶液在100℃时的饱和蒸气压. 五、反应活化能E a =250kJ ⋅mol -1,反应温度从300K 升高到310K 速率常数k 增加多少倍?(10分)六、银—氯化银电极和甘汞电极组成电池,在25℃时电池电动势0.0455伏,电池反应H ∆=1.07410⨯J 。
浙江大学物理化学考研试题及答案

2mol 2mol 300K 350K 100kPa 800kPaS∆−−→理想气体理想气体浙江大学硕士学位研究生入学考试物理化学(乙)参考答案一、填空:1. a b c d2.联系统计热力学与宏观热力学的桥梁,表明了熵的统计意义。
3.0.618min -1。
4.0.770V 。
5.00ln ()pp m RTRT V dp RTbdp RTbp pϕ=-==⎰⎰exp()bp ϕ= ,exp()f p p bp ϕ==。
6.n 2/n 1=0.32二、答:不矛盾。
当0p →时,任何气体符合理想气体模型,,1m pV RT Z ==。
在一定压力下,气体分子间距离较小,分子间的吸引力较大,使真实气体较气体易被压缩;同时,真实气体的分子又占一定体积,气体分子自由活动空间变小,使真实气体难被压缩。
这两种相反的作用因素对真实气体行为的影响在b 和b’点刚好抵消,数值上满足Z=1,,1m pV RT Z ==成立。
三、解:1.F =C -P +2=1-3+2=02.OA 线是冰的熔化曲线,OA 线斜率为负表示增大压力,冰的熔点下降。
根据克拉佩龙方程:**m mH dp dT T V ∆=∆,熔化过程,*m H ∆>0,***()()0m m m V V l V s ∆=-<,所以0dp dT <。
3.ln /b RT p p μμ=+ ,*ln /c RT p p μμ=+ , *p p >b c μμ∴>,说明同温度下过冷水(b )能自发地转变为冰(c ),过冷水与其饱和蒸气的平衡不是稳定平衡,但因为过冷水可以在一定时间内存在,所以称亚稳平衡。
四、提示:可以从以下几个方面展开,(1)2ln a E d kdT RT=,对于平行反应,活化能不同,反应速率受温度的影响不同,可以通过选择最适宜温度来控制反应物产率。
(2)催化剂具有选择性。
(3)选择适当波长的光,可以进一步提高反应的选择性。
浙江大学1998-2008年攻读硕士学位研究生入学考试试题及详解(免费-非常棒)
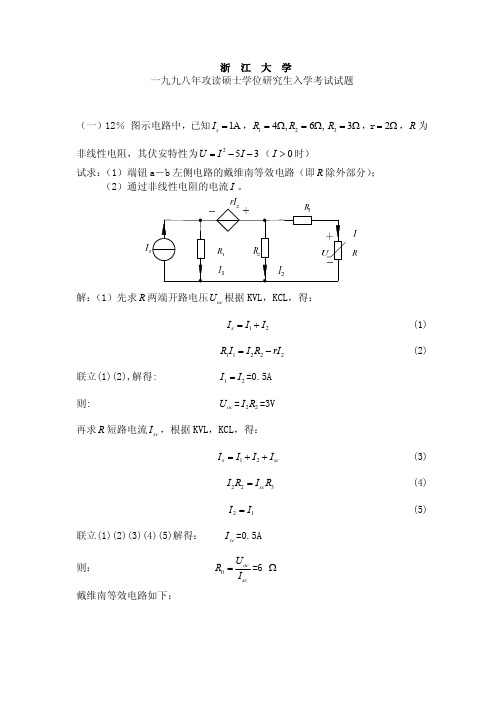
I L = 18 2 sin(w t - 36.9o ) 则此时电压 ¢ = -M u2 dI L = - M w18 2 cos(wt - 36.9) = -3 2 cos(wt - 36.9) dt
对于分量 u ¢¢¢(t ) = 5 2 sin 3w t ,由于 L 与 C 并联支路发生谐振,相当于开路则: u3 (t ) = 5 2 sin 3wt
+
(2)根据 KVL,可得: 6 I + I 2 - 5 I - 3 =3 解得: I =2A 或 I =-3A(舍去)
求 U oc 令解:将电流源开路,得如下电路:
设流过 R1 , R2 的电流分别为 I1 , I 2 则: rI1 + R1 I1 = R2 I 2 得: I1 = I 2
即受控源相当于 r =2 W 的电阻,等效电阻 R0 = ( R1 + r ) // R2 + R3 =6 W (本题主要应用戴维南定理, KVL, KCL 定理分析非线性电路, 对于求等效电阻 R0 , 一、求出负载两端的开路电压 U oc 和短路电流 I sc , R0 = U oc ;二、将负载外接电 I sc
(本题将列写状态方程与运算放大器结合起来,考虑运放的“虚短” “虚断”特 性,列写方程,参数选取电容电压和电感电流做为状态变量。 ) (四) 12% 图 (a) 所示电路的拓扑有向图 G 如图 (b) 所示, 其中 R1 = 4W, R2 = 8W , R3 = 4W, R4 = 1W , is (t ) = 2 sin 2t A , us (t ) = 5 2 sin(2t - 30° ) V 。 试求: (1)图 G 的降阶关联矩阵[A] (2)支路导纳矩阵[Y]; (3)节点导纳矩阵[ Yn ]; (4)列出节点电压方程。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
浙 江 大 学
2001年攻读硕士学位研究生入学考试试题
考试科目 物理化学 (乙) 编号
注意:答案必须写在答题纸上,写在试题纸或草稿上均无效。
一、填空(26分)
1.2mol 理想气体分别经历下列4个过程,体积都由V 变到2V 。
请分别计算过程前后的熵变:
(a )等温自由膨胀△S 1为( )-1
J K ⋅;
(b )等温可逆膨胀△S 2为( )-1J K ⋅;
(b )绝热自由膨胀△S 3为( )-1J K ⋅;
(d )绝热可逆膨胀△S 4为( )-1J K ⋅;
2.在15℃时,纯水的蒸气压为1.7kPa ,当某不挥发性溶质加入水中形成10.1mol kg -⋅的溶液时,蒸气压为0.7kPa ,则溶液与纯水之间的化学势之差为( )1J mol -⋅;
3.设葡萄糖在人体(设体温为37℃)血液中和尿中的质量摩尔浓度分别为3105.5-⨯和515.510mol kg --⨯⋅,若将1mol 葡萄糖从尿中转移到血液中,肾脏至少要作功( )kJ 。
4.试估算T =300K 、V =10-6m 3时氩气分子的配分函数q =( )。
已知Ar 的相对原子质量为39.95,普朗克常数为346.62610
J s -⨯⋅、玻尔兹曼常数为2311.38110J K --⨯⋅。
5.用同一电导池测得浓度30.01mol dm -⋅的A 溶液和浓度30.1mol dm -⋅的B 溶液的电阻分
别为1000Ω和500Ω,则它们的摩尔电导率之比,A ,B /m m ΛΛ为( )。
6.关系式r m G ∆=-zFE 的重要意义是( )
7.可将反应:222H ()1/2O ()H O()g g l +→设计成电池( )
8.“C 2H 2在空气中的爆炸界限为:低限2.5%,高限80%。
”此含义是( )
9.兰格缪尔吸附等温式的表达式为(
),它适用条件为( )。
二、(4分)真实气体和理想气体的逸度f 与压力p 的关系如
图1所示,图中a 和b 点都有f p = ,所以a 点是理想气体
的标准状态,b 点是真实气体的标准状态。
这种说法对吗?为
什么?
三、(8分)在101.325kPa 外压下,水的沸点为100℃,氯苯的沸点为130℃,水和氯苯的共沸点为91℃,水和氯苯两者完全不互溶。
试完成:
1. 示意该二组分系统的气—液平衡相图;
2. 指出各相区的平衡相和三相线的相平衡关系;
3. 该系统的上述特点对我们有何启示:
四、(10分)聚丙烯由丙烯单体聚合而成,丙烯单体的储存以液体状态为好,请估算能耐多大压力的储罐可以满足储存液体丙烯的要求。
已知丙烯常压沸点为225.7K ,假设夏季阳光下的最高温度为60℃。
五、(10分)煤,燃料油里总有一些含硫杂质,当它们燃烧时有SO 2和SO 3生成。
通过热力学计算,说明是否可以用生石灰CaO 来吸收SO 3,以减少烟道废气对空气的污染?已知燃烧炉温在1200℃左右,且有如下一些热力学函数(298.15K )可以选用:
六、(10分)某药物的有效成分分解掉30%即为失效。
若在276K 时,保存期为2年,如果将该药物在298K 时放置14天,通过计算说明此药物是否失效?已知分解活化能1130kJ mol a E -=⋅,并设药物分解百分数与浓度无关。
七、(10分)乙醛热分解的机理为:
133CH CHO CH CHO k −−→+
23342CH CH CHO CH CH CHO k +−−→+
323CH CHO CO CH k −−→+
图1
43326CH CH C H k +−−→
1. 试推导生成甲烷的速率方程;
2. 若各基元反应的活化能分别为1112318kJ mol ,41.8kJ mol E E --=⋅=⋅,
1375.3kJ mol ,E -=⋅140kJ mol E -=⋅,求生成甲烷反应的表观活化能。
八、(10分)已知25℃时AgBr 的溶度积134.8810,(Ag Ag)0.7994V sp K E -+=⨯= ,
-2{Br ()Br } 1.065V,E l = 试计算25℃
时: 1. 标准电极电势-(Br ,AgBr()Ag(s));E s
2. AgBr(s)的f m G ∆ 。
九、(12分)工业上通过乙苯催化脱氢制苯乙烯,且常采用如下生产条件:
1. 减压;
2. 反应温度600℃;
3. 原料气中加入大量水蒸气,使水蒸气与乙苯蒸气的物质的量(摩尔)比为9:1。
试用有关物理化学原理解释为什么工业上采用这样一些条件。
(已知600℃时的K p
=0.178,脱氢反应为吸热反应。
)。
