第四章 多组分系统热力学练习题及答案
04 多组分系统热力学 习题课(含答案)
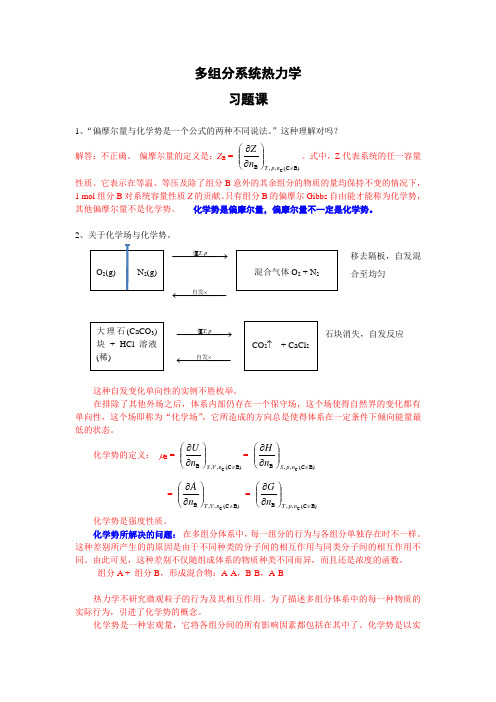
多组分系统热力学习题课1、“偏摩尔量与化学势是一个公式的两种不同说法。
”这种理解对吗? 解答:不正确。
偏摩尔量的定义是:Z B = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n Z 。
式中,Z 代表系统的任一容量性质。
它表示在等温、等压及除了组分B 意外的其余组分的物质的量均保持不变的情况下,1 mol 组分B 对系统容量性质Z 的贡献。
只有组分B 的偏摩尔Gibbs 自由能才能称为化学势,其他偏摩尔量不是化学势。
化学势是偏摩尔量,偏摩尔量不一定是化学势。
2、关于化学场与化学势。
−−−−→−pT,恒 移去隔板,自发混合至均匀−−−−−←⨯自发−−−−→−pT,恒 石块消失,自发反应 −−−−−←⨯自发这种自发变化单向性的实例不胜枚举。
在排除了其他外场之后,体系内部仍存在一个保守场,这个场使得自然界的变化都有单向性,这个场即称为“化学场”,它所造成的方向总是使得体系在一定条件下倾向能量最低的状态。
化学势的定义: μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV S n U = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np S n H= B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂nV T n A = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G化学势是强度性质。
化学势所解决的问题: 在多组分体系中,每一组分的行为与各组分单独存在时不一样。
这种差别所产生的的原因是由于不同种类的分子间的相互作用与同类分子间的相互作用不同。
由此可见,这种差别不仅随组成体系的物质种类不同而异,而且还是浓度的函数。
组分A + 组分B ,形成混合物:A-A ,B-B ,A-B热力学不研究微观粒子的行为及其相互作用。
为了描述多组分体系中的每一种物质的实际行为,引进了化学势的概念。
化学势是一种宏观量,它将各组分间的所有影响因素都包括在其中了。
化学势是以实际应用为背景引入的一个概念,有很强的实践性。
化学势的物理意义:μB = B)(C ,,B C ≠⎪⎪⎭⎫⎝⎛∂∂np T n G = 偏摩尔Gibbs 自由能G B它表示在T 、p 和其他组分的含量不变的条件下,增加1 mol 组分B 对于体系总Gibbs自由能的贡献。
自测习题 第 章 多组分系统热力学

第4章 多组分系统热力学思考题:1. 理想液态混合物和理想气体的微观模型有何不同?2. 理想稀溶液要“稀”到什么程度才算理想稀溶液?3. 在相同的温度和压力下,相同质量摩尔浓理想液态混合物和理想气体的微观模型有何不同?度的葡萄糖和食盐水溶液的渗透压是否相同?4. 在一完全密闭的透明恒温箱中放有两个体积相同的杯子。
往A ,B 杯中分别倒入1/3体积的纯水和蔗糖水溶液,并置于该恒温箱中。
假设恒温箱很小,有少量水蒸发即可达到饱和。
那么经足够长时间后,两杯中会发生什么现象?解释原因。
选择题:1. 下述各量中,哪些是偏摩尔量?( ) A. C n P T B n H ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ B. C n V T B n U ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ C. C n V T p A ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ D. C n V p T G ,,⎟⎠⎞⎜⎝⎛∂∂ E. C n p T B n V ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ F. Cn p S B n H ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ 下述各量中,哪些不是化学势?( )A. *,B m G B. C n S V B n U ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ C. C n p T B n H ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ D. Cn p T B n G ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ E. B μ F. Cn V T B n A ,,⎟⎟⎠⎞⎜⎜⎝⎛∂∂ 2. 单一组分过冷液体的化学势比其固体的化学势( )A. 高B. 低C. 相等D. 不可比较3. 重结晶制盐的过程中,析出的NaCl 固体的化学势比母液中NaCl 的化学势( )A. 高B. 低C. 相等D. 不可比较4.在溶剂中加入非挥发性溶质后沸点升高,说明该溶剂的化学势比未加溶质前的化学势()A. 高B. 低C. 相等D. 不可比较5.恒温恒压下,在A、B组成的均相体系中,若A的偏摩尔体积随浓度的改变而增加时,B的偏摩尔体积将()A. 增加B. 减少C. 不变D. 不一定6.0℃,2PΘ时,水的化学势比冰的化学势()A. 高B. 低C. 相等D. 不可比较7.混合理想气体中组分i的标准态与混合非理想气体中组分i的标准态相比较,其关系为()A. 相同B. 不同C. 不一定相同D. 无关系8.下列哪种方法对消灭蚂蟥更有利?()A. 用手拍B. 用刀切成几段C. 扔到岸边暴晒D. 扔到岸边向其身体撒盐9.恒温下,B溶于A中组成溶液。
物理化学第四章复习题解答1

第四章多组分系统热力学及其在溶液中的应用复习题解答1.下列说法是否正确,为什么?(1)溶液的化学势等于溶液中个组分的化学势之和;答:错。
溶液无化学势。
(2)对于纯组分,其化学势就等于它的Gibbs自由能;答:错。
对于纯组分其化学势等于其摩尔Gibbs自由能。
(3)在同一稀溶液中,溶质B的浓度分别可以用xB,mB,cB表示,其标准态的表示方法也不同,则其相应的化学势也就不同;答:错。
因为pB=kx ·xB = km ·mB =kc ·cB,μ= μx*+RTln xB= μm*+RTln (mB/mº)= μc*+RTln (cB/cº),所以其标准态的表示方法可不同,但其相应的化学势相同。
(4)在同一溶液中,若标准态规定不同,则其相应的相对活度也就不同;答:对。
?(5)二组分理想液态混合物的总蒸气压,一定大于任一组分的蒸气分压;答:对。
p = pA+ pB p> pA 或 p> pB(6)在相同温度、压力下,浓度都是0.01mol·kg-1的食糖和食盐水溶液的渗透压相等;(6)错。
食糖以分子形式存在于水溶液中,而食盐以离子形式存在于水溶液中,虽然浓度相同,但在溶液中的粒子数不同,所以产生的渗透压不等。
(7)稀溶液的沸点一定比纯溶剂高;答:错。
稀溶液中所加的溶质若是难挥发的非电解质,则其沸点一定比纯溶剂高;若加的是易挥发的溶质就不一定。
(8)在KCl重结晶过程中,析出的KCl(s)的化学势大于母液中KCl的化学势;答:错。
应该相反,化学势从高到低的方向变化。
析出的KCl(s)的化学势小于母液中KCl 的化学势。
(9)相对活度a=1的状态就是标准态;答:错。
对溶质,在T,pº下,当γ→1时,各自浓度均为1的假想态为标准态。
(10)在理想液态混合物中,Roult定律与Henry定律相同。
答:对。
pB= pB *·xB =kx ·xB2.想一想,这是为什么?(1)在寒冷的国家,冬天下雪前,在路上洒盐;答:利用稀溶液凝固点较纯溶剂低,在路上洒盐可降低冰点,防止路因结冰而变滑。
第四章、多组分系统热力学

第四章,多组分系统热力学一、选择题1. 在 298K 时,A 和 B 两种气体单独在某一溶剂中溶解,遵守亨利定律,亨利常数分别为 kA 和 KB,且知 KA>KB,则当 A 和 B 压力(平衡时的)相同时,在一定量的该溶剂中所溶解的关系为 ( ) B (A) A 的量大于 B 的量 (B) A 的量小于 B 的量(C) A 的量等于 B 的量 (D) A 的量与 B 的量无法比较2. 在 400K 时,液体 A 的蒸气压为 4×104Pa,液体 B 的蒸气压为 6×104Pa,两者组成理想液体混合物,平衡时,溶液中 A 的物质的量分数为 0.6,则气相中 B 的物质的量分数为: ( ) B(A) 0.60 (B) 0.50 (C) 0.40 (D) 0.313. 已知挥发性纯溶质 A 液体的蒸气压为 67 Pa,纯溶剂 B 的蒸气压为 26665Pa,该溶质在此溶剂的饱和溶液的物质的量分数为 0.02,则此饱和溶液(假设为理想液体混合物)的蒸气压为:( ) C(A) 600 Pa (B) 26198 Pa (C) 26133 Pa (D) 599 Pa4. 已知 373.2K 时,液体 A 的饱和蒸气压为 133.32 kPa,另一液体 B 可与 A构成理想液体混合物。
当 A 在溶液中的物质的量分数为 0.5 时,A 在气相中的物质量分数为 2/3 时,则在 373.2K时,液体 B 的饱和蒸气压应为: ( ) A(A) 66.66 kPa (B) 88.88 kPa (C) 133.32 kPa (D) 266.64 kPa5. 已知 373K 时液体 A 的饱和蒸气压为 133.24kPa,液体 B 的饱和蒸气压为66.62kPa。
设 A 和 B形成理想溶液,当 A 在溶液中的摩尔分数为 0.5 时,在气相中 A 的摩尔分数为: ( ) D(A) 1 (B) 1/2 (C) 1/3 (D) 2/36. 关于亨利系数,下列说法中正确的是: ( ) D(A) 其值与温度、浓度和压力有关(B) 其值与温度、溶剂性质和浓度有关(C) 其值与温度、溶质性质和浓度有关(D) 其值与温度、溶质和溶剂性质及浓度的标度有关7. 已知 373K 时,液体 A 的饱和蒸气压为 5×104 Pa,液体 B 的饱和蒸气压为 105Pa,A 和 B构成理想液体混合物,当 A 在溶液中的物质的量分数为 0.5时,气相中 B 的物质的量分数为:( ) A(A) 1/1.5 (B) 1/2 (C) 1/2.5 (D) 1/38.2molA物质和3molB物质在等温、等压下,混合形成理想液态混合物,该系统中A和B的偏摩尔体积分别为1.79×10-5m3×mol-1,2.15×10-5m3×mol-1,则混合物的总体积为:() C(A)9.67×10-5m3 (B)9.85×10-5m3(C)1.003×10-4m3 (D)8.95×10-5m39.298K,标准压力下,苯和甲苯形成理想液态混合物。
第四章--多组分系统热力学习题

第四章多组分系统热力学选择题1. 在和101325Pa•下水的化学势与水蒸气化学位的关系为(A) μ(水)=μ(汽) (B) μ(水)<μ(汽)(C) μ(水)>μ(汽) (D) 无法确定答案:A。
两相平衡,化学势相等。
2.下列哪种现象不属于稀溶液的依数性(A) 凝固点降低(B)沸点升高(C) 渗透压(D)蒸气压升高^答案:D。
稀溶液的依数性之一为蒸气压下降。
3.98K时,A、B两种气体在水中的亨利常数分别为k1和k2,且k1>k2,则当P1=P2时,A、B在水中的溶解量C1 和C2 的关系为(A) C1>C2 (B) C1<C2 (C) C1=C2 (D) 不能确定答案:B4.将非挥发性溶质溶于溶剂中形成稀溶液时,将引起(A) 沸点升高(B) 熔点升高(C) 蒸气压升高(D) 都不对答案:A。
稀溶液的依数性包括沸点升高、凝固点下降、蒸气压下降和渗透压。
5. 涉及纯物质标准状态的下列说法中不正确的是(A) 纯理想气体的标准状态就是标准压力P(100KPa)下的状态(B) 纯液体物质的标准状态就是标准压力P(100KPa)下的纯液体—(C) 纯固体物质的标准状态就是标准压力P(100KPa)下的纯固体(D) 不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同答案:D6. 稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它们有关,其中正确的是(A) 只有溶质不挥发的稀溶液才有这些依数性(B) 所有依数性都与溶液中溶质的浓度成正比(C) 所有依数性都与溶剂的性质无关(D) 所有依数性都与溶质的性质有关答案:B7. 关于亨利系数, 下面的说法中正确的是!(A) 其值与温度、浓度和压力有关(B) 其值只与温度、溶质性质和浓度标度有关(C) 其值与溶剂性质、温度和浓度大小有关(D) 其值与温度、溶剂和溶质的性质及浓度标度等因素都有关答案:D8. 定义偏摩尔量时规定的条件是(A) 等温等压 (B) 等熵等压(C) 等温, 溶液浓度不变 (D) 等温等压, 溶液浓度不变答案:D9. 关于偏摩尔量, 下面的说法中正确的是~(A) 偏摩尔量的绝对值都可求算(B) 系统的容量性质才有偏摩尔量(C) 同一系统的各个偏摩尔量之间彼此无关(D) 没有热力学过程就没有偏摩尔量答案:B10. 关于偏摩尔量, 下面的叙述中不正确的是(A) 偏摩尔量是状态函数, 其值与物质的数量无关(B) 系统的强度性质无偏摩尔量(C) 纯物质的偏摩尔量等于它的摩尔量(D) 偏摩尔量的数值只能为整数或零-答案:D11. 影响沸点升高常数和凝固点降低常数值的主要因素是(A) 溶剂本性 (B) 温度和压力 (C )溶质本性(D) 温度和溶剂本性答案:A 。
第四章 多组分系统热力学及其在溶液中的应用

第四章 多组分系统热力学及其在溶液中的应用1.在298K 时,有0.10kg 质量分数为0.0947的硫酸H 2SO 4水溶液,试分别用(1)质量摩尔浓度B m ;(2)物质的量浓度和B c (3)摩尔分数B x 来表示硫酸的含量。
已知在该条件下,硫酸溶液的密度为331.060310kg m -⨯⋅ ,纯水的浓度为3997.1kg m -⋅ 。
解:质量摩尔浓度:()2410.19.47%/1009.47%0.1981.067mol H SO B n m W kg -⨯==-⨯=⋅水物质量浓度:()24331009.47%0.10.19.47%/98997.11.02310mol H SO B n c V m --⨯⨯===⨯g 水 摩尔分数:242420.0189H SO B H SO H On x n n ==+2、在K 298和大气压力下,含甲醇()B 的摩尔分数B x 为0.458的水溶液密度为30.8946kg dm -⋅,甲醇的偏摩尔体积313()39.80V CH OH cm mol -=⋅,试求该水溶液中水的摩尔体积2()V H O 。
解:3322CH OH CH OH H O H O V n V n V =+3322CH OH CH OHH O H OV n V V n -=以1mol 甲醇水溶液为基准,则330.45832(10.458)180.027290.894610m V dm ρ⨯+-⨯===⨯ ∴23310.027290.45839.801016.7210.458H OV cm mol ---⨯⨯==⋅-3.在298K 和大气压下,某酒窖中存在酒10.0m3,其中含乙醇的质量分数为0.96。
今欲加水调制含乙醇的质量分数为0.56的酒,试计算(1)应加入水的体积;(2)加水后,能得到含乙醇的质量分数为0.56的酒的体积已知该条件下,纯水的密度为3997.1kg m -⋅,水和乙醇的偏摩尔体积为()25C H OH ω()()6312/10V H O m mol --⋅ ()()63125/10V C H OH m mol --⋅0.96 14.61 58.0 0.5617.11 56.58解:设加入水的物质的量为O H n 2',根据题意,未加水时,2520.9610.96::9.3914618C H OH H O n n -== 2525221C H O H C H O H H O H OV n V n V =⋅+⋅ 即 661001.581061.1410522--⨯⨯+⨯⨯=O H H C O H n n 解出:25167882C H OH n mol =217877H O n mol = 加入水后,25220.5610.56:():0.4984618C H O HH O H On n n -'+== 20.5610.56167882:(17877):0.4984618H O n -'+== 2'317887H O n mol = 加入水的物质的体积为23331788718105.727()999.1H O V m -⨯⨯'== 2525222252'26'6()56.5810(17877)17.1110C H OH C H OH H O H OH OC H OH H OV n V n n V n n--=++=⨯⨯++⨯⨯329.4984495 5.76753115.266V m =+=4.在K 298和kPa 100下,甲醇)(B 的摩尔分数B x 为30.0的水溶液中,水)(A 和甲醇)(B 的偏摩尔体积分别为:132765.17)(-⋅=mol cm O H V ,133632.38)(-⋅=mol cm OH CH V 。
第四章多组分系统热力学2

物化习题第四章多组分系统热力学一判断题1、在101.3Kpa下,往纯水中加入少量NaCl,与纯水比较,此稀溶液沸点升高。
()2、偏摩尔量集合公式Z=∑nBzB,m适用条件是恒温过程。
()恒温恒压过程3、Henry系数Kx,B只与溶剂溶质性质有关,而与温度无关。
()温度不同,亨利系数不同。
温度升高,系数升高。
4、沸点升高系数Kb的数值与溶剂、溶质的性质有关,且与温度有关。
()Kb的量仅与溶剂的性质有关5.、若A分子和B分子之间的相互作用力,与A,B各自处于纯态时分子之间的相处作用力相同,混合后,则有⊿Hmin=0.( )6、标准就态是认为规定的某些特定状态。
()7、理想溶液中,各种微粒间的相互作用力可忽略不计。
()处于凝聚态的分子,其分子间的距离很小,分子间的相互作用力和分子的体积均不能忽略。
8、一切纯物质的凝固点都随外压的增大而上升。
()9、稀溶液的非典一定比纯溶剂的沸点高。
()在同一外压条件下10、在相同温度和压力下,相同质量摩尔浓度的葡萄糖和食盐水的渗透压不相同。
()Ⅱ=CbRT,溶液的渗透压的大小只由溶液中的溶质的浓度决定,而与溶质的本性无关。
11、摩尔分数和质量摩尔浓度与温度无关,而物质的量浓度与温度有关()12、在相平衡中,若各相中均有组分B,则组分B在个相中的化学势一定相等。
()系统处于相平衡,由于系统任一组分B在其存在的每个相中的化学势相等。
13、溶剂中融入挥发性溶质,肯定会引起溶液的蒸汽压升高。
()14、二组分理想液态混合物的总蒸汽压大于任一组分的蒸汽压。
()处于中间态。
15、只有广度性质才有偏摩尔量。
( )16、凡是自由能降低的过程一定都是自发过程。
()17、拉乌尔定律和亨利定律既适合于理想溶液,也适合于稀溶液。
()18、偏摩尔量因为与浓度有关,因此它不是一个强度性质。
()19、某一体系达平衡时,熵最大,自由能最小。
()20、在一个多组分溶液中,只有溶质才有偏摩尔量。
()21、封闭系统中,由状态1经定温、定压过程变化到状态2,非体积功W′>△G和△G﹤0,则此过程一定能发生。
《多组分系统热力学》习题及答案.doc

(A)纯理想气体的标准状态就是标准压力P(100KPa)T 的状态 (B)纯液体物质的标准状态就是标准压力P (lOOKPa)下的纯液体(C) 纯固体物质的标准状态就是标准压力P (lOOKPa)下的纯固体(D) 不同的物质在相同温度下都处于标准状态时,它们的同一热力学函数值都应相同 答案:D 6.稀溶液的依数性包括蒸汽压下降、沸点升高、凝固点降低和渗透压,下面的陈述都与它 们有关,其中正确的是(A)只有溶质不挥发的稀溶液才有这些依数性 正比 (0所有依数性都与溶剂的性质无关 答案:B7. 关于亨利系数,下面的说法中正确的是 (A)其值与温度、浓度和压力有关 (0其值与溶剂性质、温度和浓度大小有关 度等因素都有关答案:D8. 定义偏摩尔量时规定的条件是 (A)等温等压(B)等嫡等压(C)等温,溶液浓度不变(D)等温等压,溶液浓度不变答案:D9. 关于偏摩尔量,下面的说法中正确的是 (A)偏摩尔量的绝对值都可求算(B)(0同一系统的各个偏摩尔量之间彼此无关 答案:B10. 关于偏摩尔量,下面的叙述中不正确的是 (A)偏摩尔量是状态函数,其值与物质的数量无关(0纯物质的偏摩尔量等于它的摩尔量 (B)所有依数性都与溶液中溶质的浓(D)所有依数性都与溶质的性质有(B)(D其值只与温度、溶质性质和浓度标度有关 其值与温度、溶剂和溶质的性质及浓度标系统的容量性质才有偏摩尔量 没有热力学过程就没有偏摩尔量 (D(B)系统的强度性质无偏摩尔量(D)偏摩尔量的数值只能为整《多组分系统热力学》习题及答案选择题1. 在373. 15K 和101325Pa 下水的化学势与水蒸气化学位的关系为(A) u (水)=p(汽)(B) u (水)< P (汽)(C) 11(水)>口(汽)(D)无法确定 答案:A 。
两相平衡,化学势相等。
2. 下列哪种现象不属于稀溶液的依数性(A)凝固点降低 (B)沸点升高 (C)渗透压 (D)蒸气压升高 答案:D 。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
第四章多组分系统热力学练习题及答案
1.20 ︒C下HCl溶于苯中达平衡,气相中HCl的分压为101.325 kPa时,溶液中HCl的摩尔分数为0.0425。
已知20 ︒C时苯的饱和蒸气压为10.0 kPa,若20︒C时HCl和苯蒸气总压为101.325 kPa,求100 g笨中溶解多少克HCl。
解:设HCl在苯中的溶解符合Henry定律
2.60 ︒C时甲醇的饱和蒸气压是84.4 kPa,乙醇的饱和蒸气压是47.0 kPa。
二者可形成理想液态混合物。
若混合物的组成为二者的质量分数各50 %,求60 ︒C时此混合物的平衡蒸气组成,以摩尔分数表示。
解:质量分数与摩尔分数的关系为
求得甲醇的摩尔分数为
根据Raoult定律
3.80 ︒C是纯苯的蒸气压为100 kPa,纯甲苯的蒸气压为38.7 kPa。
两液体可形成理想液态混合物。
若有苯-甲苯的气-液平衡混合物,80 ︒C时气相中苯的摩尔分数,求液相的组成。
解:根据Raoult定律
4. A,B两液体能形成理想液态混合物。
已知在温度t时纯A的饱和蒸气压
,纯B的饱和蒸气压。
(1)在温度t下,于气缸中将组成为的A, B混合气体恒温缓慢压缩,求凝结出第一滴微小液滴时系统的总压及该液滴的组成(以摩尔分数表示)为多少?
(2)若将A, B两液体混合,并使此混合物在100 kPa,温度t下开始沸腾,求该液态混合物的组成及沸腾时饱和蒸气的组成(摩尔分数)。
解:1. 由于形成理想液态混合物,每个组分均符合Raoult定律; 2. 凝结出第
一滴微小液滴时气相组成不变。
因此在温度t
混合物在100 kPa ,温度t 下开始沸腾,要求
5. 已知101.325kPa 下,纯苯(A )的正常沸点和摩尔蒸发焓分别为353.3K 和30762J·mol -1,纯甲苯(B )的正常沸点和摩尔蒸发焓分别为383.7K 和31999J·mol -1。
苯和甲苯形成理想液态混合物,若有该种液态混合物在101.325kPa ,373.1K 沸腾,计算混合物的液相组成。
解:在373.1K 苯的饱和蒸气压为*A,2p ,则
*
A,2*A,1
3072611
ln()()0.55518.314373.1353.3
p p =-
-= **A,2A,1=1.7422 1.7422176.525p p p kPa θ⨯=⨯= 在373.1K 甲苯的饱和蒸气压为*B,2p ,则 *
B ,2
*B ,13199911
l n ()()0.28508.314373.1
383.7
p p =--=- *
B,2p =0.7520×p =76.198kPa
在液态混合物沸腾时(101.325kPa 下):
p =*A,2p x A +*
B,2p (1-x A ) x A = (p -*B,2p ) / (**A,2B,2
p p -)101.32576.198
0250176.52576.198
-==-
x B =0.750
6. 邻二甲苯和对二甲苯形成理想液态混合物,在25℃时,将1mol 邻二甲苯与1mol 对二甲苯混合,求此混合过程的Δmix V ,Δmix H ,Δmix S ,Δmix G 。
解:Δmix V=0;Δmix H =0;
Δmix S =-R ∑B B ln x n =-8.314J ·K -1·mol -1×2×1mol ×ln0.5 =11.5J ·K -1; Δmix G =RT ∑B B ln x n =-3.43kJ
7. 10 g 葡萄糖(C 6H 12O 6)溶于400 g 乙醇中,溶液的沸点较纯乙醇的上升0.1428 ︒C 。
另外有2 g 有机物质溶于100 g 乙醇中,此溶液的沸点则上升0.1250 ︒C 。
求此有机物质的相对分子质量。
解:10 g 葡萄糖(C 6H 12O )溶于400 g 乙醇中
2 g 有机物质溶于100 g 乙醇中
8.已知0︒C ,101.325 kPa 时,O 2在水中的溶解度为;N 2在水中的
溶解度为。
试计算被101.325 kPa ,体积分数
,
的空气所饱和了的水的凝固点较纯水的降低了多少?
解:为101.325 kPa 的空气所饱和了的水中溶解的O 2和N 2的物质两分别为
查表知水的凝固点降低系数为
,因此
9. 已知樟脑(C 10H 16O )的凝固点降低系数为。
(1)某一溶质相
对分子质量为210,溶于樟脑形成质量分数为5 %的溶液,求凝固点降低多少?(2)另一溶质相对分子质量为9000,溶于樟脑形成质量分数为5 %的溶液,求凝固点降低多少?
解:容易导出质量分数和质量摩尔浓度间的关系
因此,
10.在25 C 时,10 g 某溶剂溶于1 dm 3溶剂中,测出该溶剂的渗透压为
,确定该溶质的相对分子质量。
解:溶剂的渗透压表示为。
