08 电化学
物理化学08章_电解质溶液

1、
当通电结束,阴、阳两极部溶液浓度相同, 但比原溶液各少了2mol,而中部溶液浓度不变。
2、 3
通电结束,阳极部正、负离子各少了3mol, 阴极部只各少了1mol,而中部溶液浓度仍保持不变。
3、离子的电迁移现象结果
1 向阴、阳两极迁移的正、负离子物质的量总和恰好 等 于通入溶液的总电量
1Au3 e 1Au
3
3
1 H O e 1O +H
22
42
(3) n(O2) 14n(13Au)
= 11.20 g
4.57103 mol
4 197.0 gmol1/3
Au3 3e Au
3 H O 3e 3O +H
22
42
(3) n(O2) 34n(Au) = 3 1.20 g 4.57103 mol 4 197.0 gmol1
( 2 CuSO4 )
7.17 103 S m2 mol1
二、电导的测定
R1 Rx R3 R4
若已知 l、A、c, 则可求得 、m
电导池常数
K cell
l A
1
R
R
25℃时在一电导池盛以c=0.02mol.dm-3的KCl溶液,测得其电阻为82.4Ω,若在同 一电导池中盛以c=0.0025 mol.dm-3的K2SO4 溶液,测得其电阻为326.0 Ω。已知 25℃0.02mol.dm-3的KCl溶液的电导率为0.2768s.m-1,试求:
2 4 c( K SO ) 2.799 10 s.m .mol
24
三、电导率和摩尔电导率与浓度的关系
强电解质:
浓度增加,电导率升高;
但达一最高点下降
弱电解质: 溶液电导率随浓度变化 不显著
第08章 电化学基础

∴ E (H+/H2)= -0.28V
2HOAc+2e ⇌2OAc- + H2(g) EӨ =-0.28V
8.3.3 沉淀对电极电势的影响
例 298K时,在Fe3+、Fe2+的混合溶液中加入NaOH时有Fe(OH)3、Fe(OH)2
沉淀生成,假设无其它反应发生,当沉淀反应达到平衡时,保持C(OH-) =1. 0mol· -1 ,求E(Fe3+/Fe2+)为多少? L
荷过剩,CuSO4溶液中则由于Cu2+的沉积而负电荷过剩。
从而阻止电子从锌极流向铜极,电池反应便会停止,直至 无电流产生。 3:当有盐桥存在时,随着反应的进行,盐桥中的负离子进 入ZnSO4溶液中,正离子进入CuSO4溶液中,以保持溶液的
电中性,使电流连续产生。
原电池的构造是这样的,如何表示原电池呢?
=1.60V 说明:含氧酸盐在酸性介质中氧化性增强。
8.3.3 酸度对电极电势的影响
例 已知电极反应2H++2e =H2(g),EӨ =0.0V ,向体系中加入NaOAc,使得 C(HOAc)=C(NaOAc)=1. 0mol· -1 ,P(H2)=PӨ,求E(H+/H2)。 L
Ka = 1.8*10-5
确定了标准之后,如何确定其它电极电势呢?
8.3.2 标准电极电势-电极电势的定义
将待测电极与标准氢电极组成一个原电池,测得该原
电池的电动势(E),就可以知道待测电极相对于标准氢
电极的电极电势。
E(电池)= E(待测)- E(标准氢电极)
测定Cu电极的EӨ,组成如下电池:
(-)Pt|H2(g)∣H+(CӨ)‖Cu2+(CӨ)∣Cu(+) EӨ = EӨ(Cu2+/Cu) - EӨ(H+/H2) 0 ∴ EӨ(Cu2+/Cu)=0.340V
全国通用2024_2025三年高考化学真题分项汇编专题08电化学及其应用

专题08电化学及其应用2024年高考真题1.(2024·广东卷)以熔融盐为电解液,以含Cu Mg 、和Si 等的铝合金废料为阳极进行电解,实现Al 的再生。
该过程中A .阴极发生的反应为2+Mg 2e Mg --=B .阴极上Al 被氧化C .在电解槽底部产生含Cu 的阳极泥D .阳极和阴极的质量改变相等【答案】C【解析】依据电解原理可知,电解池中阳极发生失电子的氧化反应,阴极发生得电子的还原反应,该题中以熔融盐为电解液,含Cu Mg 、和Si 等的铝合金废料为阳极进行电解,通过限制肯定的条件,从而可使阳极区Mg 和Al 发生失电子的氧化反应,分别生成Mg 2+和Al 3+,Cu 和Si 不参与反应,阴极区Al 3+得电子生成Al 单质,从而实现Al 的再生,据此分析解答。
A .阴极应当发生得电子的还原反应,事实上Mg 在阳极失电子生成Mg 2+,A 错误;B .Al 在阳极上被氧化生成Al 3+,B 错误;C .阳极材料中Cu 和Si 不参与氧化反应,在电解槽底部可形成阳极泥,C 正确;D .因为阳极除了铝参与电子转移,镁也参与了电子转移,且还会形成阳极泥,而阴极只有铝离子得电子生成铝单质,依据电子转移数守恒及元素守恒可知,阳极与阴极的质量改变不相等,D 错误;故选C 。
2.(2024·全国甲卷)一种水性电解液Zn-MnO 2离子选择双隔膜电池如图所示(KOH 溶液中,Zn 2+以Zn(OH)24-存在)。
电池放电时,下列叙述错误的是A .Ⅱ区的K +通过隔膜向Ⅲ区迁移B .Ⅰ区的SO 24-通过隔膜向Ⅱ区迁移C . MnO 2电极反应:MnO 2+2e -+4H +=Mn 2++2H 2OD .电池总反应:Zn+4OH -+MnO 2+4H +=Zn(OH)24-+Mn 2++2H 2O【答案】A【解析】依据图示的电池结构和题目所给信息可知,Ⅲ区Zn 为电池的负极,电极反应为Zn-2e -+4OH -=Zn(OH)24-,Ⅰ区MnO 2为电池的正极,电极反应为MnO 2+2e -+4H +=Mn 2++2H 2O ;电池在工作过程中,由于两个离子选择隔膜没有指明的阳离子隔膜还是阴离子隔膜,故两个离子隔膜均可以通过阴、阳离子,因此可以得到Ⅰ区消耗H +,生成Mn 2+,Ⅱ区的K +向Ⅰ区移动或Ⅰ区的SO 24-向Ⅱ区移动,Ⅲ区消耗OH -,生成Zn(OH)24-,Ⅱ区的SO 24-向Ⅲ区移动或Ⅲ区的K +向Ⅱ区移动。
电化学原理和方法

电化学原理和方法电化学是研究电荷在电化学界面上转移和反应的学科,是物理化学的重要分支之一。
通过电化学实验和研究,可以揭示物质的电化学性质,并应用于电池、电解池、电解制备和分析等领域。
本文将介绍电化学的基本原理和常用的实验方法。
一、电化学基本原理1. 电解学和电池学电解学研究的是电解液中电荷的转移现象,它关注电离和非电离物质在电解液中的电化学行为。
电池学则研究的是电池的性质和工作原理,包括原电池、电解池和燃料电池等。
2. 电化学反应电化学反应可以分为氧化还原反应和非氧化还原反应。
在氧化还原反应中,电荷由氧化物传递给还原物,形成氧化物和还原物之间的电荷转移反应。
在非氧化还原反应中,电荷转移到非氧化还原剂和氧化剂之间,但没有氧化或还原的过程。
3. 电化学方程式电化学方程式是描述电化学反应的方程式,它将反应物和生成物之间的电荷转移过程表示为化学方程式。
在方程式中,电子传递通常用电子符号“e-”表示,离子迁移则用相应的离子符号表示。
4. 电极和电动势电极是电化学反应发生的场所,分为阳极和阴极。
阳极是发生氧化反应的地方,而阴极则是发生还原反应的地方。
电动势是衡量电化学反应自发性的物理量,通过比较不同半反应的电动势可以判断反应的进行方向。
二、常用电化学实验方法1. 极化曲线法极化曲线法是一种常见的电化学实验方法,用于研究电化学界面上的电荷转移和反应过程。
它通过改变外加电势的大小,并测量电流的变化,绘制电流对电势的曲线图,从而得到电化学反应的特征。
2. 循环伏安法循环伏安法是研究电化学反应动力学过程的重要实验方法。
它通过不断改变电势,使电化学反应在阳极和阴极之间来回进行,然后测量反应的电流响应,从而得到电化学反应的动力学参数。
3. 旋转圆盘电极法旋转圆盘电极法是一种用于研究电化学反应速率的实验方法。
它通过将电极固定在旋转的圆盘上,使电解液与电极之间产生强制对流,从而提高反应速率,并测量反应的电流响应,得到反应速率的信息。
物理化学:第08章_电解质溶液
anion anode
返回
2020/11/12
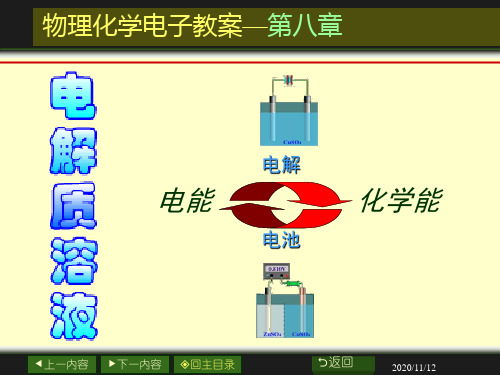
1.电解质溶液的导电机理
在电解池中
阳极上发生氧化作用
-
- 电源 +
e-
+
e-
2Cl aq Cl2(g) 2e
阴
阳
阴极上发生还原作用
极
极
CuCl2
Cu2 aq 2e Cu(s)
电解池
上一内容 下一内容
回主目录
例题
解: 1 Au3+ e = 1 Au
3
3
OH
1 4
O2
1 2
H2O e
(1) Q zF 196500197.01.g20mgol-1 /3 Cmol1
= 1763 C
(2)
t
Q I
1763 C 0.025 A
7.05104
s
(3)
m(O2)
1 4
M
(O2)
=197.01g.20mgol1
返回
2020/11/12
1.电解质溶液的导电机理
在原电池中
阳离子移向阴极
负
负载电阻
正
极
e-
Zn
极
Cu e-
e-
阳 Zn2+ Cu2+ 阴
极 SO24-
SO24- 极
ZnSO4溶液 CuSO4溶液
在阴极上发生还原的是
Cu2 aq 2e Cu(s)
阴离子迁向阳极 在阳极上发生氧化的是
Danill电池
上一内容 下一内容 回主目录
返回
2020/11/12
2. 法拉第定律
人们把在数值上等于1 mol元电荷的电荷量称 为Faraday常数,用F表示。
08年电化学高考试题解析(四)

10.如题图所示,将紧紧缠绕不同金属的铁钉放入培养皿中,再加入含有适量酚酞和NaCl 的琼脂热溶液,冷却后形成琼胶(离子在琼胶内可以移动),下列叙述正确的是( )A .a 中铁钉附近呈现红色B .b 中铁钉上发生还原反应C .a 中铜丝上发生氧化反应D .b 中铝条附近有气泡产生11.右图为直流电源电解稀Na 2SO 4水溶液的装置,通电后在石墨电极a 和b 附近分别滴加石蕊溶液,下列实验现象正确的是( )A .逸出气体的体积:a 电极的小于b 电极的B .电极逸出无味气体,另一电极逸出刺激性气味气体C .a 电极附近呈红色,b 电极附近呈蓝色D .a 电极附近呈蓝色,b 电极附近呈红色12.电池是人类生产和生活中的重要能量来源,各式各样电池的发展是化学对人类的一项重大贡献。
下列有关电池的叙述正确的是( )A .锌锰干电池工作一段时间后碳棒变细B .氢氧燃料电池可将热能直接转变为电能C .氢氧燃料电池工作时氢气在负极被氧化D .太阳能电池的主要材料是高纯度的二氧化硅13.下列叙述正确的是( )A .在原电池的负极和电解池的阴极上都是发生失电子的氧化反应B .用惰性电极电解Na 2SO 4溶液,阴阳两极产物的物质的量之比为1:2C .用惰性电极电解饱和NaCl 溶液,若有1 mol 电子转移,则生成1 molNaOHD .镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀14.据报道,我国拥有完全自主产权的氢氧燃料电池车将在奥运会期间为运动员提供服务。
某种氢氧燃料电池的电解液为KOH 溶液。
下列有关电池的叙述不正确的是( )A .正极反应式为:O 2+2H 2O +4e - ===4OH -B .工作一段时间后,电解液中的KOH 的物质的量不变C .该燃料电池的总反应方程式为:2H 2+O 2===2H 2OD .用该电池电解CuCl 2溶液,产生2.24LCl 2(标准状况)时,有0.1mol 电子转移15.(08海南卷)如何防止铁的锈蚀是工业上研究的重点内容。
(完整版)08电化学基础与氧化还原平衡习题解答

10. 已知下列反应的原电池电动势为0.46V,且Zn2+/Zn 的Eθ=-0.76V,则氢电极溶液中的pH为( D ) Zn(s)+2H+(x mol·L–1)Zn2+(1 mol·L–1)+H2(101.3kPa) (A)10.2 (B)2.5 (C)3 (D)5.1
11.下列氧化还原电对中,Eθ值最大的是(D)
……( D )
(A) O2(g)+4H+(aq)+4e =2H2O(l) (B) Fe3+(aq)+e-=Fe2+(aq)
(C)Fe(s)+2Fe3+(aq)= Fe2+(aq)
(D) 2 Fe3+(aq)+3e = Fe(s)
15.使下列电极反应中有关离子浓度减小一半,
而E值增加的是
(B)
(A)Cu2+ +2e = Cu
电化学基础 与氧化还原平衡
习题解答
一、选择题
1.根据反应式: 2MnO4-+10Fe2+ +16H+=2Mn 2+ +10Fe3+ +8H2O 设计成原电池,其原电池的表示式是…… ( C ) (A) Fe | Fe2+ ,Fe3+ || Mn2+ ,MnO4-, H+ | Mn (B) Pt | MnO4-,Mn2+ ,H+ || Fe2+ ,Fe3+| Pt (C) Pt | Fe2+ ,Fe3+ || Mn2+ ,MnO4-,H+ | Pt (D) Mn | MnO4-,Mn2+ ,H+ || Fe2+,Fe3+ | Mn
电化学的原理

电化学的原理
首先,电解是指利用外加电压使电解质溶液或熔融的电解质发生分解的过程。
在电解过程中,正极吸引阴离子,负极吸引阳离子,使得电解质分解成相应的阴阳离子。
电解的原理可以用法拉第电解定律来描述,即电解质的分解与通过电解质的电荷量成正比。
电解在工业生产中有着广泛的应用,例如电镀、电解制氢、电解制氧等。
其次,电化学反应是指在电化学条件下,化学反应与电流直接相关的反应。
在电化学反应中,电子转移是不可或缺的,它使得化学反应在电化学条件下发生。
电化学反应的原理可以通过纳尔斯特方程来描述,即电化学反应速率与电极上的电势差成正比。
电化学反应在电池、电解池、电化学传感器等领域有着重要的应用。
总的来说,电化学的原理是电与化学之间相互转化的基本规律。
通过对电解和电化学反应的研究,可以更深入地理解电化学的本质,为电化学在能源、环境、材料等方面的应用提供理论基础。
希望本文能够帮助读者更好地理解电化学的原理,促进电化学领域的发展和应用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
可逆电极
第一类电极( 第一类电极(the first-class electrode) ) 金属浸入含有该金属离子的溶液中所形成的电极。 金属浸入含有该金属离子的溶液中所形成的电极。
以铜电极为例, 以铜电极为例,做负极时电极可表示为 电极符号: 电极符号:
Cu ( s ) Cu 2+ ( a )
电极反应: 电极反应:
Pt ( s ), H 2 ( p ) H + ( a )
2 H + + 2e → H 2
可逆电极
第二类电极( 第二类电极(the second-class electrode) )
金属表面覆盖一层该金属的难溶盐, 金属表面覆盖一层该金属的难溶盐,然后再浸 入含有该盐的相同阴离子溶液中组成的电极。 入含有该盐的相同阴离子溶液中组成的电极。
8.2.3 电导测定的应用
1. 检验水的纯度和海水中的含盐量 电导率是一个与离子浓度呈线性关系的物理量, 利用电导率仪测定或监测系统的电导率,就可以知 道系统的离子浓度随时间的变化情况。 在海洋考察中利用电导率仪快速测定海水的电 导率,电导率愈大,说明海水中总的含盐量愈高 根据含盐量的大小,可提供给开发盐场(希望 含盐量高)和选择埋设海底电缆(希望含盐量低, 减少腐蚀)的工程作参考
金属的防腐
2. 牺牲性阳极保护法 将被保护的金属如铁作阴极,较活泼的金属如 Zn作牺牲性阳极。 海洋中的铁制船体常常用镶嵌Zn块的方法保 护船体,Zn作牺牲性阳极,被腐蚀后定期更换。 3. 阴极电保护法 外加电源组成一个电解池,将被保护金属作 阴极,废金属作阳极。 这种方法常用来保护管道和闸门等。
电极电势和电池的电动势
Pt | H2(g,100kPa) | H+(aH+=1 )
Θ 规定: 规定: E H
+
/ H2 ( g )
=0
氢电极
电极电势和电池的电动势
测其它电极的相对电势 方法: 方法:标准氢电极做负极 待测电极做 待测电极做正极 E电池 = E+– E- = E+– Eθ H _
+
第8章
电化学
Pt
Zn
盐桥
Cu
KCl 溶 液
ZnSO 4 (aq)
CuSO 4 (aq)
Hg2Cl2
Hg
第8章 电化学
8.1 电化学的基本概念 8.2 电导及其应用 8.3 强电解质溶液理论简介 8.4 8.5 8.6 8.7 8.8 可逆电池和可逆电极 可逆电池热力学 电极电势和电池的电动势 电动势测定的应用 极化作用和电极反应
可逆电池的书写方法
将化学反应设计成电池 Zn(s) + H 2SO 4 (aq ) → H 2 ( pH ) + ZnSO 4 (aq )
2
( −)
(+)
Zn(s) Zn 2+ (aZn 2+ ) + 2e − →
2H + (aH+ ) + 2e − H 2 ( pH2 ) →
Zn(s) | ZnSO 4 (aq)‖H 2SO 4 (aq) | H 2 (pH 2 ) | Pt
/ H2 ( g )
= E+
给定电极总是作为正极,发生还原反应, 给定电极总是作为正极,发生还原反应, 总是作为正极 所以,由此定义的电极电势为还原电极电势 所以,由此定义的电极电势为还原电极电势 还原电势越大, 还原电势越大,越 易 发生还原反应
实 例
θ 测Cu2+/Cu电极的 E Cu 电极的
金属的防腐
4. 钝化保护法 在铁外面包裹一层紧密的氧化物,保护里边 的金属不再被继续腐蚀,使铁处于钝化区。 5. 提高金属本身的抗蚀能力 在金属冶炼过程中,加一定量的其他元素, 如在铁中加Cr、Ni、Mn等元素,炼成不锈钢,达 到防腐的目的。
8.2.3 电导测定的应用
例: 检验水的纯度和海水中的含盐量 去除水中杂质的方法较多,常用的方法有: (1)用不同的离子交换树酯,分别去除阴离子和 阳离子,得去离子水。 (2)用石英器皿,加入 KMnO 4 和 KOH , 去除 CO 2 及有机杂质,二次蒸馏,得“电导水”。 普通的蒸馏水中含有 CO 2 和玻璃器皿溶下的硅 酸钠等,不一定符合电导测定的要求。
可逆电池的书写方法
Zn
Cu
Zn
盐桥
Cu
ZnS O 4 (aq ) 素瓷烧杯
C uS O 4 (aq )
ZnSO 4 (aq)
CuSO 4 (aq)
(1)
(2 )
(1) Zn(s)│ZnSO 4 (aq)│CuSO 4 (aq)│Cu(s) (2) Zn(s)│ZnSO 4 (aq)‖CuSO 4 (aq)│Cu(s)
原电池、电解池
原电池: 原电池: 将化学能转化为电能的装置 电解池: 电解池: 将电能转化为化学能的装置
电化学规定
阳极:失去电子,发生氧化反应的电极 阳极:失去电子,发生氧化反应的电极 氧化反应 阴极:得到电子,发生还原反应的电极 阴极:得到电子,发生还原反应的电极 还原反应 正极:电势高的电极 正极:电势高的电极 负极:电势低的电极 负极:电势低的电极 电解池 阳极 阴极 正极 负极 原电池 阳极 阴极 负极 正极
电导G: 电导 :电阻 R 的倒数 单位: S(西门子 单位: 西门子 西门子) 1 1 A A G= = =κ R ρ l l 电导率,单位: 电导率,单位:S·m-1电导和电导率电Fra bibliotekG = κ A l
长度 = l
面积=A
单位立方体
电导率κ
(a ) 电导率的定义
8.2.3 电导测定的应用
1. 检验水的纯度和海水中的含盐量 纯水本身有微弱的解离
Cu 2 + + 2e → Cu
可逆电极
汞齐电极( 汞齐电极(amalgam electrode) )
2+ 电极符号: 电极符号: Zn( Hg ) Zn (a )
电极反应: 电极反应: Zn 2+ + 2e + Hg → Zn ( Hg ) 气体电极( 气体电极(gas electrode) ) 电极符号: 电极符号: 电极反应: 电极反应:
为什么稀盐酸溶液能够导电呢? 为什么稀盐酸溶液能够导电呢? 为什么稀盐酸溶液能够导电呢? 为什么稀盐酸溶液能够导电呢?
电导和电导率
描述导体导电能力大小的物理量 描述导体导电能力大小的物理量 导电能力
l 电阻: 电阻:R = ρ A
单位: 欧姆 欧姆) 单位:Ω(欧姆 电阻率,单位: 电阻率,单位:Ω·m
⒉电池
导体
电子导体 自由电子的定向运动 自由电子的定向运动 定向 如:金属、石墨 金属、 特点: 特点: 离子导体 特点: 特点: T↑,导电能力 ↓ ↑ (∵T↑,质点热运动加剧,阻碍电子运动 ∵ ↑ 质点热运动加剧,阻碍电子运动) 离子的定向运动 离子的定向运动 定向 (包括电解质溶液和熔融电解质 包括电解质溶液和熔融电解质) 包括电解质溶液和熔融电解质 (1) T↑,导电能力 ↑ ↑ (∵T↑,溶液粘度减小,有利于离子运动 ∵ ↑ 溶液粘度减小,有利于离子运动) (2) 有化学反应
不可逆电池( 不可逆电池(Irreversible cell) )
凡是不能满足可逆电池条件的电池通称为不可逆电池。 凡是不能满足可逆电池条件的电池通称为不可逆电池。 放电时∶ 放电时∶ Zn + CuSO 4 =Cu + ZnSO 4 充电时: 充电时: Cu
+ Cu 2+ =Cu 2+ + Cu
[H + ] = [OH − ] = 10−7 mol ⋅ dm −3
∞ Λm (H 2O) = 5.5 ×10−2 S ⋅ m 2 ⋅ mol−1
H 2 O ⇌ H + + OH −
这样,纯水的电导率应为
5.5 ×10−6 S ⋅ m −1
事实上,水的电导率小于1 × 10−4 S ⋅ m −1 就认为是 很纯的了,有时称为“电导水”,若大于这个数值, 那肯定含有某种杂质。
8.9 金属的腐蚀与防腐 8.10 化学电源
8.1.1 原电池和电解池
电化学在国民经济中占有重要地位 ⒈电解 精炼和冶炼有色金属和稀有金属 电解法制备化工原料 电镀法保护和美化金属 金属氧化着色等 汽车、宇宙飞船、照明、通讯 计算机、人造器官、清洁能源 ⒊ 金属的防腐,材料保护,光电化学 ⒋ 生物电化学,电化学分析
金属的电化学腐蚀与防腐
金属腐蚀主要分两类: (1)化学腐蚀 金属表面与介质如气体或非电解质液体等发 生化学作用称为化学腐蚀,这时无电流产生。 (2)电化学腐蚀 金属与介质如潮湿空气或电解质溶液等,因形成微 电池,金属作为阳极发生氧化而使金属发生腐蚀。
金属的电化学腐蚀与防腐
腐蚀机制: 腐蚀机制: 铁在酸性介质中只能氧化成二价铁: 铁在酸性介质中只能氧化成二价铁: 二价铁被空气 中的氧气氧化成三价铁, 中的氧气氧化成三价铁, 三价铁在水溶液中生成氢 氧化铁沉淀, 氧化铁沉淀,又可能部分失水生成 Fe2 O3 。
2+
/ Cu
动画 动画
θ 测Zn+/Zn电极的 E Zn 电极的
+
/ Zn
常见电极的标准电极电势见表8.4(P323) 常见电极的标准电极电势见表 ( 表中电极电势越小( ),该电极越容易发生氧化 表中电极电势越小(负),该电极越容易发生氧化 越小 该电极越容易发生 反应,可用作还原 还原剂 反应,可用作还原剂。 表中电极电势越大( ),该电极越容易发生还原 表中电极电势越大(正),该电极越容易发生还原 越大 该电极越容易发生 反应,可用作氧化 氧化剂 反应,可用作氧化剂。
金属的防腐
1. 用保护层防腐 (1)非金属保护层 在金属表面涂上油漆、搪瓷、陶瓷、玻璃、塑料 和沥青等,将金属与腐蚀介质隔开。 (2)金属保护层 在需保护金属的表面用电镀或化学镀方法镀上Au, Ag,Ni,Cr,Zn,Sn等金属,保护内层不被腐蚀。 镀锌铁(白铁)和镀锡铁(马口铁)在镀层完好时, 有同样的保护功能。
