初三化学溶解度专题复习题(含答案)汇总
中考化学溶液 溶解度20篇(附带答案解析)经典
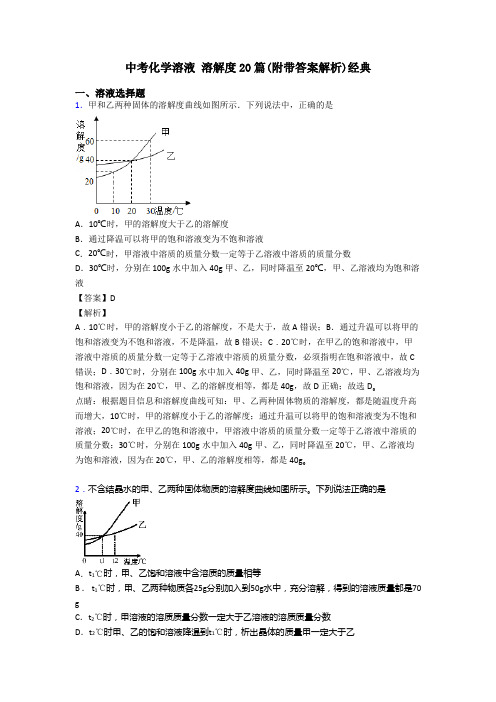
中考化学溶液溶解度20篇(附带答案解析)经典一、溶液选择题1.甲和乙两种固体的溶解度曲线如图所示.下列说法中,正确的是A.10℃时,甲的溶解度大于乙的溶解度B.通过降温可以将甲的饱和溶液变为不饱和溶液C.20℃时,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数D.30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液【答案】D【解析】A.10℃时,甲的溶解度小于乙的溶解度,不是大于,故A错误;B.通过升温可以将甲的饱和溶液变为不饱和溶液,不是降温,故B错误;C.20℃时,在甲乙的饱和溶液中,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数,必须指明在饱和溶液中,故C 错误;D.30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液,因为在20℃,甲、乙的溶解度相等,都是40g,故D正确;故选D。
点睛:根据题目信息和溶解度曲线可知:甲、乙两种固体物质的溶解度,都是随温度升高而增大,10℃时,甲的溶解度小于乙的溶解度;通过升温可以将甲的饱和溶液变为不饱和溶液;20℃时,在甲乙的饱和溶液中,甲溶液中溶质的质量分数一定等于乙溶液中溶质的质量分数;30℃时,分别在100g水中加入40g甲、乙,同时降温至20℃,甲、乙溶液均为饱和溶液,因为在20℃,甲、乙的溶解度相等,都是40g。
2.不含结晶水的甲、乙两种固体物质的溶解度曲线如图所示。
下列说法正确的是A.t1℃时,甲、乙饱和溶液中含溶质的质量相等B.t1℃时,甲、乙两种物质各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70 gC.t2℃时,甲溶液的溶质质量分数一定大于乙溶液的溶质质量分数D.t2℃时甲、乙的饱和溶液降温到t1℃时,析出晶体的质量甲一定大于乙【答案】B【解析】A、t1℃时,甲、乙溶解度相等,所以等质量的饱和溶液中含溶质的质量相等,故A错误;B、t1℃时,甲、乙两种物质的溶解度是40g,所以各25g分别加入到50g水中,充分溶解,得到的溶液质量都是70g,故B正确;C、t2℃时,溶液的饱和状态不确定,所以甲溶液的溶质质量分数不一定大于乙溶液的溶质质量分数,故C错误;D、t2℃时甲、乙的饱和溶液的质量不确定,所以降温到t1℃时,析出晶体的质量甲不一定大于乙,故D错误。
初三化学溶解度知识点-+典型题含答案

初三化学溶解度知识点-+典型题含答案一、选择题1.根据如图物质的溶解度曲线,判断下列说法正确的是A.将乙的饱和溶液过滤,能得到不饱和溶液B.t1℃时,甲溶液、乙溶液的溶质质量相等C.t2℃185g甲溶液降温至t1℃时,能析出49g晶体D.将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变答案:D【解析】A、将饱和溶液变为不饱和溶液最可靠的方法是加溶剂或者是改变温度。
将乙的饱和溶液过滤,不能得到不饱和溶液,说法错误;B、由图可知t1℃时,甲、乙溶解度相等。
t1℃时,甲溶液、乙溶液是否饱解析:D【解析】A、将饱和溶液变为不饱和溶液最可靠的方法是加溶剂或者是改变温度。
将乙的饱和溶液过滤,不能得到不饱和溶液,说法错误;B、由图可知t1℃时,甲、乙溶解度相等。
t1℃时,甲溶液、乙溶液是否饱和不清楚,溶质质量是否相等无法判断,说法错误;C、t2℃185g甲溶液是否饱和不清楚,故将t2℃185g甲溶液降温至t1℃时,能析出49g晶体,说法错误;D、t1℃时,甲物质的溶解度是36g,饱和溶液溶质质量分数=36 36100gg g×100%=26.5%,所以将26%的甲溶液从t2℃降温到t1℃时,溶质质量分数不变,正确;故选:D。
点睛:根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的。
2.下图是A、B、C三种物质的溶解度曲线,下列说法错误的是( )A.将t2℃时A、B、C的饱和溶液同时降温至t1℃后,所得溶液中溶质的质量分数由大到小的顺序是C>B>AB.当A中含有少量B时,可以通过降温结晶的方法提纯AC.升高温度可使接近饱和的C溶液变为饱和D.t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A答案:A【解析】A、由溶解度曲线可知,AB两种物质的溶解度随温度的升高而升高,C物质的溶解度随温度的升高和降低,将t2℃时A、B、C的饱和溶液同时降温至t1℃后AB两种物质仍然为饱和溶液,C为不饱和溶解析:A【解析】A、由溶解度曲线可知,AB两种物质的溶解度随温度的升高而升高,C物质的溶解度随温度的升高和降低,将t2℃时A、B、C的饱和溶液同时降温至t1℃后AB两种物质仍然为饱和溶液,C为不饱和溶液,C溶液中溶质的质量分数不变,t1℃时B的溶解度大于A的溶解度,故B 的质量分数大于A 的质量分数,C 的质量分数小于B的质量分数,故错误;B、A的溶解度随温度的变化较大,B 的溶解度随温度的变化不大,故当A中含有少量B 时,可以通过降温结晶的方法提纯A,正确;C、由图可知,C物质的溶解度随温度的升高而降低,故升高温度可使接近饱和的C溶液变为饱和,正确;D、由图可知,t1℃时,A、B、C三种物质的溶解度由大到小的顺序是C>B>A,正确。
中考化学化学溶解度综合经典题附答案解析

中考化学化学溶解度综合经典题附答案解析一、初中化学溶解度1.下图为甲、乙、丙三种固体物质在水中的溶解度曲线,下列说法正确的是A.50℃时,分别将等质量的甲和乙溶于适量的水恰好配成饱和溶液,所得溶液的质量前者比后者大B.若甲中混有少量的乙,最好采用蒸发结晶的方法提纯甲C.将50℃甲、乙、丙三种物质的饱和溶液降温到10℃,析出晶体最多的是甲D.向100g 50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出,可能是因为甲物质溶于水显著放热【答案】D【解析】A、50℃时,甲的溶解度大于乙的溶解度,分别将等质量的甲和乙溶于适量的水恰好配成饱和溶液,所需要的水甲比乙少,所得溶液的质量前者比后者小,错误;B、甲的溶解度随温度升高变化明显,当甲溶液中混有少量的乙时,可采用降温结晶提纯甲,错误;C、50℃,甲、乙、丙三种物质的饱和溶液降温到10℃时,不知三种溶液质量大小,故无法判断析出晶体质量多少,错误;D、向100g50℃的水中加入65g甲固体,发现全部溶解,一段时间后又有部分甲的晶体析出,由于甲的溶解度随温度升高而增大,先溶解则说明温度升高了,后析出则说明温度降低了,甲溶于水会放出显著热量,正确。
故选D。
2.室温下,饱和食盐水露置在干燥的空气中,过一段时间后有少量固体析出,这是因为()A.氯化钠的溶解度减小了B.溶液中溶质的质量分数减小了C.溶剂质量减小了D.溶液变成不饱和溶液了【答案】C【解析】A、温度不变溶质的溶解度不变,错误;B、析出溶质后溶液仍为这一温度下的饱和溶液,溶质质量分数不变,错误;C、饱和食盐水露置在干燥的空气中,水分会不断蒸发减小,正确;D、析出溶质的溶液所剩溶液一定饱和,错误。
故选C。
点睛:在本题中蒸发溶剂,溶质会析出,始终保持室温时的饱和溶液。
3.下列有关溶解度的说法错误的是()A.20℃时,甲和乙的溶解度相等B.40℃时,若将40g乙放入160g水中充分溶解,所得溶液的溶质质量分数为20% C.40℃时,将甲、乙两物质的饱和溶液各100g,降温至20℃,析出晶体(均不含结晶水)的质量关系是:m(甲)=m(乙)D.20℃时,将甲物质的饱和溶液升温到40℃,溶液变为不饱和溶液【答案】C【解析】【详解】A、通过分析溶解度曲线可知,20℃时,甲和乙的溶解度相等,故A正确,不符合题意;B、40℃时,乙物质的溶解度是40g,所以若将40g乙放入160g水中充分溶解将完全溶解,故所得溶液的溶质质量分数为40g200g100%=20%,故B正确,不符合题意;C、40℃时,甲物质的溶解度大于乙物质的溶解度,将甲、乙两物质的饱和溶液各100g,降温至20℃,甲、乙物质的溶解度相等,所以析出晶体(均不含结晶水)的质量关系是:m(甲)>m(乙),故C错误,符合题意;D、20℃时,将甲物质的饱和溶液升温到40℃,溶解度增大,所以溶液变为不饱和溶液,故D正确,不符合题意。
初三化学溶解度专题复习题(含答案)资料讲解

溶解度专题复习一、溶液的形成1溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性注意:a、溶液不一定无色,如CuS04溶液为蓝色FeSO t溶液为浅绿色Fe2(SO4)3溶液为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量=溶质的质量+溶剂的质量溶液的体积< 溶质的体积+溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒一一碘的酒精溶液)、溶解度1、固体的溶解度(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克(2)溶解度的含义:20 C时NaCI的溶液度为36g含义:在20C时,在100克水中最多能溶解36克NaCI或在20C时,NaCI在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素: ①溶质、溶剂的性质(种类)大多数固体物的溶解度随温度升高而升高; 少数固体物质的溶解度受温度的影响很小; 极少数物质溶解度随温度升高而降低。
如②温度如如KNO3NaClCa(OH)22、溶质和溶剂的判断(1)固体、气体溶于液体时,固体、气体是溶剂;(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3、饱和溶液、不饱和溶液例:B(7)(1)(2)(3)物质,t3C时A的溶解度为80g P点的的含义在该温度时,N 点为t?C时A的不饱和溶液,可通过力口入A降温,蒸发溶剂的方法使它变为饱和A和C的溶解度相同(4)t1C时A、B、C、溶解度由大到小的顺序C>B>A(5)从A溶液中获取A晶体可用降温结晶的方法获取晶体。
适宜采用蒸发结晶的方法获取晶体(1)概念:饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
初三化学溶解度专题复习题(含答案)汇总

溶解度专题复习一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性注意:a、溶液不一定无色,如CuSO4溶液为蓝色FeSO4溶液为浅绿色Fe2(SO4)3溶液为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量= 溶质的质量+ 溶剂的质量溶液的体积<溶质的体积+ 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)2、溶质和溶剂的判断(1)固体、气体溶于液体时,固体、气体是溶剂;(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3、饱和溶液、不饱和溶液(1)概念:饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)判断方法:要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶液。
(3注:①Ca(OH)2②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl 二、溶解度1、固体的溶解度(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
最新 中考化学溶液 溶解度20篇(附带答案解析)经典
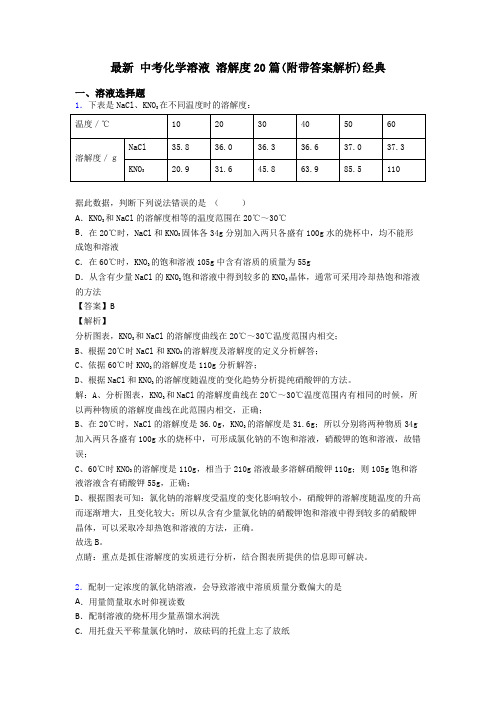
最新中考化学溶液溶解度20篇(附带答案解析)经典一、溶液选择题1.下表是NaCl、KNO3在不同温度时的溶解度:据此数据,判断下列说法错误的是()A.KNO3和NaCl的溶解度相等的温度范围在20℃~30℃B.在20℃时,NaCl和KNO3固体各34g分别加入两只各盛有100g水的烧杯中,均不能形成饱和溶液C.在60℃时,KNO3的饱和溶液105g中含有溶质的质量为55gD.从含有少量NaCl的KN03饱和溶液中得到较多的KNO3晶体,通常可采用冷却热饱和溶液的方法【答案】B【解析】分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内相交;B、根据20℃时NaCl和KNO3的溶解度及溶解度的定义分析解答;C、依据60℃时KNO3的溶解度是110g分析解答;D、根据NaCl和KNO3的溶解度随温度的变化趋势分析提纯硝酸钾的方法。
解:A、分析图表,KNO3和NaCl的溶解度曲线在20℃~30℃温度范围内有相同的时候,所以两种物质的溶解度曲线在此范围内相交,正确;B、在20℃时,NaCl的溶解度是36.0g,KNO3的溶解度是31.6g;所以分别将两种物质34g 加入两只各盛有100g水的烧杯中,可形成氯化钠的不饱和溶液,硝酸钾的饱和溶液,故错误;C、60℃时KNO3的溶解度是110g,相当于210g溶液最多溶解硝酸钾110g;则105g饱和溶液溶液含有硝酸钾55g,正确;D、根据图表可知:氯化钠的溶解度受温度的变化影响较小,硝酸钾的溶解度随温度的升高而逐渐增大,且变化较大;所以从含有少量氯化钠的硝酸钾饱和溶液中得到较多的硝酸钾晶体,可以采取冷却热饱和溶液的方法,正确。
故选B。
点睛:重点是抓住溶解度的实质进行分析,结合图表所提供的信息即可解决。
2.配制一定浓度的氯化钠溶液,会导致溶液中溶质质量分数偏大的是A.用量筒量取水时仰视读数B.配制溶液的烧杯用少量蒸馏水润洗C.用托盘天平称量氯化钠时,放砝码的托盘上忘了放纸D.将水倒入烧杯时,有少量水溅出【答案】D【解析】A. 用量筒量取水时仰视读数,量取实际水的体积偏大,故溶液中溶质的质量分数偏小,错误;B. 配制溶液的烧杯用少量蒸馏水润洗相当于溶剂水的体积偏大,故溶液中溶质的质量分数偏小,错误;C. 用托盘天平称量氯化钠时,放砝码的托盘上忘了放纸相当于称量氯化钠的质量偏小,故配得的溶液中溶质的质量分数偏小,错误;D. 将水倒入烧杯时,有少量水溅出,相当于溶液中水的体积偏小,故溶液中溶质的质量分数偏大,正确。
初三化学溶解度专题复习题(含答案)

初三化学溶解度专题复习题(含标准答案)(word 版可编辑修改)1/ 14初三化学溶解度专题复习题(含标准答案)(word 版可编辑修改)编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(初三化学溶解度专题复习题(含标准答案)(word 版可编辑修改))的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快 业绩进步,以下为初三化学溶解度专题复习题(含标准答案)(word 版可编辑修改)的全部内容。
溶解度专题复习一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性注意:a、溶液不一定无色,如CuSO4溶液为蓝色 FeSO4溶液为浅绿色 Fe2(SO4)3溶液为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量 = 溶质的质量 + 溶剂的质量溶液的体积〈溶质的体积 + 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒-—碘的酒精溶液)2、溶质和溶剂的判断(1)固体、气体溶于液体时,固体、气体是溶剂;(2)两种液体相溶时,量多的是溶剂,量少的是溶质.(3)溶液中若有水存在,无论水的量多还是(4)在不指明溶剂时,溶剂一般是水.3、饱和溶液、不饱和溶液(1)概念: 饱和溶液:在一定温度下、一定量的溶叫做这种溶质的饱和溶液不饱和溶液:在一定温度下、一定量的溶液,叫做这种溶质的不饱(2)判断方法:要确定某一溶液是否饱和,只要看余溶质存在,如有,且溶质的质量不再减少,不饱和溶液.(3注:①Ca(OH)2②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液2 / 14②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl二、溶解度1、固体的溶解度(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克(2)溶解度的含义: 20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解极少数物质溶解度随例:(4)溶解度曲线(1)t3℃时A的(2)P点的的含(3)N点为 t3物质,降温,蒸发溶剂的方法使它变为饱和)t1℃时A、(5)从A溶液中(6)从B的溶液中获取晶体,适宜采用蒸发(7)t2℃时A、B、C的饱和溶液各W克,降温到析出的有 C(8)除去A中的泥沙用过滤法;分离A与B(含2、气体的溶解度3 / 144 / 14(1)气体溶解度的定义:在压强为101kPa 和一定温度时,气体溶解在1体积水里达到饱和状态时的气体体积.(2)影响因素: ①气体的性质 ②温度(温度越高,气体溶解度越小)③压强(压强越大,气体溶解度越大)3、混合物的分离(1)过滤法:分离可溶物 + 难溶物(2)结晶法:分离几种可溶性物质结晶的两种方法蒸发溶剂,如NaCl(海水晒盐)降低温度(冷却热的饱和溶液,如KNO 3)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液由不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
初三化学溶解度专题复习题(含答案)汇总

溶解度专题复习一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性注意:a、溶液不一定无色,如CuSO4溶液为蓝色FeSO4溶液为浅绿色Fe2(SO4)3溶液为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量= 溶质的质量+ 溶剂的质量溶液的体积<溶质的体积+ 溶剂的体积d、溶液的名称:溶质的溶剂溶液(如:碘酒——碘的酒精溶液)2、溶质和溶剂的判断(1)固体、气体溶于液体时,固体、气体是溶剂;(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3、饱和溶液、不饱和溶液(1)概念:饱和溶液:在一定温度下、一定量的溶剂里,不能溶解某种溶质的溶液,叫做这种溶质的饱和溶液。
不饱和溶液:在一定温度下、一定量的溶剂里,还能继续溶解某种溶质的溶液,叫做这种溶质的不饱和溶液。
(2)判断方法:要确定某一溶液是否饱和,只要看在一定温度下有没有不能继续溶解的剩余溶质存在,如有,且溶质的质量不再减少,则为该溶质的饱和溶液;否则为该溶质不饱和溶液。
(3注:①Ca(OH)2②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl 二、溶解度1、固体的溶解度(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克(2)溶解度的含义:20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度大多数固体物的溶解度随温度升高而升高;如KNO3少数固体物质的溶解度受温度的影响很小;如NaCl极少数物质溶解度随温度升高而降低。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
溶解度专题复习一、溶液的形成1、溶液(1)溶液的概念:一种或几种物质分散到另一种物质里形成的均一的、稳定的混合物,叫做溶液(2)溶液的基本特征:均一性、稳定性注意:a、溶液不一定无色,如CuSO4溶液为蓝色 FeSO4溶液为浅绿色 Fe2(SO4)3溶液为黄色b、溶质可以是固体、液体或气体;水是最常用的溶剂c、溶液的质量 = 溶质的质量 + 溶剂的质量溶液的体积 <溶质的体积 + 溶剂的体积d2、溶质和溶剂的判断(1)固体、气体溶于液体时,固体、气体是溶剂;(2)两种液体相溶时,量多的是溶剂,量少的是溶质。
(3)溶液中若有水存在,无论水的量多还是量少,水都是溶剂。
(4)在不指明溶剂时,溶剂一般是水。
3、饱和溶液、不饱和溶液(1)概念:叫做这种溶质的饱和溶液。
溶液,叫做这种溶质的不饱和溶液。
(2不饱和溶液。
(3注:①Ca(OH)2②最可靠的方法是:加溶质、蒸发溶剂(4)浓、稀溶液与饱和不饱和溶液之间的关系①饱和溶液不一定是浓溶液②不饱和溶液不一定是稀溶液,如饱和的石灰水溶液就是稀溶液③在一定温度时,同一种溶质的饱和溶液要比它的不饱和溶液浓(5)溶解时放热、吸热现象溶解吸热:如NH4NO3溶解溶解放热:如NaOH溶解、浓H2SO4溶解溶解没有明显热现象:如NaCl二、溶解度1、固体的溶解度(1)溶解度的定义:在一定温度下,某固态物质在100g溶剂里达到饱和状态时所溶解的质量四要素:①条件:一定温度②标准:100g溶剂③状态:达到饱和④质量:溶解度的单位:克(2)溶解度的含义: 20℃时NaCl的溶液度为36g含义:在20℃时,在100克水中最多能溶解36克NaCl或在20℃时,NaCl在100克水中达到饱和状态时所溶解的质量为36克(3)影响固体溶解度的因素:①溶质、溶剂的性质(种类)②温度体积水里达到饱和状态时的气体体(2)结晶法:分离几种可溶性物质结晶的两种方法蒸发溶剂,如NaCl(海水晒盐)降低温度(冷却热的饱和溶液,如KNO3)蒸发结晶(蒸发溶剂法):将固体溶质的溶液加热(或日晒,或在风力的作用下)使溶剂蒸发,使溶液由不饱和溶液转化为饱和溶液,再继续蒸发溶剂,使溶质从溶液中析出。
适用范围:溶解度受温度变化影响不大的物质,如氯化钠。
降温结晶(冷却热饱和溶液法):冷却热的饱和溶液,使溶质从溶液中结晶析出。
适用范围:溶解度受温度变化影响较大的物质,如氯酸钾。
1、下列关于溶液的说法:①溶质只能是固体;②溶剂一定是水;③一种溶液中只含有一种溶质;④溶液是无色的纯净物。
其中错误的是( )A.①③④B.①②③C.②③④D.①②③④2、下列物质中属于溶液的是()A.石灰水 B.液氧C.牛奶 D.冰水3、下列清洗方法中,利用乳化作用的是( )(A)用自来水洗手(B)用汽油清洗油污 (C)用洗涤剂清洗油腻的餐具(D)用盐酸清除铁锈4、小琪往右图所示的烧杯中加入一种物质,搅拌后,发现塑料片的水结了冰。
她加入的物质是()A.食盐B.硝酸铵 C.生石灰D.氢氧化钠固体5、如右图所示,向小试管里分别加入一定量的下列物质,右侧U型管中的液面未发生明显变化,该物质是()A、浓硫酸B、食盐C、生石灰D、烧碱6、使不饱和溶液变为饱和溶液,下列方法中最可靠的是()A.升高温度B.加入溶质C.降低温度D.倒掉一部分溶液7、下列方法中,能够使硝酸钾在水中的溶解度增大的是( )A. 增加水的质量B. 在水中增加硝酸钾的质量C. 升高水的温度D. 降低水的温度8、据文字记载,我们的祖先在神农氏时代就开始利用海水晒盐。
海水晒盐的原理是( )A. 日晒风吹使海水中的氯化钠蒸发B. 日晒风吹使溶液由饱和变为不饱和C. 日晒风吹使氯化钠的溶解度变小D. 日晒风吹使水分蒸发晶体析出9.在20℃时,A物质的不饱和溶液,浓度为10%,如再加入5gA或蒸发掉32.26g水,都可成为饱和溶液,则20℃时,A的溶解度为()A 13.4gB 15.5gC 16.7g D无法计算10.现有40℃时KNO3的饱和溶液82.0g,当温度下降至10℃时,溶液质量为60.5g,此时需加水102.4g才能把析出的晶体全部溶解,则40℃时KNO3的溶解度是( )A 32gB 64gC 40.5gD 21.5g11.将60℃的硫酸铜饱和溶液100克,冷却到20℃,下列说法正确的是( )A 溶液质量不变B 溶剂质量发生变化C 溶液为饱和溶液,浓度不变D 有晶体析出,溶剂质量不变12. 下列接近饱和的溶液升高温度后能达到饱和的是()A. NaCl溶液B. KNO3溶液 C. 2)(OHCa溶液 D. NH4Cl溶液13. 要增大硝酸钾的溶解度,可采用的措施是()A. 增大溶剂量B. 充分振荡C. 降低温度D. 升高温度14、. 在20℃时,食盐的溶解度是36 g,将5 g食盐放入10 g 水中,在20℃时,所得食盐饱和溶液( C )A. 15 gB. 14 gC. 13.6 gD. 12.5 g15、. 20℃时,25g水中溶解0.1g某物质即达到饱和,该物质的溶解性是()A. 难溶B. 易溶C. 可溶D. 微溶16.、 25℃时,80g水中最多能溶解8gM晶体,50℃时,100g水中最多能溶解10 g N晶体,则M和N的溶解度相比()A. M>NB. M<NC. M=ND. 无法比较17. t℃时,在m g水中溶解某物质ng,溶液恰好达到饱和,t℃时该物质的溶解度计算式正确的是()A. nm100B. mn100(g) C.nmn+100D.mn(g)18、 t℃时,M物质的溶解度为S g,则b g M物质在t℃时,可配成的饱和溶液的质量是()A.gSSb)100(+B.(100+S+b)gC.gbbS)100(+D.gSb10019、有A、B、C三种物质,20℃时分别溶解在水中制成饱和溶液。
已知A物质1 g溶解后得到11 g饱和溶液;B物质130 g制成1150 g溶液;C物质25 g溶解在350 g水里,三种物质中溶解度由大到小的顺序是()A. A > B >CB. B>A>CC. B> C > AD. C >B>A20、20℃时,氯酸钾的溶解度为7.4克,其含义是( )A.20℃时,100克水中最多能溶解氯酸钾7.4克B.20℃时,100克氯酸钾饱和溶液中含有氯酸钾7.4克C.把7.4克氯酸钾溶解在100克水中,恰好制成饱和溶液D.7.4克氯酸钾可以溶解在100克水里。
21、.固体物质溶解度曲线上的任意一点表示( )A.一定温度和一定量溶剂里溶解溶质的质量B.相应温度下,100克溶剂里溶解溶质的质量C.相应温度下,100克溶剂里最多能溶解溶质的质量D.溶液达到饱和状态时溶解溶质的质量22.30℃时KClO 3的溶解度为10g ,424g KClO 3溶液中加入10g KClO 3和6g 水恰好达到饱和,原溶液中含溶剂为( )A.200gB.400gC.390.8gD.394g23.在温度不变的情况下,将t ℃的KNO 3溶液100克蒸发掉2.5克水,析出2克晶体,再蒸发 5 克水,又析出5克晶体,则该温度下KNO 3的溶解度是( )A.7.5克B.80克C.90.3克D.100克 24.将某物质溶液蒸发50g 水后,温度降到t ℃,析出8g 该物质晶体(不含结晶水);再蒸发50g 水,仍保持t ℃,又析出10g 晶体,那么原溶液欲达到t ℃时的饱和溶液,至少应( )A.蒸发掉10g 水B.加入2g 该物质C.蒸发掉15g 水D.加入8g 该物质25.t ℃时,Mg 某物质A 的饱和溶液,A 溶解的量一定达到了最大值W ,该物质在t ℃时溶解 度可表示为( )A.N N -100100gB.W M W 100- gC.W M N M +- gD.WM 100g26.某温度下,对于某固体溶质的饱和溶液,下列有关关系式中,不正确的是( )A.溶质质量+溶剂质量=溶液质量B.溶剂质量溶质质量溶解度=g 100 C.溶液质量溶质质量溶解度溶解度=+g 100 D.溶液质量溶质质量溶解度=g 10027.某溶质不含结晶水,将一定质量的该溶质的饱和溶液,从60℃降到20℃时,溶液保持不变 的是( )A.溶液的质量B.溶质的质量C.溶液的浓度D.溶剂的质量28.同一温度下,从100 mL 饱和食盐水中取出10 mL ,下列说法正确的是( ) A .溶液变稀 B .溶液由饱和变为不饱和 C .仍为饱和溶液 D .以上均不对29.生活中的下列现象不能说明气体溶解度随温度升高而减小的是( ) A .打开啤酒瓶盖有大量泡沫逸出 B .烧开水时沸腾前有气泡逸出 C .喝下汽水感到有气味冲到鼻腔 D .夏季黄昏池塘里的鱼常浮出水面30.测定某温度下某物质的溶解度时所用溶液必须是( ) A .浓溶液 B .稀溶液C .饱和溶液D .不饱和溶液31、右图是甲、乙两种固体物质的溶解度曲线。
据此判断下列说法不正确的( ) A.t 2℃时,甲、乙的溶解度相等B. t3℃时,将60g 乙加入100g 水中可得l60g 溶液 C .乙的溶解度受温度影响很小 D .t l ℃时,乙的溶解度大于甲的溶解度32、X 、Y 、Z 三种物质的溶解度曲线如图所示、则下列说法中正确的是( ) A .100g 水中溶解80gX 即可得到X 的饱和溶液 B .溶解:Y>X>ZC .t ℃时,X 、Y 、Z 的饱和溶液中,溶质的质量分数相等D .当X 中含有少量Z 时,可通过降温结晶来提纯X33、下图是M 、N 两种物质的溶解度曲线,在t 2℃时往盛有100g 水的烧杯中先后加入a g M 和a g N (两种物质溶解时互不影响,且溶质仍是M 、N ),充分搅拌。
将混合物的温度降低到t 1℃,下列说法正确的是( )A 、t 2℃时,得到M 的饱和溶液B 、t 2℃时,得到N 的不饱和溶液C 、温度降低到t 1℃时,M 、N 的溶质质量分数相等,得到M 、N 的不饱和溶液D 、温度降低到t 1℃时,M 、N 的溶解度相等,得到M 、N 的饱和溶液34、下图表示M 、N 两种固体物质的溶解度曲线。
下列说法错误的是( ) A .20℃时,M 的溶解度大于N 的溶解度 B .M 、N 都是易溶物质C .P 点表示t ℃时M 、N 的溶解度相等D .阴影处M 为饱和溶液35、可以证明某硝酸钾溶液是20℃时的饱和溶液的事实是( ) A .降温到10℃时,有硝酸钾晶体析出B.蒸发掉10g水,有硝酸钾品体析出C.20℃时,向原溶液中加入少量硝酸钾晶体,溶液中硝酸钾的质量分数不变D.加热到30℃,再加入硝酸钾晶体能继续溶解36、下图是A、B、C三种物质的溶解度曲线,据图回答:(1) t1℃时A、B、C三种物质的溶解度由大到小的顺序是(填写序号,下同)。
