高中化学知识结构图01866
高中化学知识结构网络图

高中化学知识构造网络图化学根本概念和根本理论元素与化合物有机化学根底化学计算化学实验化学工业知识化学根本概念和根本理论物质的分类组成原子的粒子间的关系核电荷数〔Z〕=核内质子数=核外电子数质量数〔A〕=质子数〔Z〕+中子数〔N〕元素周期律与周期表化学键与分子构造晶体类型与性质晶体类型性质比拟离子晶体分子晶体原子晶体金属晶体构造组成粒子阴、阳离子分子原子金属阳离子和自由电子粒子间作用离子键范德华力共价键金属键物理性质熔沸点较高低很高有高有低硬度硬而脆小大有大有小、有延展性溶解性易溶于极性溶剂,难溶于非极性溶剂极性分子易溶于极性溶剂不溶于任何溶剂难溶〔钠等与水反响〕导电性晶体不导电;能溶于水的其水溶液导电;熔化导电晶体不导电,溶于水后能电离的,其水溶液可导电;熔化不导电不良〔半导体Si〕良导体〔导电传热〕典型实例NaCl、NaOHNa2O、CaCO3干冰、白磷冰、硫磺金刚石、SiO2晶体硅、SiCNa、Mg、AlFe、Cu、Zn化学反响类型离子反响氧化复原反响的有关概念的相互关系化学反响中的能量变化化学平衡弱电解质的电离平衡溶液的酸碱性盐类的水解酸碱中和滴定电化学返回页顶元素与化合物钠及其化合物碱金属氯及其化合物卤素氧族元素硫的重要化合物碳及其化合物硅及其化合物材料氮族元素氮和磷氨硝酸镁和铝铁及其化合物铜及其化合物返回页顶有机化学根底烃不饱和链烃芳香烃分类通式构造特点化学性质物理性质同分异构烷烃C n H2n+2(n≥1)①C-C单键②链烃①与卤素取代反响(光照)②燃烧③裂化反响一般随分子中碳原子数的增多,沸点升高,液态时密度增大。
气态碳原子数为1~4。
不溶于水,液态烃密度比水的小碳链异构烯烃C n H2n(n≥2)①含一个C≡C键②链烃①与卤素、H:、H2O等发生加成反响②加聚反响③氧化反响:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构炔烃C n H2n-2(n≥2)①含一个C≡C键②链烃①加成反响②氧化反响:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构苯及其同系物C n H2n-6(n≥6)①含一个苯环②侧链为烷烃基①取代反响:卤代、硝化、磺化②加成反响③氧化反响:燃烧,苯的同系物能被KMnO4酸性溶液氧化简单的同系物常温下为液态;不溶于水,密度比水的小侧链大小及相对位置产生的异构烃的衍生物构造、通式、化学性质鉴别类别官能团构造特点通式化学性质卤代烃-X〔卤素原子〕C-X键在一定条件下断裂C n H2n+1O2〔饱和一元〕(1)NaOH水溶液加热,取代反响(2)NaOH醇溶液加热,消去反响醇-OH〔羟基〕(1)—OH与烃基直接相连(2)—OH上氢原子活泼C n H2n+2O2〔饱和一元〕(1)取代:脱水成醚,醇钠,醇与羧酸成酯,卤化成卤代烃(2)氧化成醛(—CH2OH)(3)消去成烯醛(1)醛基上有碳氧双键(2)醛基只能连在烃基链端C n H2n O2〔饱和一元〕(1)加成:加H2成醇(2)氧化:成羧酸羧(1)—COOH可电离出H+(2)—COOH难加成C n H2n O〔饱和一元〕(1)酸性:具有酸的通性(2)酯化:可看作取代酯,R 必须是烃基C n H2n O2〔饱和一元〕水解成醇和羧酸酚(1)羟基与苯环直接相连(2)—OH上的H比醇活泼(3)苯环上的H比苯活泼(1)易取代:与溴水生成2,4,6-三溴苯酚(2)显酸性(3)显色:遇Fe3+变紫色代表物质转化关系糖类类别葡萄糖蔗糖淀粉纤维素分子式〔C6H12O6〕〔C12H22O11〕〔C6H10O5〕〔C6H10O5〕构造特点多羟基醛分子中无醛基,非复原性糖由几百到几千个葡萄糖单元构成的天然高分子化合物由几千个葡萄糖单元构成的天然高分子化合物主要性质白色晶体,溶于水有甜味。
高中化学知识结构网络图

C2H4
H2 C2H2 CO2 NO2 H2S
Zn+H2SO4(稀)==ZnSO4+H2↑ CaC2+2H2O→Ca(OH)2+CH≡CH↑ CaCO3+2HCl==CaCl2+CO2↑+H2O Cu+4HNO3(浓)==Cu(NO3)2+2NO2↑+2H2O FeS+H2SO4(稀)==FeSO4+H2S↑
36
气体的干燥
干燥是用适宜的干燥剂和装置除去气体中混有的少量水分。常用装置有干燥管(内装固体干燥 剂)、洗气瓶(内装液体干燥剂)。 所选用的干燥剂不能与所要保留的气体发生反应。常用干燥剂及可被干燥的气体如下: (1)浓硫酸(酸性干燥剂):N2、O2、H2、Cl2、CO、CO2、SO2、HCl、NO、NO2、CH4、C2H4、C2H2 等(不 可干燥还原性或碱性气体)。 (2)P2O5(酸性干燥剂):可干燥 H2S、HBr、HI 及浓硫酸能干燥的气体(不可干燥 NH3 等)。 (3)无水 CaCl2(中性干燥剂):可干燥除 NH3 以外的其他气体(NH3 能与 CaCl2 反应生成络合物 CaCl2·8NH3)。 (4)碱石灰(碱性干燥剂):可干燥 NH3 及中性气体(N2、O2、H2、CO、NO、CH4、C2H4、C2H2 等)。 不能干燥酸性气体。 (5)硅胶(酸性干燥剂):可干燥 Cl2、O2、H2、CO2、CH4、C2H4、C2H2(硅胶能吸附水,也易吸附其 他极性分子,只能干燥非极性分子气体)。 (6)其他:如生石灰、NaOH 也可用于干燥 NH3 及中性气体(不可干燥有酸性或能与之作用的气 体)。
均聚反应
nCH2=CH2+nCH2=CH—CH2
共聚反应 发生加聚反应的单体 有两种或多种 ①以某分子中碳氧双键中的氧原子与另一个基团中的 活泼氢原子结合成水而进行的缩聚反应。
(完整word版)高中化学必修一知识网络结构图.doc
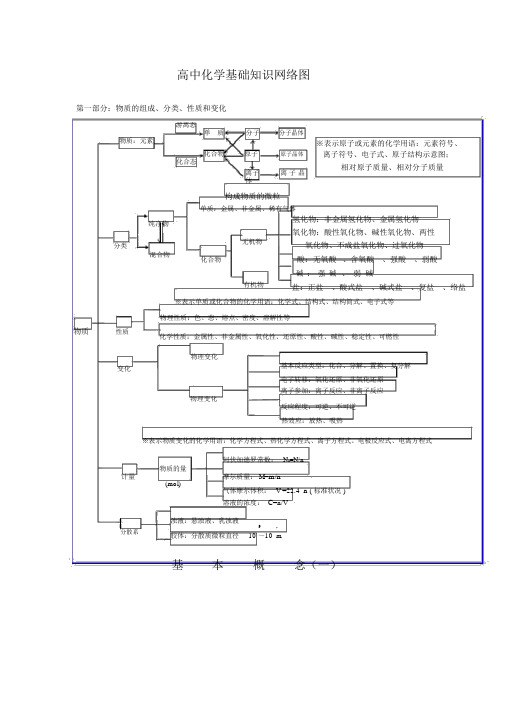
高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化游离态分子分子晶体单质物质:元素化合物原子原子晶体化合态离子离子晶体构成物质的微粒单质:金属、非金属、稀有气体※表示原子或元素的化学用语:元素符号、离子符号、电子式、原子结构示意图;相对原子质量、相对分子质量纯净物氢化物:非金属氢化物、金属氢化物氧化物:酸性氧化物、碱性氧化物、两性分类无机物氧化物、不成盐氧化物、过氧化物混合物化合物酸:无氧酸、含氧酸、强酸、弱酸碱:强碱、弱碱有机物盐:正盐、酸式盐、碱式盐、复盐、络盐※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等物理性质:色、态、熔点、密度、溶解性等物质性质化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性物理变化变化基本反应类型:化合、分解、置换、复分解电子转移:氧化还原、非氧化还原离子参加:离子反应、非离子反应物理变化反应程度:可逆、不可逆热效应:放热、吸热※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式计量分散系阿伏加德罗常数:N A=N/n物质的量摩尔质量: M=m/n(mol)气体摩尔体积:V =22.4 n ( 标准状况 )溶液的浓度: C=n/V浊液:悬浊液、乳浊液-9-7胶体:分散质微粒直径10 ~10 m基本概念(一)色、态、味溶解度、熔点、沸点密度、硬度、导电性导热性、塑性游离态物理性质单质宏观元素金属性、非金属性氧化性、还原性酸性、碱性稳定性、可燃性金属化学性质单质非金属纯净物稀有气体化合物化合态化合物组大多数有机物稀有气体分子晶体分酸子气态及挥发性物质原子晶体原石墨(混合晶体)子微观金属晶体大多数盐强碱离子晶体离碱性氧化物子部分过氧化物性质分类无机物物质氢化物氧化物变化酸碱盐有机物金属氢化物酸性非金属氢化物碱性成盐氧化物两性特殊不成盐氧化物含氧酸、无氧酸强酸、弱酸强碱、弱碱可溶碱、难容碱正盐酸式盐碱式盐复盐;络盐潮解、分馏混合物升华、萃取有机、无机物理变化化学变化化合、分解、置换、复分解风化、干馏氧化还原;非氧化还原溶解、盐析裂化、裂解分子、离子基本概念(二)吸热、放热可逆、不可逆第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)物质结构分子化分分分子子子学的的间运键形极作成性用动力状共离金(态范价子属极非德特键键键性极华殊分性共离金力性子分)价子属子电化化单影子合合质物物及响云合物金理性晶质体结构简图类型电子式金分原离属子子子晶晶晶晶横:周期体体体体原子核外电子原子核(分排层布)规律最次各能外外层量层层最最不不多低超超容原过过纳理8 18 2n个个 2个表示方法表的结构元素种类起止序号中子质量数同位素核电荷数元素质子性规质原子序数变律化元素周期律表现形式元素实周质期律元编元元核素素归素决外周制周纳性定电期期质子表律的排周布期周性期性n=1 n=2 n=3 n=4 n=5 n=6 n=7 纵:族2短周期1~ 28 3~10周元素性质8 11~ 18 原18长周期19~36 期子18 37~54 表结位32 55~86 构置21 不完全周期87~111主族:ⅠA ~Ⅶ A副族:ⅢB ~Ⅶ B 、Ⅰ B Ⅱ BⅧ族0族比较类型离子晶体原子晶体分子晶体构成晶体微粒阴、阳离子原子分子形成晶体作用力离子键共价键范德华力熔沸点较高很高低硬度硬而脆大小物导电性不良熔融.导电绝缘体 ( 半导体 ) 不良理水溶液性传热性不良不良不良质延展性不良不良不良溶解性易溶于极性溶剂不溶于任何溶剂相似相溶典型实例NaCl ,KBr 单质:金刚石、 SiC 、单质:H2、O2 Si 、SiO2 化合物:冰、干冰化表示方法学反特点速率算:v A =△c A /△t 位: mol/L ·s(min 或 h )是平均速率,均取正同一反用不同的物表示速率,数可能不同各物表示的速率比等于反方程式的系数比化和化学化反学学反平衡速率影响因素用条合件成的氨化适于学平衡内因 (主 )外因()可逆反化学平衡建立的条件: v 正=v 逆≠ 0化学平衡的特征(平衡志的判断)反物的构、性度温度催化其他条件光、超声波、激光、放射⋯定各成分百分含量保持不等v 正 =v 逆≠ 0平衡条件改,平衡状改化学平衡、化学反应速率度影响化学平衡因素平衡移原理(勒沙特列原理 )温度强电解质(完全电离 ) AB A -+B -已电离的弱电解质分子数(电离度的定义 (电离度α = ×100%)电离平衡 AB A -+B - 弱电解质的分子总数电 弱 部解 电 分电离度平衡的移动化 质解 电质 离水的离子积 K W =1× 10-14(25℃ )合物) 水的电离平衡 H 2OH ++OH-溶液的酸碱性: PH=-log[H + ]实质装置发生条件表示方式-离子方程式离子反应非氧化还原常见类型氧化还原类型盐类的水解规律(酸碱性性判断)影响因素复分解反应水解反应络合反应置换反应溶液中氧化还原反应原理蓄电池化 能应用电源干电池高能电池学 的 原电池能 转化学能电解池电能与 换原理氯碱工业(电解饱和食盐水)电 :电镀应用非电解精练(精练铜)电解 电冶炼金属(冶炼铝)质电解 质 溶 液比较装置能量转换 (实质) 装置特点电极名称电子流向电极反应原电池 电解池化学能→电能电能→化学能(两极分别发生氧化还原反应产生电流) (在电流作用下两极分别发生氧化还原反应)外电路无电源;两极为活泼性不同 外电路必须有直流电源;两极材料均(或其中之一为能导电的非金属)的金属 能导电即可负极(-)——较活泼 阴极——连接电源负极正极(+)较不活泼 阳极——连接电源正极e ee负极(-)→正极(+)电源负极→阴极电源正极→阳极氧化n+活泼金属失去电子+还原n+还原负极: M -ne → M 阴极: 2H +2e →H 2 ↑或 M + ne → M被氧化、被溶解、被腐蚀。
高中化学知识结构图
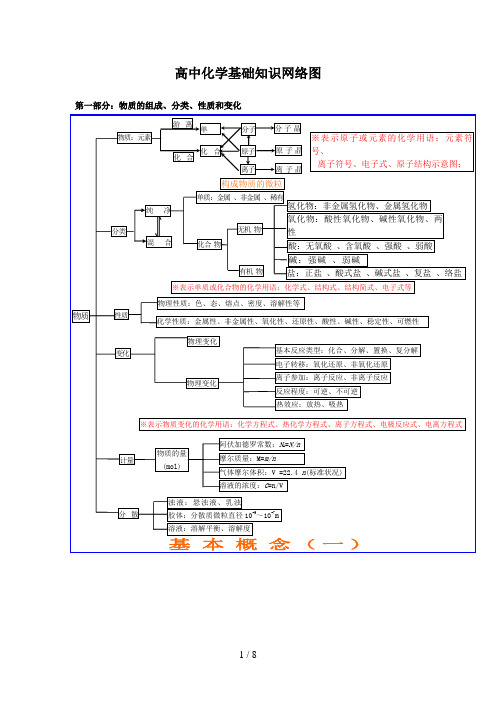
原子晶体 晶体类型 分子晶体
金属晶体
比较
类型
构成晶体微粒
形成晶体作用力
熔沸点
硬度
物理性质
导电性
传热性
延展性
溶解性
典型实例
离子晶体 阴、阳离子
离子键 较高
硬而脆
不良 水熔溶不 不融液..良良导电 易溶于极性溶剂
NaCl,KBr
原子晶体 原子 共价键 很高 大
绝缘体(半导体)
不良 不良 不溶于任何溶剂 单质:金刚石、SiC 、Si、SiO2
化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性
物理变化
变化
基本反应类型:化合、分解、置换、复分解
电子转移:氧化还原、非氧化还原
物理变化
离子参加:离子反应、非离子反应 反应程度:可逆、不可逆
热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
内因(主)
反应物的结构、性质 浓度
压强
合成氨适于 条件的选择
化学平衡
外因(辅 )
可逆反应
温度 催化剂 其他条件 光、超声 波、激光、放射线…
化学平衡、化学
化学平衡建立的条 定 各成分百分含量保持不变
件:v正=v逆≠0 化学平衡的特征
等 v正=v逆≠0 动 动态平衡
(平衡标志的判断) 变 条件改变,平衡状态改变
n=1 n=2
结构简图 电子式
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)
规律 性质变化
元素周期律
元素周期律
实质
核外电子排布周期性
决定
元素性质的周期性
高中化学知识结构网络图

高中化学知识结构网络图化学基本概念和基本理论物质的分类组成原子的粒子间的关系核电荷数(Z)=核内质子数=核外电子数质量数(A)=质子数(Z)+中子数(N)元素周期律与周期表化学键与分子结构晶体类型与性质离子反应氧化还原反应的有关概念的相互关系化学反应中的能量变化溶液与胶体化学反应速率化学平衡弱电解质的电离平衡溶液的酸碱性盐类的水解酸碱中和滴定电化学元素与化合物钠及其化合物碱金属氯及其化合物卤素氧族元素硫的重要化合物碳及其化合物硅及其化合物材料氮族元素氮和磷氨硝酸镁和铝铁及其化合物铜及其化合物有机化学基础烃不饱和链烃芳香烃分类通式结构特点化学性质物理性质同分异构烷烃C n H2n+2(n≥1)①C-C单键②链烃①与卤素取代反应(光照)②燃烧③裂化反应一般随分子中碳原子数的增多,沸点升高,液态时密度增大。
气态碳原子数为1~4。
不溶于水,液态烃密度比水的小碳链异构烯烃C n H2n(n≥2)①含一个C≡C键②链烃①与卤素、H:、H2O等发生加成反应②加聚反应③氧化反应:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构炔烃C n H2n-2(n≥2)①含一个C≡C键②链烃①加成反应②氧化反应:燃烧,被KMnO4酸性溶液氧化碳链异构位置异构苯及其同系物C n H2n-6(n≥6)①含一个苯环②侧链为烷烃基①取代反应:卤代、硝化、磺化②加成反应③氧化反应:燃烧,苯的同系物能被KMnO4酸性溶液氧化简单的同系物常温下为液态;不溶于水,密度比水的小侧链大小及相对位置产生的异构烃的衍生物类别官能团结构特点通式化学性质卤代烃-X(卤素原子)C-X键在一定条件下断裂C n H2n+1O2(饱和一元)(1)NaOH水溶液加热,取代反应(2)NaOH醇溶液加热,消去反应醇-OH(羟基)(1)—OH与烃基直接相连(2)—OH上氢原子活泼C n H2n+2O2(饱和一元)(1)取代:脱水成醚,醇钠,醇与羧酸成酯,卤化成卤代烃(2)氧化成醛(—CH2OH)(3)消去成烯醛(1)醛基上有碳氧双键(2)醛基只能连在烃基链端C n H2n O2(饱和一元)(1)加成:加H2成醇(2)氧化:成羧酸羧(1)—COOH可电离出H+(2)—COOH难加成C n H2n O(饱和一元)(1)酸性:具有酸的通性(2)酯化:可看作取代酯,R 必须是烃基C n H2n O2(饱和一元)水解成醇和羧酸酚(1)羟基与苯环直接相连(2)—OH上的H比醇活泼(3)苯环上的H比苯活泼(1)易取代:与溴水生成2,4,6-三溴苯酚(2)显酸性(3)显色:遇Fe3+变紫色代表物质转化关系类别葡萄糖蔗糖淀粉纤维素分子式(C6H12O6)(C12H22O11)(C6H10O5)(C6H10O5)结构特点多羟基醛分子中无醛基,非还原性糖由几百到几千个葡萄糖单元构成的天然高分子化合物由几千个葡萄糖单元构成的天然高分子化合物主要性质白色晶体,溶于水有甜味。
高中化学知识结构网络图.总结

高中化学知识结构网络图化学基本概念和基本理论物质的分类组成原子的粒子间的关系核电荷数(Z )=核内质子数=核外电子数核外电子数 质量数(A )=质子数(Z )+中子数(N ) 元素周期律与周期表化学键与分子结构晶体类型与性质 晶体类型晶体类型 性质比较性质比较离子晶体离子晶体 分子晶体分子晶体 原子晶体原子晶体 金属晶体金属晶体结构结构 组成粒子组成粒子阴、阳离子阴、阳离子 分子分子 原子原子 金属阳离子和自由电子金属阳离子和自由电子 粒子间作用离子键离子键 范德华力范德华力 共价键共价键 金属键金属键 物理物理性质性质熔沸点熔沸点 较高较高 低 很高很高 有高有低有高有低硬度硬度硬而脆硬而脆 小 大 有大有小、有延展性有大有小、有延展性 溶解性溶解性易溶于极性溶剂,难溶于非极性溶剂难溶于非极性溶剂 极性分子极性分子易溶于极性溶剂易溶于极性溶剂不溶于任何溶剂 难溶(钠等与水反应)难溶(钠等与水反应)导电性导电性晶体不导电;晶体不导电;能溶于水的其水溶液导电;熔化导电液导电;熔化导电 晶体不导电,溶于水后能电离的,其水溶液可导电;熔化不导电电;熔化不导电不良(半导体Si )良导体(导电传热)良导体(导电传热)典型实例NaCl 、NaOH Na 2O 、CaCO 3 干冰、白磷干冰、白磷 冰、硫磺冰、硫磺金刚石、SiO 2 晶体硅、SiC Na 、Mg 、Al Fe 、Cu 、Zn 化学反应类型离子反应氧化还原反应的有关概念的相互关系化学反应中的能量变化化学反应速率弱电解质的电离平衡溶液的酸碱性酸碱中和滴定电化学钠及其化合物碱金属氯及其化合物氧族元素硫的重要化合物碳及其化合物硅及其化合物材料氮族元素氨硝酸铁及其化合物铜及其化合物有机化学基础芳香烃分类分类 通式通式 结构特点结构特点 化学性质化学性质物理性质物理性质 同分异构同分异构 烷烃烷烃C n H 2n+2 (n ≥1) ①C-C 单键单键 ②链烃②链烃①与卤素取代反应(光照) ②燃烧②燃烧③裂化反应③裂化反应 一般随分子中碳原子数的增多,沸点升高,液态时密度增大。
高中化学知识结构图-高中课件精选

高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化大纲要求(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求物质结构和元素周期律(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
化学反应与能量(1)了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(3)了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
(4)了解热化学方程式的含义。
(5)了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
(6)了解焓变与反应热的含义。
了解△H=H(反应产物)—H(反应物)表达式的含义。
(7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
(8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
(9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
化学反应速率和化学平衡(1)了解化学反应速率的概念、反应速率的定量表示方法。
高中化学知识结构图

高中化学知识结构图高中化学基础知识网络图第一部分:物质的组成、分类、性质和变化大纲要求(1)了解分子、原子、离子等概念的含义。
了解原子团的定义。
(2)理解物理变化与化学变化的区别与联系。
(3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。
(4)理解酸、碱、盐、氧化物的概念及其相互联系。
第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液)大纲要求物质结构和元素周期律(1)了解元素、核素和同位素的含义。
(2)了解原子构成。
了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。
(3)了解原子核外电子排布。
(4)掌握元素周期律的实质。
了解元素周期表(长式)的结构(周期、族)及其应用。
(5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。
(6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。
(7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。
(8)了解化学键的定义。
了解离子键、共价键的形成。
化学反应与能量(1)了解氧化还原反应的本质是电子的转移。
了解常见的氧化还原反应。
掌握常见氧化还原反应的配平和相关计算。
(2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。
(3)了解化学能与热能的相互转化。
了解吸热反应、放热反应、反应热等概念。
(4)了解热化学方程式的含义。
(5)了解能源是人类生存和社会发展的重要基础。
了解化学在解决能源危机中的重要作用。
(6)了解焓变与反应热的含义。
了解△H=H(反应产物)—H(反应物)表达式的含义。
(7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。
(8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。
了解常见化学电源的种类及其工作原理。
(9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。
化学反应速率和化学平衡(1)了解化学反应速率的概念、反应速率的定量表示方法。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
.. '. 高中化学基础知识网络图 第一部分:物质的组成、分类、性质和变化 大纲要求(1)了解分子、原子、离子等概念的含义。了解原子团的定义。 (2)理解物理变化与化学变化的区别与联系。 (3)理解混合物和纯净物、单质和化合物、金属和非金属的概念。 (4)理解酸、碱、盐、氧化物的概念及其相互联系。
物质 性质 物质:元素 游离态 化合态 单 质 化合物 分子晶体 原子晶体 离子晶体 离子 分子
原子
构成物质的微粒
※表示原子或元素的化学用语:元素符号、 离子符号、电子式、原子结构示意图; 相对原子质量、相对分子质量
分类 单质:金属 、非金属 、稀有气体
混 合 物 纯 净 物
无机 物 化合 物
有机 物
氢化物:非金属氢化物、金属氢化物 氧化物:酸性氧化物、碱性氧化物、两性 氧化物、不成盐氧化物、过氧化物 酸:无氧酸 、含氧酸 、强酸 、弱酸 碱:强碱 、弱碱 盐:正盐 、酸式盐 、碱式盐 、复盐 、络盐 ※表示单质或化合物的化学用语:化学式、结构式、结构简式、电子式等 物理性质:色、态、熔点、密度、溶解性等 化学性质:金属性、非金属性、氧化性、还原性、酸性、碱性、稳定性、可燃性 物理变化 变化
物理变化 基本反应类型:化合、分解、置换、复分解
离子参加:离子反应、非离子反应 电子转移:氧化还原、非氧化还原
反应程度:可逆、不可逆 热效应:放热、吸热
※表示物质变化的化学用语:化学方程式、热化学方程式、离子方程式、电极反应式、电离方程式
计量 物质的量 (mol) 气体摩尔体积:V =22.4 n(标准状况)
摩尔质量:M=m/n
溶液的浓度:C=n/V
阿伏加德罗常数:NA=N/n
分散系 浊液:悬浊液、乳浊液 胶体:分散质微粒直径10-9~10-7m 溶液:溶解平衡、溶解度 基 本 概 念(一) .. '. 组物质 氧化物
基 本 概 念(二)
性质
变化 分类
色、态、味 溶解度、熔点、沸点 密度、硬度、导电性 导热性、塑性
强碱 化学性质 金属
酸 非金属
纯净物
稳定性、可燃性
化合物 元素
大多数有机物 无机物 物理性质 酸性、碱性 氧化性、还原性 金属性、非金属性 单质 化合物 宏观 物理变化 游离态 化合态 酸性 大多数盐 气态及挥发性物质 微观 稀有气体 分子晶体 分 子 原 子 原子晶体 金属晶体 石墨(混合晶体) 碱性氧化物 部分过氧化物 离子晶体 离 子 稀有气体 单质 有机物 氢化物 金属氢化物
强碱、弱碱 含氧酸、无氧酸 强酸、弱酸
非金属氢化物 成盐氧化物
不成盐氧化物
碱性 两性 特殊
酸
正盐 碱 可溶碱、难容碱
盐 酸式盐 碱式盐 复盐;络盐
混合物
化学变化 潮解、分馏
升华、萃取 溶解、盐析
裂化、裂解
有机、无机
吸热、放热 化合、分解、置换、复分解 氧化还原;非氧化还原 分子、离子
可逆、不可逆
风化、干馏 ..
'. 第二部分:基本理论(物质结构、化学反应速率、化学平衡、电解质溶液) 大纲要求
物质结构和元素周期律 (1)了解元素、核素和同位素的含义。 (2)了解原子构成。了解原子序数、核电荷数、质子数、中子数、核外电子数以及它们之间的相互关系。 (3)了解原子核外电子排布。 (4)掌握元素周期律的实质。了解元素周期表(长式)的结构(周期、族)及其应用。 (5)以第3周期为例,掌握同一周期内元素性质的递变规律与原子结构的关系。 (6)以IA和VIIA族为例,掌握同一主族内元素性质递变规律与原子结构的关系。 (7)了解金属、非金属在元素周期表中的位置及其性质递变的规律。 (8)了解化学键的定义。了解离子键、共价键的形成。 化学反应与能量 (1)了解氧化还原反应的本质是电子的转移。了解常见的氧化还原反应。掌握常见氧化还原反应的配平和相关计算。 (2)了解化学反应中能量转化的原因,能说出常见的能量转化形式。 (3)了解化学能与热能的相互转化。了解吸热反应、放热反应、反应热等概念。 (4)了解热化学方程式的含义。 (5)了解能源是人类生存和社会发展的重要基础。了解化学在解决能源危机中的重要作用。 (6)了解焓变与反应热的含义。了解△H=H(反应产物)—H(反应物)表达式的含义。 (7)理解盖斯定律,并能运用盖斯定律进行有关反应焓变的简单计算。 (8)了解原电池和电解池的工作原理,能写出电极反应和电池反应方程式。了解常见化学电源的种类及其工作原理。 (9)理解金属发生电化学腐蚀的原因,金属腐蚀的危害,防止金属腐蚀的措施。 化学反应速率和化学平衡 (1)了解化学反应速率的概念、反应速率的定量表示方法。 (2)了解催化剂在生产、生活和科学研究领域中的重大作用。 (3)了解化学反应的可逆性。 (4)了解化学平衡建立的过程。了解化学平衡常数的含义,能够利用化学平衡常数进行简单的计算。 (5)理解外界条件(浓度、温度、压强、催化剂等)对反应速率和化学平衡的影响,认识并能用相关理论解释其一般规律。 (6)了解化学反应速率和化学平衡的调控在生活、生产和科学研究领域中的重要作用。 电解质溶液 (1)了解电解质的概念。了解强电解质和弱电解质的概念。 (2)了解电解质在水溶液中的电离,以及电解质溶液的导电性。 .. '. (3)了解弱电解质在水溶液中的电离平衡。 (4)了解水的电离,离子积常数。 (5)了解溶液pH的定义。了解测定溶液pH的方法,能进行pH的简单计算。 (6)了解盐类水解的原理、影响盐类水解程度的主要因素、盐类水解的应用。 (7)了解离子反应的概念、离子反应发生的条件。了解常见离子的检验方法。 (8)了解难溶电解质的溶解平衡。了解溶度积的含义及其表达式,能进行相关的计算。
元素 质子
同位素 中子
分子
物质结构
原子
原子核 核外电子
分子的极性 质量数 分子的形成 原子序数 核电荷数 分
子间作用力(范德华力) 离子化合物 离子键 共价键 金属键 极性分子 非极性分子 化学键 影响物理性质 共价化合物 金
属单质及合金
运动状态 排布规律
(分
层
)
特殊性
电子云
元素性质的周期性 最外层不超过8个 次外层不超过18个 各层最多容纳2n2个 能量最低原理 性质变化 规律 元素周期律 元素周期律 表现形式 元素周期律 核外电子排布周期性 晶体类型 金属晶体 分子晶体 原子晶体 离子晶体 表示方法 结构简图 电子式 元素周期表
实质
决定
横:周期 周期表位置 原子结构 元素性质 归纳 编制 表的结构 起止序号 n=1 n=2 n=3 n=6 n=4 n=5 n=7 2 主族: 副族: 元素种类
纵:族 1~2
18 8 3~10
8 11~18
19~36 37~54 18
ⅢB~ⅦB、ⅠB ⅡB 32 55~86
87~111
短周期 长周期 不完全周期 21 ⅠA~ⅦA
Ⅷ族 0族 .. '. 离子晶体 原子晶体 分子晶体 构成晶体微粒 阴、阳离子 原子 分子 形成晶体作用力 离子键 共价键 范德华力
物理性质
熔沸点 较高 很高 低 硬度 硬而脆 大 小 导电性 不良 绝缘体(半导体) 不良 传热性 不良 不良 不良 延展性 不良 不良 不良 溶解性 易溶于极性溶剂 不溶于任何溶剂 相似相溶 典型实例 NaCl,KBr 单质:金刚石、SiC、Si、SiO2 单质:H2、O2 化合物:冰、干冰
类型 比较
化学平衡、化学 反应速率
化学反应速率
和化学平衡
化学反应 合成氨适于条件的选择
化学反应速率
化学平衡
特点 表示方法 :vA=△cA/△t单位:mol/L·s(min或h ) 计算 影响因素
是平均速率,均取正值 同一反应选用不同的物质表示速率,数值可能不同 各物质表示的速率比 等于该反应方程式的系数比 内因(主) 外因(辅) 反应物的结构、性质 浓度 压强 温度 催化剂 其他条件 光、超声 波、激光、放射线…
应用
可逆反应 化学平衡建立的条 件:v正=v逆≠0 化学平衡的特征 (平衡标志的判断)
影响化学平衡因素
各成分百分含量保持不变 动态平衡 条件改变,平衡状态改变 定 等 动 变 浓度 压强 平衡移动原理 (勒沙特列原理) 温度 v正=v逆≠0
.导电 熔融 水溶液
