(研03)第三章 习题讲解-3
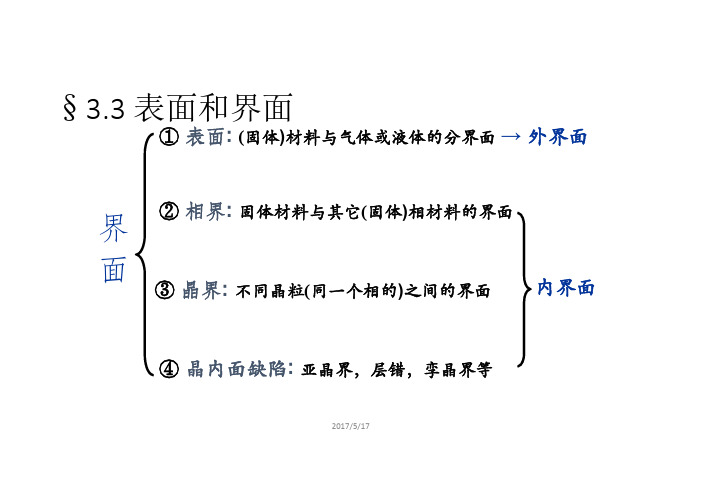
第三章 3.3表面及界面
12 23 cos 2 31 cos 3 0 1 2 3 2
如果是同一相的晶粒,平衡时晶粒 间最常见的夹角为120o。
2017/5/17
§3.3.3 相界
• 相界:不同相(相: 具有特定的结构和成分组成)之间 的界面。 按相界面上原子间匹配程度分为: 共格界面、半共格界面、非共格界面
100
2017/5/17
§3.3.2 晶界
• 晶界的平衡
晶界能的存在,使晶界有收缩的趋势。 类似与表面张力,单位长度晶界上的收缩力F = ( : 晶界能) 看左图,为了使O点不动,则: grain1
31
grain3 O 3
12
1 2
grain2 23
23 31 12 或: sin 3 sin 1 sin 2
(通过这道题我们可以明白,晶体中的位错线互相缠结构成位错网络。位 错网中位错彼此纠缠,相互钉扎。如果在外切应力作用下让位错移动,类 似于F-R位错源的开动,外切应力需要大于一个临界值,此临界值正比于 1/D,所以如果材料的位错密度越大(即D越小),则材料越难变形。所以高密 度的位错对材料有强化作用。)
② 大角度晶界
大角度晶界结构复杂。绝大部分晶粒间形成的是大角度晶界。 大角度晶界的晶界能与晶粒之间的取向基本无关。
2017/5/17
2.
大角度晶界
大角度晶界(high angle grain boundaries )为原子呈 不规则排列的一过渡层。大多数晶粒之间的晶界都属于大 角度晶界。 重合位置点阵( coincidence site lattice )模型:图 3.67, 该模型说明,在大角度晶界结构中将存在一定数 量重合点阵原子。
高数习题(第三章)第三章重难点总结复习

再来说说2展开,对比3我们发现它少了 1 x3 1= 1 x3的这样一个三阶项,所以就是展开的
3!
3!
少了。
那么3就是正确的.首先我们能够找到所有的三阶及比其低阶的量,其次由于sin x的泰勒展开
起步为x, 所以两式相乘时e x只需要展开到二阶即可得到三阶项.类似的,e x泰勒展开起步为1, 所以我们的sin x展开到三阶就可以得到最后的三阶项.这个就是开头说的所有的意思.
2.ex 1 x x2 o x2 2
sin x x o x
3.ex 1 x x2 o x2 2
sin x x 1 x3 o x3 3! 对于1展开,错误在于没有和第一种加的情况相区分,这样如果两式相乘,导致 x3 与sin x任意
3! 一项展开都不是我们所需要的,因为是比三阶高.即展开多了.
a
lim
n
n2 n2
n
a
、
注:第四种方法虽然结果正确,但是我们一般不采取这种方法。
7.若 lim x0
sin 6x xf x3
x
0, 则 lim x0
6 f x
x2
解析:恒等变形后使用洛必达法则
lim
x0
6x
xf x3
x
lim
x0
6
x
sin 6x x3
sin
6x xf x3
x
lim 6x sin 6x lim 6 6 cos 6x 36
分析:令F x f x g x F x在a,b上连续,在a,b内可导,在题设条
件下,要证存在 a,b,F '' =0.已知F a F b =0,只需再证c a,b, F c =0.
1由题设x1 a,b, M
医学统计学李晓松主编第2版高等教育出版社附录第3章思考与练习答案.doc

第三章实验研究设计【思考与练习】一、思考题1. 实验设计根据对象的不同可分为哪几类?2. 实验研究中,随机化的目的是什么?3. 什么是配对设计?它有何优缺点?4. 什么是交叉设计?它有何优缺点?5. 临床试验中使用安慰剂的目的是什么?二、案例辨析题“三联药物治疗士兵消化性溃疡”一文中,对2000~2006年在某卫生所采用三联药物治疗的38例消化性溃疡患者进行分析。
内镜检测结果显示,痊愈13人,显效14人,进步7人,无效4人,有效率达89.5%。
据此认为该三联疗法的疗效较好,且由于其价格适中,可在部队卫生所中推广。
该结论是否正确?如果不正确,请说明理由。
三、最佳选择题1. 实验设计的三个基本要素是A. 处理因素、实验效应、实验场所B. 处理因素、实验效应、受试对象C. 受试对象、研究人员、处理因素D. 受试对象、干扰因素、处理因素E. 处理因素、实验效应、研究人员2. 实验设计的三个基本原则是A. 随机化、对照、重复B. 随机化、对照、盲法C. 随机化、重复、盲法D. 均衡、对照、重复E. 盲法、对照、重复3. 实验组与对照组主要不同之处在于A. 处理因素B. 观察指标C. 抽样误差D. 观察时间E. 纳入、排除受试对象的标准4. 为了解某疗法对急性肝功能衰竭的疗效,用12头健康雌性良种幼猪建立急性肝功能衰竭模型,再将其随机分为两组,仅实验组给予该疗法治疗,对照组不给予任何治疗。
7天后观察两组幼猪的存活情况。
该研究采用的是A. 空白对照B. 安慰剂对照C. 实验对照D. 标准对照E. 自身对照5. 观察指标应具有A. 灵敏性、特异性、准确度、精密度、客观性B. 灵敏性、变异性、准确度、精密度、客观性C. 灵敏性、特异性、变异性、均衡性、稳定性D. 特异性、准确度、稳定性、均衡性、客观性E. 灵敏性、变异性、准确度、精密度、均衡性6. 比较两种疗法对乳腺癌的疗效,若两组患者的乳腺癌分期构成不同可造成A. 选择性偏倚B. 测量性偏倚C. 混杂性偏倚D. 信息偏倚E. 失访性偏倚7. 将两个或多个处理因素的各水平进行组合,对各种可能的组合都进行实验,该实验设计方案是A. 随机区组设计B. 完全随机设计C. 析因设计D. 配对设计E. 交叉设计8. 在某临床试验中,将180例患者随机分为两组,实验组给予试验药+对照药的模拟剂,对照给予对照药+试验药的模拟剂,整个过程中受试对象和研究者均不知道受试对象的分组。
解析几何第三章习题及解答

第三章 常见曲面习题3.11.证明:如果2220a b c d ++->,那么由方程2222220x y z ax by cz d ++++++=给出的曲面是一球面,求出它的球心坐标和半径。
证明:将方程配方得222222()()()x a y b z c a b c d +++++=++-,由2220a b c d ++->,得到方程表示球心是(,,)a b c ---2.求过三点(3,0,0),(0,2,0),(0,0,1)的圆的方程。
解:空间中的圆可由过三点(3,0,0),(0,2,0),(0,0,1)的一个球面和一个平面的交线表示,设过该三点的球面方程为2220x y z ax by cz d ++++++=,得到930,420,10a d b d c d ++=⎧⎪++=⎨⎪++=⎩球面方程为22294(1)032d dx y z x y d z d ++++---++=,其中d 任意。
过该三点的平面方程是132x yz ++=,所以所求圆的方程可以为 2226()2(9)3(4)6(1)60,23660x y z d x d y d z d x y z ⎧++-+-+-++=⎨++-=⎩ 其中d 任意。
3.证明曲线24224324,1,(,)1,1t x t t t y t t t t z t t ⎧=⎪++⎪⎪=∈-∞+∞⎨++⎪⎪=⎪++⎩在一球面上,并此球面方程。
证明:因为曲线满足2322222224242422242424()()()111()(1)11tt t x y z t t t t t t t t t t y t t t t++=++++++++=++==++++即22211()24x y z +-+=,所以曲线在一个球面上。
4.适当选取坐标系,求下列轨迹的方程(1)到两定点距离之比等于常数的点的轨迹; (2)到两定点距离之和等于常数的点的轨迹; (3)到定平面和定点等距离的点的轨迹。
2003年全国硕士研究生入学统一考试数学三真题及答案

2003年全国硕士研究生入学统一考试数学三试题解析一、填空题(本题共6小题,每题4分,满分24分.把答案填在题中横线上.)(1)设⎪⎩⎪⎨⎧=≠=,0,0,0,1cos )(x x xx x f λ其导函数在0=x 处连续,则λ的取值范围是_________. 【答案】λ>2【考点】分段函数的导数、函数连续的概念、无穷小量的性质 【难易度】★★★【详解】本题涉及到的主要知识点:①分段函数求导时,函数连续部分可直接对函数求导,间断点处的导数需要用导数的定义来求; ②导函数也是函数,函数连续需要满足该处极限值与函数值相等; ③有界函数与无穷小的乘积是无穷小,与无穷大的乘积是无穷大;解析:⎪⎪⎩⎪⎪⎨⎧==--=--≠+=--+='-→→→---,01cos lim 001cos lim 0)0()(lim ,01sin 1cos )1)(1sin (1cos )(20002121x x x x x x x f x f x x x x x x x x x x x f x x x λλλλλλλλ)(x f ' 在0=x 处连续,∴)(lim 0x f x →与)0(f 都存在且相等,当0→x 时,x1cos 、x1sin均为有界函数, ∴若要)1sin 1cos (lim )(lim 2100xx x x x f x x --→→+='λλλ存在,必有0lim ,0lim 2010==-→-→λλλx x x x ,01>-∴λ且02>-λ,即2>λ,同理,若要xxx 1cos lim 2-→λ存在,必有0lim 20=-→λx x ,即2>λ,此时,0)0()(lim 0==→f x f x综上,λ的取值范围是2>λ.(2)已知曲线b x a x y +-=233与x 轴相切,则2b 可以通过a 表示为2b =_________.【答案】4a^6【考点】平面曲线的切线 【难易度】★【详解】本题涉及到的主要知识点: ①曲线在切点的斜率为0,即0='y ; ②切点还应满足曲线方程; 解析:由题设,在切点处有0332200=-='=a x y x x ,所以.22a x = 又在此点y 坐标为0,即b x a x +-=023030,故.44)3(6422202202a a a x a x b =⋅=-=(3)设0>a ,⎩⎨⎧≤≤==,,0,10,)()(其他x a x g x f 而D 表示全平面,则⎰⎰=-=Dy x x y g x f I d d )()(_________.【答案】a^2【考点】二重积分的计算 【难易度】★★★【详解】本题涉及到的主要知识点:①若被积函数只在某区域内不为零,则二重积分的计算只需在积分区域与被积函数不为零的区域的公共部分上积分即可;②直接坐标系下,二重积分的运算,可根据被积区域属于X 型还是Y 型来选择适当的方法进行计算; 解析: 只有当10,10≤-≤≤≤x y x 时,被积函数才不为零,212101210,102])1[()()(a dx x x a dy dx a dxdy a dxdy x y g x f I x xx y x D=-+===-=∴⎰⎰⎰⎰⎰⎰⎰+≤-≤≤≤.(4)设n 维向量0,),0,,0,(<=a a a Tα;E 为n 阶单位矩阵,矩阵T TaE B E A αααα1,+=-=, 其中A 的逆矩阵为B ,则=a _________. 【答案】1-【考点】逆矩阵的概念、矩阵的计算 【难易度】★★【详解】解析:)1)((T TaE E AB αααα+-= T T T Ta a E αααααααα⋅-+-=11 TT T T a a E αααααααα)(11-+-=TT T a aE αααααα21-+-=E aa E T=+--+=αα)121(,于是有0121=+--a a ,即0122=-+a a ,解得 .1,21-==a a 已知0a < ,故1a =-.(5)设随机变量X 和Y 的相关系数为9.0,若4.0-=X Z ,则Y 与Z 的相关系数为_________. 【答案】9.0【考点】协方差的性质、相关系数的性质 【难易度】★【详解】本题涉及到的主要知识点:①),cov()4.0,cov(),cov()4.0,cov(),cov(X Y Y X Y X Y Z Y =+=+=; ②相关系数是指随机变量间的线性相关程度; 解析:方法1 9.0),(),(=====XY YX YZ DXDY X Y Cov DZ DY Z Y Cov ρρρ方法2 b aX Z +=,若1=a ,则Z 与X 正线性相关,所以Y 与Z 的相关系数与Y 与X 的 相关系数相等.(6)设总体X 服从参数为2的指数分布,X 1,X 2,…,X n 为来自总体X 的简单随机样本,则当∞→n 时,211i n i n X n Y ∑==依概率收敛于_________.【答案】1/2【考点】常用分布的数字特征、大数定律 【难易度】★★【详解】本题涉及到的主要知识点: ①X 服从参数为λ的指数分布,则21)(,1)(λλ==X D X E ;②一组相互独立且具有有限期望与方差的随机变量n X X X ,,,21 ,当方差一致有界时,其算术平均值依概率收敛于其数学期望的算术平均值;解析:22221,,,nX X X 满足大数定律的条件,则根据大数定律有∑==n i i n X n Y 121依概率收敛于21]41)21[(1])[(11)1()(12121212=+=+===∑∑∑∑====n i n i i i n i i n i i n n DX EX n EX n X n E Y E .二、选择题(本题共6小题,每小题4分,满分24分.每小题给出的四个选项中,只有一项符合题目要求,把所选项前的字母填在题后的括号内.)(1)设)(x f 为不恒等于零的奇函数,且)0('f 存在,则函数xx f x g )()(=( ) (A )在0=x 处左极限不存在. (B )有跳跃间断点0=x . (C )在0=x 处右极限不存在. (D )有可去间断点0=x .【答案】D【考点】函数间断点的类型、导数的概念 【难易度】★【详解】本题涉及到的主要知识点: ①导数的定义公式000)()(lim)(0x x x f x f x f x x --='→;②可去间断点的定义:左右极限存在且相等,但不等于函数值或函数在该点没有定义; 解析:显然0x =为()g x 的间断点,且由()f x 为不恒等于零的奇函数知,(0)0f =.于是有)0(0)0()(lim )(lim)(lim 00f x f x f x x f xg x x x '=--==→→→存在,故0x =为可去间断点. (2)设可微函数),(y x f 在点),(00y x 取得极小值,则下列结论正确的是( ) (A )),(0y x f 在0y y =处的导数等于零. (B )),(0y x f 在0y y =处的导数大于零. (C )),(0y x f 在0y y =处的导数小于零. (D )),(0y x f 在0y y =处的导数不存在. 【答案】A【考点】全微分存在的必要条件 【难易度】★【详解】本题涉及到的主要知识点: ①可微必有偏导数存在;②多元函数取极值的必要条件:0),(,0),(0000='='y x f y x f y x ;解析:可微函数(,)f x y 在点),(00y x 取得极小值,根据取极值的必要条件知0),(00='y x f y ,即),(0y x f 在0y y =处的导数等于零.(3)设2||n n n a a p +=,2||n n n a a q -=,n =2,1…,则下列命题正确的是( ) (A )若n n a∑∞=1条件收敛,则n n p ∑∞=1与n n q∑∞=1都收敛.(B )若n n a∑∞=1绝对收敛,则n n p ∑∞=1与n n q∑∞=1都收敛.(C )若n n a∑∞=1条件收敛,则n n p ∑∞=1与nn q∑∞=1的敛散性都不定.(D )若n n a∑∞=1绝对收敛,则n n p ∑∞=1与n n q∑∞=1的敛散性都不定.【答案】B【考点】绝对收敛与收敛的关系、收敛级数的基本性质 【难易度】★★【详解】本题涉及到的主要知识点: ①如果级数∑∞=1n nu各项的绝对值所构成的正项级数∑∞=1n nu收敛,则称级数∑∞=1n nu绝对收敛;如果级数∑∞=1n nu收敛,而级数∑∞=1n nu发散,则称级数∑∞=1n nu条件收敛;②如果级数∑∞=1n nu绝对收敛,则级数∑∞=1n nu必定收敛;③如果级数∑∞=1n nu和∑∞=1n nv分别收敛于和s 、δ,则级数∑∞=±1)(n n nv u也收敛,且其和为δ±s ;解析:∑∞=1n n a 绝对收敛,即∑∞=1n n a 收敛,当然也有级数∑∞=1n n a 收敛,再根据2nn n a a p +=,2nn n a a q -=及收敛级数的运算性质知,∑∞=1n np与∑∞=1n nq都收敛.(4)设三阶矩阵⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡=a b b b a b b b a A ,若A 的伴随矩阵的秩等于1,则必有( ) (A )b a =或02=+b a . (B )b a =或02≠+b a . (C )b a ≠且02=+b a . (D )b a ≠且02≠+b a . 【答案】C 【考点】矩阵的秩 【难易度】★★【详解】本题涉及到的主要知识点:①(2)n n ≥阶矩阵A 与其伴随矩阵A *的秩之间有下列关系:.1)(,1)(,)(,0,1,*)(-<-==⎪⎩⎪⎨⎧=n A r n A r n A r n A r②若n 阶矩阵A 不满秩,则必有0=A ;解析:方法1 根据A 与其伴随矩阵A *秩之间的关系知,秩(A )=2,故有2(2)()0a b bb a b a b a b b b a=+-=,即有02=+b a 或a b =. 但当a b =时,显然秩(A)2≠, 故必有 a b ≠且02=+b a . 方法2 根据A 与其伴随矩阵A *秩之间的关系知,秩(A )=2 将A 作初等行变换00a b b ab b A b a b b a a b b b a b a a b ⎡⎤⎡⎤⎢⎥⎢⎥=→--⎢⎥⎢⎥⎢⎥⎢⎥--⎣⎦⎣⎦当a b =时,不合题意(排除(A)\(B)) 故a b ≠201100100101001ab b a b b a b b b A b a a b b a a b +⎡⎤⎡⎤⎡⎤⎢⎥⎢⎥⎢⎥=--→-=-⎢⎥⎢⎥⎢⎥⎢⎥⎢⎥⎢⎥----⎣⎦⎣⎦⎣⎦故02=+b a ,且a b ≠时,秩(A )=2.(5)设n ααα 21,均为n 维向量,下列结论不正确...的是( ) (A )若对于任意一组不全为零的数s k k k 21,,都有0221≠+++s s k k k ααα ,则s ααα 21,线性无关.(B )若s ααα 21,线性相关,则对于任意一组不全为零的数s k k k 21,,有0221=+++s s k k k ααα .(C )s ααα 21,线性无关的充分必要条件是此向量组的秩为s . (D )s ααα 21,线性无关的必要条件是其中任意两个向量线性无关. 【答案】B【考点】向量组的线性相关与线性无关 【难易度】★★【详解】解析:(A): 若对于任意一组不全为零的数s k k k ,,,21 ,都有02211≠+++s s k k k ααα ,则s ααα,,,21 必线性无关,因为若s ααα,,,21 线性相关,则存在一组不全为零的数s k k k ,,,21 ,使得 02211=+++s s k k k ααα ,矛盾. 成立.(B): 若s ααα,,,21 线性相关,则存在一组,而不是对任意一组不全为零的数s k k k ,,,21 , 都有.02211=+++s s k k k ααα 不成立.(C) s ααα,,,21 线性无关,则此向量组的秩为s ;反过来,若向量组s ααα,,,21 的秩为s , 则s ααα,,,21 线性无关,成立.(D) s ααα,,,21 线性无关,则其任一部分组线性无关,当然其中任意两个向量线性无关,成立. (6)将一枚硬币独立地掷两次,引进事件:A 1={掷第一次出现正面},A 2={掷第二次出现正面},A 3={正、反面各出现一次},A 4={正面出现两次},则事件( ) (A )A 1,A 2,A 3相互独立.(B )A 2,A 3,A 4相互独立.(C )A 1,A 2,A 3两两独立. (D )A 2,A 3,A 4两两独立.【答案】C【考点】事件的独立性 【难易度】★★【详解】本题涉及到的主要知识点:①B A ,两事件相互独立的充要条件为:)()()(B P A P AB P = ②,,A B C 三事件相互独立的充要条件为:1),,A B C 两两相互独立;2))()()()(C P B P A P ABC P =. 解析:方法1 因为21)(1=A P ,21)(2=A P ,21)(3=A P ,41)(4=A P ,且41)(21=A A P , 41)(31=A A P ,41)(32=A A P ,41)(42=A A P 0)(321=A A A P ,可见有)()()(2121A P A P A A P =,)()()(3131A P A P A A P =,)()()(3232A P A P A A P =, )()()()(321321A P A P A P A A A P ≠,)()()(4242A P A P A A P ≠.故321,,A A A 两两独立但不相互独立;432,,A A A 不两两独立更不相互独立.方法2 由三事件相互独立的定义可知:相互独立必两两独立;反之,两两独立不一定相互独立. 可见(A )(B )必不正确,因为如果(A )(B )正确,则(C )(D )必也正确,但正确答案不 能有两个因此只要检查(C )和(D ){}{}{}{}{}2342341110244P A A A P P A P A P A φ==≠=,432,,A A A 不两两独立.三、(本题满分8分)设)1(π1πsin 1π1)(x x x x f --+=,)1,21[∈x 试补充定义f (1)使得f (x )在]1,21[上连续. 【考点】函数连续的概念、函数左极限与右极限的概念 【难易度】★★★【详解】解析:])1(π1πsin 1π1[lim )(lim 11x x x x f x x --+=--→→π1)π()π(61lim π1πtsin ππt sin πlim π1]π1πt sin 1[lim π1]π1πt)πsin(1[lim π11])1(π1πsin 1[lim π12300001=+=-+=-+=--+-=--+=++++-→→→→→t t t t t t x t x x t t t t x 由于()f x 在)1,21[上连续,因此定义 π1)1(=f ,使()f x 在]1,21[上连续.四、(本题满分8分)设),(v u f 具有二阶连续偏导数,且满足12222=∂∂+∂∂v f u f ,又2(21,[),(x xy f y x g =)]2y -,求 2222y gx g ∂∂+∂∂.【考点】多元复合函数的求导法 【难易度】★★★ 【详解】解析:vfx u f y x v v f x u u f x g ∂∂+∂∂=∂∂∂∂+∂∂∂∂=∂∂,vf y u f x y v v f y u u f yg ∂∂-∂∂=∂∂∂∂+∂∂∂∂=∂∂, vf v f x v u f xy u f y xg ∂∂+∂∂+∂∂∂+∂∂=∂∂∴2222222222, vf v f y u v f xy u f x yg ∂∂-∂∂+∂∂∂-∂∂=∂∂2222222222, 12222=∂∂+∂∂vfu f , 222222222222)()(vf y x u f y x yg x g ∂∂++∂∂+=∂∂+∂∂∴=.22y x + 五、(本题满分8分)计算二重积分y x y x I y x Dd d )sin(e22)π(22+=-+-⎰⎰,其中积分区域}π|),{(22≤+=y x y x D .【考点】二重积分的计算 【难易度】★★★ 【详解】 解析:y x y x I y x Dd d )sin(e22)π(22+=-+-⎰⎰dxdy y x e e Dy x)sin(22)(22+=⎰⎰+-π=.sin 2022dr r re d er ⎰⎰-πππθ令2r t =,则dt t e d e I t ⎰⎰-=πππθ200sin 21.记tdt e A t sin 0⎰-=π,则0sin t t A e tde π--=-⎰=]cos sin [0⎰----ππtdt e t e t t=⎰--πcos ttde =]sin cos [0tdt e te t t⎰--+-ππ=.1A e -+-π因此 )1(21π-+=e A , ⎰+=+=+=--ππππππππθ20).1(2)1(2)1(2121e e e d e e I).1(2)1(2πππππe e e I +=+=-六、(本题满分9分)求幂级数)1|(|2)1(121<-+∑∞=x n x nnn 的和函数)(x f 及其极值.【考点】幂级数的和函数、函数的极值 【难易度】★★★★【详解】本题涉及到的主要知识点:求和函数一般都是先通过逐项求导、逐项积分等转化为可直接求和的几何级数情形,然后再通过逐项积分、逐项求导等逆运算最终确定和函数.解析: 等式21()1(1)(1)2nnn x f x x n ∞==+-<∑两边求导得212212211()(1)(1)(1).1nn nn n n n n n xf x xx xx x x∞∞∞--+==='=-=-=-=-+∑∑∑ 上式两边从0到x 积分,得).1ln(211)0()(202x dt t t f x f x+-=+-=-⎰由(0)1f =, 得).1(),1ln(211)(2<+-=x x x f令0)(='x f ,求得唯一驻点0x =. 由于2221()10,(1)x f x x -''=-=-<+01)0(<-=''f ,所以()f x 在0x =处取得极大值,且极大值为(0)1f = 七、(本题满分9分)设)()()(x g x f x F =,其中函数)(),(x g x f 在),(+∞-∞内满足以下条件:)()(x g x f =',)()(x f x g ='且0)0(=f x e x g x f 2)()(=+.(1)求)(x F 所满足的一阶微分方程; (2)求出)(x F 的表达式. 【考点】一阶线性微分方程 【难易度】★★★【详解】本题涉及到的主要知识点:一阶线性微分方程)()(x Q y x P y =+'的解为⎪⎭⎫ ⎝⎛+⎰⎰=⎰-C dx e x Q Ce y dx x p dx x p )()()( 解析:(1)由)()()()()(x g x f x g x f x F '+'='=)()(22x f x g +2[()()]2()()f x g x f x g x =+-=2(2)2()x e F x -可见()F x 所满足的一阶微分方程为.4)(2)(2xe x F x F =+' 相应的初始条件为(0)(0)(0)0Ffg ==.(2)]4[)(222C dx e e e x F dx x dx +⎰⋅⎰=⎰- =]4[42C dx e e x x +⎰- =.22xx Ce e -+将(0)0F =代入上式,得1C =- 所以.)(22x xe ex F --=八、(本题满分8分)设函数)(x f 在]3,0[上连续,在)3,0(内可导,且3)2()1()0(=++f f f ,1)3(=f . 试证必存在)3,0(∈ξ,使0)(='ξf . 【考点】罗尔定理、介值定理 【难易度】★★★【详解】本题涉及到的主要知识点:①介值定理推论 在闭区间上连续的函数必取得介于最大值M 与最小值m 之间的任何值; ②罗尔定理 如果函数)(x f 满足 (1)在闭区间],[b a 上连续 (2)在开区间),(b a 内可导(3)在区间端点处得函数值相等,即)()(b f a f = 那么在),(b a 内至少有一点ξ,使得0)(='ξf .解析: ()f x 在]3,0[上连续,所以()f x 在]2,0[上连续,且在]2,0[上必有最大值M 和最小值m ,∴M f m ≤≤)0(,M f m ≤≤)1(,M f m ≤≤)2(. ∴.3)2()1()0(M f f f m ≤++≤由介值定理知,至少存在一点]2,0[∈c ,使.13)2()1()0()(=++=f f f c f因为)3(1)(f c f ==, 且()f x 在[,3]c 上连续,在(,3)c 内可导,所以由罗尔定理知,必存在)3,0()3,(⊂∈c ξ,使.0)(='ξf九、(本题满分13分)已知齐次线性方程组⎪⎪⎪⎩⎪⎪⎪⎨⎧=+++++=+++++=+++++=+++++,0)(,0)(,0)(,0)(332211332211332211332211nn n n n n n n x b a x a x a x a x a x b a x a x a x a x a x b a x a x a x a x a x b a 其中01=/∑=ini a试讨论n a a a ,,,21 和b 满足何种关系时,(1)方程组仅有零解;(2)方程组有非零解.在有非零解时,求此方程组的一个基础解系. 【考点】齐次线性方程组解的判定 【难易度】★★★ 【详解】解析:方程组的系数行列式b a a a a a b a a a a a b a a a a a b a n n nn++++= 321321321321||A bbb b b b a a a b a n 000000321---+=bb b a a a b an i 0000000032∑+=).(11b a b ni i n +=∑=-(1)当0≠b 且01=/+∑=b aini 时,0≠A ,方程组仅有零解.(2)当0=b 时,原方程组的同解方程组为02211=+++n n x a x a x a . 由01≠∑=ni ia可知,),,2,1(n i a i =不全为零. 不妨设01≠a ,得原方程组的一个基础解系为T a a )0,,0,1,(121 -=α,T a a )0,,1,0,(132 -=α,.)1,,0,0,(,1T n n a a -=α当i n i a b ∑=-=1时,由01=/∑=ini a知b ≠0,系数矩阵可化为⎥⎥⎥⎥⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎢⎢⎢⎢⎣⎡----∑∑∑∑====n i i n nni inni in ni ia a a a a a a a a a a a a a a a a a a a 1321132131213211(将第1行的-1倍加到其余各行,再从第2行到第n 行同乘以∑=-ni ia11倍)→⎥⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎢⎣⎡----∑=1001010100113211 n ni ia a a a a( 将第n 行n a -倍到第2行的2a -倍加到第1行,再将第1行移到最后一行)→.0000100101010011⎥⎥⎥⎥⎥⎥⎦⎤⎢⎢⎢⎢⎢⎢⎣⎡---由于秩1)(-=n A r ,则0=Ax 的基础解系是T)1,,1,1( =α.十、(本题满分13分)设二次型),0(222),,(31232221321>+-+==b x bx x x ax AX X x x x f T其中二次型的矩阵A 的特征值之和为1,特征值之积为-12. (1)求b a ,的值;(2)利用正交变换将二次型f 化为标准形,并写出所用的正交变换和对应的正交矩阵. 【考点】矩阵的特征值的性质、用正交变换化二次型为标准形 【难易度】★★★★ 【详解】解析:(1)二次型f 的矩阵为.200200⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡-=b b a A 设A 的特征值为).3,2,1(=i i λ 由题设,有1)2(2321=-++=++a λλλ,.12242002002321-=--=-=b a b ba λλλ解得1,2a b ==-. (2) 由矩阵A 的特征多项式)3()2(22202012+-=+----=-λλλλλλA E ,得A 的特征值.3,2321-===λλλ对于,221==λλ解齐次线性方程组0)2(=-x A E ,得其基础解系 T )1,0,2(1=ξ,.)0,1,0(2T=ξ对于33-=λ,解齐次线性方程组0)3(=--x A E ,得基础解系.)2,0,1(3T-=ξ由于321,,ξξξ已是正交向量组,为了得到规范正交向量组,只需将321,,ξξξ单位化,由此得T )51,0,52(1=η,T )0,1,0(2=η,.)52,0,51(3T -=η令矩阵[]12300100Q ηηη⎤⎥⎥==⎢⎥⎢⎥,则Q 为正交矩阵. 在正交变换X QY =下,有⎥⎥⎥⎦⎤⎢⎢⎢⎣⎡-=300020002AQ Q T ,且二次型的标准形为.322232221y y y f -+=十一、(本题满分13分)设随机变量X 的概率密度为⎪⎩⎪⎨⎧∈=;,0],8,1[,31)(32其他x x x f)(x F 是X 的分布函数,求随机变量)(x F Y =的分布函数.【考点】连续型随机变量分布函数的计算 【难易度】★★★ 【详解】解析:当1x <时,()0F x =; 当8x > 时,()1F x =.对于]8,1[∈x ,有.131)(3132-==⎰x dt t x F x设()G y 是随机变量()Y F x =的分布函数. 显然,当0<y 时,()G y =0;当1≥y 时,()G y =1. 对于)1,0[∈y ,有})({}{)(y X F P y Y P y G ≤=≤==})1({}1{33+≤=≤-y X P y X P=.])1[(3y y F =+于是,()Y F x =的分布函数为0,0,(),01,1, 1.y G y y y y <⎧⎪=≤<⎨⎪≥⎩若若若 十二、(本题满分13分)设随机变量X 与Y 独立,其中X 的概率分布为⎪⎪⎭⎫ ⎝⎛7.03.021~X , 而Y 的概率密度为)(y f ,求随机变量Y X U +=的概率密度)(u g .【考点】多个相互独立随机变量简单分布函数的计算 【难易度】★★★【详解】本题涉及到的主要知识点:①求二维随机变量函数的分布,一般用分布函数法转化为求相应的概率.②两个随机变量和的分布,其中一个是连续型一个是离散型,要求用全概率公式进行计算 解析:设()F Y 是Y 的分布函数,则由全概率公式,知U X Y =+的分布函数为}{}{)(u Y X P u U P u G ≤+=≤==}2{7.0}1{3.0=≤++=≤+X u Y X P X u Y X P =}22{7.0}11{3.0=-≤+=-≤X u Y P X u Y P . 由于X 和Y 独立,可见()0.3{1}0.7{2}G u P Y u P Y u =≤-+≤-=).2(7.0)1(3.0-+-u F u F由此,得U 的概率密度)2(7.0)1(3.0)()(-'+-'='=u F u F u G u g=).2(7.0)1(3.0-+-u f u f。
第三章-股票价值评估习题讲解学习

第三章股票价值评估 (2)单项选择题(20个) (2)多项选择题(20个) (4)判断题(20个) (6)计算题(10个) (7)关键名词 (13)简答题 (13)参考答案 (14)一、单项选择题 (14)二、多项选择题 (14)三、判断题 (14)四、计算题 (14)五、名词解释(略) (20)六、简答题 (20)第三章股票价值评估单项选择题(20个)1.一般来说,历史增长率的波动性越大,未来增长率预测值的精确度()。
A.越大 B.越小 C.相同 D.没有影响2.下列表述错误的是()。
A.预测取样时段的经济处于周期中的哪一阶段,对历史增长率会有很大影响B.对于周期性公司,如果使用萧条时期的历史增长率进行预测,则增长率很可能为负数C.预测周期性公司的未来增长率,应尽量选取一个经济周期的历史数据D.与常规公司相比,周期性公司的增长率对经济环境的变化更为敏感3.关于股利稳定增长模型,下列表述错误的是()。
A.每股股票的预期股利越高,股票价值越大B.必要收益率越小,股票价值越小C.股利增长率越大,股票价值越大D.该模型的基本假设为股利支付是永久性的,股利增长率为一常数,且折现率大于股利增长率4.某公司年初以40元购入一支股票,预期下一年将收到现金股利2元,预期一年后股票出售价格为48元,则此公司的预期收益率为()。
A.4.5% B.5% C.30% D.25%5.“公司通常具有较好的投资机会,处于大规模投资扩张阶段,公司收益主要用于再投资,并且需要较大规模的外部筹资”,符合这一特征的公司属于()。
A.收益型股票公司 B.增长型股票公司 C.衰退型股票公司 D.稳定型股票公司6.下列表述中有误的是()。
A.公司自由现金流量是指公司在支付了经营费用和所得税之后,向公司权利要求者支付现金之前的全部现金流量B.公司的权利要求者主要包括普通股股东、债权人和优先股股东C.公司自由现金流量是对整个公司而不是股权进行估价,但股权价值可以用公司价值减去发行在外债务的市场价值得到D.利用公司自由现金流量和股权自由现金流量对公司价值进行评估时,均可采用公司的加权平均成本作为折现率7.某企业本年末流动资产为150万元,流动负债为80万元,其中短期银行借款为30万元,预计未来年度流动资产为250万元,流动负债为140万元,其中短期银行借款为50万元,若预计年度的息前税后营业利润为350万元,折旧与摊销为90万元,则营业现金净流量为()。
工程力学顾晓勤编著习题解答第三章
第三章 平衡方程的应用习题解析3—1静定多跨梁的荷载及尺寸如图3-1所示,长度单位为m ,求支座反力和中间铰处的压力。
图3-1 题3—1图解:a)按照约束的性质画静定多跨梁BC 段受力图(见图3-2),对于BC 梁由平衡条件得到如下方程:图3-2062021660cos ,0)(201=⨯⨯-⨯=∑=NC ni i B F F M ,kN 120=NC F060sin ,001=-=∑=NC Bx ni ix F F F , kN 9.10360sin 0==NC Bx F F060cos kN 620,001=+⨯-=∑=NC By ni iy F F F , kN F By 60=故支座反力C 反力kN 120=NC F ,方向垂直与支撑面;中间铰处B 的压力kN 9.103=Bx F 、kN 60=By F 。
如果同学有兴趣,可以进一步计算固定端A 约束反力,按照约束的性质画AB 段受力图(见图3-3),由作用反作用定律得'Bx F Bx F =kN 9.103=、'By F By F =kN 60=。
对于BC 梁由平衡条件得到如下方程:图3-3'1,0Bx Ax ni ix F F F ==∑=kN 9.103=01=∑=ni iy F , 'By Ay F F =kN 60=0340,0)('1=⨯-⋅-=∑=By A ni i A F m kN M F M ,A M m kN ⋅=220b) 按照约束的性质画静定多跨梁ABC 段、CD 段受力图(见图3-4),对于BC 梁由平衡条件得到如下方程:图3-40m kN 22.521m kN 54,0)(21=⋅⨯⨯-⋅-⨯=∑=ND ni i C F F M , m kN 5.2⋅=ND F0,01==∑=Cx ni ix F F0kN 25.2,01=+⨯-=∑=ND Cy ni iy F F F , kN 5.2=Cy F由作用反作用定律得'Cx F Cx F ==0、'Cy F Cy F =kN 5.2=。
考研数学习题第三章
第三章1、x x x ln cot ln lim0→=2、求函数x x y cos 2+=在区间⎥⎦⎤⎢⎣⎡2,0π上的最大值3、验证柯西中值定理对函数()x x f sin 2=和()x x g cos 1-=在⎥⎦⎤⎢⎣⎡2,0π上的正确性4、⎪⎭⎫ ⎝⎛-=x e y 1ln 有( ) A 一条铅直渐近线,无水平渐近线 B 两条铅直渐近线,无水平渐近线C 两条铅直渐近线,一条水平渐近线D 一条铅直渐近线,一条水平渐近线5、()3232x x x f +=( )A 只有极大值()11=-f ,无极小值B 只有极小值()11=-f ,无极大值C 有极大值()1-f ,有极小值()0fD 有极小值()1-f ,有极大值()0f6、在上()+∞∞-,单调的函数有( )A ()x x x x f sin 3++=B ()x x e x f x sin +-=-C ()x e x f x +=-D ()()1ln 2-+=x x x f7、若()x f 为()l l +-,内的可导函数,且为奇函数,则()x f '( )A 必为()l l +-,内的奇函数B 必为()l l +-,内的偶函数C 必为()l l +-,内的非奇非偶函数D 可能为奇函数,也可能为偶函数。
8、若抛物线2ax y =与x y ln =相切,求a 。
9、求()x x x f arcsin -=的单调区间。
10、若()⎥⎥⎦⎤⎢⎢⎣⎡⎪⎭⎫ ⎝⎛+=∞→tx x x t t f 211lim ,求()='t f11、设()⎪⎩⎪⎨⎧=≠-=-00014x x x e x f x ,求()='0f12、设函数)(x f 在闭区间[]1,0上可导并且1)(0<<x f ,在开区间)1,0(内有,1)(≠'x f 证明在开区间)1,0(内有且仅有一个x ,使x x f =)(13.设),0,0(>>+=x a a a xa y xa a x a 试求y '14.试在曲线段)80(2<<=x x y 上求一点M 的坐标,使得由曲线在M 点的切线与直线0,8==y x 所围三角形面积最大15.设)(x f 在],[b a 上连续,在),(b a 内二阶可导,证明存在)(b c a C <<使)(4)()2(2)()(2c f a b b a f b f a f ''-=+-+16.设,1)(,0xx f ab =<则在b x a <<内,使))(()()(a b f a f b f -'=-ξ成立的点ξ( ) A 、只有一点 B 、有两个点 C 、不存在 D|是否存在a,b 值有关17.设)(x f 处处连续,且在1x x =处有0)(1='x f ,在2x x =处不可导,那么( )A 、1x x =及2x x =都必不是)(x f 的极值点B 、只有1x x =,是)(x f 的极值点C 、1x x =及2x x =都有可能是)(x f 的极值点D 、只有2x x =是)(x f 的极值点18.求曲线x arctgx y -=的单调区间。
计量经济学第三章多元线性回归模型习题
第三章练习题及参考解答3.1为研究中国各地区入境旅游状况,建立了各省市旅游外汇收入(Y ,百万美元)、旅行社职工人数(X1,人)、国际旅游人数(X2,万人次)的模型,用某年31个省市的截面数据估计结果如下:ii i X X Y 215452.11179.00263.151ˆ++-= t=(-3.066806) (6.652983) (3.378064)R 2=0.934331 92964.02=R F=191.1894 n=311)从经济意义上考察估计模型的合理性。
2)在5%显著性水平上,分别检验参数21,ββ的显著性。
3)在5%显著性水平上,检验模型的整体显著性。
练习题3.1参考解答:(1)由模型估计结果可看出:从经济意义上说明,旅行社职工人数和国际旅游人数均与旅游外汇收入正相关。
平均说来,旅行社职工人数增加1人,旅游外汇收入将增加0.1179百万美元;国际旅游人数增加1万人次,旅游外汇收入增加1.5452百万美元。
这与经济理论及经验符合,是合理的。
(2)取05.0=α,查表得048.2)331(025.0=-t 因为3个参数t 统计量的绝对值均大于048.2)331(025.0=-t ,说明经t 检验3个参数均显著不为0,即旅行社职工人数和国际旅游人数分别对旅游外汇收入都有显著影响。
(3)取05.0=α,查表得34.3)28,2(05.0=F ,由于34.3)28,2(1894.19905.0=>=F F ,说明旅行社职工人数和国际旅游人数联合起来对旅游外汇收入有显著影响,线性回归方程显著成立。
3.2 表3.6给出了有两个解释变量2X 和.3X 的回归模型方差分析的部分结果:表3.6 方差分析表RSS 的自由度各为多少?2)此模型的可决系数和调整的可决系数为多少?3)利用此结果能对模型的检验得出什么结论?能否确定两个解释变量2X 和.3X 各自对Y 都有显著影响?练习题3.2参考解答:(1) 因为总变差的自由度为14=n-1,所以样本容量:n=14+1=15因为 TSS=RSS+ESS 残差平方和RSS=TSS-ESS=66042-65965=77回归平方和的自由度为:k-1=3-1=2残差平方和RSS 的自由度为:n-k=15-3=12(2)可决系数为:2659650.99883466042ES R TSS S === 修正的可决系数:222115177110.998615366042i ie n R n ky--=-=-=ᄡ--¥¥(3)这说明两个解释变量2X 和.3X 联合起来对被解释变量有很显著的影响,但是还不能确定两个解释变量2X 和.3X 各自对Y 都有显著影响。
《统计学》(第二版)学习指导与习题训练答案2012-03第三章静态分析指标习题答案
第三章静态分析指标习题答案一、名词解释用规范性的语言解释统计学中的名词。
1. 总量指标:指反映在一定时间、空间条件下某种现象的总体范围、总体规模、总体水平的指标。
2. 强度相对数:指同一时期两个性质不同但有一定联系的总量指标之比。
3. 平均指标:指将同质总体内各单位某一数量标志的差异抽象化,用以反映同类现象在具体条件下的一般水平。
4. 算术平均数:指总体标志总量与总体单位总量之比,它是分析社会经济现象一般水平和典型特征的最基本指标。
5. 调和平均数:指总体各单位标志值倒数的算术平均数的倒数,也称为倒数平均数。
6. 众数:指总体中出现次数最多的标志值,它能直观地说明客观现象分配中的集中趋势。
7. 中位数:指现象总体中各单位标志值按大小顺序排列,居于中间位置的那个标志值。
8. 标准差:指总体各单位标志值与其算术平均数离差平方的平均数的算术平方根。
9. 标志变异指标:指反映总体各单位标志值之间差异大小的综合指标,又称为标志变动度。
二、填空题根据下面提示的内容,将适宜的名词、词组或短语填入相应的空格之中。
1. 平均指标、相对指标2. 两个有联系、联系程度3. 104. 系数、成数、有名数5. 相对数、平均数6. 期中7. 102.22、660、6488. 水平法、累计法9. 结构相对数10. 高11. 不同空间12. 计划完成相对数、结构相对数13. 总体标志总量、总体单位总量14. 调和平均数、算术平均数15. 集中趋势、离中趋势16. 那个标志值17. 绝对数、比重18. 同质总体19. 平均差、标准差、离散系数、标准差20. P21. 标准差、其算术平均数22. 360023. 平方、平均差24. 412.31元、103.08%25. 相等、中位数三、单项选择从各题给出的四个备选答案中,选择一个最佳答案,填入相应的括号中。
1 B2 D3 C4 B5 C6 D7 C8 B9 B 10 D11 D 12 B 13 B 14 D 15 D16 C 17 A 18 B 19 B 20 B21 A 22 C 23 B 24 B 25 B26 A 27 D 28 B 29 A 30 B四、多项选择从各题给出的四个备选答案中,选择一个或多个正确的答案,填入相应的括号中。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
例7:如果采用定值比热,则有Δu = cVΔT 及Δh = cpΔT,①为什 么这两个公式可以用来计算任意过程中理想气体的热力学能变化 和焓变化?②对于非理想气体,这两个公式的适用范围怎样? 解:(1)理想气体的热力学能和焓仅是温度的函数,∴它们的 变化仅与初、终两态的温度有关,而与经历的过程及初终两态的 压力、比体积等都无关。因此,可以选择最简便的途径来建立它 们的计算公式,由此得出的结论可适用于具有相同初态温度 T1 及 终态温度 T2 的任何过程。 ∴ Δu = cVΔT及Δh = cpΔT是计算理想气体热力学能变化和焓变 化的普适公式。
3
例5:试分析多变指数在 1<n<k 范围内的膨胀过程的性质。 解:首先在 p-v 图和 T-s 图上画出四条基本过程线,作为参考线。
从初态 1 开始画线: 1<n<k 的过程线应在定温线和绝热线之间,又为 膨胀过程,∴该过程线在 p-v 图上应在定容线右侧,在T-s 图上应在定温线 右下方,如图中 1- 2 所示。
4
例6:将满足下列要求的理想气体多变过程表示在 p-v 图和 T-s 图上:①气体 进行 n = 0.8 的多变膨胀过程,并指出其过程是吸热还是放热,以及Δu 的正负号; ②气体升温、升压又放热,并指出其多变指数的范围。 解:首先在 p-v 图和 T-s 图上画出四条基本过程线作为参考线。
(1)从初态 1 开始画线:n = 0.8 的过程线应在定压线和定温线之间,又为膨 胀过程,∴该过程线在 p-v 图上应在定容线右侧,在T-s 图上应在定压线右下方, 如图中 1- ① 所示。从图可见,该过程线在绝热线的右方,故为吸热过程,即 q> 0;同理可知ΔT >0, ∴Δu >0。 (2)从初态 1 开始画线:升温只能在 T-s 图的左上和右上;升压只能在 p-v 图的左上和右上;放热只能在 p-v 图和 T-s 图中绝热线的左侧。其交集便是 p-v 图 和 T-s 图的左上,由T-s 图知,该曲线位于定温线和绝热线之间,如两个图中的 1② 所示。 ∴该过程的多变指数的范围为1<n<k。
绝热过程所做的功用a-c线段下面的面积表示;定温过程 所做的功用a-b线段下面的面积表示。
由图可知:膨胀时,定温过程a-b做功较多。
2
例3: ①气体的比定压热容 cp、比定容热容cV、比热力学 能 u、比焓 h 与哪些因素有关?
②由比焓 h 和温度 T 两个状态参数能否确定气体的状态?
答:(1)对于理想气体,cp、cV 只是温度的单值函数; 对于实际气体,cp、cV 不仅是温度的函数,还是压力或比体 积的函数。 同样的,对于理想气体,u 和 h 只是温度的单值函数;对 于实际气体,u 和 h 不仅是温度的函数,也是压力或比体积 的函数。 (2)对于一般气体,需要两个独立的状态参数确定其状 态。因此,对于理想气体,由 h 和 T 不能确定其状态;对于 实际气体,由 h 和 T 可以确定其状态。
(1)如果b、c在同一条绝热线上,
∴
从而
ΔUbc = -Wbc>0
ΔUac>ΔUab
(2)若b、c在同一条定温线上,则ΔUbc = 0
从而
ΔUac = ΔUab
1
例2:理想气体从同一初态膨胀到同一终压,定温膨胀与 绝热膨胀相比,哪个过程做功多? 答:绝热过程线a-c比定温过程线a-b要陡,画出两个过程 的 p-v图。
例1:一定量的理想气体从 a 经历两个任意过程 a→b 和 a→c, 如图所示。①若b、c两点在同一条绝热线上,比较ΔUab与ΔUac的
大小。②若b、c两点在同一条定温线上,结果又如何?
答:∵热力学能是状态参数, ∴ ΔUac = ΔUab + ΔUbc 则b-c为绝热压缩过程, Qbc = 0 由于:Qbc = ΔUbc + Wbc
(2)对于非理想气体,这两个公式只能分别用来计算定容过程
的热力学能变化及定压过程的焓值变化,而对于其他过程,这两 公式都不适用的。
6
过程线在过起点的绝热线右方,这表明是吸热过程,即 q>0;过程线 在定容线的右方,这表明是膨胀过程,即 w>0; 而过程线又在定温线的 下方,表明在过程中气体的温度降低,即Δu<0,Δh<0。 综上所述,这一过程是一个加热的膨胀过程,但膨胀时气体对外所作的 功大于加入的热量,∴气体的热力学能减少而温度降低。
