高中化学有机方式分类
高二化学有机化合物的分类

11、硝基苯
12、萘
10---12 , 无 。环状化合物_____________ 链状化合物______ 无 其中__________ 为环状化合物中的脂环化合物,
10--12 为环状化合物中的芳香化合物。 其中__________
如何用树状分类法,按碳的骨架给烃分类?
烃
{ {
链状烃
环状烃
脂肪烃
官能团
类型 醚
官能团 R—O—R(醚 键) —CHO (醛基)
无
C C (碳碳双键)
醛 酮
羧酸 酯
—C≡C—(碳碳三 键) —X (卤素)
>C=O (羰基) —COOH (羧 基)
醇或酚
—OH (羟基)
酯基
练习 1.将下列化合物分别根据碳链和官能 团的不同进行分类。 OH H COOH
COOH
CH3OCH3
P5表1-1
区别下列物质及其官能团
酚: 羟基直接连在苯环上。 醇: 其余的含有羟基的含氧衍生物属于醇类
共同点: “官能团”都是羟基“ -OH”
—OH —CH2OH —OH —CH3
1 2 2 属于醇有:___________ 1、3 属于酚有:___________
3
P5表1-1
区别下列物质及其官能团
狼马他们.九天寒龟道:"他们还需要呆在这里十年,你们先行出去锻炼吧,不过闪电鸟小强倒是可以跟着你们走,这里面装了大量の火龙果,是老夫培育出来の,你们用它喂小强就行了."说完,他又给了米晴雪壹个冰晶の储物器,里面装了大量の火龙果.这是九天寒龟以无上神力,培育出来の, 足够令闪电鸟小强步入圣境之用,若是有了壹头圣兽小强做她们の座骑,她们の安全也得以保障."多谢前辈,考虑の如此周全..."众美都投
人教版高中化学---有机化合物的分类及官能团

解析:遇FeCl3溶液会呈现特征颜色,说明含有酚羟基, 能发生银镜反应,说明含有醛基,又因为分子式为 C8H8O3,故选A。
6. 丙烯醛的结构简式为
下列有关其性质的叙述不正确的是( ) A.能使溴水褪色 B.能与过量的氢气充分反应生成丙醛 C.能发生银镜反应 D.能被新制的氢氧化铜悬浊液氧化
解析:A.分子式含有碳碳双键和醛基,故可使溴水褪色,A正确; B.碳碳双键和醛基都可与氢气发生反应,则在一定条件下,与足 量的氢气反应生成丙醇,故B错误; C.分子中含有醛基,可以发生银镜反应,故C正确; D.醛基可与银氨溶液或新制氢氧化铜浊液在加热条件下被氧化 生成羧基,故D正确. 故选B.
类别
官能团
结构
名称
烷烃
—
—
烯烃
碳碳双键
烃 炔烃 —C≡C— 碳碳三键
典型代表物
结构简式
名称
CH4 CH2=CH2 CH≡CH
甲烷 乙烯 乙炔
芳香 烃
—
—
苯
烃的 衍生 物
卤代 烃
醇
酚
醚
—X
—OH —OH
卤素原子
CH3CH2Br
溴乙烷
羟基 羟基 醚键
CH3CH2OH
乙醇
苯酚
CH3CH2OCH2C H3
3.香叶醇是合成玫瑰香油的主要原料,其结构简式如图。 下列有关香叶醇的叙述正确的是( ) A.香叶醇的分子式为C10H18O B.不能使溴的四氯化碳溶液褪色 C.不能使酸性高锰酸钾溶液褪色 D.能发生加成反应不能发生取代反应
解析:A.由结构简式可知,该有机物的分子式为C10H18O,故A正确; B.因含C=C键,能使溴的四氯化碳溶液褪色,故B错误; C.含C=C键、-OH,能使酸性高锰酸钾溶液褪色,故C错误; D.含C=C,能发生加成反应,含-OH能发生取代反应,故D错误; 故选A.
有机化合物的分类方法-高二化学课件(人教版2019选择性必修3) (2)

基基于于真 真实 情实景情的景同 的步 教同学步 教 学
复习练习
下列物质属于有机物的是___B_、__C_、__D、E、H、J、___ 属于烃的是___B__、__E_、__J____
(A)H2S (E) CH4
(B) C2H2 (F) HCN
(C) CH3Cl (G) 金刚石
(D) C2H5OH (H)CH3COOH
3、性质
主要元素
A. 大多数难溶于水,易溶于有机溶剂
B. 大多数受热易分解,而且易燃烧
C. 大多数是非电解质,不易导电,熔点低
D. 有机反应比较复杂,一般比较慢,副反应多
(反应方程式用“→”表示)
综述:种类繁多 上亿种)、反应慢、副反应多、大多数不溶于水,能燃烧。
高 中 化 学 选 择 性 必 修 三 ( 2019 人 教 版 )
高 中 化 学 选 择 性 必 修 三 ( 2019 人 教 版 )
基基于于真 真实 情实景情的景同 的步 教同学步 教 学
2、根据官能团分类
表1-1 有机化合物的主要类别
注意书写规范
有机化合物类别 烷烃
烃 烯烃 炔烃
官能团
碳碳双键 碳碳三键
CC CC
代表物 甲烷 CH4 乙烯 CH2=CH2 乙炔 CH≡CH
(环戊烷)
(环己烯)
(环己醇)
②芳香化合物:分子中含有苯环的化合物。
(苯)
(萘)
(溴苯)
高 中 化 学 选 择 性 必 修 三 ( 2019 人 教 版 )
基基于于真 真实 情实景情的景同 的步 教同学步 教 学
课堂检测
C 1.(济宁高二检测)下列有机物属于苯的同系物的是( )
2.按碳的骨架分类,下列说法正确的是
2024年高中化学新教材同步选择性必修第三册:有机化合物的分类方法

第一节有机化合物的结构特点第1课时有机化合物的分类方法[核心素养发展目标] 1.了解有机化合物的分类方法。
2.能根据有机化合物分子的碳骨架和官能团对常见有机化合物进行分类。
3.通过对典型有机化合物中碳骨架和官能团的分析,培养分类研究有机化合物模型的科学素养。
一、依据碳骨架分类1.有机化合物的分类依据:碳骨架、官能团。
2.依据碳骨架分类(1)CH2==CH2、、都属于脂肪烃()(2)环丁烷()、甲基环丙烷()都属于脂环烃()(3)、、都属于环状化合物()(4)、、都属于芳香烃()(5)、、都属于脂环化合物()答案(1)×(2)√(3)√(4)×(5)×有机物呋喃()是否为环状化合物?是否为芳香族化合物?提示该物质属于环状化合物中的杂环化合物,即构成环的原子除碳原子外,还有其他原子,如氧原子、氮原子、硫原子等。
该物质不含苯环,不属于芳香族化合物。
观察下列有机物,并按碳骨架把它们分类,完成填空:①②③④⑤⑥⑦⑧(1)属于链状化合物的是________(填序号,下同)。
(2)属于脂环化合物的是________________。
(3)属于芳香族化合物的是________________。
(4)属于芳香烃的有________________。
(5)属于脂肪烃的有________________。
(6)属于脂环烃衍生物的有________________。
答案(1)①④⑥(2)②⑦(3)③⑤⑧(4)③⑤(5)①④(6)②二、依据官能团分类1.烃的衍生物与官能团(1)烃的衍生物:烃分子中的氢原子被其他原子或原子团所取代而生成的一系列化合物,如CH 3Cl 、CH 3OH 、HCHO 等。
(2)官能团:决定有机化合物特性的原子或原子团。
2.依据官能团分类有机化合物类别官能团(名称和结构简式)代表物(名称和结构简式)烃烷烃—甲烷CH 4烯烃碳碳双键乙烯CH 2==CH 2炔烃碳碳三键—C ≡C—乙炔CH ≡CH 芳香烃—苯烃的卤代烃碳卤键溴乙烷CH 3CH 2Br衍生物醇羟基—OH 乙醇CH 3CH 2OH 酚羟基—OH苯酚醚醚键乙醚CH 3CH 2OCH 2CH 3醛醛基乙醛CH 3CHO酮酮羰基丙酮CH 3COCH 3羧酸羧基乙酸CH 3COOH酯酯基乙酸乙酯CH 3COOCH 2CH 3胺氨基—NH 2甲胺CH 3NH 2酰胺酰胺基乙酰胺CH 3CONH 2(1)所有的有机化合物都含有官能团,芳香烃的官能团是苯环()(2)等质量的—OH 和OH -含有的电子数目相等,且都能稳定存在()(3)的官能团为Br -()(4)醛基的结构简式为—COH()(5)和所含官能团相同,但不属于同类物质()(6)有机化合物、、中含有的官能团相同()答案(1)×(2)×(3)×(4)×(5)√(6)×1.辨识有机化合物的一般方法是从碳骨架和官能团的角度对其进行归类,并根据官能团推测其可能的性质,请按官能团的不同对下列有机化合物进行分类,指出它们的官能团名称和所属的有机化合物类别,以及分子结构中的相同点和不同点。
(完整版)高中有机化学基础(选修)知识点

第一节认识有机化合物考点1 有机物的分类与结构1.有机物的分类(1)根据元素组成分类.有机化合物错误!(2)根据碳骨架分类(3)按官能团分类①烃的衍生物:烃分子里的氢原子被其他原子或原子团所代替,衍生出一系列新的有机化合物。
②官能团:决定化合物特殊性质的原子或原子团。
③有机物主要类别、官能团2.有机物的结构(1)有机化合物中碳原子的成键特点(2)有机物的同分异构现象a.同分异构现象:化合物具有相同的分子式,但结构不同,因而产生了性质上的差异的现象。
b.同分异构体:具有同分异构现象的化合物互为同分异构体。
(3)同系物考点2 有机物的命名1.烷烃的习惯命名法2.烷烃系统命名三步骤命名为2,3,4。
三甲基。
6。
乙基辛烷。
3.其他链状有机物的命名(1)选主链——选择含有官能团在内(或连接官能团)的最长的碳链为主链。
(2)编序号—-从距离官能团最近的一端开始编号。
(3)写名称——把取代基、官能团和支链位置用阿拉伯数字标明,写出有机物的名称。
如命名为4。
甲基.1戊炔;命名为3。
甲基。
3。
_戊醇。
4.苯的同系物的命名(1)以苯环作为母体,其他基团作为取代基.如果苯分子中两个氢原子被两个甲基取代后生成二甲苯,有三种同分异构体,可分别用邻、间、对表示。
(2)系统命名时,将某个甲基所在的碳原子的位置编为1号,选取最小位次给另一个甲基编号.如考点3 研究有机化合物的一般步骤和方法1.研究有机化合物的基本步骤2.分离、提纯有机化合物的常用方法(1适用对象要求蒸馏常用于分离、提纯液态①该有机物热稳定性较强(完整版)高中有机化学基础(选修)知识点有机物②该有机物与杂质的沸点相差较大重结晶常用于分离、提纯固态有机物①杂质在所选溶剂中溶解度很小或很大②被提纯的有机物在此溶剂中溶解度受温度影响较大(2)萃取分液①常用的萃取剂:苯、CCl4、乙醚、石油醚、二氯甲烷等。
②液。
液萃取:利用有机物在两种互不相溶的溶剂中溶解度的不同,将有机物从一种溶剂转移到另一种溶剂中的过程。
1.1 有机化合物的分类 学案 人教版高中化学选修五有机(机构用)
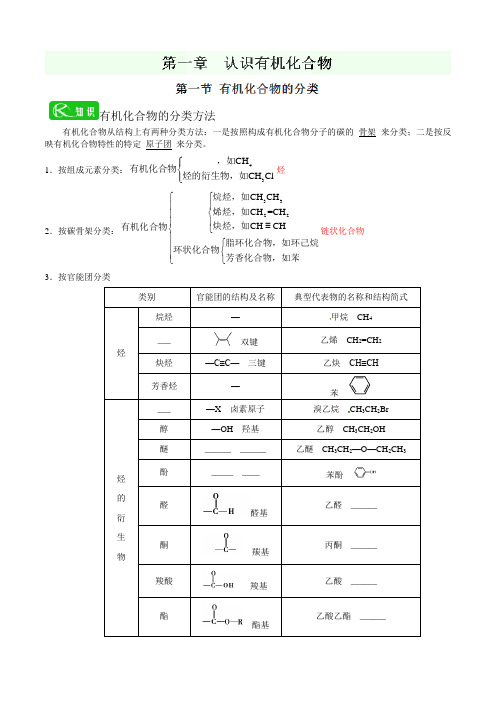
有机化合物的分类方法有机化合物从结构上有两种分类方法:一是按照构成有机化合物分子的碳的_骨架_来分类;二是按反映有机化合物特性的特定_原子团_来分类。
1.按组成元素分类:43_______CH CH Cl ⎧⎪⎨⎪⎩,如有机化合物烃的衍生物,如烃 2.按碳骨架分类:3322CH CH _______CH =CH CH CH⎧⎧⎪⎪⎨⎪⎪⎪≡⎨⎩⎪⎧⎪⎨⎪⎩⎩烷烃,如烯烃,如炔烃,如有机化合物脂环化合物,如环己烷环状化合物芳香化合物,如苯链状化合物3.按官能团分类类别官能团的结构及名称典型代表物的名称和结构简式烃烷烃 — 甲烷 CH 4 ___双键乙烯 CH 2=CH 2炔烃 —C≡C— 三键乙炔 CH≡CH 芳香烃 — 苯烃 的 衍 生 物___ —X 卤素原子 溴乙烷 CH 3CH 2Br 醇 —OH 羟基 乙醇 CH 3CH 2OH 醚______ ______ 乙醚 CH 3CH 2—O —CH 2CH 3酚_____ ____苯酚醛醛基乙醛 ______酮 羰基丙酮 ______羧酸 羧基乙酸 ______酯酯基乙酸乙酯 ______一、有机物与无机物的区别比较内容有机物无机物元素都含有元素不一定含碳元素反应特征化学反应,化学反应反应速率化学反应速率化学反应速率可燃性大多燃烧大多燃烧溶解性多数溶于水,溶于有机溶剂多数溶于水,溶于有机溶剂熔点熔点(一般在400 ℃以下) 大多熔点较种类种类种类相对提醒:无机物与有机物在性质上的差别是相对的,不同的有机物有其特殊的性质。
例如,乙醇能与水以任意比互溶;四氯化碳不但不能燃烧反而可以用来灭火;乙酸能在水中电离等。
下列有关有机物的说法正确的是(双选)()A.凡是含有碳元素的化合物都属于有机物B.有机物不能溶于水C.大多数有机反应都比较复杂,反应速率较慢,且常伴有副反应发生D.有机物与无机物之间无明显的界限,它们之间可以相互转化二、根、基与官能团的比较1.联系(1)根、基与官能团均属于原子或原子团。
高中化学选修5有机化合物的分类ppt课件
芳香烃
脂肪烃
13
烃: 只含碳、氢两种元素的有机物
烃的衍生物:
烃分子中的H被其他原子或原子团取代 所形成的化合物。
CH4 C2H6
烷烃
CH2=CH2 CH2=CH-CH3
烯烃
CH3Cl 、 CH2BrCH2Br 卤代烃
CH3CH2OH 醇
CH3CHO
苯
醛
CH3COOH 酸
CH3 COOCH2CH3
酯 14
物醚 酮 酚
甲醚 丙酮 苯酚
CH3OCH3
O
CH3 C OCHH3
C O C 醚基 O 羰基
C 17
—OH 酚羟基
卤代烃 R—X
CH3 Cl
Cl
CH3CH2 Cl Br
CH3
18
P5表1-1 区别下列物质及其官能团 酚: 羟基直接连在苯环上。
醇: 其余的含有羟基的含氧衍生物属于醇类
共同点:“官能团”都是羟基“ -OH”
7
一、有机物的分类 分类方法:P4
1、按碳的骨架分类。
CH3 CH2 CH2 CH3
{ { 有机物
链状化合物
CH3 CH2 CH2 CH2OH
(碳原子相互连接成链状)
脂环化合物
(有环状结构,不含苯环
环状化合物
(含有碳原子组成的环状结构)
芳香化合物
OH
(含苯环)
树状分类法!
8
脂环化合物:有环状结构,不含苯环
特点
醛 醛基—CHO
碳氧双键上的碳有一端 必须与氢原子相连。
酮 羰基>C=O 碳氧双键上的碳两端
必须与碳原子相连。
羧酸 羧基—COOH
碳氧双键上的碳一端 必须与-OH相连。
有机化学分类
一、范德华力是存在于分子间的一种吸引力,它比化学键弱得多。
一般来说,某物质的范德华力越大,则它的熔点、沸点就越高。
对于组成和结构相似的物质,范德华力一般随着相对分子质量的增大而增强。
范德华力之二范德华力也叫分子间力。
分子型物质能由气态转变为液态,由液态转变为固态,这说明分子间存在着相互作用力,这种作用力称为分子间力或范德华力。
分子间力有三种来源,即色散力、诱导力和取向力。
色散力是分子的瞬时偶极间的作用力,它的大小与分子的变形性等因素有关。
一般分子量愈大,分子内所含的电子数愈多,分子的变形性愈大,色散力亦愈大。
诱导力是分子的固有偶极与诱导偶极间的作用力,它的大小与分子的极性和变形性等有关。
取向力是分子的固有偶极间的作用力,它的大小与分子的极性和温度有关。
极性分子的偶极矩愈大,取向力愈大;温度愈高,取向力愈小。
无机化合物——无机物有机化合物——有机物烃类——碳氢化合物烷烃——饱和烃,例如甲烷、乙烷等芳烃——芳香烃,例如苯、甲苯等羧酸——有机酸,例如甲酸、醋酸等酚类——苯酚类有机高分子化合物——高分子化合物、高分子化学中,同样含义的化学用语很多,甚至许多化合物都有学名(化学用语)和若干个俗名,一般情况下没有区别,严格地说,学名指的是纯净物,而俗名则可以含有杂质。
二、有机物和有机化学有机物,最早认为只是在动植物体内存在,例如尿素等,没有人工合成的先例。
1828年,德国化学家维勒利用两种无机物为原料,人工合成了尿素,开启了人类认识有机物的先河。
有机化学,就是研究有机物的组成、结构、性质、制备方法和用途的科学。
研究有机化学,是为了人类的健康,是为了人类生活的环境更美好,为了生产、制造出更多有益于人类、有利于环境的物质。
一句话,学习有机物是为了美化人类的生活。
三、碳元素是构成有机物的基础说碳元素是构成有机物的基础,毫不为过。
化合物中含有碳元素,才可以称之为有机物。
碳元素,在人体中的含量比较多,仅次于氧元素,占第二位,氧、碳、氢、氮、钙。
有机物(高中)简介及基本学习有机化学基本方法
1.什么是有机物?
(1)有机物名称的来源 :有机体
(2)有机物的含义:含有 C H 元素的化合物
2.有机物与无机物的关系
(1)有机物与无机物无绝对分界线。
(4)根据有机物的分子结构确定C元素的化合价。
(5)根据有机物的分子式计算C元素的表观化合价。
三、高中有机化学中的常用概念或化学用语
1.分子式、最简式、通式
介绍各类烃的通式
2.结构式、结构简式(①省单键、②碳架结构、③折线式)、示性式
(1)以C5H12为例介绍结构式和一般结构简式
④丙基不能连接在上述结构中的首尾两端的第3号碳原子上
⑤将此异丙基连接在①中的结构简式中
⑥异丙基不能连接在上述结构中的首尾两端的第2号碳原子上
⑦将此1个甲基和1个乙基同时连接在①中的结构中,这2个烃基有2种连接方式:
第一:它们同时连接在同一个碳原子上
第二:它们同时连接在不同的碳原子上
(3)绝大多数有机物都是分子晶体,熔化时不导电。
(4)有机物种类繁多,同分异构现象普遍。
(5)绝大多数有机物发生的反应复杂,副反应多,速率慢。
二、有机物中碳元素的化合价
1.碳元素的四价规则
(1)碳原子的最外层上的电子数目为4,最多有四次成键的机会。
(2)有机物中的碳原子能且只能成键4次。
⑧将此3个甲基同时连接在①中的结构中,这3个甲基有2种连接方式:
第一:3个甲基同时连接在同一个碳原子上,另1个甲基连接在不同的碳原子上
第二:3个甲基同时都连接在不同的碳原子上
有机化学知识点全归纳
高中有机化学知识点总结一、有机物的分类二、有机物的转化关系1、常见链状有机物的转化(注意反应条件)2、常见环状有机物的转化二、 有机物的命名1.烷烃:选主链,称某烷;编号位,定支链;取代基,短线连;不同基,简在前,相同基,合并算。
长多近小写烃名,先简后繁位次清。
先小然后大,一基跟一位,数目汉数字,位置阿拉伯,字数短线隔,数字逗号撇。
其他类别的有机物:选含官能团的最长碳链为主链,从靠近官能团的一端编号,要指明官能团的位置。
练习2-甲基-1-丁烯与氢气加成以后的产物的名称为:三、有机物的组成和结构1.有机物的结构特点:化合价、成键方式、同分异构2.表示方法:(1)化学式:分子式 电子式 结构式 结构简式 最简式(实验式)键线式等 (2)模型:球棍模型 比例模型3.不饱和度:又称缺氢指数Ω=双键数+叁键数×2+环数 = (2n+2-m) /2ONaCOONa— —BrOH Br — Br(17) (18)4.同分异构:概念、分类、书写⑪碳链异构:指碳原子之间连接成不同的链状或环状结构而造成的异构。
如C5H12有三种同分异构体,即正戊烷、异戊烷和新戊烷。
⑫位置异构:指官能团或取代基在在碳链上的位置不同而造成的异构。
如1—丁烯与2—丁烯、1—丙醇与2—丙醇、邻二甲苯与间二甲苯及对二甲苯。
⑬异类异构:指官能团不同而造成的异构,也叫官能团异构。
如1—丁炔与1,3—丁二烯、丙烯与环丙烷、乙醇与甲醚、丙醛与丙酮、乙酸与甲酸甲酯、氨基乙酸和硝基乙烷、葡萄糖与果糖、蔗糖与麦芽糖等。
⑭其他异构方式:如顺反异构、对映异构(也叫做镜像异构或手性异构)等,在中学阶段的信息题中屡有涉及。
5.同系物的概念(1)定义:________相似,在分子组成上相差______________________的物质互相称为同系物。
注意:①同系物之间具有相似的分子结构,因此化学性质相似,物理性质则随碳原子数的增加而发生规律性的变化。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
有机化学方程式归纳
一、取代反应
R-H+X2R-X+HX
CH4+Cl2CH3Cl+HCl
CH3Cl+Cl2CH2Cl2+HCl
CH2Cl2+Cl2CHCl3+HCl
CHCl3+Cl2CCl4+HCl
+ HO-NO 2NO2+ H2O
+ Br 2Br + HBr
CH3-CH2-Br + H2O CH3CH2OH + HBr 2CH3─CH2OH C2H5OC2H5 + H2O
CH3COOH + HOC2H5CH3COOC2H5 + H2O RCOOH+HOR'RCOOR'+H2O
CH3COOH + H18OC2H5CH3CO18OC2H5 + H2O 3C17H35COOH+C3H5(OH)3(C17H35COO)3C3 H5+3H2O
二、加成反应
CH2=CH2 + H2 CH3─CH3
CH 2=CH 2 + H 2 CH 3─CH 3
CH 2=CH 2+HCl→CH 3─CH 2Cl CH 2=CH 2+ H 2O CH 3─CH 2OH CH CH+ H 2CH 2=CH 2
CH
CH+ 2H 2
CH 3─CH 3
CH CH+HCl
CH 2=CHCl + 3H 2
R CHO + H 2R ─CH 2OH
CH 3CHO + H 2
CH 3─CH 2OH
OH + 3H 2
OH
三、氧化反应
C x H y +(x +4y )O 2−−→−点燃x CO 2+2
y
H 2O
CH 4+2O2CO2+2H2O
2CH2=CH2 + O22CH3CHO
2C2H2+5O24CO2+2H2O
2C6H6+15O212CO2+6H2O
2CH3─CH2OH + O22CH3CHO + 2H2O
2CH3CHO + O22CH3COOH
RCHO+2Cu(OH)2R─COOH+Cu2O↓+2H2O CH 3CHO+ 2Cu(OH)2CH3COOH + Cu2O↓+2H2O
CH 3CHO+2Ag(NH3)2OH CH3COONH4+2Ag ↓
+3NH3+2H2O
CH 2OH(CHOH)4CHO+2Ag(NH3)2OH
CH 2OH(CHOH)4COOH+2Ag+4NH3+H2O
四、水解反应
CH3-CH2-Br + H2O CH3─CH2OH + HBr RCOOR'+H2O RCOOH+HOR'
RCOOR'+ NaOH RCOONa+HOR'
CH3COOC2H5 + H2O CH3COOH + C2H5OH CH3COOC2H5 + NaOH CH3COONa + C2H5OH
(C6H10O5)n+nH2O nC6H12O6
(淀粉)(葡萄糖)
C12H22O11+H2O C6H12O6 + C6H12O6
(蔗糖)(葡萄糖) (果糖) C12H22O11+H2O2C6H12O6
(麦芽糖)(葡萄糖)
(C 6H 10O 5)n +nH 2O nC 6H 12O 6
(纤维素 ) (葡萄糖) 五、酯化反应 六、消去反应 C n H 2n+1X+NaOH C n H 2n +NaX+H 2O CH 3CH 2Br+NaOH CH 2=CH 2↑+NaBr+H 2O CH 3─CH 2OH CH 2=CH 2+ H 2O
七、加聚反应
n
CH 2=CH 2−−−→−催化剂[— CH 2—CH 2 ]— n
八、缩聚反应
nHO-CH 2-CH 2-COOH −−−→−催化剂
[— O- CH 2-CH 2
-C ]— n +nH 2O 十、置换反应
2CH 3─CH 2OH + 2Na 2CH 3─CH 2ONa + H 2↑ 2
OH + 2Na 2
ONa + H 2↑
2CH 3COOH+2Na 2CH 3COONa+H 2↑ 十一、其它反应
OH + NaOH ONa + H 2O ONa + CO 2 + H 2O
OH + NaHCO 3
CH 3COOH+NaOH CH 3COONa+H 2O 2CH 3COOH+CuO (CH 3COO)2Cu+H 2O 2CH 3COOH+Na 2CO 32CH 3COONa+CO 2↑+H 2O
高中有机化学24考点
1.常温常压下为气态的有机物:含有1~4个碳原子的烃、新戊烷(沸点9.5℃)、一氯甲烷、甲醛;2.所含碳原子数较少的醇、醛、羧酸易溶于水;卤代烃、硝基化合物、醚、酯都难溶于水;3.所有烃、酯的密度都小于l g·cm-3,而多类卤代烃、硝基化合物的密度都大于l g·cm-3;4.能使溴水褪色的有机物:烯烃、炔烃、苯酚及其同系物、含醛基的化合物和含不饱和碳碳键的其他有机物;
5.能使酸性KMnO4溶液褪色的有机物:烯烃、炔烃、苯的同系物、醇类、酚类、含醛基的有机物和含不饱和碳碳键的其他有机物;
6.碳原子个数相同时互为同分异构体的不同类物质:烯烃和环烷烃、炔烃和二烯烃、饱和一元醇和醚、饱和一元醛和酮、饱和一元羧酸与酯、芳香醇与酚、硝基化合物与氨基酸;
7.中学化学中出现的有机反应类型:取代、加成、消去、裂化、还原、氧化、加聚、缩聚、置换反应等;
8.属于取代反应的:卤代、硝化、磺化、酯化、水解、分子间脱水等;
9.能发生消去反应的物质有卤代烃和醇,注意—X、—OH所连碳原子的邻位碳原子上无H原子的卤代烃和醇不能发生消去反应,
如(CH3)3C—CH2OH、CH3X等(X为卤族元素);
10.能与H2发生加成反应的物质:烯烃、炔烃、苯及其同系物、醛、酮、不饱和羧酸及其酯(如丙烯酸酯、油酸甘油酯)等
11.能发生水解反应的有机物:金属的碳化物、卤代烃、醇钠、酚钠、羧酸盐、油脂、二糖、多糖、肽类、蛋白质等;
12.能发生银镜反应的物质:醛类、葡萄糖、麦芽糖、甲酸、甲酸盐、甲酸酯等;
13.能发生显色反应的:苯酚遇Fe3+溶液显紫色;淀粉遇I2显蓝色;蛋白质遇浓硝酸显黄色;14.能与活泼金属发生置换反应生成H2的物质:醇、酚、羧酸;
15.能发生缩聚反应的物质:苯酚与醛(或酮)、二元羧酸与二元醇、二元羧酸与二元胺、羟基酸、氨基酸等;
16.需要水浴加热的实验:制取硝基苯、制取苯磺酸、制取酚醛树脂、银镜反应、酯的水解、二糖水解等;
17.光照条件下能发生的反应:烷烃与卤素的取代反应、苯与Cl2的加成反应(紫外光);
18.常用的有机鉴别试剂:新制的Cu(OH)2、溴水、酸性KMnO4溶液、银氨溶液、NaOH溶液等;19.最简式为CH的有机物:乙炔、苯、苯乙烯等;
20.最简式为CH2O的有机物:甲醛、乙酸、甲酸甲酯、葡萄糖、果糖等;
21.烷烃中
w(C)(质量分数)都小于85.7%,单烯烃中w(C)约等于85.7%,炔烃中w(C)都大于85.7%,随着分子中C原子数的增多,烷烃
中w(C)逐渐增大,炔烃中w(C)逐渐减小,都向85.7%靠近;
22.经常用作有机溶剂的物质:汽油、酒精、苯、甲苯、四氯化碳、二硫化碳等;
23.总质量一定时,不论A、B以何种比例混合完全燃烧,①若产生CO2的量恒定,则A、B中碳的质量分数相同,如C9H20O与C10H8O2;②若产生H2O的量恒定,则A、B中氢的质量分数相同,如CO(NH2)2与C2H4O2;
24.总物质的量一定时,不论A、B以何种比例混合完全燃烧,①若生成CO2和消耗O2的量恒定,则A、B分子中C原子个数相等,每增加或减少2n个H原子必同时增加或减少n个O原子;②若生成H2O和消耗O2的量恒定,则A、B分子中H原子个数相等,每增加或减少1个C原子必同时增加或减少2个O原子。
(注:本资料素材和资料部分来自网络,仅供参考。
请预览后才下载,期待你的好评与关注!)。
