第六章 精馏2
化工原理下册——精馏-讲
2 汽液相平衡关系式
蒸馏分离的物系由加热至沸腾的液相和产生的蒸汽相构 成。相平衡关系是蒸馏过程分析的重要基础。 1)用饱和蒸气压表示气液平衡关系
液相为理想溶液,遵循拉乌尔定律: 在某一温度下,稀溶液的蒸气压等于纯溶剂的蒸气压乘以溶剂的摩尔分数。
手册中查
气相为理想气体,遵循道尔顿分压定律: 某一气体在气体混合物中产生的分压等于在相同温度下它单独占有整个容器时 所产生的压力;而气体混合物的总压强等于各气体分压之和。
由此可知,简单蒸馏,即将液体混合物进行一次部分气化(单 级)的过程,只能起到部分分离的作用,只适用于要求粗分或初步 加工的场合。而要使混合物中的组分得到高纯度(几乎完全)的 分离,只有进行精馏。
1.4.2 多次部分气化和部分冷凝
1. 过程分析
如果将图1所示的蒸馏单级分离加以组合 , 变成如图3所示的多级分离流程(以3级为例 ). 若将第1级溶液部分气化所得气相产品在 冷凝器中加以冷凝, 然后再将冷凝液在第2级 中部分气化, 此时所得气相组成为y2,y2>y1, 这种部分气化的次数(级数)愈多, 所得到的 蒸汽浓度也愈高, 最后几乎可得到纯态的易挥 发组分. 同理, 若将从各分离器所得到的液相 产品分别进行多次部分气化和分离, 那么这种 级数愈多, 得到的液相浓度也愈低, 最后可得 到几乎纯态的难挥发组分.
图3 多次部分气化的分离示意图
上述的气-液相浓度变化情况可以从图中清晰地看到.因此,同时多 次地进行部分气化是使混合物得以完全分离地必要条件.
不难看出, 图6-3所示的流程在工业上是不能采用的, 因其存在以 下两个问题:
(1)分离过程得到许多中间馏分, 如图中的组成为x1.x2 等液相产品,因此 最后纯产品的收率就很低;
图6所示的为精馏塔的模型,目前工业上 使用的精馏塔是它的体现。塔中各级的易挥发 组分浓度由上至下逐级降低,而温度逐步增高。 当某级的浓度与原料液的浓度相同或相近时, 原料液就由此级进入。
第六章 精馏

FxF W xW D y D F W D
W F xF 即: y D F W xW F W
相平衡关系:
xW yD 1 ( 1) xW
例:将轻组分摩尔分率为0.38的某二元混合物150kmol作简 单蒸馏或平衡蒸馏.已知体系的相对挥发度为3,试求:
2、具有负偏差的非理想溶液 产生负偏差的原因: 不同分子间的吸引力aAB大于相同分子间的吸引力aAA和aBB。 当负偏差达到一定程度时,也会出现“共沸”现象,就 会出现最低蒸气压和相应的最高恒沸点 如:硝酸水溶液在P=1atm下,当x=0.383时,点M为最高 恒沸点121.9℃
四、相对挥发度 1、挥发度 挥发度是指体系达到平衡时,某一组分A在气相中的分压pA 与该组分在相应条件下液相中的浓度xA(摩尔分率)之比。 A-B混合液 A的挥发度:υA = pA/xA B的挥发度:υB = pB/xB 2、相对挥发度 溶液中易挥发组分的挥发度与难挥发组分的挥发度之比 称为相对挥发度
1)、如残液中轻组分摩尔分率为0.28,简单蒸馏所得馏出 液的量和平均组成;
2)、若改为平衡蒸馏,液相的平均浓度为0.28,求所得气 相产品的量和组成。
第四节 双组分连续精馏
一、精馏装置 组成:精馏塔、冷凝 器、再沸器 精馏:
1、精馏段(加料板 以上部分)
2、提馏段(加料板 及以下部分) 3、回流
蒸馏的分类:
1、按照被蒸馏的混合物组分数分为: 二元蒸馏和多元蒸馏 2、按照操作过程是否连续可分为: 间歇蒸馏和连续蒸馏 3、按操作压力可分为:
常压蒸馏、加压蒸馏和减压蒸馏
4、按照操作方式分: 简单蒸馏、平衡蒸馏、精馏和特殊精馏(恒沸精馏、萃取精馏)
第二节 双组分的气液相平衡
精馏优秀课件

1. 连续精馏操作流程
2. 间歇精馏操作流程
26
3. 精馏塔旳操作情况
tn-1
塔板上: yn+1<xn-1, tn+1>tn-1 两者互不平衡
即:存在温度差和浓度差
tn+1
成果:传质和传热
yn >xn
理论(理想)板
若: ① 气液两相接触时间足够长
② 板上混合足够均匀
即:
则:离开第n块板时旳汽-液二相 构成构成平衡关系
3. 塔釜产品屡次部分汽化
t1
t1
t1’
t1'
t2’
t
' 2
操作流程
操作在相图上旳反应
成果:对初级混合液部分汽化后得到旳液相在塔底经屡次部分汽化 20 最终可得液相浓度为x2`(较低)旳塔底产品构成。
4. 过程进行旳必要条件及存在问题讨论 ① 由2、3可知:欲使混合液得到有效分离,必须同步分别对 塔顶汽相和塔釜液相进行屡次部分泠凝和屡次部分汽化。
双组分 —— 要点讨论 多组分 —— 简要简介
蒸馏操作实例:石油炼制中使用旳 250 万吨常减压装置幻灯片 5 5
§6.1 双组分溶液旳汽-液相平衡
汽液相平衡是分析精馏原理和进行设备计算旳理论基础,过程 以两相到达平衡为极限。
§6.1.1 溶液旳蒸汽压和拉乌尔定律(Raoult’s law)
一. 纯组分饱和蒸汽压 在密闭容器内,在一定温度下,纯组分液体旳汽液两相到达平 衡状态,称为饱和状态,其蒸汽为饱和蒸汽,其压力为饱和蒸 汽压。
16
泡点线
0
xA xf
yA 1.0
x(y)
§ 6.3.2 精馏原理和流程
精馏流程(熟悉有关旳概念)
化学工程基础:第六章 精馏

式中 qn,F——原料液流量,kmol/h; qn,D——馏出液流量,kmol/h; qn,W——塔底产物流量,kmol/h; xF——原料液中易挥发组分的摩尔分率; xD——馏出液中易挥发组分的摩尔分率; xW——釜残液中易挥发组分的摩尔分率;
➢纯液体的挥发度是指该液体在一定温度下的饱和蒸气压。 ➢溶液中各组分的挥发度定义为该组分在蒸气中的分压
和与之相平衡的液相中的摩尔分率之比,即
vA=pA/xA vB=pB/xB ➢相对挥发度定义为溶液中易挥发组分的挥发度与难挥
发组分挥发度之比。
A pA xA B pB xB
vA pA xA
易挥发组分由液相转移到气相,结果
xn<xn-1,yn>yn+1。
yn-1
xn-1
yn
xn yn+1
xn+1
塔内气液的流动
yn-1 假设蒸汽和液体充分接触,并
在离开第n层板时达到相平衡,
即yn与xn平衡,这说明塔板主 xn-1
yn
要起到了传质作用。
➢理论塔板 : 若yn和xn满
足气液平衡方程,此种塔板
溶液上方的蒸汽总压为
P pA pB pA0xA pB0 (1 xA )
xA
P pB0 pA0 pB0
(a)
当总压P不高时,平衡的气相可视为理想气体,服从道 尔顿分压定律,即
pA Py A
yA
pA0 P
xA
(b)
式(a)和(b)为两组分理想物系的气液平衡关系式。
6.2.2 相对挥发度及气液平衡方程
组
➢平衡线离对角线越远,表
第六章 精馏

6.4.1 计算的前提
为了计算简化,假设进料中各组分的摩尔气化热
相等,同时定如下:
引入塔中的进料预热至泡点,温度与进料板温度接近; 塔身绝热,没有热损失 各层塔板上气化和冷凝的物质的量相等 回流采用全凝操作,回流组成与产品组成相同; 精馏段各层的回流量都相等; 提馏段各层的回流量都相等; 提馏段回流量等于精馏段回流量与进液量之和。
求全回流下的最小理论塔板数 求出最小回流比,确定实际回流比 由以上两结果求得理论板数
全回流下的最小理论板数:
相对挥发度定义式6-3: yA/yB=αxA/xB 对第1块板:yA1/yB1=α yA2/ /xB1 对第2块板:yA2/yB2=αxA2/xB2 同时,全回流操作相当于操作线为对角线y=x, 则yA2=xA1;yB2=xB1 故, yA1/yB1=α2xA2/xB2 类推得到 yA1/yB1=αNxAN/xBN
6-2.1 平衡蒸馏的计算
过程描述:
将原料加热到超过进料的泡点,当此 气液混合相进入闪蒸塔的瞬间,蒸汽 和残液处于平衡。从而达到分离目的。
特点:
在较低温度下得到较高的馏出率 多用在高温易分解的物质的蒸馏
气化率和液化率
f=V/F q=W/F=1-f 平衡蒸馏的计算 xD=(f-1)xw/f+xf/f 或 xD=qxw/(q-1)-xf/(q-1)
图解求算的原理
第1块板上:y1和x1满足平衡方程, 即点( y1,x1)在平衡线上; 第2块板上升的蒸气y2与第一块板 下降的回流液满足操作线方程, 即点( y2,x2)在操作线上。 则从y1 到y2需要一块理论板。 依此类推。
精馏2

若将上述精馏段物料 衡算方程式标绘在y-x坐标 图 上 , 是 一 条 过 点 ( x D, xD),斜率为R/(R+1),截 距 为 xD/(R+1) 的 直 线 。 故 称精馏段物料衡算方程为 精馏段操作线方程。
练 习 题 目
思考题 1. 精馏原理是什么,精馏与简单蒸馏有何不同? 2. 塔顶液体回流和塔底上升蒸汽流的作用如何? 3 . 为什么说理论板是一种假定,理论板的引入 在精馏计算中有何重要意义? 4. 恒摩尔流假定的内容如何? 5. 操作线表示何种关系,它是如何获得的? 作业题: 5
二、全塔物料衡算
精馏塔各 股物料(包括进 料、塔顶产品 和塔底产品)的 流量、组成之 间的关系可通 过全塔物料衡 算来确定。
馏出液 原料液
qn,V
qn,V
qn, L
qn,L
釜残液
精馏塔的物料衡算
二、全塔物料衡算
总物料衡算
F D W
易挥发组分衡算
馏出液采出率 易挥发组分回收率 难挥发组分回收率
一、理论板的概念
理论板的概念
离开该板的气液两相互成平衡;温度,组成 塔板上各处的液相组成均匀一致。
理论板提出的意义 用作衡量实际板分离效率的依据和标准。通 常,在工程设计中,先求得理论板层数,再用塔 板效率予以校正,即可求得实际塔板层数。
二、恒摩尔流的假定
1.恒摩尔气流 精馏段
精馏段中上升 气体摩尔流量
总物料衡算
dL dD
易挥发组分衡算
Lx ( L dL )( x dx ) ydD
联立以上两式,并略去二阶无穷小量得
dL dx L yx
三、简单蒸馏过程的计算
设 初始时,釜液量为F, 组成为xF 。 结束时,釜液量为W,组成为xW。 积分
化学工程基础第6章精馏-2详解

• 显然,R越大,所需理论塔板数越少。当R增到 无穷大时,其实质上是馏出液量为零,即上升 蒸汽在冷凝器中冷凝后全部回流,故称为全回 流,这是增大回流比的极限。因此,此时分离 所需的理论塔板数为最小理论塔板数。
一块实际板汽变 相化 浓度 一块理论板汽变 相化 浓度
yn* ——与 xn成平衡的气相组成。
• (2)液相莫弗里板效率(EML)
EMLxxnn11
xn xn*
一块实际板液变 相化 浓度的 一块理论板液变 相化 浓度的
xn* ——与 yn成平衡的液相组成。
2.总板效率
ETN NT
NNT ET
式中 ET称 :为全塔 N为 效实 率际 ;塔 NT为 板理 数论 ;板
• 5. xd (xw)与qn,w qn,D的关系
lnqn,F xf dxw
qn,W xw xd xw
§6多组成精馏和其他精馏方法简介
• 6-1多组分简单精馏
• 如何由简单蒸馏发展为大型精馏塔?为什 么塔顶要引入回流?为什么必须在塔中部 加料?这是进行精馏计算之前必须解决的 问题。
• 多组分精馏的原理
➢ 由此可以求出理论塔板数。 ➢ 这种方法计算的结果较准确。
4-2 图解法
通常采用直角梯级图解法。其实质仍然是以平 衡关系与操作关系为依据,将两者绘在x-y图上 ,便可图解得出达到指定分离任务所需的理论 塔板数及加料板位置。
图解步骤如下: ➢ ①作平衡线(x-y)与对角线 ➢ ②作精馏段操作线, yn1R R 1xnR x d1
“化工原理”第6章《精馏》复习题.

《化工原理》第六章“精馏”复习题一、填空题1. 在汽-液相平衡的t-x-y图中,沸点与液相组成的关系曲线,称为________,沸点与汽相组成的曲线,称为____________.( ***答案***液相线(或泡点线) 汽相线(或露点线))2. 精馏过程,就是利用混合液的各组分具有不同的__________,利用_____________、_____________的方法,将各组分得以分离的过程. (***答案*** 沸点(或挥发度) 多次部分汽化多次部分冷凝)3. 当塔板中上升的汽相与下降液相之间达到_____时,该塔板称理论塔板。
***答案*** (相平衡)4. 分离某些α接近1的物系时,可采用一些特殊的精馏方法,如_______,_________.(***答案***萃取精馏恒沸精馏)5. 分离要求一定。
当回流比为一定时,在五种进料状况中,____进料的q值最大,其温度______,此时,提馏段操作线与平衡线之间的距离____,分离所需的总理论板数________。
(***答案***冷液tF <t泡最远最少)6. 精馏操作的依据是混合液中各组分的_____差异。
实现精馏操作的必要条件包括___________和_____________。
(挥发度。
塔顶液相回流塔底上升气流)7. 试述五种不同进料状态下的q值:(1)冷液进料____;(2)泡点液体进料_____;(3)汽液混合物进料___;(4)饱和蒸汽进料____;(5)过热蒸汽进料________。
(***答案***(1)q>1(2)q=1(3)0<q<1(4)q=0 (5)q<0)8. 某精馏塔在操作时,加料热状态由原来的饱和液体进料改为冷液进料,且保持F,xf,回流比R和提馏段上升蒸汽量V'不变,则此时D____,xd____,W____,xw______。
(增加,不变,减少,无法确定)(***答案*** 减少,增加,增加,增加)9. 某精馏塔操作时,F,x F,q,D保持不变,增加回流比R,则此时x D___,x W____V____,L/V____。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
确定露点温度或 气相组成
汽液平衡相图
(1)、温度—组成图 (t-x-y图)
分析温度—组成图 二条线:泡点线、露点线。 三个相区:液相区、气相区、气液两相区。 两个温度:泡点温度、露点温度 杠杆定律:
加热器
存在的两个问题: 加热器 (1)中间产品多,收率低。 (2) 设备复杂、能耗大,操作不便。
L2 x2
L3 x3
由 图 可 知 , X1 <Xf <Y1 , X1 <X2 <Y1 , X2 与Xf比较接近, X3 与Y1 比 较接近,若将第二级产生的中间产品X2 于第一级的原料XF 混合, X3 与Y1 混 合这样消除了中间产品。由于温度较高 的蒸汽与温度低的X3确接触,使液体部 分气化,蒸汽自身被冷凝,省去了中间 加热器与冷凝器。
6-3.1 精馏的依据
1、相图的分析指出,进行多次部分气化和多次部分冷凝, 可以将混合物分离成纯的或接近于纯的组分。液体混合物 经过多次部分气化后可变为高纯度的难挥发组分,汽体混 合物经过多次部分冷凝后可变为高纯度的易挥发组分。
2、同成分蒸汽的露点比同成分溶液的泡点为高。
3、精馏处理的常是由沸点相差不多的组分所组成的溶液, 各组分的摩尔汽化热相差不大。
n( L) n( L) dn( L) dn( D) dn( L) dn( D)
易挥发组分衡算:
n( L) x n( L) dn( L)( x dx) ydn( D)
dn dx n y x
n( F ) x f dx ln x w y x n(W )
上式积分的计算:
P t
A xW xF x或y yD
L xW
平衡蒸馏的计算
全塔物料衡算
n( F ) n( D) n(W )
易挥发物料衡算
n( F ) xf n( D) yD n(W ) xW
x y 1 ( 1) x
w D
W
§6-3
连续精馏
精馏操作就是在同一设备内多次而且 同时运用部分气化和冷凝的方法,以得到 接近于纯的易挥发组分和接近于纯的难挥 发组分的操作。
x x x
3 2 1
1.00 蒸汽的多次部分冷凝 y2 y1
y3
y
y0 x0 x1 x2 x3
x 0> x 1> x 2> x 3 y0> y1> y2> y3
溶液的多次部分气化
0
x
1.00
§6-2 简单蒸馏
6-2.1 简单蒸馏的操作和应用 使混合液在蒸馏釜中逐渐受热气化,并不断将生成 的蒸气引入冷凝器,以达到混合液中各组分得以分离 的方法,称为简单蒸馏或微分蒸馏。 主要应用在以下方面: (1)在规模不大的工厂做不精密的分离。 (2)处理组分间相对挥发度很大的混合物。 (3)作为回收的手段。 (4)作为精馏前的预处理。
νB = pB / x B
组分A、B 的挥发度。
对理想溶液,符合拉乌尔定律
νA = pA / xA = pA0 xA / xA = pA0 νB = pB0
理想溶液中, 各组分的挥发度等于其饱和蒸汽压.
(2)相对挥发度 相对挥发度定义: 溶液中两组分挥发度之比。
A pA / x A B pB / x B
法加以分离。
[小结] t--x--y 和x--y 以及相对挥发度从三个不同的角度
表达了溶液的气液平衡关系 , 都能判断双组分溶液能否分离及 分离的难易程度。
6-1.3 非理想的两组分互溶体系
乙醇-水
硝酸-水
t
x y
t
x y
y
y
x
x
N6
(一)正偏差
溶液中相异分子间的排斥力大于相同分子的排斥力,使 真实溶液比相同组成的理想溶液在同条件下有较高的蒸汽 压,在特殊条件下出现最低恒沸点,如乙醇-水溶液 。 (二)负偏差 溶液中相异分子间的吸引力大于相同分子的吸引力,使 真实溶液比相同组成的理想溶液在同条件下有较低的蒸汽压, 在特殊条件下出现最高恒沸点,如硝酸-水物系。 (三)讨论 ①具有恒沸点的溶液用一般蒸馏的方法,其浓度最多达到恒 沸组成。 ②非理想溶液不一定具有恒沸点,但有恒沸点的是明显的、 偏差大的非理想溶液;具有恒沸点的溶液在总压发生改变 时,恒沸组成也发生变化,p↓,xM↑。
6-1.4 压力对气液平衡的影响
总压对 t-y-x 关系比对 y-x 关系的影响大; 当总压变化不大时,总压对 y-x 关系的影响可以忽略不计 一般来说,压力降低,使体系的相对挥发度增大,压力增 大则使体系的相对挥发度降低。
6-1.5 以t-x-y相图表示的蒸馏过程
在总压一定的条件下,将组成 为 xf 的溶液加热至该溶液的泡 点 tA ,产生第一个气泡的组成 为 yA。
第六章
精 馏
本章目录:
§6-1 精馏原理 §6-2 简单蒸馏 §6-3 连续精馏 §6-4 连续精馏理论塔板数的计算 §6-5 间歇精馏
§6-6 多组分精馏
§6-7 特殊精馏 §6-8 板式塔
蒸馏是利用物系在发生相变过程中组分间的挥 发性的差异,将液体混合物中各组分分离的操作。
气相区 露点
t/C
两相区
露点线
继续加热,随温度升高,物 系变为互成平衡的汽液两相, 两相温度相同组成分别为 yA 和 xA 。
泡点 泡点线
液相区
0
x
A
xf x(y)
y
A
1.0
当温度达到该溶液的露点,溶液全部汽化成为组成为 yA= xf 的气相,最后一滴液相的组成为 xA。
杠杆反比定律: 蒸汽的物质的量溶液的物质的量=n(V) n(L)=NO OM
1
气 相 组 成
y
x
0
液相组成
1
X —Y 图
6-1.2 挥发度及相对挥发度
(1)挥发度:表示某种溶液易挥发的程度。 若为纯液体时,通常用其当时温度下饱和蒸气压来表示, 如pA0 。 若为溶液时,各组分的挥发度,则用它在一定温度下蒸气 中的分压和与之平衡的液相中该组分的 摩尔分率之比来表 示,
νA = pA / xA νA 、νB —
1.图解积分法:在xw至xf范围内,由各x值从平衡线求得 相应的y值后,以x对 1/(y-x) 作图,从曲线下面积可求 得[n(F)/n(w)]的值。 2.当溶液接近理想溶液时,根据y=αx/[1+(α -1)x], 直接积分,得:
n( F ) 1 1 xw xf (1 xw ) ln ln ln 1 xf n(W) 1 xw(1 xf )
2、按蒸馏方法分:
{
本章主要讨论 常压下双组分 连续精馏
特殊精馏
双组分蒸馏 多组分蒸馏 复杂系蒸馏 常压 减压(热敏性物料)
3、按组分数分:
4、按操作压力分:
{ {
加压
蒸馏是气液两相间的传质过程; 组分在两相中的浓度(组成)偏离平衡的程度来 衡量传质推动力的大小,传质过程以两相达到相 平衡为极限; 气液相平衡是分析蒸馏原理和进行蒸馏设备计算 的理论基础。
yA
* PA x A /
p
泡点方程 pA =pA0xA pB = pB
0x B
0 p pB xA 0 PA PB0
p = pA+ pB =pA0xA+ pB0 xB
= PA0xA+PB0(1-xA)
用途:(1)已知泡点,计算液相组成。 (2)已知液相组成求泡点。 X=f(pt) 露点方程
0 理想溶液 p0 / pB A
x y 1 ( 1) x
相对挥发度的意义 其值的大小可用于判断某混合溶液能否用蒸馏方法加以 分离以及分离的难易程度。
当α>1时,表示组分A较B容易挥发, α愈大,挥发度差
异愈大,分离愈容易。
当α=1时,气相组成与液相组成相同,不能用普通精馏方
o A
(2) 气液相平衡图(y—x图)
沸点--组成(t-x-y)图
t—x—y 图
y —x 图
y2
t1 t2
x
1
y1
x y1 y2
2
x
1
x
2
(X—Y图)
平衡线位于对角线的上方; 平衡线离对角线越远,表示 该溶液越易分离。 注意: 总压对 t-y-x 关系比对 y-x 关系的影响大; 当总压变化不大时,总压对 y-x 关系的影响可以忽略不计 蒸馏中使用 y-x 图较t-y-x 图更为方便。
塔顶产品
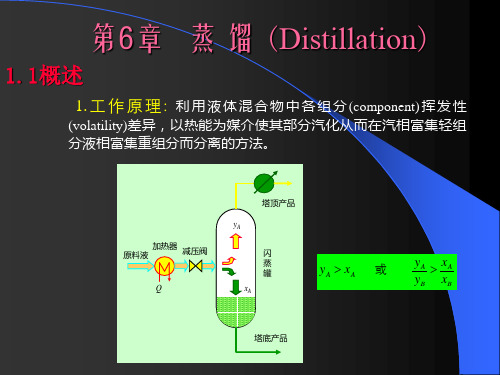
yA 原料液 加热器 减压阀 闪 蒸 罐 xA
y A xA
或
Q
y A 用 用于均相液体混合物的分离,达到提纯或回收 组分的目的。 蒸馏分离的依据 利用液体混合物中各组分挥发能力的差异。
蒸馏分类
1、按操作方法分:
{
连续蒸馏 间歇蒸馏 简单蒸馏(分离要求不高) 平衡蒸馏(闪蒸) 精馏
难挥发组分:通常将沸点高的组分称为难挥发组分。
理想溶液:在这种溶液内,组分A、B分子间作用力aAB
与纯组分A的分子间作用力aAA或纯组分B的分子间作用力 aBB相等。理想溶液一般是由物性和结构相似,分子大小
相近的物质组成。
相律:若外界只有温度和压强两个条件影响物系的平 衡状态,则平衡体系中的自由度可表示为:
多次部分气化、部分冷凝
t
x4 x3 x2 x1 x2
y4
y3 y2 y1 y2 x3 x4 y3
y4
A
xf
x
V3 y3
V2 y2
冷凝器
' L 3x3
