【名师原创解析】福建省漳州市芗城中学2017届高三上学期月考化学试卷(9月)
福建省漳州市芗城中学2017届高三9月月考数学(文)试题
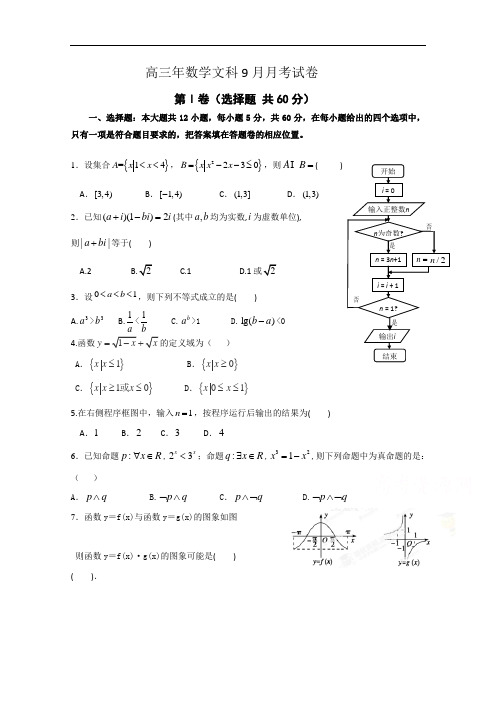
高三年数学文科9月月考试卷第Ⅰ卷(选择题 共60分)一、选择题:本大题共12小题,每小题5分,共60分,在每小题给出的四个选项中,只有一项是符合题目要求的,把答案填在答题卷的相应位置。
1.设集合{}=14A x x <<,{}2230B x x x =--≤,则=B A ( ) A .[3,4) B .[1,4)-C .(1,3]D .(1,3) 2.已知()(1)2a i bi i +-=(其中,ab 均为实数,i 为虚数单位), 则||a bi +等于( )A.2C.1D.13.设01a b <<<,则下列不等式成立的是( )A.3a >3bB.a 1<b1 C.ba >1 D.)lg(ab -<04.函数y = )A .{}1x x ≤ B .{}0x x ≥ C .{}10x x x ≥≤或 D .{}01x x ≤≤5.在右侧程序框图中,输入1n =,按程序运行后输出的结果为( ) A .1 B .2 C .3 D .46.已知命题:p x R ∀∈,23x x <;命题:q x R ∃∈,321x x =-,则下列命题中为真命题的是:( ) A .p q ∧B.p q ⌝∧C .p q ∧⌝ D.p q ⌝∧⌝7.函数y =f(x)与函数y =g(x)的图象如图则函数y =f(x)·g(x)的图象可能是( )( ).8.对一组数据x i (i =1,2,3,…,n ),如果将它们改变为x i +c (i =1,2,3,…,n ),其中c ≠0,则下面结论中正确的是( )A .平均数与方差均不变B .平均数变了,而方差保持不变C .平均数不变,而方差变了D .平均数与方差均发生了变化9.已知1c >,a b = ( )A.a b >B.a b =C.a b <D.a 、b 的大小不确定10. 已知函数()f x 为奇函数,当0x ≥时,2()log (1)f x x m =++,则(1f 的值为( )A .12-B .2log (2-C .12D .2log (2 11.若幂函数mx m m x f )1()(2--=在(0,+∞)上为增函数,则实数m 等于( ) A. 2 B.-1C.3D.-1或212.设函数()3,12,1x x b x f x x -<⎧=⎨≥⎩,若143f f ⎡⎤⎛⎫= ⎪⎢⎥⎝⎭⎣⎦,则b =( ) A .1 B .14-C .14-或1 D .1-第Ⅱ卷(非选择题 共90分)二、填空题:本大题共4小题,每小题5分,共20分,把答案填在答题卷的相应位置。
福建省漳州市芗城中学高三10月月考化学试题(无答案)

注意事项:1、本试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
考试时间90分钟,满分100分。
2、答卷前,考生务必将自己的班级、姓名、班级座号、考号填写在答题卷指定的位置。
3、请将答案填写在答题卷上,否则不得分。
可能用到的相对原子质量:H—1 C—12 N—14 O—16 Na—23 Mg—24 Al—27 P—31 S—32 Cl—35.5 K—39 Ca—40 Fe—56 Cu—64 Zn—65 Ag—108可能用到的对数:lg2=0.3 lg3=0.5 lg5=0.7 lg7=0.9第Ⅰ卷(选择题共45分)一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个....选项符合题意)12.用如右图表示的一些物质或概念间的从属关系中不正确的是3A.根据纯净物的元素组成,将纯净物分为单质和化合物B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类反应4.最近,兰州近代物理研究所研制出我国首批氧-18气体(18O2)。
氧-18是氧的一种同位素,称为重氧,下列说法正确的是A.1.8g氧-18气体的物质的量是0.1molB.0.1mol重氧气体的体积是2.24LC.重氧气体的摩尔质量为36gD.0.1mol重氧水所含中子数约是6.02 ⨯1023个5.若N A表示阿佛加德罗常数,下列说法正确的是A.1 mol氦气分子中含2N A个氦原子B.25℃时,l L pH=13的Ba(OH)2溶液中含有OH-的数目为0.1N AC.1.8 g重水(21H2O)中所含质子的个数为N AD.1L 0.2mol/L的FeCl3溶液中Fe3+的数目为0.2N A6.在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+为0.8mol,Cl-为1.3mol,Mg2+为0.5mol,则SO42-的物质的量为A.0.1mol B.0.5mol C.0.15mol D.0.25mol7.氯气是一种化学性质很活泼的单质,它具有较强的氧化性,下列叙述中不正确...的是A.红热的铜丝在氯气里剧烈燃烧,生成棕黄色的烟B.氯气通入品红溶液中,溶液会褪色,是因为氯气具有漂白性C.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰D.氯气能与水反应生成HClO和HCl,久置氯水最终变为稀盐酸8.已知:KClO3+6HCl(浓)===KCl+3Cl2↑+3H2O。
漳州市芗城中学2017届高三上学期月考化学试卷(9月) 含解析

2016—2017学年福建省漳州市芗城中学高三(上)月考化学试卷(9月)一、单选题(本大题共13小题,共52分)1.我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧",“以烧酒复烧二次…价值数倍也”.这里用到的实验方法可用于分离()A.苯和水B.乙酸乙酯和乙酸C.食盐水和泥沙 D.硝酸钾和硫酸钠2.下列关于物质分类的说法正确的是()A.根据原子最外层电子数的多少可将元素分为金属元素和非金属元素B.根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等C.汽油、漂白粉、水玻璃、王水均为混合物D.纯碱、熟石灰、醋酸、食盐水均为电解质3.下列关于有机物的叙述正确的是()A.乙醇.甲苯均能与钠反应生成氢气B.异丁烷与戊烷互为同分异构体C.油脂、蛋白质均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别4.下列应用或事实与胶体的性质无关的是()A.洪灾发生地的农民用明矾净化河水作为生活用水B.豆腐圣地安徽八公山豆制品厂用石膏或盐卤点制豆腐C.在饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀D.安徽海螺集团各水泥厂用先进的电除尘技术除去空气中的粉尘5.N A为阿伏加德罗常数的值.下列说法正确的是()A.1 L 0。
1 mol/LNaHSO4溶液中含有HSO4﹣总数为0。
1N AB.16g16O2和18 g18O2中含有的质子数均为8N AC.1 mol Fe与足量的稀硝酸反应,转移电子数为2N AD.标准状况下,2。
24 L Cl2溶于水所得溶液中含有的氯离子数为0。
1N A6.某烃的相对分子质量小于70,1mol该烃最多可与2mol H2发生加成反应,加成产物最多能与10mol Cl2发生取代反应,则该烃的分子式为()A.C3H6B.C3H4 C.C4H6 D.C5 H87.下列离子方程式中正确的是()A.铜与浓硝酸反应:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2OB.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl﹣C.AlCl3溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓D.Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O8.等物质的量的甲酸、乙酸及甘油(如图)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)()A.4种B.5种C.6种D.7种9.有关反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,的下列说法错误的是()A.FeS2既是氧化剂也是还原剂B.CuSO4在反应中被还原C.14 mol CuSO4氧化了1 mol FeS2D.被还原的S和被氧化的S的质量之比为3:710.设阿伏伽德罗常数的数值为N A,下列说法正确的是()A.1。
福建省漳州市芗城中学2013届高三(上)月考化学试卷(9月份)

2012-2013学年福建省漳州市芗城中学高三(上)月考化学试卷(9月份)一、选择题(34分)7.(2分)(2013春•芗城区校级月考)用N A表示阿伏加德罗常数的数值,下列说法正确的是8.(2分)(2007秋•四平期中)跟Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质⇌碳酸氢钠溶液中加入足量的烧碱溶液:10.(2分)(2013春•芗城区校级月考)在无色透明的强酸性溶液中,能大量共存的离子组是13.(2分)(2012秋•成都校级期末)VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO42﹣mol/L mol/L mol/L Dmol/L14.(2分)(2013春•芗城区校级月考)人们在研究金星大气成分时发现金星大气中有一种称为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列的电子式为:15.(2分)(2013春•芗城区校级月考)周期表中铋元素的数据见图,下列说法正确的是()16.(2分)(2013秋•榆阳区校级月考)将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入的CO2体积(V)的关系如图所示,图中AB段表示的先后反应的离子方程式是()①CO2+OH﹣═HCO3﹣②CO2+2OH﹣═CO32﹣+H2O③CO32﹣+Ba2+═BaCO3↓④BaCO3+CO2+H2O═Ba2++2HCO3﹣⑤CO32﹣+CO2+H2O═2HCO3﹣.17.(2分)(2012秋•丛台区校级月考)某中性的溶液中含有Na+、NH4+、Fe2+、Br﹣、CO32 2﹣七种离子中的某几种.进行以下实验:①在原溶液中滴加足量氯水后,有气泡﹣、I﹣、SO3产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不二、填空题(50分)18.(8分)(2013春•芗城区校级月考)实验室配制一定物质的量浓度的烧碱溶液,在下列各种情况下,所得溶液的物质的量浓度将如何变化(填“偏高”、“偏低”或“无影响”)(1)在天平两托盘上分别垫上纸质、大小相同的两片纸,再将氢氧化钠固体放在纸上称量.(2)定容时,俯视观察刻度线.(3)在倒入氢氧化钠溶液前,容量瓶中有少量水,未经干燥.(4)将配制好的溶液转移至刚用蒸馏水洗净的试剂瓶.19.(8分)(2013春•芗城区校级月考)H2O2是一种重要的氧化剂,亦具有还原性.下列①~④个涉及H2O2的反应(未配平、条件略).①Na2O2+HCl→NaCl+H2O2②H2O2→H2O+O2③Ag2O+H2O2→Ag+O2+H2O④H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O.据此,填写下列空白:(1)配平上述反应④[]H2O2+[]Cr2(SO4)3+[]KOH→[]K2CrO4+[]K2SO4+[]H2O 当0.1mol氧化剂参加反应时,转移电子个.(2)H2O2仅体现还原性的反应是(填代号),此反应中的氧化产物为.(3)H2O2体现弱酸性的反应是(填代号),其理由为.20.(12分)(2013春•芗城区校级月考)A、B、C、D、E、F属于短周期主族元素.其中A 元素原子是短周期中原子半径最大的原子,B是最小的原子;C元素原子的最外层电子数为m,次外层电子数为n;D元素原子的L层电子数为m+n,M层电子数为m﹣n;E元素原子的最外层电子数等于其电子层数,且在周期表中与D元素相邻;F元素原子的核外电子数是C元素原子的2倍.A、B、C三种元素可组成化合物X,C、D可组成化合物Y,C、E可组成化合物Z.(1)写出E元素符号;A的原子结构示意图;(2)F在元素周期表的位置为;硒(se)是人体必需的微量元素,与F同一主族,其最高价氧化物对应的水化物化学式为;(3)A→F六种元素所形成的简单离子中,与Mg2+具有相同电子层结构的是(用离子符号表示);各离子半径由大到小的顺序为;(4)化合物Z与X的水溶液反应的离子方程式为;(5)化合物Y用途广泛,试列举其中一种用途.21.(15分)(2013•山东模拟)有X、Y、Z三种物质,它们之间存在如图转化关系:(1)若X、Y、Z三种物质的焰色反应均为黄色,三个反应均为化合反应,则Y的化学式为,Z的电子式为;Y、Z两种物质相比,相同的化学键类型为,当②、③两个反应生成的Z量相等时,转移电子数目比为.(2)若X、Y、Z三种均为常见化合物且三种物质中均含有相同的两种短周期元素,0.1mol/L 的三种物质的溶液pH:Y>X>Z>7,则①的化学方程式为,③的离子方程式为.(3)若X、Y、Z三种物质均含有同一种金属元素,X是单质,Y是日常生活中最重要的盐,②的反应条件为电解,则②的化学方程式为,③的离子方程式为.22.(7分)(2014春•浦东新区期末)有一固体混合物,可能由Na2CO3、CaCO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成.为检验它们,做了以下实验:(1)将固体混合物溶于水,搅拌后得无色透明溶液;(2)往此溶液中滴加过量的硝酸钡溶液,有白色沉淀生成;(3)过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解.试判断:①固体混合物中肯定有,②肯定没有,③可能有;对可能有的物质,可采取向滤液中滴加溶液的方法来检验.三、实验题23.(16分)(2010•石家庄模拟)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.实验过程:Ⅰ.按图组装仪器,检查装置的气密性;Ⅱ.将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;Ⅲ.关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.请回答以下问题(装置中原有空气对实验的影响忽略不计):(1)装置A中发生反应的化学方程式为.(2)装置B的作用为.装置C的作用为.(3)实验过程中通入N2的目的为.否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:(若不能,此问不作答.)2012-2013学年福建省漳州市芗城中学高三(上)月考化学试卷(9月份)参考答案与试题解析一、选择题(34分)克氨气,其物质的量为=0.2mol 来分析解答.克氨气的物质的量为=0.2mol/L7.(2分)(2013春•芗城区校级月考)用N A表示阿伏加德罗常数的数值,下列说法正确的是8.(2分)(2007秋•四平期中)跟Na、Na2O、Na2O2、NaOH、Na2CO3、NaHCO3六种物质⇌碳酸氢钠溶液中加入足量的烧碱溶液:10.(2分)(2013春•芗城区校级月考)在无色透明的强酸性溶液中,能大量共存的离子组是13.(2分)(2012秋•成都校级期末)VL Fe2(SO4)3溶液中含有Fe3+mg,则溶液中SO42﹣mol/L mol/L mol/L Dmol/L的物质的量为mol====14.(2分)(2013春•芗城区校级月考)人们在研究金星大气成分时发现金星大气中有一种称为硫化羰(COS)的分子,其结构与CO2类似,硫化羰是一种与生命密切相关的物质,下列的电子式为:分子电子式为分子电子式为:分子电子式为:15.(2分)(2013春•芗城区校级月考)周期表中铋元素的数据见图,下列说法正确的是()16.(2分)(2013秋•榆阳区校级月考)将足量CO2通入NaOH和Ba(OH)2的混合稀溶液中,生成沉淀的物质的量(n)和通入的CO2体积(V)的关系如图所示,图中AB段表示的先后反应的离子方程式是()①CO2+OH﹣═HCO3﹣②CO2+2OH﹣═CO32﹣+H2O③CO32﹣+Ba2+═BaCO3↓④BaCO3+CO2+H2O═Ba2++2HCO3﹣⑤CO32﹣+CO2+H2O═2HCO3﹣.17.(2分)(2012秋•丛台区校级月考)某中性的溶液中含有Na+、NH4+、Fe2+、Br﹣、CO32 2﹣七种离子中的某几种.进行以下实验:①在原溶液中滴加足量氯水后,有气泡﹣、I﹣、SO3产生,溶液呈橙黄色;②向呈橙黄色溶液中加入BaCl2溶液时无沉淀生成;③橙黄色溶液不二、填空题(50分)18.(8分)(2013春•芗城区校级月考)实验室配制一定物质的量浓度的烧碱溶液,在下列各种情况下,所得溶液的物质的量浓度将如何变化(填“偏高”、“偏低”或“无影响”)(1)在天平两托盘上分别垫上纸质、大小相同的两片纸,再将氢氧化钠固体放在纸上称量偏低.(2)定容时,俯视观察刻度线偏高.(3)在倒入氢氧化钠溶液前,容量瓶中有少量水,未经干燥无影响.(4)将配制好的溶液转移至刚用蒸馏水洗净的试剂瓶偏低.分析操作对溶质的物质的量或对溶液的体积的影响判断.分析操作对溶质的物19.(8分)(2013春•芗城区校级月考)H2O2是一种重要的氧化剂,亦具有还原性.下列①~④个涉及H2O2的反应(未配平、条件略).①Na2O2+HCl→NaCl+H2O2②H2O2→H2O+O2③Ag2O+H2O2→Ag+O2+H2O④H2O2+Cr2(SO4)3+KOH→K2CrO4+K2SO4+H2O.据此,填写下列空白:(1)配平上述反应④[3]H2O2+[1]Cr2(SO4)3+[10]KOH→[2]K2CrO4+[3]K2SO4+[8]H2O 当0.1mol氧化剂参加反应时,转移电子 1.204×1023个.(2)H2O2仅体现还原性的反应是③(填代号),此反应中的氧化产物为O2.(3)H2O2体现弱酸性的反应是①(填代号),其理由为此反应中由其盐与强酸盐酸反应值制得.20.(12分)(2013春•芗城区校级月考)A、B、C、D、E、F属于短周期主族元素.其中A 元素原子是短周期中原子半径最大的原子,B是最小的原子;C元素原子的最外层电子数为m,次外层电子数为n;D元素原子的L层电子数为m+n,M层电子数为m﹣n;E元素原子的最外层电子数等于其电子层数,且在周期表中与D元素相邻;F元素原子的核外电子数是C元素原子的2倍.A、B、C三种元素可组成化合物X,C、D可组成化合物Y,C、E可组成化合物Z.(1)写出E元素符号Al;A的原子结构示意图;(2)F在元素周期表的位置为第三周期ⅥA族;硒(se)是人体必需的微量元素,与F 同一主族,其最高价氧化物对应的水化物化学式为H2SeO4;(3)A→F六种元素所形成的简单离子中,与Mg具有相同电子层结构的是Na+、Al3﹣、O2﹣(用离子符号表示);各离子半径由大到小的顺序为O2﹣>Na+>Al3﹣;(4)化合物Z与X的水溶液反应的离子方程式为Al2O3+2OH﹣=2AlO2﹣+H2O;(5)化合物Y用途广泛,试列举其中一种用途制造光导纤维、光学仪器等.,;21.(15分)(2013•山东模拟)有X、Y、Z三种物质,它们之间存在如图转化关系:(1)若X、Y、Z三种物质的焰色反应均为黄色,三个反应均为化合反应,则Y的化学式为Na2O,Z的电子式为;Y、Z两种物质相比,相同的化学键类型为离子键,当②、③两个反应生成的Z量相等时,转移电子数目比为1:2.(2)若X、Y、Z三种均为常见化合物且三种物质中均含有相同的两种短周期元素,0.1mol/L 的三种物质的溶液pH:Y>X>Z>7,则①的化学方程式为Na2CO3+Ca(OH)2═CaCO3↓+2NaOH,③的离子方程式为CO32﹣+CO2+H2O═2HCO3.(3)若X、Y、Z三种物质均含有同一种金属元素,X是单质,Y是日常生活中最重要的盐,②的反应条件为电解,则②的化学方程式为2NaCl+2H2O2NaOH+H2↑+Cl2↑,③的离子方程式为2Na+2H2O═2Na++2OH﹣+H2↑.电子式为,OO22.(7分)(2014春•浦东新区期末)有一固体混合物,可能由Na2CO3、CaCO3、Na2SO4、CuSO4、CaCl2、NaCl等混合组成.为检验它们,做了以下实验:(1)将固体混合物溶于水,搅拌后得无色透明溶液;(2)往此溶液中滴加过量的硝酸钡溶液,有白色沉淀生成;(3)过滤,将沉淀物置于稀硝酸中,发现沉淀部分溶解.试判断:①固体混合物中肯定有Na2CO3、Na2SO4,②肯定没有CaCO3、CuSO4、CaCl2,③可能有NaCl;对可能有的物质,可采取向滤液中滴加AgNO3溶液溶液的方法来检验.三、实验题23.(16分)(2010•石家庄模拟)小苏打(NaHCO3)试样中含有碳酸钠晶体(Na2CO3•10H2O),为测定试样中小苏打的质量分数w(NaHCO3),实验小组同学设计了如下装置进行实验.实验过程:Ⅰ.按图组装仪器,检查装置的气密性;Ⅱ.将试样m1g放入硬质玻璃管中,装置B、C、D中药品如图,已知加药品后装置B的质量为m2g、装置C的质量为m3g;Ⅲ.关闭活塞a,点燃酒精灯加热试样,直到B装置中无气泡冒出后,打开活塞a向装置中通入N2,一段时间后,撤掉酒精灯,关闭活塞a;Ⅳ.称得装置B的质量为m4g、装置C的质量为m5g.请回答以下问题(装置中原有空气对实验的影响忽略不计):(1)装置A中发生反应的化学方程式为2NaHCO3Na2CO3+CO2↑+H2O,Na2CO3•10H2O Na2CO3+10H2O.(2)装置B的作用为吸收反应生成的水蒸气.装置C的作用为吸收反应生成的二氧化碳.(3)实验过程中通入N2的目的为使装置中的二氧化碳和水蒸气全部排出被装置BC全部吸收.否得到准确的w(NaHCO3),若能,则w(NaHCO3)的计算式为:×100%(若不能,此问不作答.)3O3NaO×100%=故答案为:×。
福建省漳州市高三上学期化学9月月考试卷

福建省漳州市高三上学期化学9月月考试卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分)我们看到的普通玻璃一般呈淡绿色,这是因为在制造玻璃的过程中加入了()A . 氧化钴B . 二价铁C . 氧化亚铜D . 氧化镁2. (2分)已知C﹣C可以绕键轴旋转,对于结构简式如图所示的烃,下列说法正确的是()A . 分子中最多有12个碳原子处于同一平面上B . 分子中至少有9个碳原子处于同一平面上C . 该烃的一氯取代物最多有4种D . 该烃是苯的同系物3. (2分) (2016高二下·静海期中) 下列实验装置能达到实验目的是(夹持仪器未画出)()A . 用甲装置检验1﹣溴丙烷消去产物B . 实验室用乙装置制取乙烯C . 用丙装置收集甲烷气体D . 用丁装置证明酸性强弱:盐酸>碳酸>苯酚4. (2分)下列叙述正确的是()①向久置于空气中的NaOH溶液中加盐酸时有气体产生②浓硫酸可用于干燥H2、NO2等气体,但不能干燥NH3、SO3等气体③CO2和Na2O2反应生成Na2CO3和O2 , SO2和Na2O2反应生成Na2SO3和O2④足量的硫单质与64 g 铜反应,有2 mol电子发生转移⑤水玻璃为硅酸钠,是纯净物⑥氢氧化铁胶体与氯化铁溶液分别蒸干灼烧得相同的物质A . ①④⑤B . ①②⑥C . ②③④D . ④⑤⑥5. (2分) (2019高三上·揭阳月考) 室温下,将尿酸钠(NaUr)悬浊液静置,取上层清液,再通入HCl,溶液中尿酸的浓度c(HUr)与pH 的关系如图所示。
已知:Ksp(NaUr)=4.9×10-5 ,Ka(HUr)=2.0×10-6。
下列说法正确的是()A . 上层清液中,c(Ur-) = 7.0×10-2mol·L-1B . 在M→N 的变化过程中,c(Na+)·c(Ur-)将逐渐减小C . 当c(HUr)= c(Ur-)时,c(Cl-)=c(Ur-)D . 当pH=7时,2c(Na+)= c(Ur-)+c(Cl-)6. (2分) (2016高一下·成都期中) 短周期主族元素W,X,Y,Z的原子序数依次增大,W,X原子的最外层电子数之比为4:3,Z原子比X原子的核外电子数多4.下列说法正确的是()A . W,Y,Z的非金属性大小顺序一定是Z>Y>WB . W,X,Y,Z的原子半径大小顺序可能是W>X>Y>ZC . Y,Z形成的某化合物常可用作萃取剂D . WY2分子中既有非极性键又有极性键7. (2分)下图Ⅰ、Ⅱ分别是甲、乙两组同学将反应“AsO43-+2I-+2H+ AsO33-+I2+H2O”设计成的原电池装置,其中C1、C2均为碳棒。
福建省漳州市高三上学期化学9月月考试卷B卷

福建省漳州市高三上学期化学9月月考试卷B卷姓名:________ 班级:________ 成绩:________一、单选题 (共7题;共14分)1. (2分) (2019高一上·邵东期末) 下列有关硅材料的说法错误的是()A . 晶体硅是良好的半导体材料和制作太阳能电池的材料B . SiO2可用于制造光导纤维C . 普通玻璃是以纯碱、石灰石和石英为原料经高温烧结而制成的D . SiO2是酸性氧化物,它可溶于水生成硅酸2. (2分) (2017高二下·湖州期中) 科学研究发现,具有高度对称性的有机分子具有致密性高,稳定性强,张力能大等特点,因此这些分子成为2014年化学界关注的热点,下面是几种常见高度对称烷烃的分子碳架结构,这三种烷烃的二氯取代产物的同分异构体数目分别是()A . 2种,4种,8种B . 2种,4种,6种C . 1种,3种,6种D . 1种,3种,8种3. (2分) (2018高一上·三明期中) 如图是一种试验某气体化学性质的实验装置,图中B为开关。
如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C处红色布条颜色褪去。
则D瓶中盛有的溶液是()A . 浓H2SO4B . 浓NaOH溶液C . 饱和Na2SO4溶液D . 石灰乳4. (2分)下列叙述正确的是()A . 标准状况下,1 mol任何物质的体积都约为22.4 LB . 1 mol任何气体所含分子数都相同,体积也都约为22.4 LC . 在20℃时,1 mol的任何气体的体积总比22.4 L大D . 1 mol H2和O2的混合气体所含原子总数为2NA5. (2分)下列溶液中有关物质的量浓度关系正确的是()A . pH=2的HA溶液与pH=12的MOH溶液任意比混合:c(H+)+c(M+)=c(OH-)+c(A-)B . pH相等的CH3COONa、NaOH和Na2CO3三种溶液:c(NaOH)<c(CH3COONa)<c(Na2CO3)C . 等物质的量的CH3COOH和CH3COONa溶于水:c(CH3COO-)+c(OH-)=c(H+)+c(CH3COOH)D . 0.1mol/L的NaHA溶液,其pH=4:c(HA-)>c(H+)>c(H2A)>c(A2-)6. (2分) (2016高一下·邯郸期中) 四种短周期元素的离子aXm+、bYn+、cZn﹣、dRm﹣,它们具有相同的电子层结构,若m>n,对下列叙述正确的是()①a﹣b=n﹣m②元素的原子序数a>b>c>d③元素非金属性Z>R④最高价氧化物对应水化物的碱性X>Y⑤还原性Rm﹣>Zn﹣⑥X一定可与冷水反应.A . 只有②正确B . ①②③④正确C . ①②③⑥正确D . ②③⑤正确7. (2分)一种三室微生物燃料电池(MFC)污水净化系统原理如图所示,图中废水有机物可用C6H10O5表示.有关说法不正确的是()A . 电子从a极经负载到b极B . c为氯离子交换膜,d为钠离子交换膜,中间室可用作海水淡化C . 负极反应式:C6H10O5﹣24e﹣+7H2O═6CO2↑+24H+D . 反应后将左右两室溶液混合较反应前两室溶液混合的酸性强二、综合题 (共3题;共19分)8. (8分)如何除去下列物质中混有的少量杂质(括号内为杂质).写出最佳的离子方程式.(1) NaHCO3溶液(Na2CO3):________.(2) FeCl2溶液(FeCl3):________.(3)单质Mg粉(Al):________.9. (7分) (2017高二上·淄博期中) 工业上一般在恒容密闭容器中采用下列反应合成甲醇:CO(g)+2H2(g)⇌CH3OH(g)(1)判断反应达到平衡状态的依据是(填字母序号,下同).A . 生成CH3OH的速率与消耗CO的速率相等B . 混合气体的密度不变C . 混合气体的相对平均分子质量不变D . CH3OH、CO、H2的浓度都不再发生变化E . 气体的压强不再改变(2)表所列数据是该反应在不同温度下的化学平衡常数(K).某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应后,达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为________,此时的温度为________.(3)要提高CO的转化率,可以采取的措施是________.a.升温 b.加入催化剂 c.增加CO的浓度 d.恒容下加入H2使压强变大e.恒容下加入惰性气体使压强变大 f.分离出甲醇(4)在250℃时,测得某密闭容器中各物质的物质的量浓度见表:此时反应的正、逆反应速率的关系是:v(正)________v(逆)(填“>”“<”或“═”).10. (4分) W、M、X、Y、Z是周期表前36号元素中的四种常见元素,其原子序数依次增大。
福建省漳州市芗城区2016_2017学年高一化学上学期期中试题

福建省漳州市芗城区2016-2017学年高一化学上学期期中试题注意事项....:1、试卷分为第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。
考试时间90分钟,满分100分。
2、答卷前,考生务必将自己的班级、姓名、年段编号(考号)、班级座号填写在答题卷指定的位置。
3、请将答案填写在答题卷指定的位置,否则不得分。
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Mg-24 Al-27S-32 Cl-35.5 K-39 Ca-40 Cu-64 Zn-65第I卷(选择题共34分)一、选择题(每小题只有一个选项符合题意,每小题2分,共34分)1、下列物质类型中,前者包括后者的是A.溶液、分散系B.氧化物、化合物C.溶液、胶体D.化合物、电解质2、下列说法中正确的是A、铁的摩尔质量就是铁的相对原子质量B、CO32-的摩尔质量是60g/molC、1molO2的质量是32g/molD、标准状况下,1 mol H2O体积约为22.4L3、在0.25 mol Na2SO4中,含有的氧原子个数约为A、1B、0.25C、6.02×1023D、3.01×10234、用特殊方法把固体物质加工到纳米级(1-100nm,1nm=10-9m)的超细粉末粒子,然后制得纳米材料。
下列分散系中的分散质的微粒直径和这种粒子具有相同数量级的是A、溶液B、悬浊液C、胶体D、乳浊液5、下列反应进行分类时,既属于氧化还原反应又属于置换反应的是A、4CO+ Fe3O高温3Fe +4CO2B、2KClO32KCl+3O2↑C、Zn+H2SO4=ZnSO4+H2↑D、CH4+2O2CO2+2H2O6、.以下实验装置一般不用于...分离物质的是()7、设N A表示阿伏加德罗常数的值,下列叙述中正确的是A.11.2L氧气所含的原子数为N A B.2.3g金属钠变为钠离子得到0.1N A电子C.0.5mol/LH2SO4中的H+数为N A D.常温常压下32g O2与O3的混合物含有的氧原子数为2N A8、物质的量相等的 NO和NO2具有相同的①分子数②原子数③氮原子数④氧原子数⑤质量⑥体积A、①③B、①③⑥C、②④⑤D、①②③⑥9、与50 mL 0.1 mol·L-1Na2CO3溶液中Na+的物质的量浓度相同的溶液是A、50 mL 0.2 mol·L-1的NaCl溶液B、100 mL 0.1 mol·L-1的NaCl溶液C、25 mL 0.2 mol·L-1的Na2SO4溶液D、10 mL 0.5 mo l·L-1的Na2CO3溶液10、将10 mL 5 mol/L 的HCl溶液稀释到 200 mL,从中取出5 mL,这5 mL溶液的物质的量浓度为A、0.5 mol/LB、0.25 mol/LC、0.1 mol/LD、1 mol/L11、在一定条件下,跟酸、碱、盐都能反应的物质是A.Na2CO3B.CaCO3C.K2O D.CO212、a molH2SO4中含有b个氧原子,则阿伏加德罗常数可以表示为A、a/4b mol-1B、b/4a mol-1C、a/b mol-1D、b/a mol-113、已知0.5 L盐酸和硫酸的混合溶液中含有0.1 mol Cl-和0.2 mol SO42-,则此溶液中H+的物质的量浓度是A、1 mol/LB、0.5 mol/LC、0.6 mol/LD、0.1 mol/L14、下列的分离方法不正确的是A、用过滤的方法除去食盐中的泥沙B、用蒸馏的方法将自来水制成蒸馏水C、用酒精萃取溴水中的溴D、用蒸发浓缩、降温结晶、过滤的方法从硝酸钾和氯化钠的混合溶液中获得硝酸钾晶体15、下列除杂方案中,括号内为除去杂质所需的药品,其中正确的是A.NaOH溶液中混有Ba(OH)2 [K2SO4 ] B.Cu(NO3)2溶液中混有AgNO3 [Cu粉]C.CO2中混有CO [炽热的炭] D.CO2中混有HCl气体 [NaOH溶液]16、等质量的CH4和NH3相比较,下列结论错误的是A、它们的分子个数之比为17:16B、它们的原子个数之比为17:16C、它们的氢原子个数之比为17:12D、它们所含氢的质量比为17:1217、分别用物质的量浓度都是0.1mol/L的NaCl溶液、MgCl2溶液、AlCl3溶液分别与同体积、同物质的量浓度AgNO3溶液反应,消耗这三种溶液的体积比为A、1:2:3B、3:2:1C、6:3:2D、2:3:6第Ⅱ卷(非选择题共66分)二、填空题(22分)18、(6分)在63Li、73Li、2311Na、2412Mg、146C、147N中(1)63Li和73Li 互称,它们的化学性质;(2)146C和147N的相等,2311Na和2412Mg的相等;(3)2412Mg的原子结构示意图:,其电子所占据的电子层中,能量最高的是层(填符号)。
福建省漳州市芗城中学2017届高三9月月考化学试题(高一化学备课组) 含答案

高一备课组(2016、9)7.下列关于有机物的说法正确的是()A.实验室制备硝基苯加入试剂的顺序为:先加入浓硫酸,再滴加苯,最后滴加浓硝酸B.蔗糖和葡萄糖不是同分异构体,但属同系物C.可用金属钠区分乙酸、乙醇和苯D.石油裂解和煤的干馏都是化学变化,而石油的分馏和煤的气化都是物理变化8.N A为阿伏加德罗常数,下列叙述错误的是()A.46 g NO2和N2O4混合气体中含有原子总数为3N AB.常温常压下,Cu-Zn原电池中,正极产生1。
12 L H2时,转移的电子数应小于0。
1N AC.12 g金刚石中含有的共价键数为2N AD.2。
1 g DTO中所含中子数为N A9.下列反应的离子方程式书写正确的是()A.98。
3%的硫酸加入到稀氢氧化钡溶液中:H+(aq)+OH—(aq)═H2O(l) △H=-57。
3kJ/molB.向NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应是:3NH4++ Fe3++3SO42-+ 3Ba2++ 6OH-=3BaSO4↓+Fe(OH)↓+3NH3·H2O3C.淀粉碘化钾溶液在空气中变蓝:4I—+ O2+ 4H+═2I2+2 H2O D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32- + 6H+ +2MnO 4-═5SO 42— + 2Mn 2++3H 2O10.为精确测定工业纯碱中碳酸钠的质量分数(含少量NaCl ),准确称量W 0 g 样品进行实验,下列实验方法所对应的实验方案和测量数据最合理(除W 0外)的是( )11—、HCO 3—离子中的两种组成,可以发生如图转化,下列说法不正确的是( )A .在甲中滴加丁可能发生反应:HCO 3—+ Ba 2++OH —= BaCO 3↓+白色沉淀C无色溶液D ↑H2OB.溶液丙中还可以大量共存的离子有:I—、NO3—、SO42-C.白色沉淀A可能溶解在溶液D中D.甲为NaHCO3,乙为AlCl312.硝酸生产中,500℃时,NH3和O2可能发生如下反应:① 4NH3(g)+5O2 (g) 4NO (g) +6H2O (g) △H =-9072kJ·mol-1K=1.1×1026② 4NH3(g) +4O2(g) 2N2O (g) +6H2O (g) △H=-1104.9kJ·mol-1K=4.4×1028③ 4NH3 (g) +3O2(g) 2N2 (g)+6H2O (g)△H=-1269.02kJ·mol-1K=7。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
2016-2017学年福建省漳州市芗城中学高三(上)月考化学试卷(9月)一、单选题(本大题共13小题,共52分)1.我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…价值数倍也”.这里用到的实验方法可用于分离()A.苯和水B.乙酸乙酯和乙酸C.食盐水和泥沙 D.硝酸钾和硫酸钠2.下列关于物质分类的说法正确的是()A.根据原子最外层电子数的多少可将元素分为金属元素和非金属元素B.根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等C.汽油、漂白粉、水玻璃、王水均为混合物D.纯碱、熟石灰、醋酸、食盐水均为电解质3.下列关于有机物的叙述正确的是()A.乙醇.甲苯均能与钠反应生成氢气B.异丁烷与戊烷互为同分异构体C.油脂、蛋白质均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别4.下列应用或事实与胶体的性质无关的是()A.洪灾发生地的农民用明矾净化河水作为生活用水B.豆腐圣地安徽八公山豆制品厂用石膏或盐卤点制豆腐C.在饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀D.安徽海螺集团各水泥厂用先进的电除尘技术除去空气中的粉尘5.N A为阿伏加德罗常数的值.下列说法正确的是()A.1 L 0.1 mol/LNaHSO4溶液中含有HSO4﹣总数为0.1N AB.16g16O2和18 g18O2中含有的质子数均为8N AC.1 mol Fe与足量的稀硝酸反应,转移电子数为2N AD.标准状况下,2.24 L Cl2溶于水所得溶液中含有的氯离子数为0.1N A6.某烃的相对分子质量小于70,1mol该烃最多可与2mol H2发生加成反应,加成产物最多能与10mol Cl2发生取代反应,则该烃的分子式为()A.C3H6B.C3H4 C.C4H6 D.C5 H87.下列离子方程式中正确的是()A.铜与浓硝酸反应:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2OB.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl﹣C.AlCl3溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓D.Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O8.等物质的量的甲酸、乙酸及甘油(如图)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)()A.4种B.5种C.6种D.7种9.有关反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,的下列说法错误的是()A.FeS2既是氧化剂也是还原剂B.CuSO4在反应中被还原C.14 mol CuSO4氧化了1 mol FeS2D.被还原的S和被氧化的S的质量之比为3:710.设阿伏伽德罗常数的数值为N A,下列说法正确的是()A.1.8g NH4+含有的电子数为N AB.1mol Cl2与足量Fe反应,转移的电子数为3N AC.46g的NO2与46g的N2O4含有的原子数不同D.标准状况下11.2L苯完全燃烧产生二氧化碳分子数为3N A11.关于2mol氨气,下列说法正确的是()A.质量为17 gB.含有6.02×1023个NH3分子C.标准状况下的体积为44.8 LD.溶于1 L水后,液中NH4+的浓度为2 mol.L﹣112.下列说法正确的是()A.HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性B.分子式为C2H4O2的有机物不一定是羧酸C.煤的干馏是物理变化,煤的气化和液化是化学变化D.纤维素、蛋白质、油脂、糖类在一定条件下都能发生水解反应13.设阿伏加德罗常数为N A,下列说法正确的是()A.标准状况下,22.4L乙烷含共价键数目为7N AB.25℃时,1.0LpH=13的Ba(OH)2溶液含OH﹣数目为0.2N AC.铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为N AD.常温常压下,6gHe含中子数为2N A二、填空题(本大题共6小题,共58分)14.写出下列有机物的系统命名或结构简式:(1)(2)CH3CH(CH3)C(CH3)2CH2CH3(3)2,2﹣二甲基﹣3﹣乙基己烷(4)2﹣甲基﹣2﹣丁烯.15.请同学们按照官能团的不同对下列有机物进行分类.(1)芳香烃;(2)卤代烃;(3)醇;(4)酚:;(5)醛:;(6)酮;(7)羧酸;(8)酯.16.卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是.(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等.卤素互化物中的化学键类型是(填标号).A.极性键B.非极性键C.离子键D.σ键(3)BeCl2的分子空间构型为;BF3分子中B﹣F键的键角为.(4)NF3分子中的N原子的杂化方式为.(5)HF的相对分子质量小于HC1,但其沸点却高于HC1,其原因是(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为;列式计算该晶体的密度(g•cm﹣3).17.(1)甲烷(CH4)的摩尔质量为;(2)8g CH4中约含有个分子,在标准状况下所占的体积约为L;(3)所含原子数相等的甲烷和氨气(NH3)的质量比为.18.17克NH3共有mol原子,同质量的NH3和H2S分子个数比为.在标准状况下,35.5g氯气的体积是L,将其与氢气完全化合,需氢气的物质的量是mol﹣1.19.塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料.添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害.其合成线路图如图I所示:已知以下信息:①②(﹣R1、R2表示氢原子或烃基)③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图Ⅱ所示(1)C的结构简式为,E中所含官能团的名称是.(2)写出下列有关反应的化学方程式:①E和H2以物质的量比1:1反应生成F:;②B和F以物质的量比1:2合成DBP:;反应类型为.(3)同时符合下列条件的B的同分异构体有种,写出其中任意两种同分异构体的结构简式.①不能和NaHCO3溶液反应②能发生银镜反应③遇FeC13溶液显紫色④核磁共振氢谱显示苯环上只有一种氢原子.2016-2017学年福建省漳州市芗城中学高三(上)月考化学试卷(9月)参考答案与试题解析一、单选题(本大题共13小题,共52分)1.我国明代《本草纲目》记载了烧酒的制造工艺:“凡酸坏之酒,皆可蒸烧”,“以烧酒复烧二次…价值数倍也”.这里用到的实验方法可用于分离()A.苯和水B.乙酸乙酯和乙酸C.食盐水和泥沙 D.硝酸钾和硫酸钠【考点】物质的分离、提纯的基本方法选择与应用.【分析】烧酒的制造工艺利用蒸馏的方法,可用于分离沸点不同的液体混合物,以此解答.【解答】解:烧酒的制造工艺利用蒸馏的方法,可用于分离沸点不同的液体混合物,A.苯和水互不相溶,可用分液的方法分离,故A错误;B.乙酸乙酯和乙酸沸点不同,可用蒸馏的方法分离,故B正确;C.泥沙不溶于水,可用过滤的方法分离,故C错误;D.硝酸钾和硫酸钠的溶解度不同,可用重结晶的方法分离,故D错误.故选B.2.下列关于物质分类的说法正确的是()A.根据原子最外层电子数的多少可将元素分为金属元素和非金属元素B.根据酸分子中含有的氢原子个数可将酸分为一元酸、二元酸、三元酸等C.汽油、漂白粉、水玻璃、王水均为混合物D.纯碱、熟石灰、醋酸、食盐水均为电解质【考点】酸、碱、盐、氧化物的概念及其相互联系;混合物和纯净物;电解质与非电解质.【分析】A、最外层电子数少的不一定是金属元素;B、根据酸能电离出的氢离子个数来分类;C、混合物是指由不同物质组成的;D、电解质是指在水溶液或是熔融状态下导电的化合物.【解答】解:A、最外层电子数少的不一定是金属元素,如氢元素的最外层电子数为1,但为非金属元素,故A错误;B、根据酸分子中电离出的氢离子个数,将酸分为一元酸、二元酸和多元酸,故B错误;C、汽油、漂白粉、水玻璃、王水均由不同物质组成,为混合物,故C正确;D、纯碱、熟石灰、醋酸在水溶液或是熔融状态下导电,属于电解质,但是食盐水是混合物,不是电解质,故D错误.故选C.3.下列关于有机物的叙述正确的是()A.乙醇.甲苯均能与钠反应生成氢气B.异丁烷与戊烷互为同分异构体C.油脂、蛋白质均属于高分子化合物D.乙烯和甲烷可用溴的四氯化碳溶液鉴别【考点】有机物的结构和性质.【分析】A.甲苯与Na不反应;B.异丁烷与戊烷含碳原子分别为4、5;C.油脂的相对分子质量为10000以下;D.乙烯与溴发生加成反应,而甲烷不反应.【解答】解:A.甲苯与Na不反应,只有乙醇与Na反应生成氢气,故A错误;B.异丁烷与戊烷含碳原子分别为4、5,均为饱和烃,为同系物,故B错误;C.油脂的相对分子质量为10000以下,不是高分子,而蛋白质为高分子,故C错误;D.乙烯与溴发生加成反应,而甲烷不反应,则乙烯和甲烷可用溴的四氯化碳溶液鉴别,故D正确;故选D.4.下列应用或事实与胶体的性质无关的是()A.洪灾发生地的农民用明矾净化河水作为生活用水B.豆腐圣地安徽八公山豆制品厂用石膏或盐卤点制豆腐C.在饱和氯化铁溶液中逐滴加入烧碱溶液,产生红褐色沉淀D.安徽海螺集团各水泥厂用先进的电除尘技术除去空气中的粉尘【考点】胶体的重要性质.【分析】A、明矾溶于水后能水解出氢氧化铝胶体;B、豆浆是胶体,能遇电解质溶液发生聚沉;C、氯化铁溶液能和氢氧化钠反应生成氢氧化铁沉淀;D、水泥厂空气中的粉尘形成胶体,能发生电泳.【解答】解:A、明矾溶于水后能水解出氢氧化铝胶体,具有吸附功能,故能净水,故A不选;B、豆浆是胶体,能遇电解质溶液发生聚沉,故可以用石膏或盐卤使豆浆聚沉而制豆腐,故B不选;C、氯化铁溶液能和氢氧化钠反应生成氢氧化铁沉淀,和胶体的性质无关,故C选;D、水泥厂空气中的粉尘形成胶体,能发生电泳,故能使粉尘向着某一极移动而达到除尘的效果,故D不选.故选C.5.N A为阿伏加德罗常数的值.下列说法正确的是()A.1 L 0.1 mol/LNaHSO4溶液中含有HSO4﹣总数为0.1N AB.16g16O2和18 g18O2中含有的质子数均为8N AC.1 mol Fe与足量的稀硝酸反应,转移电子数为2N AD.标准状况下,2.24 L Cl2溶于水所得溶液中含有的氯离子数为0.1N A【考点】阿伏加德罗常数.【分析】A、硫酸氢根在溶液中能完全电离;B、求出16g16O2和18 g18O2的物质的量,然后根据16O2和18O2均含16个质子来分析;C、铁和足量稀硝酸反应后变为+3价;D、氯气和水的反应为可逆反应.【解答】解:A、硫酸氢根在溶液中能完全电离,即在硫酸氢钠溶液中无硫酸氢根离子,故A错误;B、16g16O2和18 g18O2的物质的量均为0.5mol,而16O2和18O2均含16个质子,故0.5mol 两者中均含8N A个质子,故B正确;C、铁和足量稀硝酸反应后变为+3价,故1mol铁和硝酸反应后转移3N A个电子,故C错误;D、氯气和水的反应为可逆反应,不能进行彻底,故溶液中的氯离子个数小于0.1N A个,故D错误.故选B.6.某烃的相对分子质量小于70,1mol该烃最多可与2mol H2发生加成反应,加成产物最多能与10mol Cl2发生取代反应,则该烃的分子式为()A.C3H6B.C3H4 C.C4H6 D.C5 H8【考点】有关有机物分子式确定的计算.【分析】某烃的相对分子质量小于70,能与氢气发生加成反应,=5…10,且1mol该烃最多可与2mol H2发生加成反应,则应含2个双键或1个碳碳三键,加成产物最多能与10mol Cl2发生取代反应,则加成产物中含10和H,以此来解答.【解答】解:烃的相对分子质量小于70,能与氢气发生加成反应,=5…10,且1mol该烃最多可与2mol H2发生加成反应,则应含2个双键或1个碳碳三键,加成产物最多能与10mol Cl2发生取代反应,则加成产物中含10和H,该有机物中C原子数小于5,加成产物含10个H,加成生成丁烷,则该烃的分子式为C4H6,故选C.7.下列离子方程式中正确的是()A.铜与浓硝酸反应:3Cu+8H++2NO3﹣=3Cu2++2NO↑+4H2OB.向FeBr2溶液中通入足量Cl2:2Fe2++Cl2=2Fe3++2Cl﹣C.AlCl3溶液中加入过量氨水:Al3++3OH﹣=Al(OH)3↓D.Ca(HCO3)2溶液中加入少量澄清石灰水:Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O【考点】离子方程式的书写.【分析】A.反应生成硝酸铜、二氧化氮和水;B.亚铁离子、溴离子均全部被氧化;C.一水合氨在离子反应中保留化学式;D.少量澄清石灰水完全反应,生成碳酸钙、水.【解答】解:A.铜与浓硝酸反应的离子反应为Cu+4H++2NO3﹣=Cu2++2NO2↑+2H2O,故A 错误;B.向FeBr2溶液中通入足量Cl2的离子反应为2Fe2++4Br﹣+3Cl2=2Fe3++2Br2+6Cl﹣,故C错误;C.AlCl3溶液中加入过量氨水的离子反应为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,故C错误;D.Ca(HCO3)2溶液中加入少量澄清石灰水的离子反应为Ca2++OH﹣+HCO3﹣=CaCO3↓+H2O,故D正确;故选D.8.等物质的量的甲酸、乙酸及甘油(如图)混合物进行酯化反应,可得甘油三酯最多有(不考虑立体异构)()A.4种B.5种C.6种D.7种【考点】有机化合物的异构现象.【分析】等物质的量的甲酸、乙酸及甘油(如图)混合物进行酯化反应,若全部由单一的羧酸形成的甘油三酯,每种情况有2种结构,则有4种结构;若由两种羧酸形成的甘油三酯,只能是1个甲酸和1个乙酸,此时有3种结构.【解答】解:等物质的量的甲酸、乙酸及甘油(如图)混合物进行酯化反应,若全部由单一的羧酸形成的甘油三酯,每种情况有2种结构,则有4种结构:甲酸分别为1、2号碳上羟基反应,乙酸分别为1、2号碳上羟基反应;若由两种羧酸形成的甘油三酯,只能是1个甲酸和1个乙酸,此时有3种结构:甲酸与1号碳上羟基反应,乙酸与2号碳上羟基反应;甲酸与1号碳上羟基反应,乙酸与3号碳上羟基反应;甲酸与2号碳上羟基反应,乙酸与1号碳上羟基反应,可得到的甘油三酯最多有7种;故选D.9.有关反应14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,的下列说法错误的是()A.FeS2既是氧化剂也是还原剂B.CuSO4在反应中被还原C.14 mol CuSO4氧化了1 mol FeS2D.被还原的S和被氧化的S的质量之比为3:7【考点】氧化还原反应.【分析】该反应中Cu元素化合价由+2价变为+1价、S元素化合价由﹣1价变为+6价、﹣2价,Cu元素被还原、S元素被氧化和还原,据此分析解答.【解答】解:A.该反应中Cu元素化合价由+2价变为+1价、S元素化合价由﹣1价变为+6价、﹣2价,所以FeS2既是氧化剂,又是还原剂,故A正确;B.根据元素化合价知,部分FeS2和硫酸铜作氧化剂,故B正确;C.由方程式可知14molCuSO4发生反应,有3molS被氧化,所以氧化了1.5 mol FeS2,故C 错误;D.根据C知,被氧化的S和被还原的S质量比为7:3,故D正确;故选C.10.设阿伏伽德罗常数的数值为N A,下列说法正确的是()A.1.8g NH4+含有的电子数为N AB.1mol Cl2与足量Fe反应,转移的电子数为3N AC.46g的NO2与46g的N2O4含有的原子数不同D.标准状况下11.2L苯完全燃烧产生二氧化碳分子数为3N A【考点】阿伏加德罗常数.【分析】A、铵离子中含有10个电子,0.1mol铵离子含有含有1mol电子;B、1mol氯气与铁完全反应得到2mol电子;C、根据二氧化氮和四氧化二氮的最简式进行判断;D、根据标准状况下苯的状态不是气体进行判断.【解答】解:A、1.8g NH4+的物质的量为0.1mol,含有1mol电子,含有的电子数为N A,故A正确;B、1mol氯气与铁反应转移了2mol电子,转移的电子数为2N A,故B错误;C、二氧化氮和四氧化二氮的最简式为NO2,46g二者中都含有1mol最简式NO2,都含有3mol 原子,含有的原子数不同,故C错误;D、在标况下,苯不是气体,不能使用标况下的气体摩尔体积计算其物质的量,故D错误;故选:A.11.关于2mol氨气,下列说法正确的是()A.质量为17 gB.含有6.02×1023个NH3分子C.标准状况下的体积为44.8 LD.溶于1 L水后,液中NH4+的浓度为2 mol.L﹣1【考点】物质的量的相关计算.【分析】A、根据质量m=nM来计算;B、根据分子个数N=nNA来计算;C、根据体积V=nVm来计算;D、溶液的体积≠溶剂的体积,且氨气与水的反应为可逆反应、一水合氨的电离不完全.【解答】解:A、2mol氨气的质量m=nM=2mol×17g/mol=34g,故A错误;B、2mol氨气中的分子个数N=nN A=2mol×N A/mol=2N A=1.204×1024个,故B错误;C、2mol氨气在标况下的体积V=nVm=2mol×22.4L/mol=44.8L,故C正确;D、溶液的体积≠溶剂的体积,故溶液的体积大于1L,且氨气与水的反应为可逆反应、一水合氨为弱碱,只能部分电离,故溶液中的铵根离子的浓度小于2mol/L,故D错误.故选C.12.下列说法正确的是()A.HCHO溶液、(NH4)2SO4溶液均能使蛋白质变性B.分子式为C2H4O2的有机物不一定是羧酸C.煤的干馏是物理变化,煤的气化和液化是化学变化D.纤维素、蛋白质、油脂、糖类在一定条件下都能发生水解反应【考点】生活中的有机化合物.【分析】A、蛋白质溶液中加入浓的硫酸铵溶液会使蛋白质盐析;B、分子式为C2H4O2的有机物可以是酸,也可以是酯类;C、煤的干馏是将煤隔绝空气加强热使其分解的过程;D、葡萄糖不能发生水解反应.【解答】解:A、蛋白质溶液中加入浓的硫酸铵溶液会使蛋白质盐析,HCHO溶液能使蛋白质变性,故A错误;B、分子式为C2H4O2的有机物可以是酸,也可以是酯类,故B正确;C、煤的干馏是将煤隔绝空气加强热使其分解的过程,是化学变化,煤的气化和液化也是化学变化,故C错误;D、葡萄糖是单糖,不能发生水解反应,故D错误.故选B.13.设阿伏加德罗常数为N A,下列说法正确的是()A.标准状况下,22.4L乙烷含共价键数目为7N AB.25℃时,1.0LpH=13的Ba(OH)2溶液含OH﹣数目为0.2N AC.铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为N AD.常温常压下,6gHe含中子数为2N A【考点】阿伏加德罗常数.【分析】A、根据n=计算乙烷的物质的量,每个乙烷分子含有7个共价键,再根据N=nN A计算共价键数目;B、根据pH值计算氢离子浓度,再根据Kw计算氢氧根的浓度,利用n=cV计算氢氧根的物质的量,根据N=nN A计算氢氧根离子数目;C、铝与氢氧化钠溶液反应生成偏铝酸钠和氢气,氢元素化合价由+1价降低为0价,根据氢气计算电子转移;D、根据n=计算4He的物质的量,4He中子数为2,再根据N=nN A计算中子数目.【解答】解:A、标准状况下,22.4L乙烷含共价键数目为×7×N A mol﹣1=7N A,故A正确.B、pH=13的Ba(OH)2溶液,c(OH﹣)=0.1mol/L,所以1.0LpH=13的Ba(OH)2溶液含OH﹣数目为1.0L×0.1mol/L×N A mol﹣1=0.1N A,故B错误;C、铝与氢氧化钠溶液反应生成1mol氢气时,转移的电子数为1mol×2×N A mol﹣1=2N A,故C错误;D、4He中子数为2,6g4He含中子数为×2×N A mol﹣1=3N A,故D错误;故选:A.二、填空题(本大题共6小题,共58分)14.写出下列有机物的系统命名或结构简式:(1)2﹣甲基戊烷(2)CH3CH(CH3)C(CH3)2CH2CH32,3﹣二甲基戊烷(3)2,2﹣二甲基﹣3﹣乙基己烷(4)2﹣甲基﹣2﹣丁烯.【考点】有机化合物命名.【分析】判断有机物的命名是否正确或对有机物进行命名,其核心是准确理解命名规范:(1)烷烃命名原则:①长:选最长碳链为主链;②多:遇等长碳链时,支链最多为主链;③近:离支链最近一端编号;④小:支链编号之和最小.看下面结构简式,从右端或左端看,均符合“近﹣﹣﹣﹣﹣离支链最近一端编号”的原则;⑤简:两取代基距离主链两端等距离时,从简单取代基开始编号.如取代基不同,就把简单的写在前面,复杂的写在后面;(2)有机物的名称书写要规范;(3)对于结构中含有苯环的,命名时可以依次编号命名,也可以根据其相对位置,用“邻”、“间”、“对”进行命名;(4)含有官能团的有机物命名时,要选含官能团的最长碳链作为主链,官能团的位次最小.【解答】解:(1):最长碳链含有5个C,主链为戊烷,编号从左边开始,在2号C含有一个甲基,该有机物命名为:2﹣甲基戊烷,故答案为:2﹣甲基戊烷;(2),最长碳链含有5个C,主链为戊烷,编号从左边开始,在2、3号C各含有一个甲基,该有机物命名为:2,3﹣二甲基戊烷,故答案为:2,3﹣二甲基戊烷;(3)2,2﹣二甲基﹣3﹣乙基己烷,主链6个C原子,2号碳原子有两个甲基,3号碳原子有一个乙基,结构简式:,故答案为:;(4)2﹣甲基﹣2﹣丁烯,主链是丁烯,碳碳双键在2号、3号碳原子上,从碳碳双键最近一端编号,2号碳原子上有1个甲基,结构简式:,故答案为:.15.请同学们按照官能团的不同对下列有机物进行分类.(1)芳香烃⑨;(2)卤代烃③⑥;(3)醇①;(4)酚:⑤;(5)醛:⑦;(6)酮②;(7)羧酸⑧⑩;(8)酯④.【考点】芳香烃、烃基和同系物;卤代烃简介;醇类简介;羧酸简介.【分析】(1)芳香烃是仅含有碳氢元素且含有苯环的有机化合物.(2)烃分子中的氢原子被卤素原子取代后的化合物称为卤代烃.(3)醇是脂肪烃、脂环烃或芳香烃侧链中的氢原子被羟基取代而成的化合物.(4)羟基与苯环直接相连的化合物叫做酚.(5)醛是醛基(﹣CHO)和烃基(或氢原子)连接而成的化合物.(6)酮是羰基和烃基相连构成的化合物;(7)由烃基和羧基相连构成的有机化合物称为羧酸羧酸.(8)酯由羧酸与醇(酚)反应失水而生成的化合物,含有酯基.【解答】解:(1)⑨中仅含有碳氢元素且含有苯环,所以属于芳香烃;(2)③、⑥是烃分子中的氢原子被卤原子取代后生成的化合物,所以卤代烃;(3)①是烃分子中的氢原子被羟基取代生成的化合物,属于醇;(4)⑤中羟基直接连在苯环上,属于酚;(5)⑦是醛基和甲基连接而成的化合物,属于醛;(6)②中含有羰基,故为酮;(7)⑧⑩均是由羧基和烃基连接构成的有机物,属于酸;(8)④为乙酸乙酯,含有酯基,属于酯;故答案为:(1)⑨(2)③⑥(3)①(4)⑤(5)⑦(6)②(7)⑧⑩(8)④16.卤族元素是典型的非金属元素,单质及其化合物在工农业生产和生活中有重要的用途.(1)同主族元素的电负性大小存在一定的规律,卤族元素(F、Cl、Br、I)中,电负性最大的是F.(2)不同卤素原子之间可形成卤素互化物,如IBr、BrI3、BrF5、IF,等.卤素互化物中的化学键类型是(填标号)AD.A.极性键B.非极性键C.离子键D.σ键(3)BeCl2的分子空间构型为直线型;BF3分子中B﹣F键的键角为120°.(4)NF3分子中的N原子的杂化方式为sp3.(5)HF的相对分子质量小于HC1,但其沸点却高于HC1,其原因是HF分子间存在氢键,而HC子间不存在氢键(6)由F、Mg、K三种元素形成的某种晶体的晶胞结构如下图所示,晶胞边长为anm,该晶体的化学式为KMgF3;列式计算该晶体的密度(g•cm﹣3).【考点】晶胞的计算;元素电离能、电负性的含义及应用;化学键;配合物的成键情况;原子轨道杂化方式及杂化类型判断.【分析】(1)同主族自上而下电负性减小;(2)均属于分子晶体,原子之间通过共用电子对形成,属于极性键与σ键;(3)BeCl2的分子中Be原子形成2个σ键、没有孤对电子,为直线型结构;BF3分子中形成3个σ键、没有孤对电子,为平面正三角形构型;(4)NF3分子中中心原子形成3个σ键、有1个孤对电子;(5)HF分子之间形成氢键,沸点高于HCl的;(6)白色数目为12×=3、黑色球数目为8×=1、另外离子数目为1,由化合价代数和为0,可知白色球为氟离子,进而确定化学式,计算晶胞质量,再根据ρ=计算晶胞密度.【解答】解:(1)同主族自上而下电负性减小,故F的电负性最大,故答案为:F;(2)均属于分子晶体,原子之间通过共用电子对形成,属于极性键与σ键,故选:AD;(3)BeCl2的分子中Be原子形成2个σ键、没有孤对电子,为直线型结构;BF3分子中形成3个σ键、没有孤对电子,为平面正三角形构型,键角为120°,故答案为:直线型;120°;(4)NF3分子中中心原子形成3个σ键、有1个孤对电子,则为sp3杂化,故答案为:sp3;(5)HF存在分子间氢键,而HCl不存在分子间氢键,故HF的沸点高于HCl的,故答案为:HF分子间存在氢键,而HC子间不存在氢键;(6)白色数目为12×=3、黑色球数目为8×=1、另外离子数目为1,由化合价代数和为0,可知白色球为氟离子,故该化合物化学式为:KMgF3,晶胞质量为g,晶胞边长为anm(1nm=10﹣9m),该晶体的密度为g÷(a×10﹣7 cm)3=g.cm﹣3,故答案为:KMgF3;.17.(1)甲烷(CH4)的摩尔质量为16g/mol;(2)8g CH4中约含有 3.01×1023个分子,在标准状况下所占的体积约为11.2L;(3)所含原子数相等的甲烷和氨气(NH3)的质量比为64:85.【考点】摩尔质量;物质的量的相关计算.【分析】(1)根据摩尔质量在数值上和相对分子质量相等,单位为g/mol;(2)先根据n=来计算物质的量,再根据N=n×N A和V=n•Vm来计算;(3)根据分子与分子中原子的物质的量关系,求出CO和CO2的物质的量之比,然后求出质量比;【解答】解:(1)根据摩尔质量的单位为g/mol,在数值上等于该物质的相对原子质量或相对分子质量,因此CH4的摩尔质量为:16g/mol,故答案为:16g/mol;(2)CH4的物质的量为n==0.5mol,分子数N=n×N A=0.5mol×6.02×1023mol﹣1=3.01×1023个,体积V=0.5mol×22.4L/mol=11.2L;故答案为:3.01×1023;11.2;(3)因为一个甲烷分子中含有5个原子,一个NH3分子中含有4个原子,所以含原子数相等的甲烷和氨气的物质的量之比为4:5,则甲烷和氨气质量比为=64:85;故答案为:64:85;18.17克NH3共有4mol原子,同质量的NH3和H2S分子个数比为2:1.在标准状况下,35.5g氯气的体积是11.2L,将其与氢气完全化合,需氢气的物质的量是0.5mol ﹣1.【考点】物质的量的相关计算.【分析】根据n=结合分子的构成,以及c=计算有关物理量.【解答】解:n(NH3)==1mol,所含原子的物质的量为4mol;由n=可知:N(NH3):N(H2S)==2:1;n(Cl2)==0.5mol,V(Cl2)=0.5mol×22.4L/mol=11.2L;由反应Cl2+H2=2HCl可知:需氢气的物质的量是0.5mol;故答案为:4;2:1;11.2;0.5;19.塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料.添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害.其合成线路图如图I所示:已知以下信息:①②(﹣R1、R2表示氢原子或烃基)③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图Ⅱ所示(1)C的结构简式为CH3CH2OH,E中所含官能团的名称是碳碳双键、醛基.(2)写出下列有关反应的化学方程式:。
