GMP质量体系纯化水系统运行记录
GMP纯化水系统运行检查记录

GMP纯化水系统运行检查记录日期:__________________检查人:__________________检查仪器:__________________1.检查仪器准备1.1确保检查仪器已校准,并且正常工作。
1.2调整仪器到正确的检测模式,并保持稳定。
2.检查纯化水系统设备2.1检查纯化水系统设备的外观是否有任何损坏或异常。
2.2检查水泵、管道、阀门等设备是否运行正常,并且无泄漏情况。
2.3检查纯化水系统设备的温度、压力是否在正常范围内。
记录下温度和压力值。
3.检查纯化水供应质量3.1检查纯化水系统的原水质量是否满足要求,如有变化记录下具体参数。
3.2检查纯化水的电导率是否在合适的范围内。
记录下电导率值。
3.3取样并测试纯化水的微生物指标,如菌落总数、大肠菌群等。
记录下测试结果。
4.检查纯化水系统操作和记录4.1检查操作日志和记录,确保运行正常并且及时记录。
4.2检查设备校准记录,确保各项仪器设备都进行了定期校准。
4.3检查纯化水系统维护记录,确保定期维护工作得到执行。
4.4检查发生过的故障和问题的处理记录,确保问题得到解决。
4.5检查消毒程序和记录,确保纯化水系统被定期消毒。
4.6检查其它相关记录,如使用材料记录、故障维修记录等。
5.检查纯化水系统清洁和维护5.1检查纯化水系统设备的清洁情况,如管道、反应器等。
5.2检查纯化水系统设备的滤芯和膜的更换情况,如何更换时间和方法。
5.3检查纯化水系统设备的洗涤剂和消毒剂的使用情况,如何使用和存储。
6.检查纯化水系统的风险评估和控制6.1检查对纯化水系统的各种风险进行的评估和控制措施的执行情况。
6.2检查纯化水系统的紧急事件处理程序和记录,确保应急措施得到执行。
6.3检查纯化水系统的紧急备份设备和备件的存在和可用性。
7.总结和纪录7.1对纯化水系统的检查进行总结,并记录下发现的问题和需要改进的地方。
7.2确定下一步的改进措施,并制定改进计划。
符合2010版GMP要求的纯化水URS

纯化水制备系统运行记录

<5.0µs/cm
EDI
产水压力PI460.6.1.2
(0.5~1.5)bar
浓水压力PI460.6.1.1
(0.5~1.0)bar
产水电导QE460.6.2
<0.5µs/cm
浓水流量FIS460.6.1
(180-220)L/h
记录人
复核人
备注:
注:参数正常运行范围是指纯化水制备系统正常制水时的参数范围。
二级
RO
进水压力PIS460.5.4
(6.0~15.0)bar
浓水压力PI460.5.5
(6.0~10.0)bar
产水压力PT460.6.1
(1.0~3.0)bar
进水PHQE460.5.1
7.0~8.5
进水流量FI460.5.1
(2.7-3.3)m3/h
产水流量FIT460.6.1
(2.0-2.4)m3/h
处理
单元
运行参数
正常运行范围
日期:
记录时间1
记录时间2
记录时间3
记录时间4
原水罐
液位LS360.1.1
(0.2-2.4)m
流量FI360.2.1
(8.1-9.9)m3/h
多介质
过滤器
进水压力PI360.3.1
(2.0-5.0)bar
出水压力PIS360.3.2
(2.0-5.0)bar
压差
≤1.0bar
(2.0-4.0)bar
压差
≤1.0bar
一级保安
过滤器
进水压力PI270.5.1
(2.0-4.0)bar
出水压力PI270.5.2
(2.0-4.0)bar
制药厂纯化水系统GMP验证方案

专业资料目录1归纳2目的3考据范围及依照4考据组织与职责5考据周期及考据进度安排6考据项目及方法6.1 纯化水系统安装确认纯化水系统运转确认6.3 纯化水系统性能确认7考据结果与议论8考据方案的培训9考据记录word 圆满格式21归纳我企业的纯化水系统由原水罐、原水泵、石英砂过滤器、活性炭过滤器、树脂消融器、保安过滤器(5 μm)、一级反浸透装置、离子交换床、保安精美过滤器(0.22 μm)、纯化水罐、臭氧发生器、微孔膜过滤器(0.22 μ m)、纯化水输送泵、紫外灭菌器等设施组成。
原水经原水罐、石英砂过虑器、活性炭过滤器、树脂消融器、一级反浸透装置、离子交换床、保安精美过滤器、进入纯水罐再经过微孔膜过滤器(0.22 μm)、紫外灯灭菌后供给车间。
现对纯化水系统进行考据。
纯化水系统工艺流程原水进入原水罐原水泵手动石英砂过滤器正反冲洗水排放手动活性炭过滤器正反冲洗水排放再生装置(盐罐)树脂消融器再生冲洗排放5μm保安过滤器ROⅠ高压水泵RO膜组冲洗装置一级反浸透系统一级浓水排放再生装置(酸碱罐)离子交换床再生冲洗排放0.22 μm保安精美过臭氧灭菌纯水罐0.22 μm微孔过滤器纯化水输送泵3紫外线杀菌器车间各用水滴总回水纯化水储罐二车间颗粒包二车间铝塑包0.22 μm过滤器装室装室输送泵二车间散剂内二车间洗衣室包室紫外灯二车间容器具清二车间洗瓶洁存放间一车间容器具清洁存放间二车间干燥室二车间铝塑包前办理车间收粉装室一车间洗衣室间二车间总混室一车间工具干净二车间制丸室前办理车间容器二车间干燥室存放间具干净存放间二车间合坨室一车间糖浆配剂二车间粉碎室前办理车间工器室二车间硅胶干具干净存放间二车间制粒室燥室一车间糖浆灌装二车间压片室室一车间酊剂前室二车间配浆室一车间酊剂灌装一车间酊剂配剂二车间工具干净二车间包衣室室室存放间系统各部分功能4原水的预办理设施及功能石英沙过滤器内充填精选的石英砂和锰砂,可过滤掉原水中的颗粒杂质和悬浮物及部分重金属离子(比方:铁等),控制进水浊度及淤泥污染。
新版GMP对纯化水设备系统要求

新版 GMP 对纯化水设备系统的要求一、GMP 对纯化水设备系统的总体要求1.化学指标:符合中华人民共和国药典 2021 版制药纯化水要求2.卫生学检查:微生物 10CFU/100ml3.内毒素:4. 电导率≤ 2 μ S/cm 电(阻率≥ 0.5 MΩ *CM)药品生产用水应适合其用途,应至少采用饮用水作为制药用水。
各类药品生产选用的制药用水应符合?中华人民共和国2021 版药典?的相关要求。
饮用水应符合国家有关的质量标准,纯化水、注射用水应符合?中华人民共和国2021 版药典?的质量标准。
水处理设备及其输送系统的设计、安装和维护应能确保制药用水到达设定的质量标准。
水处理设备的运行不得超出其设计能力。
纯化水、注射用水储罐和输送管道所用材料应无毒、耐腐蚀;储罐的通气口应安装不脱落纤维的疏水性除菌滤器;管道的设计和安装应防止死角、盲管。
应对制药用水及水源的水质进行定期监测,并有相应的记录。
纯化水、注射用水的制备、储存和分配应能防止微生物的滋生,如注射用水可采用70 ℃以上保温循环。
应按照操作规程定期消毒纯化水、注射用水管道、储罐以及其它必要的辅助管道〔如清洁、消毒用的管道、生产用临时连接管道〕,并有相关记录。
操作规程还应详细规定制药用水微生物污染的警戒限度、纠偏限度和应采取的措施。
二、 GMP 认证对纯化水设备的要求1、结构设计应简单、可靠、拆装简便。
2、为便于拆装、更换、清洗零件,执行机构的设计尽量采用的标准化、通用化、系统化零部件。
3 、设备内外壁外表,要求光滑平整、无死角,容易清洗、灭菌。
零件外表应做镀铬等外表处理,以耐腐蚀,防止生锈。
设备外面防止用油漆,以防剥落。
4、制备纯化水设备应采用低碳不锈钢或其他经验证不污染水质的材料。
制备纯化水的设备应定期清洗,并对清洗效果验证。
5、注射用水接触的材料必须是优质低碳不锈钢〔例如 316L 不锈钢〕或其他经验证不对水质产生污染的材料。
制备注射用水的设备应定期清洗,并对清洗效果验证。
纯化水系统设备运行记录
关 时 分
时 分
正常□
异常□
紫外灭菌器
开 时 分
关 时 分
时 分
正常□
异常□
累计时间:
微孔过滤器
开 时 分
关 时 分
时 分
正常□
异常□
压力:
水处理臭氧发生器
开 时 分
关 时 分
时 分
正常□
异常□
操作人
复核人
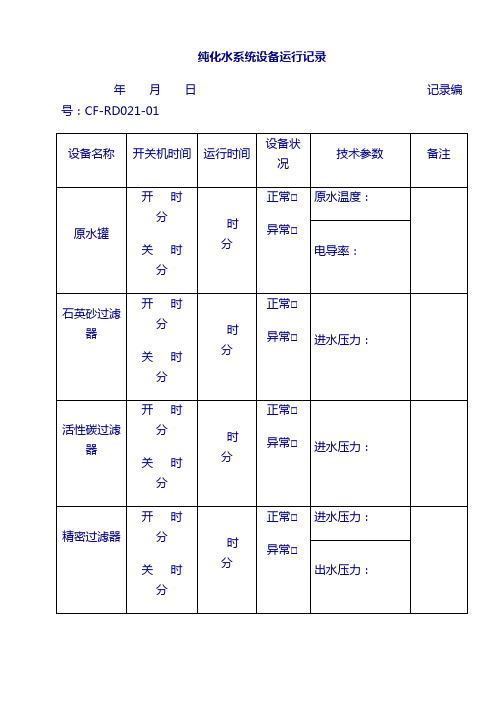
纯化水系统设备运行记录
年月日记录编号:CF-RD021-01
设备名称
开关机时间
运行时间
设备状况
技术参数
备注
原水罐
开 时 分
关 时 分
时 分
正常□
异常□
原水温度:
电导率:
石英砂过滤器
开 时 分
关 时 分
时 分
正常□
异常□
进水压力:
活性碳过滤器
开 时 分
关 时 分
时 分
正常□
异常□
进水压力:
精密过滤器
开 时 分
关 时 分
时 分
正常□
异常□
进水压力:
出水压力:
一级高压泵
开 时 分
关 时 分
时 分
正常□
异常□
膜前压力:
膜后压力:
一级反渗透
开 时 分
关 时 分
时 分
正常□
异常□
淡水流量:
浓水流量:
电导率:
中间水罐
(一级纯水)
开 时 分
关 时 分
时 分
正常□
异常□
二级高压泵
开 时 分
关 时 分
时 分
正常□
GMP纯化水系统验证之安装确认

纯化水系统验证之安装确认结合实际工作,总结纯化水系统安装确认的主要项目如下:1先决条件确认l DQ 报告已经完成并审批。
l 出场验收测试完成并形成 FAT 报告。
l 系统安装已经完成,试车和启动设备已经成功执行。
l 安装确认方案已获批准。
l 供应商的操作和维护手册必须是竣工版的。
l 执行确认活动人员已接受本方案的培训。
2人员确认l 相关人员经过培训能够满足安装确认验证要求。
3文件确认l 用户需求l 系统影响性评估l 组件关键性评估l 订购单(合同)l 功能设计规格书注:FDS 可以是一个或多个文件详细描述水系统执行的性能要求。
在试车和 OQ 时FDS 功能被测试。
l 详细设计规格书(分为软件和硬件设计说明)注:DDS 可以是一个或几个文件,详细说明水系统是怎样建造的。
在试车和IQ时FDS功能被测试或确认。
DDS 应该包括以下内容:l 设计确认l FAT报告硬件部分l P&ID 图、工艺流程图注:应体现材质、尺寸、阀门型号、管口方位、管路的标识、仪表、取样点等,关键的特征要体现出来。
l 设备平面布置图l 设备安装图l 设备配置表l 材质证明材料l 备品备件清单注:复杂组件或部位的安装图l 轴测图:(水系统安装工程结束时应建立体现实际情况的完备的竣工轴测图)注:•是一个有价值的工具,如果未来(或当时)需要对系统进行改造时,有利于改造施工,确定正确的排空系统。
•可以与焊点图结合在一起(焊点带编号),做为焊点检查和焊接记录检查的依据。
•取样点/ 使用点示意图•最好有一个系统图,还有一个平面位置图,有样有助于取样人取样。
电气控制系统l 接线电气图l 电气控制配置表l 气路图l PLC 输入输出(I/O)端口分配表l 参数表l 报警清单l 仪表清单和仪表证书l 操作和维护手册l 洁净管道配置证书(焊接报告、酸洗钝化报告)4P&ID图确认l 现场走访和检查安装系统的 PID 图,检查管路安装、管路标签、阀门标签、阀门安装、仪表安装、其它部件安装、设备安装、设备标签。
制药用纯化水系统水过GMP认证资料要求

制药用纯化水水系统GMP验证资料制药用水系统的验证,是为了证实整个工艺用水系统能够按照设计的目的进行生产和可靠操作的过程。
验证工作需要从设计阶段就开始,通过监按建造、使用过程,收集和组织相关的文件资料,最终形成完善的验证文件。
通常,工艺用水系统的验证程序分为三个方面,即确认系统中采用的所有关键的硬件和软件安装是否符合原定的要求(IQ);确认工艺用水系统中使用的设备或系统的操作是否能够满足原定的要求(OQ);确认工艺用水系统采用的工艺是否能够按照原定的要求正常的运转(PQ)。
1 验证的准备在针对一个指定的工艺用水系统,进行验证以前应该做好验证前的准备工作,包括下述使用文件所规定的有关内容。
使用文件是由建造工艺用水系统的工程公司、设备制造厂、使用者共同制作的。
要求这些文件必须以合适的形式组织起来,更便于接受药政管理部门(SDA、FDA等)的检查和批准。
系统的使用测试和文件将满足多种资格要求。
使用文件包括以下六个方面。
(1)文件清单①系统内设备,包括设备出厂标签号、生产厂商、样品序号和设备尺寸大小;②PC/PLC/DOS/WINDOWS输入,输出和警告;③阀门,包括标签号、位置、类型、尺寸;④关镀的和非关键的设施,包括标签号、位置、类型、作用/目的、范围和测定日期;⑤管道,包括节段号、类型、尺寸和完成情况;⑥滤膜,包括标签号、位置、品种、尺寸、制造用的材料、生产商、型号和孔径大小;⑦工艺过程和配套公用工程,包括系统名、提供压力、温度和所需电力;⑧采购、安装合同中所需的原材料;⑨零部件清单;⑩标准操作程序(适用于系统设备的操作、维护、测定,运行管理)。
(2)工厂测试程序①设备测试程序,测定程序和数据表;②压力测试,PLC/PC测试;③安全检查,制动设备的操作测试步骤。
(3)焊接文件①焊接管道材料的质量保证书,材料成分报告书;②焊工证书确认,焊接质量的检查记录;③焊接设备合格证书,焊接口抽样检查的百分比;④焊接记录,焊接检查百分比;⑤焊接程序,焊接检查证书和仓储。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
GMP质量体系纯化水系统运行记录
GMP(Good Manufacturing Practice)质量体系是制药行业的一项质量管理体系,旨在确保药品的质量、安全和有效性。
GMP质量体系覆盖了制药过程中的所有环节,包括纯化水系统的运行。
纯化水系统是制药过程中至关重要的一环,它用于制备药品、清洗设备和容器,并直接参与到药品的生产过程中。
因此,纯化水系统的运行记录必须按照GMP要求进行,以确保水质符合规定的要求。
以下是一份GMP质量体系纯化水系统运行记录的样例,供参考:
日期:20XX年XX月XX日
开始时间:XX:XX
结束时间:XX:XX
运行人员:XXX
1.水源水质检查:
-水源:XXX水厂自来水
-采样点:水源水入口
-采样时间:XX:XX
-采样人员:XXX
-检测项目:PH、电导率、微生物总数、总溶解固体、氯含量等
- 检测结果:PH值为X.X,电导率为XXX mS/cm,微生物总数为XXX CFU/mL,总溶解固体为XXX mg/L,氯含量为XXX ppm
2.原水处理:
-设备:XXX设备
-运行时间:XX:XX-XX:XX
-处理方法:XXX(如过滤、软化、除氯等)
-操作人员:XXX
-处理效果:原水处理后,水质符合要求,满足纯化水系统的进水质
量要求。
3.纯化水系统操作:
-设备:XXX设备(如反渗透设备、电离交换设备等)
-运行时间:XX:XX-XX:XX
-操作人员:XXX
-参数设定:进水压力为XXXMPa,运行时间为XX小时,脱盐率为XXX%等
-运行状态:系统正常运行,各设备工作正常,无异常报警。
-水质检测:对进水、一级纯化水、二级纯化水、纯化水储存罐等进
行水质检测,检测项目同水源水质检查。
-检测结果:与进水质量要求相比较,各水质指标符合要求。
4.系统维护:
-设备维护:设备按照GMP质量体系的要求进行维护,维护记录见XXX。
-消毒:对系统进行定期消毒,消毒记录见XXX。
-保养:定期更换滤芯、校准仪器等保养工作按计划进行。
5.故障记录:
-日期:XX月XX日
-故障描述:XXX(如设备故障、水质异常等)
-处理方法:XXX(如更换部件、调整操作参数等)
-处理结果:故障及时解决,系统恢复正常运行。
6.总结:
-本次纯化水系统运行记录表明系统运行稳定,水质符合要求,各设备工作正常。
-维护保养工作按计划进行,并记录在案。
-运行记录可作为未来质量审核的依据。
以上是一份GMP质量体系纯化水系统运行记录的样例,根据实际情况进行适当调整。
运行记录的目的是记录系统运行情况,并保证纯化水的质量符合要求,以确保制药过程中的产品质量和安全性。
