酸碱中和反应的微观实质课件(微课)
合集下载
《酸和碱的中和反应》PPT教学课件

2.处理工厂废水:工厂生产过程中产生的废 水需要进行一系列处理,如硫酸厂的废水可 加入熟石灰中和;
3.用于医疗:人胃液中含有适量盐酸,可以帮助消 化,但盐酸若过量则反而造成胃病,在这种情况 下,可以服用某些含碱性的药物如胃舒平中含 Al(OH)3,可以中和过量的胃酸;
蚊虫及其它很多昆虫分泌的毒液蚊酸呈酸性, 可以涂某些含碱性物质(如NH3·H2O)的药水,减 轻痛痒。
课题2 酸和碱的中和反应
-.
• 碱溶液中都含有OH-,酸溶液中都含有H+, • 酸和碱能否发生反应呢? • 你知道生活中哪些地方利用酸和碱的反应?
探索新知
一、中和反应
实验10如-8下图所示,在烧杯中加入约5mL稀 氢氧化钠溶液,滴入几滴酚酞溶液。用滴管慢慢 滴入稀盐酸,并不断搅拌溶液,至溶液颜色恰好 变成无色为止。
硫酸钠
氯化钙、硫酸钠这些由金属离子和 酸根离子构成的物质都属于盐。
• 思考:是中和反应吗?
• Fe2O3+6HCl=2FeCl3+3H2O • CO2+Ca(OH)2=CaCO3↓+H2O
二、中和反应在实际中的应用
1.改变土壤酸碱性:根据土壤情况,可以利用中 和反应,在土壤中加入酸性或碱性物质,调节 土壤酸碱性,如在酸性土壤中可以加入熟石灰 中和土壤酸性;
仔细观察微粒的变化
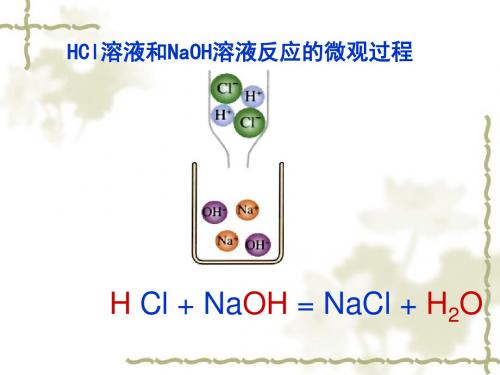
原来,稀盐酸中的 H+与氢氧化钠溶液里 的OH-结合生成水分 子。
NaOH+HCl=NaCl+
NaOH+HCl=NaCl+H2O
碱
酸盐
这种酸与碱作用生成盐和水的反 应,叫做中和反应。
CaH酸2O 2NaOH+氯H化2钙SO4= Na碱2SO4+酸2H2O
《酸和碱的中和反应》酸和碱PPT课件三

= 2NaOH
+
H2SO4==
Na2SO4
+
2H2O
盐 酸根离子
盐:由金属离子和酸根离子 组成的化合物
思考:食盐是盐吗?盐就是食盐吗?
“盐”是指一类物质,和平 时说的“食盐”不同。
中和反应:酸和碱作用生成 盐和水的反应
酸+碱→盐+水
一、常见的中和反应 酸+碱 = 盐 +水 HCl + NaOH = NaCl + H2O 2HCl + Ca(OH)2 = CaCl2 + 2H2O H2SO4+ 2 NaOH = Na2SO4 + 2H2O H2SO4+ Ca(OH)2 = CaSO4 + 2H2O HNO3 + NaOH = NaNO3 + H2O
2、处理工厂的废水
污 水 处 理
处理工厂的废水
3 、 用 于 医 药
胃 乐
胃乐说明书
[药品名称] 胃乐胶囊 [性状] 本品为胶囊剂,内容物为灰黄棕色,气味香,味微苦 [主要成分] 氢氧化铝[Al(OH)3 ]、甘草提取物、白芨、木 香等 [药理作用] 中和胃酸过多、抗溃疡、镇痛、抗炎 [功能与主治] 用于慢性胃炎胃酸和多酸胃痛。行气止痛,收 敛生肌,促进溃疡愈合。用于胃胀闷疼痛,嗳气泛酸,恶心 呕吐,气滞引起的胃腕疼痛。 [用法与用量] 口服,一次2~3粒,一日3次,空腹服用 [规格] 0.4g/粒 [贮藏] 密封,置干燥阴凉处 [包装] 20粒/盒 [有效期] 两年
好药用心制造
课堂练习一 胃酸的主要成分是 盐酸 胃乐胶囊的主要成分 氢氧化铝
氢氧化铝能中和胃酸 你能写出化学方程式吗?
Al(OH)3 + 3HCl === AlCl3 + 3H2O
酸碱中和反应的课件

和反应可以调节废水 的pH值,使废水达到排放标准
或回收利用的要求。
食品加工
在食品加工中,酸碱中和反应可 用于调整食品的口感、色泽和保
质期等方面。
05 酸碱中和反应的实验操作
实验器材的准备
实验器材
烧杯、滴定管、量筒、搅拌器、pH试纸、酸碱指 示剂等。
实验试剂
不同浓度的酸溶液和碱溶液,缓冲溶液等。
碱
在水溶液中能解离出阴离子全部是 氢氧根离子($OH^{-}$)的物质。
中和反应的原理
中和反应
酸和碱反应生成盐和水的反应。
原理
酸中的氢离子($H^{+}$)与碱中的氢氧根离子($OH^{-}$)结合生成水,同 时生成对应的盐。
中和反应的意义
01
02
03
调节溶液酸碱度
中和反应可以调节溶液的 酸碱度,使溶液达到适宜 的pH值。
分析实验结果,判断 酸碱中和反应是否完 全。
结合实验结果,探讨 酸碱中和反应在实际 生活和工业生产中的 应用。
根据实验结果,总结 酸碱中和反应的规律 和特点。
06 酸碱中和反应的注意事项
安全注意事项
01
02
03
04
实验前应佩戴防护眼镜、实验 服和化学实验防护手套,确保
个人安全。
实验过程中应避免直接接触酸 碱溶液,以防皮肤受到腐蚀。
中和反应的离子方程式
中和反应的离子方程式表示了酸和碱 在溶液中反应的实质,即氢离子(H⁺) 和氢氧根离子(OH⁻)结合生成水。
这个离子方程式表示了酸中的氢离子 和碱中的氢氧根离子结合生成水的过 程。
离子方程式可以表示为:H⁺ + OH⁻ = H₂O。
03 酸碱中和反应的类型
或回收利用的要求。
食品加工
在食品加工中,酸碱中和反应可 用于调整食品的口感、色泽和保
质期等方面。
05 酸碱中和反应的实验操作
实验器材的准备
实验器材
烧杯、滴定管、量筒、搅拌器、pH试纸、酸碱指 示剂等。
实验试剂
不同浓度的酸溶液和碱溶液,缓冲溶液等。
碱
在水溶液中能解离出阴离子全部是 氢氧根离子($OH^{-}$)的物质。
中和反应的原理
中和反应
酸和碱反应生成盐和水的反应。
原理
酸中的氢离子($H^{+}$)与碱中的氢氧根离子($OH^{-}$)结合生成水,同 时生成对应的盐。
中和反应的意义
01
02
03
调节溶液酸碱度
中和反应可以调节溶液的 酸碱度,使溶液达到适宜 的pH值。
分析实验结果,判断 酸碱中和反应是否完 全。
结合实验结果,探讨 酸碱中和反应在实际 生活和工业生产中的 应用。
根据实验结果,总结 酸碱中和反应的规律 和特点。
06 酸碱中和反应的注意事项
安全注意事项
01
02
03
04
实验前应佩戴防护眼镜、实验 服和化学实验防护手套,确保
个人安全。
实验过程中应避免直接接触酸 碱溶液,以防皮肤受到腐蚀。
中和反应的离子方程式
中和反应的离子方程式表示了酸和碱 在溶液中反应的实质,即氢离子(H⁺) 和氢氧根离子(OH⁻)结合生成水。
这个离子方程式表示了酸中的氢离子 和碱中的氢氧根离子结合生成水的过 程。
离子方程式可以表示为:H⁺ + OH⁻ = H₂O。
03 酸碱中和反应的类型
人教版九年级化学课件: 10.2酸和碱的中和反应 (共14张PPT)
谈谈本节课的收获。
作用与用途: 具有制酸、收敛与促进
溃疡愈合的作用。适用于胃溃疡、十二 指肠溃疡、急慢性胃炎、胃酸过多、胃 痉挛所致的胃痛。
3HCl+Al(OH)3====AlCl3+3H2O
二、中和反应在实际中的运用
3.农业上:改良土壤的酸碱性
二、中和反应在实际中的运用
4.工业上: 处理工厂的废水
处理硫酸厂生产中形成的含硫酸的污水。
课堂练习
2、下列反应,要借助酸碱指示剂,才能判断二者发生
反应的是( B )
A、大理石和稀盐酸
B、石灰水和稀盐酸
C、铁锈与稀盐酸
D、镁和稀硫酸
3、下列物质中,属于盐类的是(
A、Fe(OH)2 C、Na2CO3
B、Al2O3 D、H2SO4
C)
二、中和反应的运用
1.在实际生活中的运用
利用熟石灰加工的皮蛋
被蚊虫叮咬后,叮咬处很快会肿成大包, 这是因为蚊虫能在人的皮肤内分泌出蚁酸,从 而使皮肤肿痛。如果涂一些含有碱性肥皂可减 轻痛痒。
化学与生活
吃碱面时,放点醋,味道会更鲜美。
化学与生活
利用熟石灰加工 的皮蛋
二、中和反应在实际中的应用
2.医学上:中和胃酸,制成含碱性药水。
说明书 成份:氢氧化铝、碘甲基蛋氨酸、颠茄。
HCl溶液和NaOH溶液反应的微观过程
H Cl + NaOH = NaCl + H2O
HCl + NaOH == NaCl + H2O 2HCl + Ca(OH)2 == CaCl2 + 2H2O H2SO4 + 2NaOH == Na2SO4 + 2H2O H2SO4 + Ca(OH)2== CaSO4 + 2H2O
《酸和碱的中和反应》PPT课件

树”边放的是浓盐酸。
1、提出问题:酸和碱之间会发生 什么反应
2、猜想与假设:酸和碱之间能发生反应, 并有水生成
3、设计实验方案
4、进行实验探究 5、分析结果,得出结论
下面每小组自选药品和仪器,根据自己 的猜想,完成相关的实验。 稀硫酸 石 蕊试液 氢氧化钙容液 酚酞试液 稀 盐酸溶液 烧杯 玻璃杯
2.处理工业废水
酸性或碱性废水必须先进行 处理,达标后才可以排放, 否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入 下水道中?应如何处理?
新知学习 课堂小结 知能训练 上一页 下一页
3.用于医药卫生
中和蚊虫叮咬时“注 射”的蚁酸可以用含 碱性物质的溶液,如 肥皂水、稀氨水。
新知学习 课堂小结 知能训练 上一页 下一页
盐酸与氢氧化钾: HCl + KOH == KCl + H2O 盐酸与氢氧化钙: 2HCl + Ca(OH)2== CaCl2 + 2H2O 硫酸与氢氧化钾: H2SO4 + 2KOH == K2SO4 + 2H2O 硫酸与氢氧化钠: H2SO4 + 2NaOH == Na2SO4 + 2H2O
新知学习 课堂小结 知能训练 上一页 下一页
思考:熟石灰可以用来 改良酸性土壤,你知道 其中的原理是什么吗?
新知学习 课堂小结 知能训练 上一页 下一页二、中和反应在实际的应用1.改变土壤的酸碱性
利用中和反应原理,向土壤 中加入酸性或碱性物质,将 土壤pH控制在最适宜农作 物生长的范围之内。如撒熟 石灰中和酸性土壤。
新知学习 课堂小结 知能训练 上一页 下一页
胃酸过多导致胃部不适或疼痛时可口服碱性药物, 以降低胃酸的含量。如“胃舒平”(主要成分为 Al(OH)3)或小苏打片(主要成分是NaHCO3)
1、提出问题:酸和碱之间会发生 什么反应
2、猜想与假设:酸和碱之间能发生反应, 并有水生成
3、设计实验方案
4、进行实验探究 5、分析结果,得出结论
下面每小组自选药品和仪器,根据自己 的猜想,完成相关的实验。 稀硫酸 石 蕊试液 氢氧化钙容液 酚酞试液 稀 盐酸溶液 烧杯 玻璃杯
2.处理工业废水
酸性或碱性废水必须先进行 处理,达标后才可以排放, 否则会造成水体污染。
思考:化学实验产生的酸性或碱性废液能否直接倒入 下水道中?应如何处理?
新知学习 课堂小结 知能训练 上一页 下一页
3.用于医药卫生
中和蚊虫叮咬时“注 射”的蚁酸可以用含 碱性物质的溶液,如 肥皂水、稀氨水。
新知学习 课堂小结 知能训练 上一页 下一页
盐酸与氢氧化钾: HCl + KOH == KCl + H2O 盐酸与氢氧化钙: 2HCl + Ca(OH)2== CaCl2 + 2H2O 硫酸与氢氧化钾: H2SO4 + 2KOH == K2SO4 + 2H2O 硫酸与氢氧化钠: H2SO4 + 2NaOH == Na2SO4 + 2H2O
新知学习 课堂小结 知能训练 上一页 下一页
思考:熟石灰可以用来 改良酸性土壤,你知道 其中的原理是什么吗?
新知学习 课堂小结 知能训练 上一页 下一页二、中和反应在实际的应用1.改变土壤的酸碱性
利用中和反应原理,向土壤 中加入酸性或碱性物质,将 土壤pH控制在最适宜农作 物生长的范围之内。如撒熟 石灰中和酸性土壤。
新知学习 课堂小结 知能训练 上一页 下一页
胃酸过多导致胃部不适或疼痛时可口服碱性药物, 以降低胃酸的含量。如“胃舒平”(主要成分为 Al(OH)3)或小苏打片(主要成分是NaHCO3)
酸和碱的中和反应 课件

化学方程式为 NaOH+HCl=NaC。l +H2O
Contents 学习目标
1 会用pH试纸检验溶液的酸碱度。 2 了解溶液的酸碱度在实际中的意义。
pH
pH试纸和标准比色卡
pH的测定方法:
取一片pH试纸放在玻璃片(或白瓷板) 上,用 玻璃棒 蘸取待测液滴到pH试纸 上,把pH试纸显示的颜色与 标准比色卡 对照,即可读出被测液的pH。
小组实验:测定下列溶液的pH
溶 液
白 醋
汽 水
肥 皂 水
洗 洁 精
蒸 馏 水
糖 水
PH
酸 碱 性
小组实验:测定下列溶液的pH
溶 液
白 醋
汽 水
肥 皂 水
洗 洁 精
蒸 馏 水
糖 水
PH > 7
= 7
= 7
酸性 酸性 碱性 碱性
中性 中性
使用润湿后的pH试纸 酸性溶液 pH 偏大 碱性溶液 pH 偏小 中性溶液 pH 不变
课题2 酸和碱的中和反应
1.将指示剂颜色的变化填入下表:
稀盐 酸
白醋
澄清的石 灰水
肥皂 水
蒸馏 水
滴加紫
色的石 红色 红色 蕊溶液
蓝色
蓝色 紫色
滴加无 色的酚 无色 无色 酞溶液
红色
红色 无色
2.在盛有少量氢氧化钠溶液的烧杯里,滴加 几滴无色酚酞溶液,发现烧杯中的溶液变成 了 红 色,然后再往烧杯里逐滴滴加稀盐酸, 并不断用玻璃棒搅拌,发现烧杯里溶液逐渐 变成了 无 色,可见氢氧化钠确实与稀盐酸 发生了反应,这种 酸 和 碱 作用生成了盐和 水的反应,叫做 中和反应 。此反应的
Contents 学习目标
1 会用pH试纸检验溶液的酸碱度。 2 了解溶液的酸碱度在实际中的意义。
pH
pH试纸和标准比色卡
pH的测定方法:
取一片pH试纸放在玻璃片(或白瓷板) 上,用 玻璃棒 蘸取待测液滴到pH试纸 上,把pH试纸显示的颜色与 标准比色卡 对照,即可读出被测液的pH。
小组实验:测定下列溶液的pH
溶 液
白 醋
汽 水
肥 皂 水
洗 洁 精
蒸 馏 水
糖 水
PH
酸 碱 性
小组实验:测定下列溶液的pH
溶 液
白 醋
汽 水
肥 皂 水
洗 洁 精
蒸 馏 水
糖 水
PH > 7
= 7
= 7
酸性 酸性 碱性 碱性
中性 中性
使用润湿后的pH试纸 酸性溶液 pH 偏大 碱性溶液 pH 偏小 中性溶液 pH 不变
课题2 酸和碱的中和反应
1.将指示剂颜色的变化填入下表:
稀盐 酸
白醋
澄清的石 灰水
肥皂 水
蒸馏 水
滴加紫
色的石 红色 红色 蕊溶液
蓝色
蓝色 紫色
滴加无 色的酚 无色 无色 酞溶液
红色
红色 无色
2.在盛有少量氢氧化钠溶液的烧杯里,滴加 几滴无色酚酞溶液,发现烧杯中的溶液变成 了 红 色,然后再往烧杯里逐滴滴加稀盐酸, 并不断用玻璃棒搅拌,发现烧杯里溶液逐渐 变成了 无 色,可见氢氧化钠确实与稀盐酸 发生了反应,这种 酸 和 碱 作用生成了盐和 水的反应,叫做 中和反应 。此反应的
酸和碱的中和反应PPT课件14 人教版优质课件

Thyoaunk
End
结束
16 、后悔是一种耗费精神的情绪。后悔是比损失更大的损失,比错误更大的错误。所以不要后悔。 10 、聆听不代表沉默,有时安静也是一种力量。 20 、创造机遇有时并不难,只要懂得把泥土从不需要的地方移到需要的地方,但移动之前,要先能够把心中“理所当然”的冰块移走,把想像春天般铺开。 8 、如果你的个性让很多人对你敬而远之,那么你的个性是失败的,个性的成功在于能吸引,而不是能排斥。 8 、我们的梦想就在高高的山巅上,如果每天攀登一阶,矢志不渝,梦想终会实现。 20 、你要求的次数越多,你就越容易得到你想要的东西,而且也会享受到更多的乐趣。 1 、用心工作,成功根本;用心思考,力量根本;用心读书,智慧根本;用心结缘,交友根本;用心慈悲,做人根本;用心祝福,快乐根本。愿你用心,幸福一生! 19 、青春是盛开的鲜花,用它艳丽的花瓣铺就人生的道路;青春是美妙的乐章,用它跳跃的音符谱写人生的旋律;青春是翱翔的雄鹰,用它矫健的翅膀搏击广阔的天宇;青春是奔腾的河流,用它倒海 的气势冲垮陈旧的桎梏。
知能训练
食用松花蛋时常感到有涩味,这是因为制作松花蛋 的过程中用到了熟石灰和纯碱等原料。 为了减轻涩 味,可在食用松花蛋时添加某种调味品,这种调味 品最好是( B )
A、食盐
B、食醋
C、香油
D、味精
二、溶液酸碱度的表示方法—pH
知识回顾:酸碱指示剂可以检验溶液的酸碱性
石蕊溶液 酚酞溶液
稀盐酸 变红 不变色
写出三个酸与碱发生中和反应的实例:
2NaOH + H2SO4=== Na2SO4+ 2H2O
盐
Ca(OH)2 + 2HCl == CaCl2+ 2H2O KOH + HNO3 == KNO3+H2O
《中和反应的微观实质》(微课大赛获奖作品)

沪教版 九年级下册
中和反应的微观实质
温故知新
中和反应:酸和碱作用生成盐和水的反应。 表达式:酸+碱→盐+水
微观上,酸和碱之间l + NaOH
NaCl + H2O
Cl--
H+
NNaa++
OH-
H2O
中和反应实质:H+ + OH- = H2O
讲授新课
中和反应
实 质
H+ + OH- = H2O
离子个数比:H+ : OH- = 1:1
HCl + H2SO4+
Al(OH)3= AlCl3+3H2O Al(OH)3= Al2(SO4)3+6H2O
随堂练习
如图是氢氧化钠与稀盐酸恰好完全反应的微观 示意图,下列有关说法正确的是(B )
A.反应前后,溶液的PH不变 B.反应前后,Na+和Cl-数目不变 C.反应前后,H+ 和 OH- 数目不变 D.反应前后,H2O的数目不变
中和反应在我们的生产和生活中具有广泛用途,请同学们上网或 查阅资料搜集一些相关的例子。
课时小结
宏观:酸+碱→盐+水
中和反应
微观:H+ +OH- = H2O
产物:粒子相结合,形成难电 离的物质(如:水、沉淀等)
谢谢聆听
中和反应的微观实质
温故知新
中和反应:酸和碱作用生成盐和水的反应。 表达式:酸+碱→盐+水
微观上,酸和碱之间l + NaOH
NaCl + H2O
Cl--
H+
NNaa++
OH-
H2O
中和反应实质:H+ + OH- = H2O
讲授新课
中和反应
实 质
H+ + OH- = H2O
离子个数比:H+ : OH- = 1:1
HCl + H2SO4+
Al(OH)3= AlCl3+3H2O Al(OH)3= Al2(SO4)3+6H2O
随堂练习
如图是氢氧化钠与稀盐酸恰好完全反应的微观 示意图,下列有关说法正确的是(B )
A.反应前后,溶液的PH不变 B.反应前后,Na+和Cl-数目不变 C.反应前后,H+ 和 OH- 数目不变 D.反应前后,H2O的数目不变
中和反应在我们的生产和生活中具有广泛用途,请同学们上网或 查阅资料搜集一些相关的例子。
课时小结
宏观:酸+碱→盐+水
中和反应
微观:H+ +OH- = H2O
产物:粒子相结合,形成难电 离的物质(如:水、沉淀等)
谢谢聆听
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
B.反应前后,Na+和Cl-数目不变 C.反应前后,H+ 和 OH- 数目不变 D反应前后,H2O的数目不变
知识相关:中和反应实质:H+ + OH- =
例题解析 作业 H2O中和反应在我们的生产和生活中具有广泛用途,请你课后
上网或查阅资料搜集一些相关的例子。
宏观: 酸+碱=盐+水;
课堂小结
微观: H+ + OH- = H2O
酸碱 中和
粒子相结合,形成 难电离的物质(如 :水、沉淀登)
这节课
我认为
重点是……
我需要
知道的是……
我的感受
是……
我还想
去了解的是……
谢谢
中和反应的微观实质
温故知新
微观上,酸和碱之间发生怎样的反应?
化学是在分子、原子水平上研究物质的组成 结构、性质及其应用的一门自然学科。
化学反应:分子 原子
新分子
稀盐酸
氢氧化钠
= HCl + NaOH
NaCl + H2O
ClH+
Na+
Na+ Cl-
OH-
ห้องสมุดไป่ตู้
H2O
红色
无色
中和反应实质:H+ + OH- = H2O
中和反应
实 质
H+ + OH- = H2O
离子个数比:H+ : OH- = 1:1
知识讲解
3 HCl+ 1 Al(OH)3= AlCl3+3H2O
3 2 H2SO4+ Al(OH)3= Al2(SO4)3+6H2O
如图是氢氧化钠与稀盐酸恰好完全反应的微观 示意图,下列有关说法正确的是(B )
A.反应前后,溶液的PH不变
知识相关:中和反应实质:H+ + OH- =
例题解析 作业 H2O中和反应在我们的生产和生活中具有广泛用途,请你课后
上网或查阅资料搜集一些相关的例子。
宏观: 酸+碱=盐+水;
课堂小结
微观: H+ + OH- = H2O
酸碱 中和
粒子相结合,形成 难电离的物质(如 :水、沉淀登)
这节课
我认为
重点是……
我需要
知道的是……
我的感受
是……
我还想
去了解的是……
谢谢
中和反应的微观实质
温故知新
微观上,酸和碱之间发生怎样的反应?
化学是在分子、原子水平上研究物质的组成 结构、性质及其应用的一门自然学科。
化学反应:分子 原子
新分子
稀盐酸
氢氧化钠
= HCl + NaOH
NaCl + H2O
ClH+
Na+
Na+ Cl-
OH-
ห้องสมุดไป่ตู้
H2O
红色
无色
中和反应实质:H+ + OH- = H2O
中和反应
实 质
H+ + OH- = H2O
离子个数比:H+ : OH- = 1:1
知识讲解
3 HCl+ 1 Al(OH)3= AlCl3+3H2O
3 2 H2SO4+ Al(OH)3= Al2(SO4)3+6H2O
如图是氢氧化钠与稀盐酸恰好完全反应的微观 示意图,下列有关说法正确的是(B )
A.反应前后,溶液的PH不变
