磷酸二氢钠PH值测定及解离常数
磷酸二氢钠PH值测定及解离常数

磷酸二氢钠PH值测定及解离常数一、实验目的学习PH的测量方法及仪器的操作利用所学知识测量磷酸二氢钠的解离常数二、实验原理起始浓度/mol/L C O 0转化浓度/mol/L C浓度平衡C-Ca Ca Ca解离常数表达式:Ka2=a 为解离度,在温度一定时,用PH计测定PH值。
已知磷酸二氢钠的PH的值,可按PH= ,求出c( ),根据c( )=Ca即可求得一系列NaH2Po4的a和Ka2值。
取平均值即为在温度下磷酸二氢钠的解离常数。
三、仪器和药品1、仪器:酸度计、50cm 的算是滴定管两支、50cm 的碱式滴定管两支,100cm 烧杯四只、250cm 的锥形瓶两支、250mL的移液管一支、玻璃棒、0 —100 温度计一支、铁架台、滴定管夹、吸气橡皮球、滤纸。
2、药剂:NaH2PO4溶液约0.1mol/L、标准NaOH溶液约0.1mol/L、酚酞试剂四、步骤1、用移液管取25mL0.1mol/L的NaH2PO4溶液分别2只锥形瓶中,各加入2滴酚酞,分别用标准溶液NaOH溶液滴至刚出现淡红色,清清摇晃至颜色不会退去为止。
记下滴定前和滴定消耗的NaOH溶液的度数。
算出NaH2PO4的精确浓度。
公式:2、在上只干燥的100mL的烧杯中,用酸式滴定管分别加入标定的磷酸二氢钠溶液于烧杯中分别为48.00mL、24.00mL、12.00ml 、6.00mL 再用另一只装有蒸馏水的滴定管往后三只试管分别加入24.00mL、36.00mL、62.00mL蒸馏水并搅拌均匀。
3、用PH计分别测定烧杯中额浓度的NaH2PO4的PH值并记录数据与温度。
五、实验数据的记录与处理:1、磷酸二氢钠的浓度的标定C(NaOH)=()mol/L编号NaH2PO4 H2O体积NaH2PO4浓度PH C( ) 解离常数1 48.00 02 24.00 24.003 12.00 36.004 6.00 42.00表中的解离常数是Ka2–Ca3.计算Ka2de 平均值室温:T=( )℃Ka2(平均)=六、实验结果七、讨论。
磷酸氢二钠含量的测定

磷酸氢二钠含量的测定磷酸氢二钠含量的测定容量法1. 方法提要在试样中准确加人过量的盐酸标准滴定溶液,用氢氧化钠标准滴定溶液滴定过量的盐酸标准滴定溶液,以酸度计指示突跃点,根据氢氧化钠标准滴定溶液的消耗量,计算磷酸氢二钠含量。
2. 试剂和材料盐酸标准滴定溶液:c(HCl)约为1mol/L。
氢氧化钠标准滴定溶液:c(NaOH)约为1mol/L。
3. 仪器、设备酸度计配有玻璃电极和饱和甘汞电极,分度值为0.02pH单位。
电磁搅拌器:配有搅拌转子。
4. 分析步骤a) 试样的制备称取适量样品于称量瓶中,在105℃干燥4h ,置于干燥器中冷却至室温。
此样品为试样A,用于磷酸氢二钠、砷、重金属、氟化物、水不溶物含量的测定。
b) 测定称取约6.5g试样A(精确至0.0002 g),置于250mL的烧杯中,用移液管移取50.0mL盐酸标准滴定溶液和50mL水。
置于电磁搅拌器上,放人搅拌转子,搅拌至样品完全溶解。
将已校准的pH计的电极放人试验溶液中,用氢氧化钠标准滴定溶液滴定过量的盐酸标准滴定溶液,直至p H≈4出现突跃点。
记录滴定读数,计算样品消耗的盐酸标准滴定溶液的体积(V1)用氢氧化钠标准滴定溶液继续滴定至pH≈8.8 出现突跃点,记录滴定读数,计算在这两个突跃点(pH4~pH8.8)之间滴定消耗的氢氧化钠标准滴定溶液的体积(V2)5. 分析结果的表述样品消耗的盐酸标准滴定溶液的体积(V1)按式(1)计算V1= (1)式中:V—滴定至Ph≈4出现突跃点时消耗氢氧化钠标准滴定溶液的体积,mL;c1—盐酸标准滴定溶液的实际浓度,mol/L;c2—氢氧化钠标准滴定溶液的实际浓度,mol/L。
当V1c1等于或小于V2c2时,以质量百分数表示的磷酸氢二钠(以Na2HPO4计)含量(X1)按式(2)计算:X1= (2)当V1c1大于V2c2时,以质量百分数表示的磷酸氢二钠(以Na2HPO4计)含量(X2)按式(3)计算X2= (3)式中:V1—滴定至Ph≈4出现突跃点时,样品消耗的盐酸标准滴定溶液的体积,mL;V2—pH4^-pH8.8 之间滴定消耗的氢氧化钠标准滴定溶液的体积,mL;c1—盐酸标准滴定溶液的实际浓度,mol/L;c2—氢氧化钠标标准滴定溶液的实际浓度,mol/L;m—试样的质量,g;0.1420 —与 1.00 mL氢氧化钠标准滴定溶液[c(NaOH)=1.000mol/L]相当的以克表示的磷酸氢二钠的质量。
设计实验:磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定模板

设计实验:磷酸二氢钠与磷酸氢二钠混合液中各组分含量的测定模板精心整理设计实验:磷酸二氢钠(NaH2PO4)与磷酸氢二钠(Na2HPO4)混合液中各组分含量的测定实验者:XXX[1]指导老师:XXX[2]([1]武汉大学化学与分子科学学院20XX级XXX班学号:XXXX[2]武汉大学化学与分子科学学院分析实验指导老师)摘要:以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝或溴甲酚绿为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4),分别确定其含量。
关键词:酸碱滴定混合液含量测定一、实验目的实验测定混合液中NaH2PO4与Na2HPO4的含量。
二、实验基本原理磷酸(H3PO4)的解离常数Ka1=7.6*10-3Ka2=6.3*10-8Ka3=4.4*10-13NaH2PO4中[H+]=(Ka1*Ka2)1/2=2.19*10-5,pH=4.66Na2HPO4中[H+]=(Ka2*Ka3)1/2=1.66*10-10,PH=9.78PH变色范围,酚酞8.2~10.0,溴酚蓝3.0~4.6,溴甲酚绿3.0~5.2所以可以以酚酞为指示剂,氢氧化钠(NaOH)滴定磷酸二氢钠(NaH2PO4)至磷酸氢二钠(Na2HPO4);以溴酚蓝为指示剂,盐酸(HCl)滴定磷酸氢二钠(Na2HPO4)至磷酸二氢钠(NaH2PO4)。
三.主要实验试剂和仪器1.浓HCl溶液2.固体NaOH3.甲基橙溶液(1g*L-1)4.酚酞溶液(2g*L-1,乙醇溶液)5.两用滴定管(50ml)6.锥形瓶(250ml)7.移液管(25ml)8.百里酚酞9.溴酚蓝10.烧杯(100ml)四、实验操作步骤1.NaOH,HCl溶液的配置称取约2gNaOH于洁净的烧杯中,加水溶解,转移至塑料瓶中,稀释至约500mL,待标定。
另取约5mLHCl于洁净的烧杯中,加水溶解,转移至玻璃瓶中,稀释至约500mL,待标定。
磷酸二氢钠 各级电离常数

磷酸二氢钠各级电离常数
磷酸二氢钠(NaH2PO4)是一种盐类化合物,可溶于水。
它
在水中的电离过程可以表示为以下反应方程式:
NaH2PO4(s) ⇌ Na+(aq) + H2PO4-(aq)
根据这个反应方程式,可以推导出磷酸二氢钠的各级电离常数。
第一级电离常数(Ka1):H2PO4- ⇌ H+(aq) + HPO4^2-(aq)
第二级电离常数(Ka2):HPO4^2- ⇌ H+(aq) + PO4^3-(aq)
由于磷酸二氢钠是一元盐,只有一个阳离子(Na+)和一个酸
性氢离子(H+)在水中电离,因此只有一个电离常数。
该电
离常数通常被称为酸度常数(Ka)。
总的来说,磷酸二氢钠的电离常数可以表示为:Ka =
[H+][HPO4^2-] / [H2PO4-]
具体数值取决于溶液的浓度和温度。
聚合氯化铝_pH基准试剂-- 磷酸氢二钠_测定标准及内容

本试剂为白色结晶,易潮解,溶于水,不溶于聚合氯化铝醇。
分子式:Na2HPO4分子量:141.96(按1983年国际原子量)1 技术要求1.1 0.025m混合磷酸盐溶液pH(S)值(25℃):pH(S)Ⅱ= pH(S)Ⅰ±0.0051.2 Na2HPO4含量:99.0~100.1%。
1.3 水溶液反应:合格。
1.4 杂质最高含量(指标以百分含量计):2 试验方法测定中所需标准溶液、杂质标准液、制剂及制品按GB 601-77《化学试剂标准溶液制备方法》、GB 602-77《化学试剂杂质标准液制备方法》、GB 603-77《化学试剂制剂及制品制备方法》之规定制备。
2.1 0.025m混合磷酸盐溶液pH(S)值(25℃)测定:按GB 6851-86《pH基准试剂定值通则》之规定进行测定,使用铂双氢电极法。
0.025m混合磷酸盐溶液(0.025mNa2HPO4、0.025mKH2PO4)pH(S)I=6.864(25℃)。
2.2 Na2HPO4含量测定:称取2g于110℃烘至恒重的样品,称准至0.0002g,溶于100ml不含二氧化碳的水中。
按HG 3-1014-76《化学试剂电位滴定法通则》之规定,用0.5N盐酸标准溶液滴定至pH值4.2为终点。
Na2HPO4的百分含量(X)按下式计算:X= V·c×0.14196 ×100&nb0.14196----每毫克当量Na2HPO4之克数。
2.3 水溶液反应:称取2g样品,称准至0.01g,溶于100ml不含二氧化碳的水中,用酸度计测定。
PH值应在9.1~9.3之间。
2.4 杂质测定:样品须称准至0.01g。
2.4.1 澄清度试验:称取20g样品,溶于100ml水中,其浊度不得大于澄清度标准2号(参照HG 3-1168-78《化学试剂澄清度标准的制备及测定方法》)。
2.4.2 水不溶物:称取20g样品,溶于100ml水中,在水浴上保温1h,用恒重的4号玻璃滤埚过滤,以热水洗涤滤渣至洗液无磷酸盐反应,于105~110℃烘至恒重,滤渣不得大于0.4mg。
磷酸氢二钠检验
编号:ZL-SOP-QC-014-00目的:建立磷酸氢二钠检验操作规程范围:本规程适用于磷酸氢二钠的检验责任人:质检科原辅料检定人员内容:1.器具:分析天平、PH计、量筒、烧杯、玻璃棒、刻度吸管、纳氏比色管、移液管、电热恒温干燥箱、电位滴定仪、电炉、4号垂熔坩埚、水浴箱、砷盐检查反应装置2.试剂:15%碳酸钾溶液、焦锑酸钾试液、氯化铵镁试液、硼砂标准缓冲液、磷酸盐标准缓冲液、硝酸、稀硝酸、标准氯化钠溶液、硝酸银试液、盐酸、标准硫酸钾溶液、25%氯化钡溶液、稀硫酸、高锰酸钾滴定液(0.02mol/L)、标准铁溶液、盐酸溶液、10%磺基水杨酸溶液、氨试液、醋酸盐缓冲液(PH3.5)、标准铅溶液、硫代乙酰铵试液、标准砷溶液、盐酸、碘化钾试液、酸性氯化亚锡试液、锌粒、醋酸铅棉花、溴化汞试纸、硫酸滴定液(0.5mol/L)Na2HPPO4·12H2O 358.14[10039-32-4] 本品按干燥品计算,含Na2HPPO4不得少于99.0%。
3.性状:本品为无色或白色结晶或块状物,无臭;常温置空气中易风化。
本品在水中易溶,在乙醇中几乎不溶。
4.鉴别(1)钠盐:取供试品约100mg,置10ml试管中,加水2ml溶解,加15%碳酸钾溶液2ml,加热至沸;应不得有沉淀生成;加焦锑酸钾试液4ml,加热沸腾;置冰水中冷却,必要时,用玻棒摩擦试管内壁,应有致密的沉淀生成。
(2)磷酸盐:取供试品溶液,加氯化铵镁试液,即生成白色结晶性沉淀。
4.检查4.1碱度4.1.1操作步骤4.1.1.1称取样品1.0g,置于烧杯中。
4.1.1.2量取20ml水,倒入烧杯中,用玻璃棒搅拌,使完全溶解。
4.1.1.3以硼砂标准缓冲液校正仪器,以磷酸盐标准缓冲液核对,按《PH 计使用SOP》测定样品的pH值,读取并记录测定结果。
4.1.2.结果判定pH值为9.1-9.4 ,判为符合规定。
4.2溶液的澄清度与颜色4.2.1操作步骤4.2.1.1称取样品1.0g,置于烧杯中。
磷酸二氢钠基准试剂

磷酸二氢钠基准试剂磷酸二氢钠基准试剂,又称为磷酸氢二钠或磷酸一氢钠,是一种常见的化学试剂。
它的化学式为NaH2PO4,是一种无色结晶体,可溶于水。
磷酸二氢钠在实验室中有着广泛的应用,下面将详细介绍其性质、制备方法以及在化学实验中的应用。
磷酸二氢钠的性质:磷酸二氢钠是一种无水物,其分子中含有一个磷酸根离子和两个氢离子。
它是一种酸性盐,可以与碱反应生成磷酸,同时释放出水。
磷酸二氢钠的溶液呈酸性,可以用作pH调节剂。
此外,磷酸二氢钠也可作为一种营养添加剂,用于动物饲料中,提供磷元素。
磷酸二氢钠的制备方法:磷酸二氢钠可以通过磷酸与氢氧化钠反应得到。
首先,在适当的条件下,将磷酸与氢氧化钠溶解于水中,然后将两者混合反应,生成磷酸二氢钠。
反应方程式如下:H3PO4 + NaOH → NaH2PO4 + H2O磷酸二氢钠在化学实验中的应用:磷酸二氢钠作为一种基准试剂,广泛应用于化学实验中。
它可以用作标准溶液的制备,用于测定其他物质的浓度。
同时,磷酸二氢钠也可以用作缓冲液的组分,用于调节溶液的酸碱度。
在生物化学实验中,磷酸二氢钠也常用于DNA和RNA的电泳分析。
它可以作为缓冲液的组分,稳定溶液的pH值,保证实验的准确性和可重复性。
此外,磷酸二氢钠还可以用于制备无机盐缓冲液,用于细胞培养和生物学实验。
除此之外,磷酸二氢钠还可用于水质分析、食品加工、医药制造等领域。
例如,在水质分析中,磷酸二氢钠可以用于测定水中磷酸盐的含量,评估水质的优劣。
在食品加工中,磷酸二氢钠可以用作酸味剂、膨松剂和稳定剂,提供食品的口感和品质。
在医药制造中,磷酸二氢钠可以用于制备药品,如缓释片剂和注射液。
总结起来,磷酸二氢钠基准试剂是一种常用的化学试剂,具有广泛的应用领域。
它的制备方法简单,性质稳定,可用于标定溶液浓度、调节溶液酸碱度、电泳分析等实验。
在水质分析、食品加工和医药制造等领域也有着重要的作用。
磷酸二氢钠的应用不仅可以提高实验和生产的准确性,还能为人们的生活带来便利和安全。
磷酸一氢钠 磷酸二氢钠
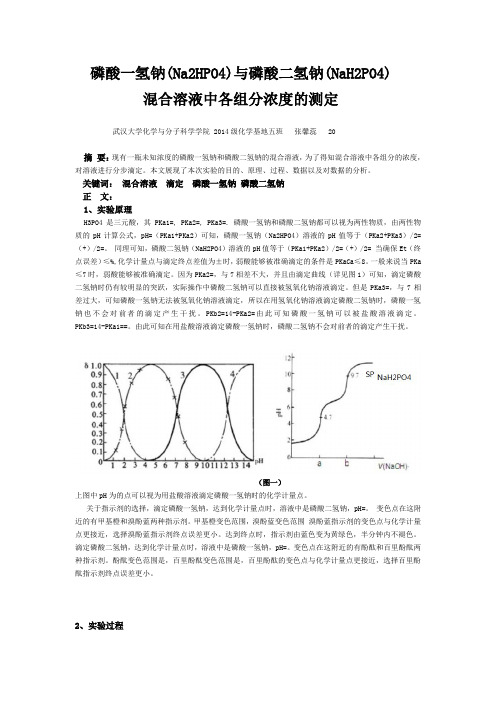
磷酸一氢钠(Na2HPO4)与磷酸二氢钠(NaH2PO4)混合溶液中各组分浓度的测定武汉大学化学与分子科学学院 2014级化学基地五班张馨蕊 20摘要:现有一瓶未知浓度的磷酸一氢钠和磷酸二氢钠的混合溶液,为了得知混合溶液中各组分的浓度,对溶液进行分步滴定。
本文展现了本次实验的目的、原理、过程、数据以及对数据的分析。
关键词:混合溶液滴定磷酸一氢钠磷酸二氢钠正文:1、实验原理H3PO4是三元酸,其PKa1=, PKa2=, PKa3=. 磷酸一氢钠和磷酸二氢钠都可以视为两性物质,由两性物质的pH计算公式,pH=(PKa1+PKa2)可知,磷酸一氢钠(Na2HPO4)溶液的pH值等于(PKa2+PKa3)/2=(+)/2=。
同理可知,磷酸二氢钠(NaH2PO4)溶液的pH值等于(PKa1+PKa2)/2=(+)/2= 当确保Et(终点误差)≤%,化学计量点与滴定终点差值为±时,弱酸能够被准确滴定的条件是PKaCa≤8。
一般来说当PKa ≤7时,弱酸能够被准确滴定。
因为PKa2=,与7相差不大,并且由滴定曲线(详见图1)可知,滴定磷酸二氢钠时仍有较明显的突跃,实际操作中磷酸二氢钠可以直接被氢氧化钠溶液滴定。
但是PKa3=,与7相差过大,可知磷酸一氢钠无法被氢氧化钠溶液滴定,所以在用氢氧化钠溶液滴定磷酸二氢钠时,磷酸一氢钠也不会对前者的滴定产生干扰。
PKb2=14-PKa2=由此可知磷酸一氢钠可以被盐酸溶液滴定。
PKb3=14-PKa1==。
由此可知在用盐酸溶液滴定磷酸一氢钠时,磷酸二氢钠不会对前者的滴定产生干扰。
(图一)上图中pH为的点可以视为用盐酸溶液滴定磷酸一氢钠时的化学计量点。
关于指示剂的选择,滴定磷酸一氢钠,达到化学计量点时,溶液中是磷酸二氢钠,pH=。
变色点在这附近的有甲基橙和溴酚蓝两种指示剂。
甲基橙变色范围,溴酚蓝变色范围溴酚蓝指示剂的变色点与化学计量点更接近,选择溴酚蓝指示剂终点误差更小。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
磷酸二氢钠PH值测定及解离常数
一、实验目的
学习PH的测量方法及仪器的操作
利用所学知识测量磷酸二氢钠的解离常数
二、实验原理
起始浓度/mol/L C O 0
转化浓度/mol/L C
浓度平衡C-Ca Ca Ca
解离常数表达式:Ka2=
a 为解离度,在温度一定时,用PH计测定PH值。
已知磷酸二氢钠的PH的值,可按PH= ,求出c( ),根据c( )=Ca即可求得一系列NaH2Po4的a和Ka2值。
取平均值即为在温度下磷酸二氢钠的解离常数。
三、仪器和药品
1、仪器:酸度计、50cm 的算是滴定管两支、50cm 的碱式滴定管两支,100cm 烧杯四只、250cm 的锥形瓶两支、250mL的移液管一支、玻璃棒、0 —100 温度计一支、铁架台、滴定管夹、吸气橡皮球、滤纸。
2、药剂:NaH2PO4溶液约0.1mol/L、标准NaOH溶液约0.1mol/L、酚酞试剂
四、步骤
1、用移液管取25mL0.1mol/L的NaH2PO4溶液分别2只锥形瓶中,各加入2滴酚酞,分别用标准溶液NaOH溶液滴至刚出现淡红色,清清摇晃至颜色不会退去为止。
记下滴定前和滴定消耗的NaOH溶液的度数。
算出NaH2PO4的精确浓度。
公式:
2、在上只干燥的100mL的烧杯中,用酸式滴定管分别加入标定的磷酸二氢钠溶液于烧杯中分别为48.00mL、24.00mL、12.00ml 、6.00mL 再用另一只装有蒸馏水的滴定管往后三只试管分别加入24.00mL、36.00mL、62.00mL蒸馏水并搅拌均匀。
3、用PH计分别测定烧杯中额浓度的NaH2PO4的PH值并记录数据与温度。
五、实验数据的记录与处理:
1、磷酸二氢钠的浓度的标定
C(NaOH)=()mol/L
编号NaH2PO4 H2O体积NaH2PO4浓度PH C( ) 解离常数
1 48.00 0
2 24.00 24.00
3 12.00 36.00
4 6.00 42.00
表中的解离常数是Ka2–Ca
3.计算Ka2de 平均值
室温:T=( )℃
Ka2(平均)=
六、实验结果
七、讨论。
