高中化学知识点总结氧化还原反应(精选课件)
高中化学知识点总结氧化还原反应

三、氧化還原反應1、準確理解氧化還原反應の概念1.1 氧化還原反應各概念之間の關係(1)反應類型:氧化反應:物質所含元素化合價升高の反應。
還原反應:物質所含元素化合價降低の反應。
氧化還原反應:有元素化合價升高和降低の反應。
(2)反應物:氧化劑:在反應中得到電子の物質還原劑:在反應中失去電子の物質(3)產物:氧化產物:失電子被氧化後得到の產物還原產物:得電子被還原後得到の產物(4)物質性質:氧化性:氧化劑所表現出得電子の性質還原性:還原劑所表現出失電子の性質(5)各個概念之間の關係如下圖例題1:下列變化過程屬於還原反應の是( D )→MgCl2→Na+→CO2 D. Fe3+→Fe例題2:下列化學反應不屬於氧化還原反應の是( C )A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2OB、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2OC、SnCl4 + 2H2O = SnO2 + 4HClD、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl1.2 常見の氧化劑與還原劑(1)物質在反應中是作為氧化劑還是作為還原劑,主要取決於元素の化合價。
①元素處於最高價時,它の原子只能得到電子,因此該元素只能作氧化劑,如+7價のMn 和+6價のS②元素處於中間價態時,它の原子隨反應條件不同,既能得電子,又能失電子,因此該元素既能作氧化劑,又能作還原劑,如0價のS和+4價のS③元素處於最低價時,它の原子則只能失去電子,因此該元素只能作還原劑,如-2價のS(2)重要の氧化劑①活潑非金屬單質,如F2、Cl2、Br2、O2等。
②元素處於高價時の氧化物、高價含氧酸及高價含氧化酸鹽等,如MnO2,NO2;濃H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③過氧化物,如Na2O2,H2O2等。
(3)重要の還原劑①金屬單質,如Na,K,Zn,Fe等。
②某些非金屬單質,如H2,C,Si等。
高中化学必修一第二章第三节氧化还原反应 (共51张PPT)

●学习目标
• 1.从化合价升降、电子得失(或偏移)的 角度理解氧化还原反应。 • 2.了解氧化反应、还原反应的概念。 • 3.初步掌握根据化合价的变化分析及判断 氧化还原反应的方法 • 4.培养由现象到本质的科学探究意识。
●阅读自学 阅读教材35-37页并完成学法大视野24-25页的填空 一 从得失氧的角度分析氧化还原反应
还原反应:物质所含元素化合价降低的反应
2)从电子的得失或偏移(本质)角度分析
氧化反应:元素的原子失去或是偏离电子的反应 还原反应:元素的原子得到或是偏向电子的反应
●巩固练习
从氧化还原反应和四种基本反应类型的角度将下列方程式进行分类
化学反应
反应类型
是否氧化还原
(1)Zn + H2SO4== ZnSO4 + H2↑ (2)3C+2Fe2O3 4Fe+3CO2↑ (3)CaCO3==CaO+CO2↑ 2KCl + 3O2↑ (4)2KClO3 (5)CaO + H2O==Ca(OH)2 (6)4P+5O2 2 P2O5 (7) Na2SO4 + BaCl2=BaSO4↓+2NaCl (8) NaOH + HCl = NaCl + H2O
●精讲倾学
氧化还原反应与四种基本反应类型
是 不是 是 不是 是 是
不是 不是
●精讲倾学 氧化还原反应与四种基本反应类型
非氧化还原反应
化合反应
分解反应 化学反应 氧化还原反应
复分解反应
置换反应
练习:学法大视野P25,体验2
小结
氧化还原反应
1)从化合价的升降(特征)角度分析
氧化反应:物质所含元素化合价升高的反应
高中化学氧化还原反应课件

在此输入标题内容从思政角度——认识氧化还原反应在此输入标题内容01.通过对化合价升降及得失电子的认识,由表及里地学习氧化还原反应的有关概念,培养宏观辨识与微观探析的能力02.从微观角度认识表示氧化还原反应的两种常见方法——双线桥法和单线桥法,培养电子守恒观念建立模型认知的核心素养素养目标小游戏:真假魔术师?在此输入标题内容碘伏与维C发生了什么神奇的反应?探秘环节在此输入标题内容探秘一:小魔术中化学反应是什么类型探秘二:碘水褪色碘单质发生了什么反应探秘三:小魔术中化学反应的实质是什么探秘四:用简笔画(线条)揭示谜底在此输入标题内容探秘一:小魔术中化学反应是什么类型?碘伏与维C反应方程式:C 6H 8O 6+I 2=C 6H 6O 6+2HI+1-2+1 +2+6–2 +2 –2+1 +1 +6-2 0 +2 0 +10 +2 0 +20 0 +2-2H 2 +CuO === Cu + H 2 O △Fe + CuSO 4 === Cu + FeSO 4O 2 +Cu === CuO 2NaOH + CuSO 4 === Cu(OH)2 + Na 2SO 4△置换反应 分解反应 化合反应 复分解反应任务1:标出各元素的化合价,并从中找出含铜元素的物质,画出铜元素的价类二维图。
体会前三个反应特征是什么。
氧化还原反应0 -1在此输入标题内容探秘一:小魔术中化学反应是什么类型问题线知识线素养线谜底一:氧化还原反应宏观辨识在此输入标题内容D 下列反应既属于氧化还原反应,又属于置换反应的是( )A.2Fe+3Cl2===2FeCl3B.Fe2O3+3CO===2Fe+3CO2C.CaO +CO2===CaCO3D.2Na+2H2O===2NaOH+H2↑在此输入标题内容探秘二:碘水褪色碘单质发生了什么反应?C 6H 8O 6+I 2=C 6H 6O 6+2HI 0-1-氧化反应:反应物所含某种(某些)元素化合价升高的反应还原反应:反应所含某种(某些)元素化合价降低的反应在此输入标题内容探秘一:小魔术中化学反应是什么类型问题线知识线素养线探秘二:碘水褪色碘单质发生什么反应谜底一:氧化还原反应宏观辨识谜底二:还原反应宏观辨识在此输入标题内容探秘二:碘水褪色碘单质发生了什么反应?-0 +2 0 +10 +2 0 +20 0 +2-2H2 +CuO === Cu + H2 O△Fe + CuSO4 === Cu + FeSO4 O2 +Cu === CuO△对立统一小试牛刀在此输入标题内容D在此输入标题内容探秘三:小魔术中化学反应的实质是什么?+17287+11281NaCl+1128Na ++17288Cl -失电子数=得电子数=电子转移数点燃-e -+e -Na +Cl -2Na+Cl 2 2NaCl钠原子和氯原子是怎样变化为Na + 、Cl - 并进而形成氯化钠?+1-1理论分析实践验证Fe与CuSO溶液组成的原电池4实践结论任务2:Fe+CuSO4=FeSO4+Cu①碳棒上有Cu析出,说明谁得了电子?②谁失了电子?Cu2+得电子生成Cu Fe失电子生成Fe2+电子转移指针偏转产生电流在此输入标题内容探秘一:小魔术中化学反应是什么类型问题线知识线素养线探秘二:碘水褪色碘单质发生了什么反应谜底一:氧化还原反应宏观辨识谜底二:还原反应宏观辨识探秘三:小魔术中化学反应的实质是什么谜底三:电子转移微观辨析在此输入标题内容探秘四:用简笔画(线条)揭示谜底?任务2:①碳棒上有Cu析出,说明谁得了电子?②谁失了电子?Cu2+得电子生成Cu Fe失电子生成Fe2+任务3:根据任务2写出铁与CuSO4溶液反应的离子方程式,打开脑洞,用简笔画(线条)表示出电子转移的方向、转移电子数在此输入标题内容Fe + Cu 2+ ==== Fe 2+ + Cu+20+20化合价升高,失2e -,氧化反应化合价降低,得2e -,还原反应Fe + Cu 2+ ==== Fe 2+ + Cu+20+202e -探秘四:用简笔画(线条)揭示谜底?双线桥法单线桥法注意事项①箭头、箭尾指向化合价变化的同种元素。
人教版高中化学史《氧化还原反应》PPT精讲课件名师课件

(2)____Fe3O4+____HNO3(稀)---____Fe(NO3)3+____NO↑ +____H2O (3)____Fe2++____Cr2O72-+____H+---____Fe3++ ____Cr3++____H2O (4)____P4+____KOH+____H2O---____K3PO4+____PH3
最新版本说课稿人教版高中化学史《 氧化还 原反应 》PPT精 讲课件 名师pp t课件 (优选 )
【 最名 新校 版课 本堂 说】课获稿奖人P教PT版-[高人中教化版学]史《高 中氧化学还 史原反《应氧 化》还PP原T精反讲应课》件P 名PT师精p讲p t课课件件((最优新选版)本)推 荐
命题点2 缺项配平 (1)ClO3-+Fe2++________---Cl-+Fe3++________。 (2)BiO3-+Mn2++________---Bi3++MnO4-+________。
【 最名 新校 版课 本堂 说】课获稿奖人P教PT版-[高人中教化版学]史《高 中氧化学还 史原反《应氧 化》还PP原T精反讲应课》件P 名PT师精p讲p t课课件件((最优新选版)本)推 荐
(3)(2016·全国Ⅲ卷)烟气中含有 SO2 和 NO,写出用 NaClO2 溶液将烟气中 NO 转化成 NO - 3 的离子方程式:________________________________________。 (4)CuSO4溶液中加入亚硫酸铵和氯化铵溶液反应生成 CuCl 沉淀的离子方程式 为__________________________________________________。 (5)PbO2 与 浓 盐 酸 共 热 生 成 黄 绿 色 气 体 , 反 应 的 化 学 方 程 式 为 ________________________________________________________________。 (6)FeCl3 与 KClO 在强碱性条件下反应可制取 K2FeO4,其反应的离子方程式为 _________________________________________________________________。 (7)(2016·江苏高考)一定条件下,向 FeSO4 溶液中滴加碱性 NaBH4 溶液,溶液 中 BH- 4 (B 元素的化合价为+3)与 Fe2+反应生成纳米铁粉、H2 和 B(OH)- 4 ,其 离子方程式为_____________________________________________________。
高中化学氧化还原反应课件.ppt

练习:
1、在下列反应中,属于氧化还原反应的是( C )
A、CaCO3+2HCl = CaCl2+CO2 +H2O
B、CaO + H2O = Ca(OH)2 C、2H2O2 催==化=剂= 2H2O + O2
高温
D、CaCO3 === CaO + CO2
三、双线桥法表示电子转移情况的步骤 及特点1 、标化合价,找变价
➢2、画线桥: ➢3、写数目: ➢4、检查:
谢谢
钠原子失电子价升 高
氯原子得电子价降 低
我想要
一个电 子。
●●
● ●
●+
●●
Cl
老兄,干嘛愁 眉苦脸的?
●
Na
你给我一个 电子,好吗?
●●
● ●
●+
●●
Cl
让我想想 那好吧
●
Na
谢谢你!
●●
●
●
●
●
●●
﹣ Cl
没关系,互相帮 助嘛。
●
Na﹢
●●
Cl
● ●
●
还 ●●原Βιβλιοθήκη 反应 ●●●
●
Cl-● ●
还原产物
被氧化 被还原
板书设计 (即小结)如下: 一、氧化还原反应 1、定义: 2、特征: 二、氧化剂和还原剂 1. 定义: 氧化剂:得到电子(元素化合价降低)的物质——被还原。 还原剂:失去电子(元素化合价升高)的物质——被氧化
2. 常见的氧化剂和还原剂:
氧化剂:O2、Cl2、HClO,MnO2等。 还原剂:Al、Zn、Fe、C、H2、CO 、KI 等
高中化学第三节 氧化还原反应优秀课件
(3)CO2 + Na2O == Na2CO3
化合反响 分解反响 化合反响
(4)Fe + CuSO4 == FeSO4 + Cu
置换反响
(5) Cl2 + 2KOH == KCl + KClO + H2 O (6)2NaHCO3 ==△= Na2CO3 + CO2↑+ H2O
(7)CaCl2 + Na2CO3 == CaCO3↓+ 2NaCl
分解反响 复分解反响
(8) H2SO4 + BaCl2 == BaSO4 ↓+ 2HCl
复分解反响
(9) Cu + 2AgNO3 == Cu(NO3)2 + 2Ag 置换反响
是 是 不是 是 是 不是 不是 不是 是
二、氧化复原反响与四种根本类型反响的关系 有单质参加的化合反响是氧化复原反响 有单质生成的分解反响是氧化复原反响。 置换反响都是氧化复原反响 复分解反响都不是氧化复原反响
电子对偏向,化合价降低,被复原 得电子,化合价降低,被复原
氧化反响:物质失去电子(或电子对偏离)的反响。 复原反响:物质得到电子(或电子对偏向)的反响
③、有电子转移〔得失或偏移〕的反响是氧化复原反响
电子的转移〔得失或偏移〕是化合价变化的实质,也是氧化 复原反响发生的实质。
从电子转移角度分析生成MgCl2反响
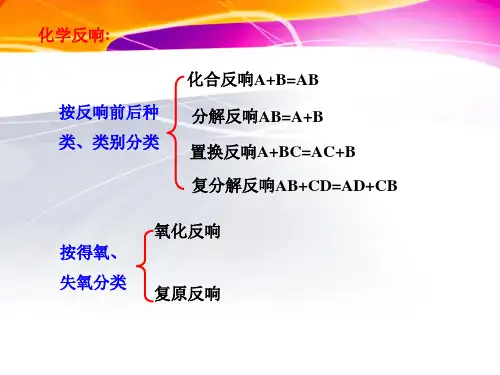
化学反响:
按反响前后种 类、类别分类
化合反响A+B=AB 分解反响AB=A+B 置换反响A+BC=AC+B 复分解反响AB+CD=AD+CB
按得氧、 失氧分类
氧化反响 复原反响
苹果的腐烂
高中化学必修一课件:2.3氧化还原反应(共28张PPT)
氧化还原反应贯穿了整个高中教材的 始末,在中学阶段的学习中,其重要 性不言而喻,是学生必须攻克的学习 重、难点之一;是学生认识物质性质, 实现物质转化的核心概念之一;其理论研究广泛应用 于日常生活、工农业生产和科学技术实践中。人教版 化学教材关于氧化还原反应的知识内容并不是集中呈 现的,而是将知识点分散在初、高中的不同章节,呈 现螺旋式编排。因此,高一阶段的学习对学生前、后 期的理解都起着“纽带”作用。
NaCl的形成过程
HCl的形成
氧化还原反应
氧化——原子失去电子或电子对 偏离的变化(本质)
氧化还原反应
电子有失必有得,一方不给,另一方就得不到; 一方不要,另一方就给不出。表现出有元素化合价升 高就同时一定有元素化合价降低,它们既对立又统一。 其实还原就是氧化的对立面。
思 • 如何定义还 考 原反应?
氧化还原反应
2、从化合价升高角度认识氧化反应
H2 + CuO = H2O +Cu 氢气被“氧化”了 2Fe+3Cl2 点=燃 2FeCl3 铁被“氯化”了
Cu+Cl2 点=燃 CuCl2
铜被“氯化”了
Zn+CuBr2 = ZnBr2 +Cu 锌被“溴化”了
氧化还原反应
氧化——物质所含元素化合价 升高的变化。
人教版必修一第二章第三节
教
设 计
教 材
学 情
学 目
教
学
教 学
理 念
分 析
分 析
标 分
法
法
过 程
析பைடு நூலகம்
氧化还原反应
依据最新修订的普通高中化 学课程标准(2017版)的化学学 科素养为目标的教学理念设计人 教版必修一第二章第三节《氧化 还原反应》第一课时。在教授学生获取知识的同 时,还重点培养学生的宏观辨识和微观探析,科 学探究和创新意识、模型认知这三方面的素养。
高中化学必修一第二章第三节-氧化还原反应优秀课件
0
+1 -1 +2 -1 0
Zn + 2HCl = ZnCl2 + H2
+1 -2 +1 +1 -1 +1 -1 +1 -2
NaOH + HCl = NaCl + H2O
不仅有得失氧的化学反响是氧化复原反响, 只要化学反响前后化合价有变化的反响 都是氧化复原反响
高温
CuO + H2 Cu + H2O
H2得到氧,被氧化,发生氧化反响
CuO失去氧,被复原,发生复原反响
思考与交流
以上反响在得氧和失氧的同时元素的化合价 有什么变化? 找出氧化反响和复原反响与元素化合价变化 的关系。
2、从化合价角度分析:
发生复原反响,被复原,化合价降低,
0
+2 -2 高温
0
+4 -2
标出反响前后 反响物升价(降价)元素 标出“得到或
各元素化合价 指向生成物对应元素 失去m×ne-
失去4e-,化合价升高,被氧化 本卷须〞知:
〔1〕箭头由反响物指向生成物,
+2
0 高温 0 +4
2CuO + C 2Cu + CO2
箭头箭尾指向化合价变化的元素 〔2〕注明“得到〞“失去〞
得到2×2e-,化合价降低,被复原
C. 有电子转移的化学反响一定是氧化复原反响。
D. 在氧化复原反响中,一种元素的化合价升高,
就必然另一种元素的化合价一定降低。
二、氧化剂和复原剂
1、氧化剂和复原剂
化合价降低,得电子,被复原
+2
0 △ 0还是+咱1哥俩好啊!
高中化学知识点总结氧化还原反应
三、氧化还原反应1、准确理解氧化还原反应的概念1.1 氧化还原反应各概念之间的关系(1)反应类型:氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价升高和降低的反应。
(2)反应物:氧化剂:在反应中得到电子的物质还原剂:在反应中失去电子的物质(3)产物:氧化产物:失电子被氧化后得到的产物还原产物:得电子被还原后得到的产物(4)物质性质:氧化性:氧化剂所表现出得电子的性质还原性:还原剂所表现出失电子的性质(5)各个概念之间的关系如下图例题1:下列变化过程属于还原反应的是( D )A.HCl→MgCl2B.Na→Na+C.CO→CO2D. Fe3+→Fe例题2:下列化学反应不属于氧化还原反应的是( C )A、3Cl2 + 6KOH =5KCl + KClO3 + 3H2OB、2NO2 + 2NaOH =NaNO3 +NaNO2 +H2OC、SnCl4 + 2H2O = SnO2 + 4HClD、3CCl4 + 2K2Cr2O7 = 2CrO2Cl2 + 3COCl2 +2KCl1.2 常见的氧化剂与还原剂(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S(2)重要的氧化剂①活泼非金属单质,如F2、Cl2、Br2、O2等。
②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
③过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂①金属单质,如Na,K,Zn,Fe等。
《高中化学人教版(必修二)课件:氧化还原反应》
酸碱中的氧化还原反应及相关 实验
探索酸碱溶液中的氧化还原反应,以及通过实验验证酸碱溶液中氧化还原反 应的发生。
金属和非金属的氧化还原反应
比较金属和非金属元素进行氧化还原反应时的特点和变化,以深化对反应机理的理解。
氧化剂和还原剂的概念及分类
认识氧化剂和还原剂的概念,了解不同类型的氧化剂和还原剂以及它们的应 用。
氧化还原反应中的电化学能
揭示氧化还原反应与电化学能之间的关联性,学习如何利用氧化还原反应来 产生电能。
氧化还原反应的实验验证
通过实验验证氧化还原反应的过程,观察反应现象,量化反应物质的变化。
电化学电池的基本概念
介绍电化学电类以及电池反应
讨论不同类型的电化学电池,并了解每种类型电池中的氧化还原反应过程和电池反应方程式。
电化学电池在生活中的应用
氧化还原反应的化学方程式
学会书写氧化还原反应的化学方程式,掌握氧化和还原反应的反应过程和物质变化。
氧化还原反应的分类
了解氧化还原反应的不同分类,如单质的氧化还原反应、元素的置换反应和氧化剂还原剂的反应。
氧化还原反应中的电荷转移和 氧化数变化
深入探讨氧化还原反应中电荷的转移和原子氧化数的变化对反应过程的影响。
高中化学人教版(必修二) 课件:氧化还原反应
让我们一起探索高中化学中令人着迷的氧化还原反应,从定义、基本概念到 实际应用。
氧化还原反应的定义及意义
氧化还原反应是指一种物质的氧化态和还原态之间的转变,是化学反应中极其重要的类型之一。
氧化还原反应的基本概念
了解氧化和还原的基本概念,包括电子的转移、原子的氧化数的变化以及电荷的转移等。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
高中化学知识点总结氧化还原反应
三、氧化还原反应
1、准确理解氧化还原反应的概念
1.1 氧化还原反应各概念之间的关系
(1)反应类型:
氧化反应:物质所含元素化合价升高的反应。
还原反应:物质所含元素化合价降低的反应。
氧化还原反应:有元素化合价升高和降低的反应.
(2)反应物:
氧化剂:在反应中得到电子(化合价降低)的物质—----表现氧化性
还原剂:在反应中失去电子(化合价升高)的物质---——表现还原性
(3)产物:
氧化产物:失电子被氧化后得到的产物-—---具有氧化性
还原产物:得电子被还原后得到的产物-—---具有还原性(4)物质性质:
氧化性:氧化剂所表现出得电子的性质
还原性:还原剂所表现出失电子的性质
注意:a.氧化剂还原剂可以是不同物质,也可以是同种物质
b氧化产物、还原产物可以是不同物质,也可以是同种物质
C。
物质的氧化性(或还原性)是指物质得到(或失去)电子的能力,与物质得失电子数目的多少无关
(5)各个概念之间的关系如下图
1。
2 常见的氧化剂与还原剂
(1)物质在反应中是作为氧化剂还是作为还原剂,主要取决于元素的化合价。
①元素处于最高价时,它的原子只能得到电子,因此该元素只能作氧化剂,如+7价的Mn和+6价的S
②元素处于中间价态时,它的原子随反应条件不同,既能得电子,又能失电子,因此该元素既能作氧化剂,又能作还原剂,如0价的S和+4价的S...文档交流仅供参考...
③元素处于最低价时,它的原子则只能失去电子,因此该元素只能作还原剂,如-2价的S
(2)重要的氧化剂
①活泼非金属单质,如F2、Cl2、Br2、O2等。
②元素处于高价时的氧化物、高价含氧酸及高价含氧化酸盐等,如MnO2,NO2;浓H2SO4,HNO3;KMnO4,KClO3,FeCl3等。
...文档交流仅供参考...
③过氧化物,如Na2O2,H2O2等。
(3)重要的还原剂
①金属单质,如Na,K,Zn,Fe等.
②某些非金属单质,如H2,C,Si等。
③元素处于低化合价时的氧化物,如CO,SO2等。
④元素处于低化合价时的酸,如HCl(浓),HBr,HI,H2S等。
⑤元素处于低化合价时的盐,如Na2SO3,FeSO4等。
1.3 电子转移的表示方法
电子转移的表示方法有双线桥法和单线桥法
(1)双线桥法
要点:a.箭头由反应物中化合价变化元素指向生成物中化合价已经变化了的同一元素。
(升高、降低各一根箭头,越过方程式中间的等号)...
文档交流仅供参考...
b.电子转移数目:化合价升高、失电子;化合价降低、得电子。
化
合价改变元素的原子个数m ×每个原子得到(或失去)电子的个数
ne-, 即m ×ne-...文档交流仅供参考...
如:
(2)单线桥法
要点:a。
线桥从反应物中化合价升高的元素出发,指向反应物中化合价降低的元素,箭头对准氧化剂中化合价降低的元素,箭头不过“=”
b.在线桥上标明转移电子总数,不写得到或失去....文档交流仅供参考... 如:
2、氧化还原反应的基本规律
2。
1 氧化还原反应的反应规律
2。
1.1 价态规律
同种元素,处于最高价态时只具有氧化性。
处于最低价态时只具有还原性。
处于中间价态时既有氧化性又有还原性。
...文档交流仅供参考...
2。
1.2歧化和归中规律
价态归中规律:同种元素不同价态之间发生氧化还原反应时,价态的变化“只靠拢,可相交,不相叉"。
2.1.3 反应先后规律
在浓度相差不大的溶液中:
(1)同时含有集中还原剂时,加入氧化剂后,还原性强的优先被氧化。
(2)同时含有集中氧化剂时,加入还原剂后,氧化性强的优先被还原。
2。
1.4 守恒规律
在任何氧化还原反应中:化合价升高总数 = 化合价降低总数,还原剂失电子总数=氧化剂得电子总数。
并且反应前后电荷数相等。
...文档交流仅供参考...
2.2 氧化性与还原性的强弱判断规律(自己总结)
(1)根据氧化还原反应方程式的判断
氧化性:氧化剂〉氧化产物
还原性:还原剂>还原产物
可总结为:比什么性,找什么剂,产物之性弱于剂.
(2)根据金属活动性顺序判断
K Ca NaMg Al Zn Fe SnPb (H)Cu Hg Ag Pt Au 从左向右还原性逐渐减弱,对应离子的氧化性逐渐增强
(3)根据非金属活动性顺序判断:
F2 Cl2Br2 I2 S
从左向右氧化性逐渐减弱,对应离子的还原性逐渐增强
(3)根据反应条件和反应的剧烈程度
反应条件要求越低,反应越剧烈,对应物质的氧化性或还原性越强。
(4)根据氧化性还原反应的程度
相同条件下:a.不同氧化剂作用于同一种还原剂,氧化产物价态高的氧化性强.
b.不同还原剂作用于同一种氧化剂,还原产物价态低的还原性强。
