12含氮化合物
有机化学课件——Chapter 11 含氮和含磷有机化合物

C6H5NH3+ · Cl氯化苯铵
(C2H5NH3+)2 · SO42硫酸二乙铵
(CH3)3N+CH2C6H5 · Br- [(C2H5)2NH2+]2 · SO42溴化三甲基苄铵 硫酸二(二乙铵)
??? ???
C4H9N+ · OH四丁基氢氧化铵
有机化学课件
(C2H5)2NH2+ · HSO4硫酸氢二乙铵
有机化学课件 22 第11章 含氮和含磷有机化合物
一、胺的碱性
N上的未共用电子对能接受一个质子,能与大多数的无机酸成 盐,所以胺具有碱性.
R
NH2 + HCl
R
+NH Cl 3
碱性强弱顺序: 脂肪胺 > NH3 > 芳香胺 pKb 3—4.5 4.75 9—10
在脂肪胺中: RNH2 < R2NH > R3N 一级 二级 三级
Na+
(2) 与羰基化合物缩合
CH3 NO2
-
CH2 NO2
O + R C R'(H)
H2O
OH R C CH2NO2 R'(H)
有机化学课件
10
第11章 含氮和含磷有机化合物
五、硝基对芳环的影响
硝基是强吸电子基, 当其与苯环直接相连时, 使芳环上的亲电取代 反应活性降低, 以致不能进行(如F-C反应). 但在卤代芳烃卤原子(如-Cl)的邻、对位引入-NO2时,卤原子的 反应活性增加,易于发生亲核取代反应.
有机化学课件 25 第11章 含氮和含磷有机化合物
二、胺的酸性
伯、仲胺中N-H键可以电离.
R2NH
R 2N - + H +
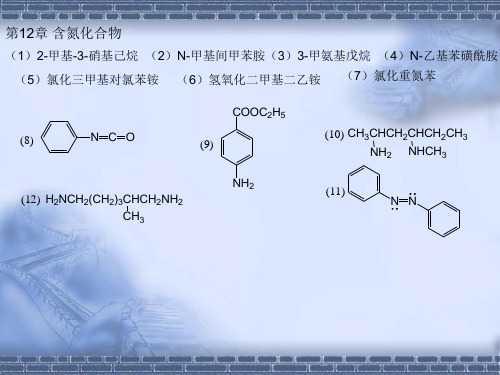
有机化学第二版高占先课后习题第12章答案
H N
O NH2 H N
NH2
OHH N
H2/Pd
12-12 根据下列反应,试确定A的构造式。
(1)CH3I过量 A(C8H15N) (2湿)Ag2O, △ 答案 A N H
(1)CH3I过量 (2湿)Ag2O, △
12-13 (1)利用RX和NH3合成伯胺的过程有什么副反应? (2)如何避免或减少这些副反应? (3)在这一合成中哪一种卤代烷不合适? (1)可发生二烷基化、三烷基化反应,生成R2NH和R3N; (2)使NH3大量过量,以增加 RX和NH3的碰撞机会生成RNH2; (3)叔卤代烃将发生消除反应,芳卤ArX也不易发生该反应。
CH3 (4)
2HNO3 2 H2SO4
CH3 NO2
Cl2 hv
CH2Cl NO2
(1) NaCN
CH2COOH NO2
Fe/HCl
CH2COOH NH2
(2) H3O,△
NO2
NO2
NO2
NH2
(5)
2HNO3 2 H2SO 4
NO2
((NH4)2S
NO2
NO2
NaNO 2-HCl 0~5¡ æ
pH=8~10
NH2 NaNO2-HCl
0~5℃
N N OH
(3)
参考(1)合成
OH COCH3 CH2CH3
HNO3 H2SO4
CH2CH3
Sn/HCl
CH2CH3
CH3COCl AlCl3
Zn-Hg HCl
CH2CH3
NaNO2-HCl 0~5℃ pH=8~10
OH H3CH2C
NO2
HO
NH2
NaNO2 / HCl
有机化学 第12章 含氮化合物

NH2 对氨基苯磺酸
4.命名芳胺时,当氮上同时连有芳基和脂肪烃基时, 应在芳胺名称前冠以N– ,明确取代基位置。
NHCH3 N(CH3)2 CH3 NCH2CH3
N-甲基苯胺
N,N-二甲基苯胺
N-甲基-N-乙基苯胺
5.氨基连在侧链上的芳胺,一般以脂肪胺为母体来 命名
CH2CH2NH2 2-苯乙胺
(二)氨与醇或酚反应
Al2O3 350~400℃,0.5MPa
CH3OH + NH3
CH3NH2 + (CH3)2NH + (CH3)3N + H2O
OH
+ NH3
(NH4)2SO3 150℃,0.6MPa
NH2
+ H2O
二、由还原反应制胺
(一)硝基化合物的还原 这是制备芳胺常用的方法。 (二)醛和酮的还原氨化 醛和酮与氨或胺反应后,再进行催化氢化,称为醛 和酮的还原氨化。
NH2 MnO2,H2SO4 ~10℃ O O
§12—4 季铵盐和季铵碱
一、季铵盐 叔胺与卤代烷反应,生成季铵盐。 季铵盐是无色晶体,溶于水,不溶于非极性
有机溶剂。 季铵盐的最重要用途是用作阳离子表面活性 剂和相转移催化剂
二、相转移催化剂
(一)含义ຫໍສະໝຸດ 当两种反应物互不相溶时,就 构成了两相。由于反应物之间不容易接触, 反应较难进行,甚至不发生反应。若加入一 种催化剂使反应物之一由原来所在的一相, 穿过两相之间的界面,转移到另一相中,使 两种反应物在均相中反应,则反应较易进行。 这种催化剂叫做相转移催化剂。
(三)与叔胺反应 脂肪族叔胺在强酸性条件下,与亚硝酸形成盐。芳 香族叔胺与亚硝酸反应,生成氨基对位取代的亚硝 基化合物(芳环上的亲电取代反应)。
有机化学:第12章 含氮化合物

R4N+X22:46:50
R4N+OH- + X-
Br CO2H + NH3 (1 mol)
NH2 CO2H OH-
NH3+ CO2-
65-70%
PhNH2 + PhCH2Cl
PhNHCH2Ph 96%
Et3N + PhCH2Cl
Et3N+CH2PhClTEBA Triethybenzylammonium chloridel
——3o胺、叔胺
22:46:50
胺的命名
四、芳香族仲胺、叔胺,基前以N-示区 别苯环的取代(P223)
22:46:50
[胺的分类之二:芳香胺、脂肪胺(P222)]
胺的命名
五、结构比较复杂的胺,将氨基为取代 基(P223)
22:46:50
六、二元胺的命名
——[胺的分类之三:一元胺、二元胺等(P222)]
H2NCH2CH2CH2CH2NH2: 1,4-丁二胺
(腐胺)
H2NCH2CH2CH2CH2CH2NH2:1,5-戊二胺
(尸胺) 腐胺、尸胺是肉腐烂时产生的,极臭、剧毒
(P224)
22:46:50
七、季铵类化合物的命名
——胺、铵(P222)
(季铵碱,碱性与KOH相当)
22:46:50 (俗名: 1227——杀菌剂)
22:46:50
胺的命名
原则:
一、简单胺按所含烃基命名(P223)
22:46:50
胺的命名
二、多个烃基时表示出烃基个数(P223)
[胺的分类之一:伯、仲、叔(P222)]
22:46:50
胺的命名
三、烃基不同时先列简单的(P223)
2021届高考一轮复习课时强化训练课题十二 氮及化合物(含解析)

2021届高考一轮复习课时强化训练课时十二氮及其化合物1.2017年1月,南京理工大学胡炳成教授团队成功合成世界上首个全氮阴离子盐,全氮阴离子化学式为N-5。
下列关于全氮阴离子盐的说法正确的是()A.每个N-5含有26个电子B.N-5的摩尔质量为71 g·mol-1C.全氮阴离子盐既含离子键又含共价键D.全氮阴离子盐可能属于电解质,也可能属于非电解质1:C解析:每个N-5中含有的电子数为7×5+1=36,A项错误;N-5的摩尔质量为14 g·mol-1×5=70 g·mol-1,B项错误;盐类均含有离子键,全氮阴离子中存在共价键,则全氮阴离子盐中既含离子键又含共价键,C项正确;全氮阴离子盐属于电解质,D项错误。
2.探究氨气及铵盐性质的过程中,下列根据实验现象得出的结论不正确的是()A.将集有氨气的试管倒扣于水槽中,液体迅速充满试管,说明氨气极易溶于水B.将pH=11的氨水稀释1 000倍,测得pH>8,说明NH3·H2O为弱碱C.加热NH4HCO3固体,观察到固体逐渐减少,试管口有液滴产生,说明NH4HCO3受热不稳定D.将红热的Pt丝伸入如图所示的锥形瓶中,瓶口出现少量红棕色气体,说明氨气的氧化产物为NO22:D解析:氨气极易溶于水生成氨水,所以将集有氨气的试管倒扣于水槽中,液体迅速充满试管,故A正确;常温下,pH=11 的氨水中c(OH-)=10-3 mol·L-1,稀释1 000倍,测得pH>8,c(OH-)>10-6 mol·L-1,说明稀释时NH3·H2O 的电离平衡正向移动,所以NH3·H2O为弱碱,故B正确;碳酸氢铵加热分解为氨气、二氧化碳和水,故C正确;氨气的氧化产物为NO,NO在锥形瓶口与氧气反应生成NO2,所以瓶口出现少量红棕色气体,故D错误。
3.实验室制取氨气、收集、验证其还原性并进行尾气处理的装置和原理能达到实验目的的是()A.用装置甲制取氨气B.用装置乙收集氨气时气体应该从a口进b口出C.装置丙中黑色固体变成红色时还原产物一定为铜D.可以用装置丁吸收氨气,进行尾气处理3:B解析:氯化铵受热分解生成氨气和氯化氢,二者在试管口遇冷又重新化合生成氯化铵,不能用装置甲制取氨气,A错误;氨气密度小于空气,可以用向下排空气法收集,即用装置乙收集氨气时气体应该从a口进b口出,B正确;装置丙中黑色固体变成红色时还原产物不一定为铜,因为氧化亚铜也是红色的,C错误;氨气极易溶于水,不能用装置丁直接吸收,应防倒吸,D错误。
华东理工大学有机化学课后答案含氮化合物

(3) .
N(CH2CH3)2 CH3CHCH2CH3
思考题12-15. 如何完成下列转变。
NH2
NHCOCH2CH2CH3 CH3CH2CH2CH2CHO H2 / Ni
答案: (1).
TM
C2H5
HCN CN SN2
C2H5 H CH3 NH2H2C
C2H5 H CH3
(2).
H CH3
Br
思考题 12-16 如保用 Gabriel 合成法来制备苯甲胺。
O C CH2Br NH C O KOH O C N CH2 C O
1. OH 2. H3O
CH2NH2
答案:
此反应为 SN2 历程,适用于位阻小的卤代烃参与的取代反应。
思考题12-17 当(R)-2-甲基丁酰胺在氢氧化钠的水溶液中与溴发生反应,预测产物的结构及它的立体化学。
答案:产物为(R)2-甲基丙胺,构型不变。
答案: (1)a>b>c>d 苯环上取代基硝基是强吸电子基,其通过共轭效应和诱导效应降低了酚氧原子上的电 子云密度,从而使质子容易离去,分子的酸性增强。 (2)a>b>c (3)b>a>c (4)A . b>c>a>d N 上供电子基团越多,N 原子上电子密度高,捕获质子能力就强。但在水中,
含氢少的胺溶剂化效应小,叔胺上没有氢,溶剂化效应极小,碱性反而比伯胺还弱。 B.a>b>c>d 仅有分子中 N 上取代基的电子效应作用。
NH2
(3).
OCH3
NO2
思考题 12-8. 请设计一个分离对甲基苯酚、环己基甲酸和对甲基苯胺混合物的方法。 答案:第一步往混合液中加入碳酸氢钠溶液 ,能溶解羧酸,分液后,(有机层留作第二步用) 往无机层中加 稀酸,羧酸即游离出。 第二步 向分离出的有机层中加入稀盐酸 ,胺能溶于盐酸溶液.分液,无机层中 加入氢氧化钠溶液即胺析出.
含氮有机化合物和杂环汇总

CH3NHCH2CH3 甲乙胺 (仲胺) 甲基-乙基-环丙基 H 3C N CH2CH3 胺(叔胺)
6
NHCH 3
N-甲基苯胺
邻-甲基苯胺 N-甲基-N-乙基 苯胺
7
NH 2 CH3
N CH3 CH2CH3
CH2NH 2
+ NH 3 Cl
苯甲胺(苄胺) 氯化苯铵 溴化四甲铵
-
(CH3)4N Br
31
第二节 重氮化合物 和偶氮化合物
重氮化合物 R-N=N(Ar)
偶氮化合物
R-N=N-R’ (Ar)
32
重氮化合物的化学性质 1.重氮基取代反应(放氮反应)
33
OH
+
N2
H
+
3 PO 2+ H 2O
O H2
/ △
N2
N2
N) 2 C ( u 2 C N KC
+
Cu
2X 2
+H
X
CN N2
X
+
27
(3) 叔胺和亚硝酸反应
N(CH3)2
N(CH3)2
+ HNO2
N O
28
鉴别:
伯胺 脂 肪 族 仲胺
HNO2
N2 黄色油 状物
叔胺
溶解
29
五.与医学有关的胺类
苯胺
NH 2 + 3Br2(水)
Br Br NH 2 Br + HBr
白
30
ห้องสมุดไป่ตู้
拓展
“新洁尔灭”
溴化二甲基十二烷基苄基铵,又称苯扎溴 铵(C6H5CH2N+(CH3)2C12H25Br-),商品名为 “新洁尔灭”。它为季铵盐型阳离子表面活性 广谱杀菌剂,杀菌力和去垢效力强,对皮肤和 组织无刺激性,对金属、橡胶制品无腐蚀作用, 不污染衣服,性质稳定,易于保存,属消毒防 腐类药物。1:1000~2000的新洁尔灭溶液广泛 用于手、皮肤、粘膜、器械等的消毒。
第12讲 氮及其化合物(讲)-2023年高考化学一轮复习讲练测(解析版)

第12讲 氮及其化合物1.结合真实情境中的应用实例或通过实验探究,了解氮及其重要化合物的主要性质,认识其在生产中的应用和对生态环境的影响。
2.结合实例认识氮及其化合物性质的多样性,了解通过化学反应可以探索物质性质、实现物质转化,认识物质及其转化在自然资源综合利用和环境保护中的重要价值。
【核心素养分析】1.变化观念与平衡思想:分析氮及其化合物的化学反应,预测在一定条件下氮及其化合物可能发生的化学变化。
2.科学探究与创新意识:发现或提出对氮及其化合物有探究价值的化学问题,能依据探究目的设计并优化实验方案,完成实验操作,能对观察记录的实验信息进行加工并获得结论。
3.科学态度与社会责任:关注氮及其化合物的社会热点问题,认识环境保护的重要性,形成可持续发展意识和绿色化学观念。
知识点一 氮气及其氧化物 1.氮的固定(1)自然固氮(2)人工固氮:合成氨工业 2.氮气(1)物理性质:无色无味气体,密度比空气略小,难溶于水。
(2)化学性质①3Mg +N 2=====点燃Mg 3N 2; ②N 2+3H 2高温、高压催化剂2NH 3; ③N 2+O 2===========放电或高温2NO 。
3.氮的氧化物(1)氮有多种价态的氧化物,氮元素从+1~+5价都有对应的氧化物,如N 2O 、NO 、N 2O 3、NO 2(或N 2O 4)、N 2O 5,其中属于酸性氧化物的是N 2O 3、N 2O 5。
(2)NO和NO2的比较性质NO NO2色、态、味无色、无味气体红棕色、有刺激性气味气体溶解性难溶于水毒性有毒,大气污染物之一有毒,大气污染物之一与水反应不反应3NO2+H2O===2HNO3+NO与氧气反应NO+O2===2NO2不反应NO与血红蛋白结合使人中毒,NO、NO2导致光化学烟雾、形成酸雨对环境的影响及破坏臭氧层【归纳总结】氮氧化物对环境的污染及防治(1)常见的污染类型①光化学烟雾:NO x在紫外线作用下,与碳氢化合物发生一系列光化学反应,产生了一种有毒的烟雾。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
芳香伯胺
CH3
NH2
芳香胺 芳香仲胺 HN(C6H5)2
芳香叔胺 N(C6H5)3
NH2
NH
N CH3
NH2
NHCH3 N(CH3)2
3
2 胺的命名
① 简单的胺以习惯命名法命名:在 “胺”字前加以烃基的名称,称“某 胺”。
(C H 3)3C N H 2
叔 丁 胺
C H 2N H 2
N H 2
苯 甲 胺 ( 苄 胺 ) 环 己 胺
?
17
▪ 不符合Hofmann消除取向的例子
当β-碳上有强吸电子基团,或可形成共轭烯烃时, 往往不符合霍夫曼规律。
18
练习:写出下列化合物经过两次霍夫曼消除后的产物
CH3
N CH3
N ββ
N H
CH3①CH3I(过 量 ) ② AgO H
β N CH3OH △
CH3 CH3
CH 3
N CH 2 CH 3
N2 OH2,Ni T, P
N2 H
还原剂: Fe/HCl, Sn/HCl, SnCl2/HCl, FeCl2/HCl
NO2
NH2
Fe
HCl
NO2
NH2
(3) 选择还原
还原剂(弱): Na2S, NaSH, (NH4)2S(只还原一个硝基)
① C H 3I(过 量 ) ② A g O H
C H 2
N (C H 3)3 O H
△
CH2
19
3 酰基化和磺酰化反应
1)酰基化 在胺的N原子上引入酰基(亲核加成-消除)
应用:保护氨基或降 低氨基的致活性
NH2 + (CH3CO)2O
(orCH3COOH)
易三元溴代
易氧化
NHCOCH3
易一元溴代 不易氧化20
Br
如何得到一元溴代产物?
NH2
(CH3CO)2O
NHCOCH3
Br2
NHCOCH3
NH2
H2O/H+
Br
Br
25
2) 硝化反应
用混酸硝化苯胺时,可将苯胺氧化成焦油状物质。 故应先将苯胺溶于浓H2SO4 ,再硝化得间位产物:
--NH2为邻对位定位基;--NH3+为间位定位基
26
如何制备o-、p-NO2产物?
RNH2 NH2 NO2
NH
(CH3)3N N(CH3)2
NaNO2/HCl 0~5℃
N2 室温
N2
室低温温反应,水 解加热有气体
黄色油状物生成
无现象
绿色
24
温故知新 5 芳胺的亲电取代反应
-NH2:强活化基团,邻对位定位基 1) 卤化反应
NH2 + 3Br2 H2O
Br NH2Br (白 )(似苯酚,可检验苯胺)
可作表面活性剂、相转移催化剂。
12
2)季铵碱:
季铵碱 季铵碱具有无机碱的性质,碱性与无机碱相当。 有些季铵碱在生物体中存在着重要生理作用:
胆碱 [OHCH2CH2N(CH3)3]+OH以卵磷脂的形式在体内调剂脂肪的代谢;
乙酰胆碱 对动物神经有调节保护作用。
13
Hofmann 消除反应(重要)
含有β-H的季铵碱受热发生消除反应,脱去水和叔胺生成烯烃。
A
12含氮化合物
C
12. 2. 1 胺的分类、命名和结构
1 胺的分类:
根据氮上所连烃基的个数分为伯、仲、叔、季胺。 *注意: 伯、仲、叔胺与伯、仲、叔醇的不同涵义
叔碳
又可分为:脂肪族和芳香族胺;一元胺、二元胺等。
2
脂伯胺
CH2NH2
脂肪胺 脂仲胺 (CH3CH2)2NH
脂叔胺 (CH3CH2)3N
2) 磺酰化反应
黄色沉淀 黄色沉淀
----可用来分离、鉴别伯、仲、叔胺。 这一反应又称为兴斯堡反应。
21
4 与亚硝酸的反应(P349)
脂肪胺和芳香胺都可与亚硝酸反应生成不同产物: 1)伯胺:
22
2)仲 胺:
3)叔胺
脂肪胺不反应
黄色油状液体 R3NNHaC N 2 lO ╳
(绿色晶体)
23
不同的胺与亚硝酸反应现象不同,可用于鉴别 脂肪及芳香伯、仲、叔胺。例如:
烯烃
OH-离子进攻β-H原子,发生双分子消除反应。
14
Hofmann 消除的取向
比较:卤代烷(或醇)的消除取向—Saytzeff 取向15
Hofmann消除取向的解释
从β-氢的位阻和酸性的差别分析源自OHHHR
CH CH CH2
N (C H 3)3
16
Hofmann 消除反应举例
1) 2)
主要产物
H
RN
H R是 给电子基团, 使 N上 电 子 更 集 中 碱性增加。
N:sp3杂 化但有部 分sp2特征
孤对电子与苯环共轭,电 子云密度减弱,碱性减弱。
8
➢ 芳香胺之间的碱性比较
芳环上吸电子取代基使胺的碱性减弱,供电子基使增强。
碱性:
pKb:
13
9.4
8.6
芳胺中分享N上孤对电子的苯环愈多,碱性也就愈弱
9
例题 1 判断碱性强弱:
NH2
﹤
NO2
NH2
﹤
NH2
﹤
CH3
N H 3 ﹤ ﹤ CH3CH2NH2 (CH3CH2)2N H
2 如何解释苄胺(
)的碱
性与烷基胺基本相同,而与芳胺不同?
10
2)成盐反应及应用
胺能与许多酸作用生成盐:
N H 2H B r
N H 3 B rN aO H
N H 2
不溶于水
4
② 系统命名:把胺看作烃的氨基衍生物, 以烃为母体,氨基为取代基。
CH3 NH2 CH3-CH-CH2-CH-CH2-CH3
2-甲基-4-氨基己烷
CH3 CH3 CH3-CH-CH2-CH-N-CH2-CH3
CH2-CH3
2-甲基-4-(二乙氨基)戊烷
➢ 氮原子上同时连有芳香烃基和脂肪烃基的胺时,以芳 香胺为母体,脂肪烃基作为氮原子上的取代基。
5
➢季铵化合物的命名
它们的命名与无机盐、无机碱的命名原则相似。
NH4+Br-
NH4+OH-
注意“氨”、“胺”及“铵”的 含义 氨基 伯仲叔胺 铵盐/季铵类化合物
6
1 胺的碱性和成盐反应
1) 胺的碱性
胺的碱性强弱是电子效应、溶剂化效应和立体效应综 合影响的结果。不同胺的碱性强弱的一般规律为:
脂肪胺(仲>伯>叔)>氨>芳香胺
27
3) 磺化反应
28
6 胺的氧化
脂肪胺及芳香胺都容易被氧化。 久置空气中的氧可使苯胺由无色透明→黄→红棕。
苯胺遇漂白粉显紫色,可用该反应检验苯胺:
N H 2C a ( O C l ) 2 O N - N H 2 ( 紫 色 )
29
12.2.4 胺的制法
1. 硝基化合物还原 (1) 催化氢化 (2)酸性还原
溶于水
不溶于水
利用这一性质可分离、提纯不溶于水的胺类化合物。 由于铵盐的水溶性较大,所以含有氨基、亚氨基或 取代氨基的药物常以铵盐的形式供用。
11
2 烷基化和季铵碱的热反应
1)烷基化:胺与卤代烃等烷基化试剂反应
伯胺
仲胺
仲胺
叔胺
季铵盐
叔胺
❖ 季铵盐:胺彻底烃基化的产物
季铵盐在有机相和水中都有一定的溶解度,
