各类藻类培养基
藻类培养基
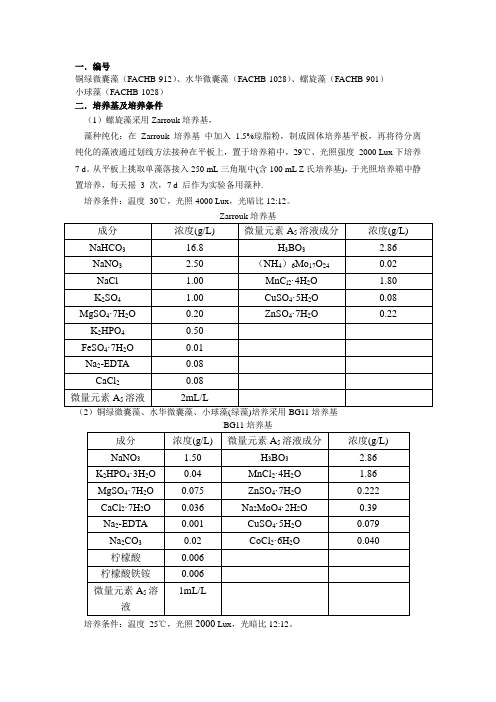
一.编号
铜绿微囊藻(FACHB-912)、水华微囊藻(FACHB-1028)、螺旋藻(FACHB-901)
小球藻(FACHB-1028)
二.培养基及培养条件
(1)螺旋藻采用Zarrouk培养基,
藻种纯化:在Zarrouk 培养基中加入 1.5%琼脂粉,制成固体培养基平板,再将待分离纯化的藻液通过划线方法接种在平板上,置于培养箱中,29℃、光照强度2000 Lux下培养7 d。
从平板上挑取单藻落接入250 mL三角瓶中(含100 mL Z氏培养基),于光照培养箱中静置培养,每天摇3 次,7 d 后作为实验备用藻种.
培养条件:温度30℃,光照4000 Lux,光暗比12:12。
(2)铜绿微囊藻、水华微囊藻、小球藻(绿藻)培养采用BG11培养基
培养条件:温度25℃,光照2000 Lux,光暗比12:12。
Zarrouk 培养基基础(不含微量元素)使用说明书

Zarrouk培养基基础(不含微量元素)使用说明书储存条件:粉末常温保存,溶液2-8℃保存。
产品编号:AMP271(不含微量元素)产品说明:Zarrouk培养基又名Z氏培养基,常用于螺旋藻、微小色球藻的培养。
A5和B6单独配制,要低温或冷冻保存,使用前要充分的摇动。
新培养基的pH值为8.2-8.5,可能会有少量沉淀产生,不影响藻类生长。
Zarrouk培养基套装组成(货号AMP271):产品组成规格编号Zarrouk培养基基础250g AMP271A5微量元素12mL(自备)AML101B6微量元素12mL(自备)AML121注:1.A5和B6已做无菌处理,并注意无菌操作,使用前要充分摇动。
2.如需制作培养基平板,应在灭菌前加入琼脂(15g/L)。
3.不同文章中Zarrouk培养基略有差异,可联系本公司定制。
液体培养基使用方法:1.烧杯中加入1L去离子水,打开磁力搅拌,缓慢加入22.04g粉末培养基,至完全溶解(可能会有少量沉淀或者浑浊,);2.pH值调节为8.2-8.5(可根据需要调整);3.121℃高压灭菌15min,冷却至室温,加入微量元素A5和B6各1mL。
固体培养基使用方法:22.04g粉末溶解于500mL去离子水;30g琼脂粉解于500mL去离子水,分别高压灭菌,之后再混合(如果培养基和琼脂一起高压灭菌,最终的培养基会变红色)。
Zarrouk培养基组分含量表:配方1(AMP272)配方2(AML331)基础配方(AMP271)组分工作液/L工作液/L工作液/L NaCl 1.00g 1.00g 1.00gCaCl20.08g0.08g0.08gNaNO3 2.5g 2.5g 2.5gFeSO4·7H2O0.01g0.01g0.01gNa2EDTA0.08g0.08g0.08gK2SO4 1.00g 1.00g 1.00g MgSO4·7H2O0.2g0.2g0.2gNaHCO316.8g16.8g16.8gK2HPO40.5g0.5g0.5gA5储备液1mL2mL-B6储备液1mL--注:1.Zarrouk培养基有多种配方,可联系我司定制。
各类藻类培养基(完整资料).doc

【最新整理,下载后即可编辑】AJS (Acidified JM:SE)Freshwater alga Dunaliella acidophilaMedium Acidified 97:3 mixture of JM and SE2See separate recipes(JM and SE2). For approximately 1 litre of final medium, mix 970 ml JM with 30 ml SE2. Add 10 ml of conc H 2SO 4 to give a pH of approximately 1.5. Autoclave at 15 psi for 15 minutes.ANT (Antia's Medium) Marine algaeStock Trace metals stock solution (chelated)per litreEDTANa2.2H2O 3.24 gFeCl3.4H2O 1.08 gMnSO4.4H2O 0.450 gZnSO4.7H2O 0.230 gNa2MoO4.2H2O 0.097 gCuSO4.5H2O 0.01 gCoSO4.7H2O 0.0056 gMake up to 1 litre with distilled water and adjust pH to 7.6 - 7.8 with dilute HCl or NaOH. Store frozen.Mediumper litreKNO30.05 gNaH2PO4.2H2O0.0078 gTris [tris(hydroxymethyl)aminomethane] 1.0 gGlycine0.3 gTrace metals stock solution (chelated) 2.5 mlThiamine HCl 500.0 µgCyanocobalamin2.0 µgBiotin1.0 µgFiltered natural seawater 800.0 mlMake up to 1 litre with distilled water and autoclave at 15 psi. Final pH should be 7.6 - 7.8.Ref Antia, Cheng & Taylor (1969)ASW (Artificial Seawater)Marine algaeStocks(1) Extra salts per litreNaNO330.0 gNa2HPO41.2 gK2HPO41.0 g(2) Vitamin solution per litreBiotin0.0002 gCalcium pantothenate 0.02 gCyanocobalamin0.004 gFolic acid 0.0004 gInositol1.0 gNicotinic acid 0.02 gThiamine HCl 0.1 gThymine0.6 gMay be stored frozen at -20°CMediumper litre*"Ultramarine Synthetica" sea salts 33.6 gExtra salts stock solution (1)Make up to 1 litre with deionized water and adjust pH to 7.6 - 7.8 with 1M NaOH or HCl. Autoclave at 15 psi for 15 minutes. Supply * as in ASW recipeBB (Bold's Basal Medium)Freshwater algaeStocksper 200 ml(1) NaNO3 5.0 g(2) MgSO4.7H2O 1.5 g(3) NaCl 0.5 g(4) K2HPO4 1.5 g(5) KH2PO4 3.5 g(6) CaCl2.2H2O 0.5 g(7) Trace elements solution: per litreZnSO4.7H2O8.82 gMnCl2.4H2O1.44 gMoO3CuSO4.5H2O1.57 gCo(NO3)2.6H2O0.49 gMay need autoclaving to dissolve.per 100 ml(8) H3BO3 1.14 g(9) EDTA - KOH solution:EDTANa25.0 gKOH3.1 gper litre(10) FeSO4.7H2O 4.98 gconc H2SO4 1.0 mlMedium Stock solutions 1 - 6 10.0 ml eachStock solutions 7 - 10 1.0 ml eachMake up to 1 litre with deionized water. For agar, add 15.0 g per litre of *Bacteriological Agar (Oxoid L11). Autoclave at 15 psi for 15 minutes.Supply* Unipath Ltd, Wade Road, Basingstoke, Hants RG24Co(NO3)2.6H2O0.005 gMedium This medium is made up in 2 parts:PART 1per litreTricine0.50 gSoil extract (SE1 - see recipe) 25.00 mlExtra nutrient salts (1) 3.75 mlMake up to 1 litre with filtered natural seawater and adjust pH to 7.6 - 7.8 with 1M NaOH or HCl.PART 2per litreNaNO31.500 gK2HPO4.3H2O0.040 gMgSO4.7H2O0.075 gCaCl2.2H2O0.036 gCitric acid 0.006 gAmmonium ferric citrate greenEDTANa20.001 gNa2CO30.020 gTrace metal solution (2) 1.00 mlMake up to 1 litre with distilled water and adjust pH to 7.4. FinalAutoclave Parts 1 and 2 separately at 15 psi, allow to cool then mix aseptically.For agar plates, add 15 g non-nutrient agar per litre.BG11 (Blue-Green Medium)Freshwater algae and protozoaStocksper litre(1) NaNO3 15.0 gper 500 ml(2) K2HPO42.0 g(3) MgSO4.7H2O3.75 g(4) CaCl2.2H2O 1.80 g(5) Citric acid 0.30 g(6)Ammonium ferric citrate green(枸橼酸铁铵, 柠檬酸铁铵)0.30 g(7) EDTANa2 0.05 g(8) Na2CO3 1.00 g(9) Trace metal solution per literH3BO32.86 gMnCl2.4H2O1.81 gZnSO4.7H2O0.22 gNa2MoO4.2H2O0.39 gCuSO4.5H2O0.08 gCo(NO3)2.6H2O0.05 gMedium Stock solution 1 100.0 mlStock solutions 2 - 8 10.0 ml eachStock solution 9 1.0 mlMake up to 1 litre with deionized water. Adjust pH to 7.1 with 1M NaOH or HCl. For agar add 15.0 g per litre of(1) Ca(NO3)2.4H2O 4.00 g(2) KH2PO42.48 g(3) MgSO4.7H2O 5.00 g(4) NaHCO3 3.18 g(5) EDTAFeNa 0.45 gEDTANa20.45 g(6) H3BO3 0.496 gMnCl2.4H2O0.278 g(NH4)6Mo7O24.4H2O0.20 g(7) Cyanocobalamin 0.008 gThiamine HCl 0.008 gBiotin0.008 g*(8) NaSiO3.9H20 (Sigma S4392) 11.4 gMedium Stock solutions 1 - 8 1.0 ml eachMake up to 1 litre with deionized water. Adjust to pH 6.9 with 1M HCl. Dispense to suitable vessels and autoclave at 15 psi forEG:JMMedium1:1 mixtureSee separate recipes (EG and JM). Mix then autoclave at 15psi for 15 minutes.E27 (E27 Medium)Marine algae, including sterility testingMedium This medium is made up in 2 parts to avoid precipitation:PART 1per litreSoil extract (SE1 - see recipe) 25.0 mlKNO30.050 gK2HPO40.005 gMgSO4.7H200.005 gGlucose0.250 g*Tryptone (Oxoid L42) 0.025 g*Liver digest (Oxoid L27) 0.025 gCyanocobalamin100.00 ngThiamine HCl 50.00 µgMake up to 500 ml with distilled water.PART 2Filtered natural seawater 500.0 mlFinal Autoclave parts 1 and 2 separately at 15 psi, allow to cool then mix aseptically. Supply* Unipath Ltd, Wade Road, Basingstoke, Hants RG24 0PW, UKE31 (E31 Medium)Marine algaeMedium This medium is made up in 2 parts to avoid precipitation:PART 1per litreSoil extract (SE1 - see recipe) 50.0 mlKNO30.10 gK2HPO40.01 gMgSO4.7H200.01 gCyanocobalamin100.00 ngThiamine HCl 50.00 µgBiotin100.0 ngMake up to 500 ml with distilled water.PART 2Filtered natural seawater 500.0 mlFinal Autoclave Parts 1 and 2 separately at 15 psi, allow to cool then mix aseptically.E31:ANTMedium1:1 mixtureSee separate recipes (E31 and ANT). Autoclave separately. Mix aseptically when cool.。
藻类的培养

一、藻种的两种培养类型一般藻种的培养有两种方式:一种是长期保存所需要的培养方法,一种是以实验为目的,短期内保藏藻种的培养方法。
长期培养最主要的问题是选择一种合适的培养基,可以在3个月到一年的时间内连续培养藻种。
最适合长期培养藻种的培养基是agar(固体琼脂培养基),但是使用agar有一个弊端,即培养物保持无菌的问题;我们可以加一层蒸馏水(咸水的藻类可以加灭菌过人工的海水)在agar上,这种做法可以保证在长期保种的过程中减少agar水分和营养的流失。
长期保种使用的培养基,不要选择营养过于丰富的,因为多数的藻,尤其是丝状藻,在营养丰富的环境生长,会发生形态结构上的变化,如果要做生理生态方面研究,实验材料的形态结构是不能异常的。
适合长期保种的贫营养的培养基有这些:Bold’s基础培养基,以及该培养基加上蛋白胨或者琼脂制成的agar,适合长期培养绿藻;Allen及其改良后的配方可以长期培养一般常见的蓝藻和绿藻;土水培养基和它的一个改良的系列也实用培养多数藻种。
对于我库提供的藻种,由于藻种长期习惯的原因,建议使用我们提供的原配方来培养,在长期培养的时候,可以适当稀释原培养基,在藻种培养过程中,生长速率会变慢,可以保持其形态结构不变。
另外,长期培养的时候,除了选择适当的培养基,还可以降低温度5~8C(降温的过程最好能循序渐进,突然改变环境温度,可能会导致藻种不适应而死亡)。
光照强度可以减小为原先的一半。
在实验之前3到4周,将长期培养的藻种接种到我们提供的培养基中(培养基必须灭菌),按照我们给予的培养条件培养,在实验前6天左右,再次接种。
短期培养则可以直接按照我们提供的培养基和培养条件培养。
由于试验的需要,常常要求在短期时间内获得大量的培养物,我们可以采用通气培养和摇床培养。
通气培养可以通CO2或洁净的空气,视培养物的多少来决定通气泵的大小,在通气的硅胶管中设置一个缓冲瓶,塞上灭菌后的脱脂棉,帮助净化空气,如果对通气有更高的要求,可以在通气管中加上一层滤膜。
微藻培养方法汇总

微藻培养方法汇总微藻是一类微小的单细胞或多细胞藻类生物,广泛存在于海水、淡水以及土壤中。
它们被广泛应用于食品、能源、环境保护等领域。
为了有效培养和利用微藻,在实验室中需要采用一系列的培养方法。
本文将介绍微藻的培养方法,包括培养基配制、光周期控制、温度控制、培养容器选择、培养规模控制等方面的内容,以帮助研究者进行微藻培养。
一、培养基的配制微藻的培养基是提供营养物质供给微藻生长的溶液。
根据不同的微藻种类和需求,可以使用不同的培养基。
常用的微藻培养基包括滨液培养基、波利文氏培养基、圣外秧基和BG11培养基等。
培养基的配制需要参考相关文献或制备实验室的经验,并保证培养基的无菌。
一般来说,培养基的配制包括以下几个步骤:1.根据培养基配方中的化学品,称取适量的试剂。
2.在去离子水中溶解试剂,根据需要调节pH值。
3.将培养基溶液装入瓶中,并进行高压灭菌或自压灭菌处理。
二、光周期控制光照是微藻生长过程中的重要环境因素,能够影响微藻的光合作用和生长速率。
光周期是指光照和黑暗轮替的时间间隔,通过控制光周期可以调节微藻的生长和代谢活性。
常用的光周期控制方法有以下几种:1.固定光周期法:固定光周期法是指在相同的光照条件下,每天提供固定时间的光照和黑暗。
这种方法适用于大多数微藻的培养。
2.逐渐增加光周期法:逐渐增加光周期法是指在一段时间内逐渐增加光照时间和减少黑暗时间。
这种方法适用于对光照变化较敏感的微藻。
3.梯度光周期法:梯度光周期法是指提供不同光周期的条件,通过对比不同光周期下的微藻生长情况来选择最适宜的光周期。
三、温度控制微藻的生长和代谢活性受温度影响较大,不同的微藻种类对温度有不同的生长适宜范围。
温度过低或过高都会影响微藻的生长和产物积累。
常用的温度控制方法有以下几种:1.室温培养法:即在室温下进行培养,适用于耐寒性较强的微藻种类。
2.恒温培养法:通过恒温培养箱或恒温培养室维持恒定的培养温度,适用于大多数微藻种类。
小球藻培养方法

小球藻培养方法小球藻是一种单细胞藻类,广泛存在于淡水和海水中。
它们具有较高的光合作用效率和快速生长速度,因此被广泛应用于生物燃料生产、生态环境修复等领域。
下面将介绍小球藻的培养方法。
1. 培养基的配制小球藻的培养基可以根据需要进行配制,一般包含以下主要成分:无机盐、有机碳源、氮源、磷源、微量元素和维生素。
其中,无机盐包括硝酸盐、磷酸盐、硫酸盐等;有机碳源可以选择葡萄糖、乳糖等;氮源可以选择硝酸盐、铵盐等;磷源可以选择磷酸盐等;微量元素可以选择铁、锰、锌、铜等;维生素可以选择硫胺素、核黄素等。
根据不同的实验要求,可以对培养基的成分进行调整。
2. 培养条件的控制小球藻的培养需要一定的环境条件。
温度通常控制在20-30摄氏度之间,光照强度通常控制在4000-6000勒克斯。
此外,pH值也是一个重要的因素,一般控制在7.5-9.5之间。
为了保持培养液的通气性,可以通过搅拌或通气装置来提供氧气。
3. 培养容器的选择小球藻的培养可以选择不同的容器,如培养瓶、培养槽等。
培养瓶通常用于小规模培养,而培养槽适用于大规模培养。
无论选择何种容器,都需要保证容器的密封性和光透性。
4. 培养种源的选择小球藻的种源可以选择已经纯化的培养物或者采集自自然环境中的藻细胞。
如果选择采集自自然环境的藻细胞,需要进行预处理,如过滤、清洗等,以去除杂质。
纯化的培养物可以通过分离培养和筛选获得。
5. 培养过程的操作将培养基倒入培养容器中,加入合适浓度的培养物,然后在适宜的环境条件下进行培养。
在培养过程中,需要定期检测培养液中的生长状况,如细胞密度、生长速率等。
可以通过显微镜观察细胞形态和数量,并根据需要进行采样和分析。
6. 培养物的保持和传代为了保持小球藻的纯度和活力,需要定期进行传代。
传代时,可以选择将培养物移植到新的培养基中,或者分离出单个细胞进行单细胞培养。
传代后的培养物需要进行适当的保存,可以冷冻保存或制备培养物冻干粉。
小球藻的培养方法是一项复杂而细致的工作,需要严格控制培养条件和操作步骤。
光合细菌、硝化细菌、小球藻、螺旋藻的培养基配方

光合细菌、硝化细菌、小球藻、螺旋藻的培养基的配方,培养条件及其用途海洋本141 谢滨桂光合细菌光合细菌培养基配方培养基成分:醋酸钠1.145g/L、蛋白陈0.055g/L、碳酸氢钠0.6g/L、硫代硫酸钠0.4g/L、氯化钠0.3g/L、硫酸镁0.1g/L、磷酸二氢钾0.05g/L。
光合细菌生长所需的环境条件1培养介质,含杂菌比较少的清洁淡水2酸碱度PH值在8-8.5为最好,光合细菌的适应PH范围在6-10之间3温度以28-36℃为最好生长温度,其适应的生长温度范围为15-41℃4光照强度以3000-4000勒克斯为最佳,即每25kg菌液需要相当于60W左右的白炽灯作光源,而太阳光照为最好且不要成本。
光合细菌的应用1养殖业①净化水质②维持生态平衡③培养浮游动物作饵料④间接增氧⑤饲料添加剂2种植业3环保业消化细菌硝化细菌培养基配方培养基成分:硫酸铵0.5g、氯化钠0.3g、硫酸亚铁0.03g、磷酸二氢纳1g、硫酸镁0.03g、氯化钙7.5g、蒸馏水1000ml、PH7.5、固体培养基加5%琼脂。
硝酸钠1g、硫酸镁0.03g、硫酸锰0.01g、硫酸二氢钾0.75g、无水碳酸钠1g、磷酸二氢钠0.25g、蒸馏水1000ml、PH7.5硝化细菌生长所需环境条件消化细菌培养的最优化条件为PH范围在7.0-9.0之间,温度30℃左右,溶解氧的量70%消化细菌的应用1亚硝酸属“氨的氧化者”因其所维持生物的食物来源是氨,氨和氨化合成的化学能足以使其生存。
2硝酸菌属,使亚硝酸分子氧化再转化为硝酸分子的细菌类,其所维持生物的食物来源是亚硝酸。
它和氨化合产生硝酸,所生成的化学能足以使其生存。
3利用这样可以净化水质。
螺旋藻螺旋藻培养基配方培养基成分:碳酸氢钠16.8g/L、碳酸钠2.5g/L、氯化钠1.00g/L、硫酸钾1.00g/L、磷酸氢二钾0.50g/L、氯化钙0.08g/L、MgSO4.7H2O 0.20g/L、FeSO4.7H2O 0.01g/L、Na2-EDTA 0.08g/L 微量元素A5溶液2ml/L微量元素溶液成分:H3BO3 2.86g/L、(NH4)6Mo17O24 0.02g/L、MnCl12.4H2O 1.80g/L、CaSO4.5H2O0.08g/L、ZnSO4.7H2O 0.22g/L螺旋藻生长所需环境条件养殖螺旋藻最重要的条件是光照、温度、培养液和通风等,培养液的PH值深度、流动、排氧及营养元素的合理供给都是影响产量的重要因素,因此,培养地应建在水质好,、光照条件适宜场地宽阔的地方PH值范围为7-11,最好是8-9,水深在0.2-0.3米之间,水温18-38℃,最好在26-32℃。
小球藻常用培养基 SE培养基

SE (Brostol’s solution)Component Amount Stock Solution(1) NaNO3 1 mL/L 25 g/100mldH2O(2) K2HPO4 1 mL/L 7.5 g/100 mL dH2O(3) MgSO4·7H2O 1 mL/L 7.5 g/100 mL dH2O(4 ) CaCl2·2H2O 1 mL/L 2.5 g/100 mL dH2O(5 ) KH2PO4 1 mL/L 17.5 g/100 mL dH2O(6 ) NaCl 1mL/L 2.5g/100ml dH2O(7) FeCl3. 6H2O 1mL/L 0.05g/100ml dH2O(8) EDTA-Fe 1mL/L1N HCl: 取4.1ml浓盐酸用蒸馏水稀释至50ml1N EDTA-Na 2称取0.9306g 溶解至50ml 蒸馏水中称取FeCl3. 6H2O 0.901g 溶于10ml以上步骤已经配制完成的1N HCl 中,然后与10ml已经配制完成的0.1N EDTA-Na 2混合,加入蒸馏水稀释至1000ml。
(9) Trace mental solution 1ml/LH3BO3 2.86g/L dH2OMnCl2·4H2O 1.86g/L dH2OZnSO4·7H2O 0.22g/L dH2ONa2MoO4.2H2O 0.39g/L dH2OCuSO4. 5 H2O 0.08g/L dH2OCo(NO3)2.6 H2O 0.05g/L dH2O(10)土壤提取液40 mL/L土壤提取液配制方法:取花园土未施过肥200g置于烧杯或三角瓶中,加入蒸馏水1000毫升,瓶口用透气塞封口,在水浴中沸水加热3小时,冷却,沉淀24小时,此过程连续进行3次,然后过滤,取上清液,于高压灭菌锅中灭菌后于4℃冰箱中保存备用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
AJS (Acidified JM:SE)
Freshwater alga Dunaliella acidophila
Medium Acidified 97:3 mixture of JM and SE2
See separate recipes( and ). For approximately 1 litre of final medium, mix 970 ml JM with 30 ml SE2. Add 10 ml of conc H2SO4 to give a pH of approximately 1.5. Autoclave at 15 psi for 15 minutes.
ANT (Antia's Medium)
Marine algae
Stock Trace metals stock solution (chelated)
per litre
EDTANa2.2H2O 3.24 g
FeCl3.4H2O 1.08 g
MnSO4.4H2O 0.450 g
ZnSO4.7H2O 0.230 g
Na2MoO4.2H2O 0.097 g
CuSO4.5H2O 0.01 g
CoSO4.7H2O 0.0056 g
Make up to 1 litre with distilled water and adjust pH to 7.6 - 7.8 with dilute HCl or NaOH. Store frozen.
Medium per litre
KNO3 0.05 g
NaH2PO4.2H2O 0.0078 g
Tris [tris(hydroxymethyl)aminomethane] 1.0 g
Glycine 0.3 g
Trace metals stock solution (chelated) 2.5 ml
Thiamine HCl 500.0 µg
Cyanocobalamin 2.0 µg
Biotin 1.0 µg
Filtered natural seawater 800.0 ml
Make up to 1 litre with distilled water and autoclave at 15 psi. Final pH should be 7.6 - 7.8.
Ref
ASW (Artificial Seawater)
Marine algae
Stocks (1) Extra salts per litre
NaNO3 30.0 g
Na2MoO4.2H2O 0.039 g
CuSO4.5H2O 0.008 g
Co(NO3)2.6H2O 0.005 g Medium This medium is made up in 2 parts:
PART 1
per litre
Tricine 0.50 g
Soil extract ( - see recipe) 25.00 ml
Extra nutrient salts (1) 3.75 ml
Make up to 1 litre with filtered natural seawater and adjust pH to 7.6 - 7.8 with 1M NaOH or HCl. PART 2
per litre
NaNO3 1.500 g
K2HPO4.3H2O 0.040 g
MgSO4.7H2O 0.075 g
CaCl2.2H2O 0.036 g
Citric acid 0.006 g
Ammonium ferric citrate green 0.006 g
EDTANa2 0.001 g
Na2CO3 0.020 g
Trace metal solution (2) 1.00 ml
Make up to 1 litre with distilled water and adjust pH to 7.4.
Final
Autoclave Parts 1 and 2 separately at 15 psi, allow to cool then mix aseptically.
For agar plates, add 15 g non-nutrient agar per litre.
BG11 (Blue-Green Medium)
Freshwater algae and protozoa
Stocks per litre
(1) NaNO3 15.0 g
per 500 ml
(2) K2HPO4 2.0 g
(3) MgSO4.7H2O 3.75 g
(4) CaCl2.2H2O 1.80 g
(5) Citric acid 0.30 g
(6)Ammonium ferric citrate green
(枸橼酸铁铵, 柠檬酸铁铵) 0.30 g
(7) EDTANa2 0.05 g
(8) Na2CO3 1.00 g
E31 (E31 Medium)
Marine algae
Medium This medium is made up in 2 parts to avoid precipitation:
PART 1
per litre Soil extract () 50.0 ml
KNO3 0.10 g
K2HPO4 0.01 g
MgSO4.7H20 0.01 g
Cyanocobalamin 100.00 ng Thiamine HCl 50.00 µg Biotin 100.0 ng
Make up to 500 ml with distilled water.
PART 2
Filtered natural seawater 500.0 ml Final Autoclave Parts 1 and 2 separately at 15 psi, allow to cool then mix aseptically.
E31:ANT
Medium 1:1 mixture
See separate recipes ( and ). Autoclave separately. Mix aseptically when cool.。
