有机化学基础思维导图(一张A3)[精选.]
高一化学知识点思维导图 A3

高一化学知识点思维导图 A3化学作为一门自然科学,其知识体系庞杂而复杂。
对于高一学生来说,学习化学的难度可想而知。
为了帮助同学们更好地理解和掌握高一化学知识,我准备了一份A3大小的化学知识点思维导图。
下面,让我们一起来探索这个思维导图吧。
导图的中心是“化学”,围绕中心分为以下几个大的主题。
1. 基本概念这一部分主要介绍了化学的基本概念,包括物质的分类、物质的性质、化学反应等。
以此为基础,我们可以更深入地理解化学的本质和研究对象。
2. 原子结构原子是构成物质的基本单位,了解原子结构的基本知识是理解化学的重要前提。
这一部分主要涉及原子的组成、亚原子粒子、元素周期表等内容。
通过学习原子结构,我们能够更好地理解化学元素之间的关系和反应机制。
3. 化学键化学键是原子之间的相互作用力,决定着化学反应的发生与速率。
在这一部分,我们将学习不同类型的化学键,如离子键、共价键等,以及它们的形成和断裂过程。
理解化学键的形成可以帮助我们预测和解释化学反应的结果。
4. 溶液和溶解度溶液是由溶质溶解于溶剂而形成的混合物。
在这一部分,我们将学习溶液和溶解度的概念,以及影响溶解度的因素。
深入了解溶液和溶解度的特性,可以为我们解决实际问题提供指导。
5. 化学反应化学反应是化学变化的核心概念,也是我们认识和探索化学世界的窗口。
这一部分将系统介绍化学反应的基本概念,如化学方程式、摩尔比例、化学平衡等。
通过学习化学反应,我们可以更好地理解物质变化的本质和规律。
6. 热化学热化学是研究化学反应中能量变化的学科。
这一部分主要包括热量的性质、热反应的热平衡、热化学方程式等内容。
通过学习热化学,我们可以了解化学反应中能量变化的原理和应用。
7. 酸碱溶液和pH值酸碱溶液是化学中的重要概念,也是日常生活中常见的化学物质。
这一部分将介绍酸碱的性质、pH值的概念以及酸碱中和反应等内容。
对于深入理解酸碱溶液和pH值的作用及应用具有重要意义。
8. 氧化还原反应氧化还原反应是化学中的重要反应类型,也是能量转化和物质变化的核心过程。
高中化学全套思维导图(高清版)

高中化学全套思维导图(高清版)第一章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第三章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第四章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第五章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第六章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第七章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第八章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第九章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十一章:物质的量与物质的量浓度1. 物质的量物质的量的定义:摩尔物质的量的计算:摩尔质量、物质的量浓度2. 摩尔体积摩尔体积的定义:摩尔体积摩尔体积的计算:气体摩尔体积、液体摩尔体积、固体摩尔体积第十二章:化学反应速率与化学平衡1. 化学反应速率化学反应速率的定义:速率影响化学反应速率的因素:温度、浓度、催化剂、表面积2. 化学平衡化学平衡的定义:平衡状态化学平衡的建立:平衡常数、平衡反应物和物的浓度第十三章:氧化还原反应与电化学1. 氧化还原反应氧化还原反应的定义:氧化剂、还原剂氧化还原反应的类型:单一置换反应、复分解反应、合成反应、分解反应2. 电化学电化学的定义:电流、电极电化学反应:原电池、电解池第十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用第十九章:物质的组成与结构1. 物质的分类纯净物:单质、化合物混合物:溶液、胶体、悬浊液2. 原子结构原子核:质子、中子电子:电子云、能级3. 元素周期表周期律:周期、族元素周期表的排列:原子序数、电子排布第二十章:化学键与化学反应1. 化学键离子键:离子化合物共价键:共价化合物金属键:金属单质2. 化学反应反应类型:合成反应、分解反应、置换反应、复分解反应化学方程式:平衡、反应物、物第二十一章:溶液与胶体1. 溶液溶质、溶剂溶液的浓度:摩尔浓度、质量浓度、体积浓度2. 胶体胶体粒子:分散相、分散介质胶体的性质:丁达尔效应、布朗运动第二十二章:酸碱反应与盐类1. 酸碱反应酸、碱的定义中和反应:酸碱反应、盐和水2. 盐类盐的分类:正盐、酸式盐、碱式盐盐的水解:酸碱盐、盐的水解平衡第二十三章:氧化还原反应1. 氧化还原反应氧化剂、还原剂氧化还原反应的配平2. 电化学原电池:电极反应、电池反应电解质:电解质溶液、电解反应第二十四章:有机化学1. 有机化合物的分类烃类:烷烃、烯烃、炔烃含氧有机物:醇、酚、醚、醛、酮、羧酸、酯2. 有机反应加成反应、消除反应、取代反应、重排反应第二十五章:化学实验1. 实验基本操作仪器使用、实验步骤、数据处理2. 化学实验安全实验室安全规范、急救措施第二十六章:化学计算1. 化学计量学摩尔质量、摩尔体积、物质的量2. 化学反应速率与化学平衡反应速率方程、速率常数、化学平衡常数第二十七章:环境化学1. 环境污染大气污染、水污染、土壤污染2. 环境保护绿色化学、可持续发展第二十八章:化学与生活1. 化学在生活中的应用食品、药品、化妆品、材料2. 化学与社会化学在工业、农业、医疗、能源等领域的应用。
有机化学第四版(董先明)思维导图 羧酸、羧酸衍生物和取代羧酸

酸性水解可逆
碱性水解不可逆
酯的水解。水解生成羧酸和醇。
1.水解反应
酯基所连的R基体积增大则水解活泼性下降,吸 电子效应增强,则水解活泼性提高
酸性水解:羧酸和铵盐 碱性水解:羧酸盐和胺(氨)
酰胺的水解。不可逆
水解活泼性:酰卤>酸酐>酯>酰胺
要用酚合成酯可以用酰氯来合成
酰卤的醇解:生成酯和卤化氢。
酸酐的醇解:生成酯和羧酸
酰卤,命名为某酰某卤
酸酐,根据相应羧酸命名为某酸酐
酯,某酸某醇(酚)酯,一般省略醇或酚
酰胺,命名为某酰胺,当酰胺氮原子有取代基时 将取代基名称标明出来,如N,N-二甲基苯丙酰胺
一般低级酰卤和酸酐室温下是液体,较高级的室 温下是固体。
液体酰卤和酸酐具有挥发性和刺激性气味
酰卤和酸酐
酯分子的对称性和极性都小于酰卤和酸酐
5.酯缩合反应
化学性质
羧酸衍生物的性质
烃基化产物在稀碱溶液中加热脱去羧基生成酮, 称为酮式分解
在浓碱溶液中脱去羰基生成羧酸,称为酸式分解
在强碱如醇钠的作用下生成烯醇盐,烯醇盐与卤 代烃或酰卤发生亲核取代反应,得到在α-碳原子 上的烃基化或酰基化的产物
酮式和烯醇式的互变平衡
乙酰乙酸乙酯合成法 丙二酸酯合成法
还原和氧化。用四氢硼钠把羰基酸还原为羟基 酸,用四氢铝锂将羰基酸还原为二醇。醛酸可以 氧化为二元羧酸。酮酸难以氧化
羰基酸的代表化合物
随着M增大,同系列脂肪羧酸的沸点上升,水溶 性下降
羧酸的酸性强于碳酸
连有推电子作用的烃基酸性减弱,连有吸电子基 团则相反
酸性
一元羧酸中甲酸的酸性最强
羧酸的性质
1.羧酸的酸性
乙二酸的酸性强于甲酸
有机化学第四版(董先明)思维导图 醇、酚、醚
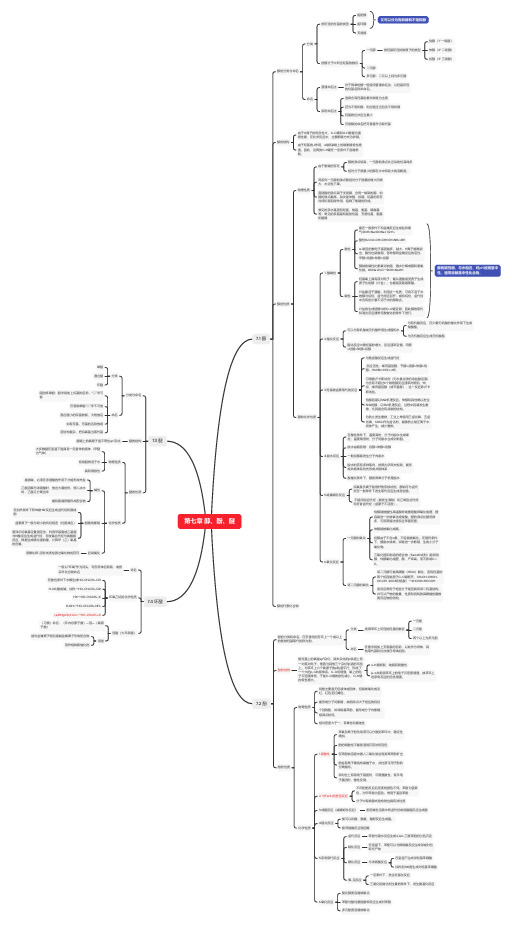
第七章醇、酚、醚7.1 醇醇的分类与命名分类按所连的烃基的类型脂肪醇脂环醇芳香醇又可以分为饱和醇和不饱和醇按醇分子中所含羟基的数目一元醇按羟基所连的碳原子的类型伯醇(1° 一级醇)仲醇(2° 二级醇)叔醇(3° 三级醇)二元醇多元醇:二元以上则为多元醇命名普通命名法对于简单的醇一般使用普通命名法,以羟基所连的烃基名称来命名。
系统命名法选择含有羟基的最长碳链为主链若为不饱和醇,则主链应当包含不饱和键羟基的位次应当最小芳香醇的命名把芳香基作为取代基醇的结构由于O原子的电负性大,C-O键和O-H键都为强极性键,在化学反应中,主要断键方式为异裂。
由于羟基的-I作用,α碳和β碳上的碳氢键极性增强。
因此,这两类C-H键在一定条件下容易断裂。
醇的性质物理性质由于氢键的存在醇的沸点较高,一元醇的沸点比近似的烃高得多相对分子质量小的醇在水中有较大的溶解度。
同系列一元醇的沸点随相对分子质量的增大而增大,水溶性下降。
直链醇的沸点高于支链醇,含同一碳架的醇,伯醇的沸点最高,其次是仲醇,叔醇。
烷基的存在对缔和有阻碍作用,阻碍了氢键的形成。
常见的亲水基团有羟基、羧基、氨基、磺酸基等;常见的亲脂基有脂肪烃基、芳香烃基、酯基和醚键醇的化学性质1. 酸碱性酸性能在一般条件下和金属反应生成盐和氢气:ROH+Na=RONa+1/2 H₂酸性H₂O>R-OH>CH≡CH>NH₃>RHα-碳连的推电子基团越多,越大,H离子越难脱出,酸性也就越弱。
各种醇同金属反应的活性:甲醇>伯醇>仲醇>叔醇醇钠的碱性比氢氧化钠强,遇水分解成醇和氢氧化钠。
RONa+H₂O→ROH+NaOH碱性羟基氧上具有孤对电子,能从强酸接受质子生成质子化的醇( 盐)。
也能接受路易斯酸。
盐能溶于强酸。
利用这一性质,可将不溶于水的醇与烷烃、卤代烃区别开,或将烷烃、卤代烃中含有的少量不溶于水的醇除去。
盐的生成使醇中的C-O键变弱,因此醇的取代和消去反应通常在酸催化的条件下进行。
