厦门大学无机化学习题16 过渡元素(二)
无机化学试题【附答案】@厦大

厦门大学“无机化学(一) ”课程试卷
化学化工学院化学系、材料系 2004 年级 化学、化学生物、化学教育、高分子专业
主考教师:郑兰荪、朱亚先、黄荣斌、林丽榕 试卷类型: (闭卷)
向 0.10 mol·dm-3草酸溶液中滴加NaOH溶液使pH = 7.00,溶液中(H 2 C 2 O 4 , HC 2 O 4 ,
C2O2 4 ) ______________浓度最大 。
(H 2 C 2 O 4 的 K a1 = 5.9 10-2,K a2 = 6.4 10-5) 21. 2 分 同离子效应使难溶电解质的溶解度_________________________; 盐效应使难溶电解质的溶解度_____________________________; 后一种效应较前一种效应_____________________________得多。 21. 2 分 下列过程的熵变的正负号分别是 :
)
4.
2 分 4 mol Br 2 和 5 mol HBr 2HBr(g) 的 K c = 1.86。 反应 H 2 (g) + Br 2 (g) 若将 3 mol H 2 , 3 放在 10 dm 烧瓶中,则…………………………………………………………………… ( ) (A) 反应将向生成更多的 HBr 方向进行 (B) 反应向消耗H 2 的方向进行 (C) 反应已经达到平衡 (D) 反应向生成更多Br 2 的方向进行 2 分 试由下列表中数据,确定压力为 101 kPa时BCl 3 的沸点为…………………… ( BCl 3 (g) BCl 3 (l) -1 f H m / kJ·mol -427.2 -403.76
厦门大学无机化学试卷

班级 姓名 分数一、选择题 ( 共18题 35分 ) 1. 2 分InCl 2为逆磁性化合物,其中In 的化合价为…………………………………………( ) (A) +1 (B) +2 (C) +3 (D) +1和+32. 2 分下列氢化物中,在室温下与水反应不产生氢气的是…………………………………( ) (A) LiAlH 4 (B) CaH 2 (C) SiH 4 (D) NH 33. 2 分和水反应得不到H 2O 2的是……………………………………………………………( ) (A) K 2O 2 (B) Na 2O 2 (C) KO 2 (D) KO 34. 2 分下列物质的水解产物中既有酸又有碱的是………………………………………… ( ) (A) Mg 3N 2 (B) SbCl 5 (C) POCl 3 (D) NCl 35. 2 分有关H 3PO 4、H 3PO 3、H 3PO 2不正确的论述是…………………………………( ) (A) 氧化态分别是+5,+3,+1 (B) P 原子是四面体几何构型的中心 (C) 三种酸在水中的离解度相近 (D) 都是三元酸6. 2 分下列各组化合物中,都有颜色的一组化合物是…………………………………… ( ) (A) SiCl 4,SnCl 4,PbO (B) CCl 4,NO 2,HgI 2 (C) SiC ,B 2H 6,N 2O 4 (D) PbO 2,PbI 2,SnS7. 2 分下列化合物中最稳定的是…………………………………………………………… ( ) (A) Li 2O 2 (B) Na 2O 2 (C) K 2O 2 (D) Rb 2O 28. 2 分1 mol 下列各物质溶于1 dm 3水中,生成的溶液 中H + 浓度最高的是……………( ) (A) SO 3 (B) P 4O 10 (C) HF (D) MgH2 厦门大学“无机化学(二)”课程试卷化学化工学院化学、材料系2004年级化学各专业试卷类型:(A 卷)对于H 2O 2和N 2H 4,下列叙述正确的是………………………………………………( ) (A) 都是二元弱酸 (B) 都是二元弱碱 (C) 都具有氧化性和还原性 (D) 都可与氧气作用10. 2 分下列分子式中错误的是……………………………………………………………… ( ) (A) SF 2 (B) SF 3 (C) SF 4 (D) SOF 411. 2 分O 22-可作为…………………………………………………………………………… ( )(A) 配体 (B) 氧化剂 (C) 还原剂 (D) 三者皆可12. 2 分下列含氧酸根中,属于环状结构的是……………………………………………… ( )(A) S O 462-(B) S O 3102-(C) P O 393-(D) P O 3105-13. 2 分BF 3通入过量的Na 2CO 3溶液,得到的产物是………………………………………( ) (A) HF 和H 3BO 3 (B) HBF 4和B(OH)3 (C) NaBF 4和NaB(OH)4 (D) HF 和B 4O 314. 2 分下列含氧酸中酸性最弱的是………………………………………………………… ( ) (A) HClO 3 (B) HBrO 3 (C) H 2SeO 4 (D) H 6TeO 615. 2 分下列各组物质氧化性变化次序不正确的是………………………………………… ( ) (A) HNO 3 > H 3PO 4 > H 3AsO 4 (B) HBrO 3 > HClO 3 > HIO 3 (C) H 2SeO 4 > H 6TeO 6> H 2SO 4 (D) HClO 4 > H 2SO 4 > H 3PO 416. 2 分锌粉与酸式亚硫酸钠反应生成……………………………………………………… ( ) (A) Na 2S 2O 4 (B) Na 2S 2O 3 (C) Na 2SO 3 (D) Na 2SO 417. 2 分用于制备K 2S 2O 8的方法是……………………………………………………………( ) (A) 在过量的硫酸存在下,用高锰酸钾使K 2SO 4氧化 (B) 在K + 离子存在下,往发烟硫酸中通入空气(C) 在K + 离子存在下,电解使硫酸发生阳极氧化作用 (D) 用氯气氧化硫代硫酸钾K 2S 2O 3鉴别Sn4+和Sn2+离子,应加的试剂为…………………………………………………()(A) 盐酸(B) 硝酸(C) 硫酸钠(D) 硫化钠(过量)二、填空题( 共8题25分)19. 5 分比较下列各物质的性质:(1) BeCl2和CaCl2的沸点,前者______________后者;(2) NH3和PH3的碱性,前者______________后者;(3) NaOCl和NaClO3的氧化性,前者______________后者;(4) BaCrO4和CaCrO4在水中的溶解度,前者______________后者;(5) TlCl和TlCl3的水解度,前者______________后者。
过渡元素化学(二)

过渡元素化学(二)过渡元素是周期表中的一组元素,其电子排布在第3到第12组之间。
这个区域由于有半满或近半满的d轨道和未填满的f轨道,使得这些元素具有特殊的性质,可以表现出很多不同的化学行为。
本文将深入探讨过渡元素的化学性质以及它们在化学反应中所扮演的角色。
1. 过渡元素的物理特征过渡元素具有许多独特的物理特征。
首先,它们具有高密度,高熔点和沸点,因为它们拥有许多未填满的d轨道,这些轨道的电子之间相互作用会导致较强的金属-金属键。
其次,它们通常是良好的导体,因为它们的未填满的d轨道使它们具有离子化趋势,容易失去电子形成正离子或者吸收电子形成负离子。
2. 过渡元素离子的颜色许多过渡元素的离子具有强烈的颜色,这是由于它们的d轨道未填满。
当电子从一个未填满的d轨道移到另一个未填满的d轨道时,会吸收光,而吸收波长的颜色就是离子呈现的颜色。
例如,二价铜在水溶液中呈现蓝色,因为它的四对未填满的d电子在s和p电子之间能吸收波长为580 nm左右的光线,这些电子从第一对d电子到第三对d电子转移。
过渡元素可以呈现多种不同的氧化态,这使得它们在许多有机和无机化学反应中都有不同的用途。
例如,铁可以以氧化态+2形式存在,也可以存在于+3的氧化态下。
由于不同的氧化态会影响到元素的化学性质,因此过渡元素在反应中所扮演的角色也会因其氧化态的不同而有所不同。
4. 过渡元素在催化反应中的作用过渡元素在催化反应中发挥着重要的作用,常见的过渡金属催化反应包括原料的直接活化、分子间的加成、还原等。
许多过渡金属催化剂的成功应用可以归功于它们容易形成中间态,也可以通过自旋、电荷、配体效应等变化调节反应活性。
与此同时,过渡元素也可以得到良好的选择性,这是由于它们的每一种氧化态具有不同的反应性能,所以它们可作为特异性催化剂。
总之,过渡元素是化学反应中非常重要的一类元素,它们具有独特的性质和特征,使得它们在许多不同的化学反应中都有不同的贡献和应用。
厦门大学2016年无机化学考研真题

厦门大学2016年招收攻读硕士学位研究生入学考试试题科目代码:617科目名称:基础化学招生专业:化学化工学院、材料科学与工程系、公共卫生学院、药学院各相关专业考生须知:答题必须使用黑(蓝)色墨水(圆珠)笔:不得直接在试题(草稿)纸上作答;凡未按规定作答均不予评阅、判分;责任考生自负。
一、单项选择题(共35题,每题2分,共70分)1.下列关于O22-和O2-的性质的说法中,不正确的是()(A)两种离子都比O2分子稳定性小(B)O22-的键长比O2-键长短(C)O22-是反磁性的,而O2-是顺磁性的(D)O2-的键能比O22-键能大2.多电子原子的能量E由()决定的(A)主量子数n (B)n,l (C)n,m,l (D)l3.在容积可变的密闭容器中通入体积比为2:3的气体A和气体B,在一定条件下发生如下反应:A+3B⇌2C(A、B、C均为气体)当反应达到平衡时,测得有50%的B转化为C,则反应前与平衡时容器内的分子数之比是()A.5:6 B.5:4 C.5:3 D.5:24.0.01mol氯化铬(CrCl3.6H2O)在水溶液中用过量AgNO3处理,产生0.02molAgCl沉淀,此氯化铬最可能为()(A){Cr(H2O)6}Cl3 (B){Cr(H2O)5Cl}Cl2.H2O(C){Cr(H2O)4Cl2}Cl.2H2O (D){Cr(H2O)3Cl3}.3H2O5.根据酸碱的溶剂理论,在液态 SO2体系中的碱是…………………………………()(A) SOCl2(B) Na2SO3(C) Na2SO4(D) PCl36.在某温度下反应 A + B = C + D Δ H < 0 ,达到平衡后再升高温度,平衡将逆向移动的原因是()A、υ (正) 减小,υ (逆) 增大B、k (正) 减小,k (逆) 增大C、υ (正) 和υ (逆) 都减小D、υ (正) 增加的倍数小于υ (逆) 增加的倍数7.已知 298 K 时反应 H 2O ( l ) →H 2 (g )+21O 2 (g) 的平衡常数 K Θ=2.86×10-42 , 在此温度下H 2O ( l ) 的饱和蒸气压为3.17 kPa ,则反应H 2O (g) HH 2 (g )+21O 2 (g) 在相同温度下的平衡常数 K Θ与下列数据最接近的是 ( )A 、7.0×10-44B 、9.1×10-41C 、4.5×10-42D 、6.8×10-438. 为了防止海轮船体的腐蚀,可在船壳水线以下位置嵌上一定数量的 ( )(A)铜块 (B)铅块 (C)锌块 (D)钠块9.{Ca (EDTA)}2-配离子中,Ca 2+的配位数是 ( )(A)1 (B)2 (C)4 (D)610.在下列碱金属电对M +/ M 中,ϕΘ最小的是 ( )A 、Li +/ LiB 、Na +/ NaC 、K +/ KD 、Rb +/ Rb11..若空气中水蒸气压高于同温度下某种盐浓溶液的蒸气压,则该盐会 ( )A 、风化B 、潮解C 、升华D 、溶解12.CaF 2的Ksp=5.3x10-9mol.L -1,在F -浓度为 3.0mol.L -1的溶液中Ca 2+可能的最高浓度是A,1.8x10-9mol.L -1CaF 2的Ksp=5.3x10-9mol.L -1,在F -浓度为3.0mol.L -1的溶液中Ca 2+可能的最高浓度是 ( )A,1.8x10-9mol.L -1 , B,1.8x10-10mol.L -1C,5.9x10-10mol.L -1 D,5.9x10-9mol.L -113. 298 K 下,H 2(g) +21O 2(g) =H 2O(g) m f H ∆= -242 kJ ·mol -1,当温度升高了100 K ,则反应的 m r S ∆值应为…………………………………………………………………… ( )(A) 比升温前大 (B) 比升温前小(C) 和升温前近似 (D) 不变14.叠氮酸的结构是 N 1—N 2—N 3,1、2、3号氮原子采用的杂化类型分别为( )。
高等无机过渡元素化学习题
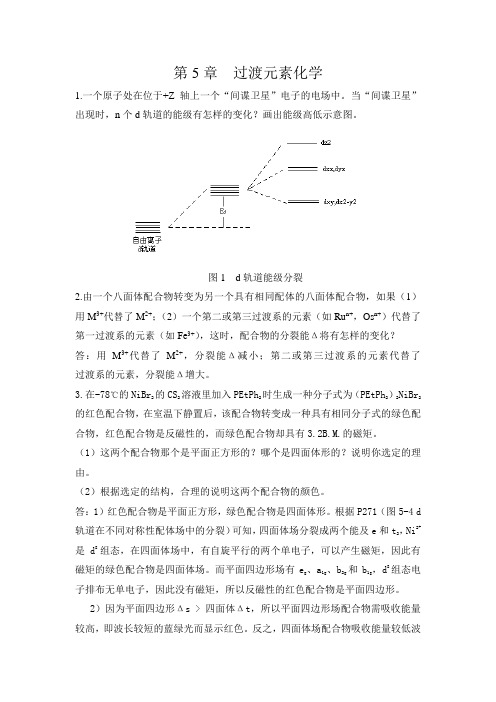
因为μ= n(n 2),分裂能Δ值 I4- < Cl4-,与 Cl 相比,I 是弱场,高自旋,
单电子数多,所以磁矩大。
14.根据下列化合物的有效磁矩,描述它们的电子结构和几何构型: (1)K2[NiF6],0.0B.M.; (2)[Mn(NCS)6]4-,6.06B.M.; (3)[PtCl4]2-,0.0B.M.; (4)CoCl42-,4.3~4.7B.M. (Et-乙基,Ph-苯基)
答:1)[Fe(H2O)6]3+:Δ < P,高自旋;[PtCl6]2-:Δ > P,低自旋。 2)Nb、Ta 的半径比 Ti 的大,外层电子多,所以能够容纳较多的配体。 3)Mo、W 的含氧酸是高酸,能结合质子,水的配位数增加,且 M-OH 键较弱,
易失水聚合,所以 Mo 和 W 比 Cr 易形成聚合度高的多酸。 4)Re 原子的电子组态为[Xe]5d56s2,在 Re2Cl82-中 Re 的氧化态为+3,价电子
答:不同。Fe(Ⅵ)的磁矩:μ= n(n 2)=2.83B.M.
Pr(Ⅲ)的磁矩:μ=g
J(J
1),根据表
5-17
得
Pr(Ⅲ)的基态光谱支项为H34,可知 S=1,L=5,J=4;g=1+ J(J 1) S(S 1) L(L 1) = 4 ;所以μ=3.58B.M.
2J (J 1)
5
18.解释下列问题: (1)[Fe(H2O)6]3+为高自旋,而[PtCl6]2-为低自旋; (2)Ti 形成 TiF62-离子,而 Nb,Ta 则形成 MF82-或 MF83-离子(其中 M=Nb,Ta) (3)Mo 和 W 比 Cr 易形成聚合度高的多酸; (4)Re 可形成含有四重 Re-Re 键的 Re2Cl82-离子,而 Mn 未见报道。
过渡元素(课后基础习题)

过渡元素1、钛的主要矿物是什么?简述从钛铁矿制取钛白得反应原理。
2、完成并配平下列反应方程式。
(1)Ti + HF →(2)TiO2 + H2SO4→(3)TiCl4 + H2O →(4)FeTiO3 + H2SO4→(5)TiO2 + BaCO3→(6)TiO2 + C + Cl2→3、完成下列反应(1)TiI4在真空中强热;(2)FeTiO3和碳得混合物在氯气中加热;得水溶液加入过量得氨;(3)向含有TiCl-26(4)向VCl3的水溶液加入过量的氨;(5)将VCl2的固体加到HgCl2水溶液中。
4、根据下列实验写出有关的反应方程式:将一瓶TiCl4打开瓶塞时立即冒白烟。
向瓶中加入浓HCl溶液和金属锌时生成紫色溶液,缓慢地加入NaOH溶液直至溶液呈碱性,于是出现紫色沉淀。
沉淀过滤后,先用HNO3处理,然后用稀碱溶液处理,生成白色沉淀。
5、完成并配平下列反应方程式−(1)V2O5 + NaOH−→−(2)V2O5 + HCl−→−(3)VO43- + H+(过量) −→−(4)VO2+ + Fe2+ + H+−→−(5)VO2+ + H2C2O4 + H+−→6、新生成的氢氧化物沉淀为什么会发生下列变化(1)Mn(OH)2几乎是白色的,在空气中变为暗褐色?(2)白色的Hg(OH)2立即变为黄色?(3)蓝色的Cu(OH)2,加热时为什么变黑?7、根据下述各实验现象,写出相应的化学反应方程式(1)往Cr2(SO4)3溶液中滴加NaOH溶液,先析出葱绿色絮状沉淀,后又溶解,此时加入溴水,溶液就由绿色变为黄色。
用H2O2代替溴水,也得到同样结果。
(2)当黄色BaCrO4沉淀溶解在浓HCl溶液中时得到一种绿色溶液。
(3)在酸性介质中,用锌还原Cr2O-2时,溶液颜色由橙色经绿色而变成蓝色。
放置时又变回绿色。
7(4)把H2S通入已用H2SO4酸化的K2Cr2O7溶液中时,溶液颜色由橙变绿,同时析出乳白色沉淀。
过渡金属元素习题及答案

本部分内容集中出现在选修三物质的结构与性质,主要考察的知识点有:一、原子或离子的电子排布式;二、分子的结构(特别是配合物结构的考察);三、中心离子的配位数;四、含有过渡元素晶体的密度和化学式的考察。
1.[物质结构与性质]K4[Fe(CN)6]强热可发生反应:3 K4[Fe(CN)6] 2 (CN)2↑+12 KCN +N2↑+ Fe3C + C(1)K4[Fe(CN)6]中Fe2+的配位数为(填数字);Fe2+基态外围电子排布式为。
(2)(CN)2分子中碳原子杂化轨道类型为;1molK4[Fe(CN)6]分子中含有σ键的数目为。
(3)O+22与CN-互为等电子体,则O+22的电子式为。
(4)Fe3C的晶胞结构中碳原子的配位数为6,碳原子与紧邻的铁原子组成的空间构型为。
2.芦笋中的天冬酰胺(结构如右图)和微量元素硒、铬锰等,具有提高身体免疫力的功效。
(1)天冬酰胺所含元素中,(填元素名称)元素基态原子核外未成对电子数最多。
(2)天冬酰胺中碳原子的杂化轨道类型有种。
(3)H2S和H2Se的参数对比见下表。
化学式键长/nm键角沸点/℃H2S 1.34 92.3º -60.75H2Se 1.47 91.0º -41.50①H2Se的晶体类型为,含有的共价键类型为。
②H2S的键角大于H2Se的原因可能为。
(4)已知铝(Mo)位于第五周期VIB族,钼、铬、锰的部分电离能如下表所示编号I5/KJ·mol-1I6/KJ·mol-1I7/KJ·mol-1I8/KJ·mol-1A 6990 9220 11500 18770B 6702 8745 15455 17820C 5257 6641 12125 13860A是(填元素符号),B的价电子排布式为。
3.由徐光宪院士发起、院士学子同创的《分子共和国》科普读物最近出版了,全书形象生动地戏说了BF3、TiO2、HCHO、N2O、二茂铁、NH3、HCN、H2S、O3、异戊二烯和萜等众多“分子共和国”中的明星。
厦门大学839无机化学(海洋化学)2013年考研专业课真题答案解析

(1)[FeF6]3-(µ=5.9 B.M.);(2)[Mn(CN)6]4-(µ=1.8 B.M.); 【考查重点】: 这是配位化合物的内容,考查配位化合物的理论、中心价层轨道的杂化、配位化合物的 磁性。 【答案解析】:
物质的磁矩 与物质轨道中单电子数 n 之间满足:
n(n 2) B ,
其中, B 为磁矩单位,称为玻尔磁子。
厦门大学 2013 年招收攻读硕士学位研究生入学考试试题答案解析
科目代码:839 科目名称:无机化学 招生专业:海洋化学
考生须知:答案必须使用墨(蓝)色墨水(圆珠)笔;不得在试卷(草稿)纸上作答; 凡未按规定作答均不予评阅、判分
一、(18 分)判断下列说法是否正确?说明理由。
(1)过渡元素的原子填充电子时是先填 4s 然后填 3d,失去电子时是先失去 3d 再失去 4s;
决化学反应的方向和限度问题,并不涉及反应速率,因为热力学中的方程是在静态或准静态 条件下推导而来,而静态或准静态要求过程无限缓慢,并不考虑时间。氧化还原反应的电极 电势(能斯特方程)正是热力学的产物,因此,它不考虑反应速率问题。
《厦门大学 839 无机化学历年考研真题及答案解析》
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
过渡元素(二)
1.试回答和解释下列事实:
(1)PdCl 2·2PF 3比PdCl 2·2NH 3稳定?而BF 3·NH 3却比BF 3·PF 3稳定得多?这是为什么? (2)相应的化学式为PtCl 2(NH 3)2的固体有两种异构体(顺、反),它们的颜色不同,一种
是棕黄色,另一种是淡黄色;它们在水中的溶解度也有差别,其中溶解度较大的应是哪一种?为什么?
(3)钌和锇的四氧化物都是低熔点的固体(RuO 4为298K 、OsO 4为314K ),试加以解释。
(4)ZrO 2的碱性比TiO 2强,为什么? (5)Nb 和Ta 的原子半径几乎相同,为什么?
2.Pt(NH 3)2(NO 3)2有α和β两种构形。
α形与草酸反应生成Pt(NH 3)2C 2O 4,但β形与草酸反应得到的反应产物却是Pt(NH 3)2(C 2O 4H)2。
为什么会出现不同的反应产物?用什么物理方法来区分α形和β形。
请画出这两种配合物的结构式。
3.完成下列方程式 (1)Pt +HNO 3+HCl → (2)PdCl 2+CO +H 2O → (3)K 2PtCl 6+K 2C 2O 4 → (4)MoO 42-+Zn 2++H + → (5)Mo 3+
+NCS -
→ (6)(NH 4)2PtCl 6 →
(7)K 2PtCl 6+N 2H 2·2HCl → (8)ZrCl 4+H 2O → (9)PtF 6+Xe → (10)Ru +KClO 3+KOH → (11)MoO 3+NaOH → (12)WO 3+NaOH → (13)WO 3·nH 2O → (14)(NH 4)2ZrF 6 →
4.Zr 和Hf 有何宝贵的特征?基于这些特性有哪些主要用途?
5.锌汞齐能将钒酸盐中的钒(V )还原至钒(II ),将铌酸盐中的铌(V )还原至铌(IV ),但
△ △
△ △
不能使钽酸盐还原,此实验结果说明了什么规律性?
6.R
3Cl
9
溶于含Pph
3
的溶剂中形成化合物为R
3
Cl
9
(Pph
3
)
3
,试画出其结构式。
7.举例说明什么是多酸(同多酸和杂多酸)?它们的主要用途。
8.试指出铂制器皿中能否进行下述各试剂参与的化学反应。
(1)HF (2)王水(3)NaOH+Na
2O
2
(4)Na
2
CO
2。
