药典方法验证要求 1200
Agilent1200高效液相色谱仪性能再确认方案

1 概述 (3)2目的 (3)3范围 (3)4职责 (3)5参考依据 (3)6 性能确认执行前检查 (3)7.性能确认 (4)7.1输液泵性能确认 (4)7.1.1流量准确度确认 (4)7.1.2流量精密度确认 (7)7.1.3梯度准确度确认 (8)7.2柱温箱性能确认 (10)7.2.1控温速率确认 (10)7.3自动进样器性能确认 (11)7.3.1进样重复性确认 (11)7.4紫外检测器性能确认 (11)7.4.1灯能量测试确认 (11)7.4.2基线漂移与基线噪声测试确认 (12)7.5蒸发光散射检测器性能确认 (13)7.5.1基线漂移与基线噪声测试确认 (13)7.6确认偏差记录 (13)7.7验证周期 (13)8修订记录 (14)9相关附件 (14)1概述高效液相色谱仪作为现代制药企业最常用的分析仪器,在我公司主要用来分析药品的含量和有关物质,为保证药品的分析质量,我们特制定本文件来对高效液相色谱仪可能影响分析结果准确性的因素进行全面的确认。
本次验证的Agilent 1200高效液相色谱仪55012007010100是由在线脱气机、四元泵、自动进样器、柱温箱、紫外检测器、蒸发光散射检测器以及相关管路等组成,该仪器为2007年购买,主要用于小儿清热止咳口服液盐酸麻黄碱含量测定及中药材及原辅料含量测定。
该仪器前一次性能确认为2012 年7月26日完成,验证周期内为正常使用状态,并按照经批准预防性维护计划执行日常维护和备品备件的跟换;除日常使用中出现的微小故障及时排除外,无明显影响仪器性能的故障维修记录和部件更换记录, 此次性能确认为正常周期确认。
2目的此确认方案的目的是对国药控股深圳中药有限公司安装在检验室仪器室IV的Agilent 1200型高效液相色谱仪55012007010100进行性能再确认并文件记录。
3范围本方案适用于国药控股深圳中药有限公司检验室使用的Agilent 1200型高效液相色谱仪55012007010100的性能确认。
药典方法学验证指导原则

药典方法学验证指导原则药典方法学验证指导原则是指用于确认药品分析方法准确性、可靠性和适用性的规范化指南。
这些原则旨在确保药品分析方法在生产和质量控制中的可靠性,保证药品质量的稳定和一致性。
以下是一般性的药典方法学验证指导原则:1.准确性(Accuracy):方法应能够提供与真实值或已知标准接近的结果。
验证过程通常涉及对已知浓度样品的测试,以评估方法的测量准确度。
2.精密度(Precision):方法应在重复测试中产生一致的结果。
通过进行重复性测试来评估方法的精密度,这有助于确定方法在变异性方面的表现。
3.线性度(Linearity):方法应能够准确测量不同浓度范围内的样品,并且结果应该与样品的浓度成正比。
验证线性通常通过测试不同浓度水平的样品来进行。
4.灵敏度(Sensitivity):方法应能够检测到样品中非常小的变化,并产生可靠的测量结果。
灵敏度验证包括检测限(LOD)和定量限(LOQ)的评估。
5.特异性(Specificity):方法应能够准确地识别和量化目标化合物,而不受其他可能存在的干扰物质的影响。
这通常通过特异性测试来确认。
6.稳定性(Stability):方法在一定时间内应保持稳定,不会因为时间、环境变化或存储条件的变化而失效。
验证方法的稳定性可以确保其长期可靠性。
7.重复性(Repeatability)和再现性(Reproducibility):重复性指同一实验室、同一操作者、同一设备和条件下重复测试的结果一致性;再现性指不同实验室、不同操作者、不同设备和条件下重复测试的结果一致性。
这些是验证方法可靠性和可复制性的重要指标。
8.系统性误差(Systematic Errors)和随机误差(Random Errors):确保方法验证过程中能够识别和控制可能出现的系统性和随机误差,以确保结果的准确性和精确性。
这些原则构成了验证药品分析方法的基本指导,有助于确保分析方法的可靠性、精确性和适用性,并且是保障药品质量和安全的重要步骤。
中国药典 方法验证

中国药典方法验证
中国药典是由中国药学会编写和发行的一本权威药学参考书,用于指导药品研发、生产和质量控制等工作。
方法验证是药典中的一项重要内容,它是用来确保药品质量和安全性的方法。
方法验证是指通过实验和分析,验证一个测试方法的适用性、可靠性和准确性。
药典中的方法验证主要包括以下几个方面:
1. 精确度验证:确定方法的准确性和重复性,包括同一实验室和不同实验室的重复性。
2. 线性范围验证:确保方法在一定浓度范围内的分析结果与样品浓度成正比关系。
3. 灵敏度验证:确定方法对待测物质的最低检测限和最低定量限。
4. 特异性验证:确定方法是否只对待测物质有反应,而不与其他物质产生干扰。
5. 稳定性验证:验证方法在不同条件下,如温度、湿度等变化时的稳定性。
6. 系统适用性验证:验证方法在不同样品基质和样品预处理方法下的适用性。
方法验证的目的是确保药品质量控制方法的准确性和可靠性,为药品研发和生产提供科学依据和技术支持。
在药品注册和监管过程中,方法验证的数据和结果是评估药品质量的重要依据之一。
(完整版)检验方法验证和确认管理规程

(完整版)检验方法验证和确认管理规程页次:共11 页第1 页文件名称:检验方法验证和确认管理规程编码:03SMP01200起草审核批准颁发部门质量保证部日期日期日期实施日期分发部门及份数:质量管理部1份目的:明确检验方法的验证和确认的管理规程,确保所采用的检验方法科学、合理,符合检验要求并能有效控制药品的内在质量。
范围:仅适用于本公司对物料、产品的理化检验方法的验证和确认;清洁验证方法的验证。
职责:质量管理部QC、QA人员、质量管理部负责人对本规程的实施负责。
内容:1. 方法验证及确认工作职责分工1.1 质量控制部QC负责验证或确认方案的起草、验证或确认工作具体实施以及报告的填写。
1.2质量控制部负责人或其指定人员负责验证或确认方案、报告的审核,组织验证或确认工作的实施,对验证或确认工作中出现的问题及时纠正。
1.3 质量保证部QA负责验证或确认方案、报告的审核,监督确认工作实施,对确认工作中出现的问题提出改进意见并监督落实。
确保检验方法验证或确认程序达到符合性要求,程序被遵照执行,并且方法的预定用途被有效的且以文件记录的数据所支持。
1.4 质量管理部负责人负责验证或确认方案及报告的审核批准。
2 方法验证2.1定义:方法验证就是根据检验项目的要求,预先设置一定的验证内容和验证标准要求,并通过设计合理的实验来验证所采用的分析方法是否符合检验项目的要求。
2.2 目的:方法验证是证明采用的方法适合于相应检测要求。
2.3 适用范围:符合下列情形之一的,应当对检验方法进行验证:(1)采用新的检验方法;(2)检验方法需变更的;(3)采用《中华人民共和国药典》及其他法定标准未收载的检验方法;(4)法规规定的其他需要验证的检验方法。
文件名称:检验方法验证和确认管理规程编码:03SMP012002.3.1 在建立药品质量标准时,应对分析方法中的各检验项目进行完整的验证。
2.3.2 当药品生产工艺变更时,制剂的组分变更、原分析方法修订时,可根据变更的内容决定对分析方法进行部分验证还是完全验证。
2024年版《中国药典》通则调整—9101药品质量标准分析方法验证指导原则

随着药物研究的发展,中国药典也需要不断进行更新和调整,以保证药品质量的安全和有效。
近日,2024年版《中国药典》通则调整发布,并对药品质量标准分析方法验证指导原则做出了一系列的调整。
2024年版《中国药典》通则调整的目的是为了进一步提高药品质量标准分析方法的准确性和可靠性,以确保药品的质量符合要求。
具体来说,对于药品质量标准的分析方法验证指导原则做出了以下调整。
首先,2024年版《中国药典》通则明确了分析方法验证指导原则的基本要求,包括准确性、精密度、线性范围、灵敏度、特异性、系统适用性等方面。
而2024年版则进一步细化了这些要求,对各个要素提出了更加具体和严格的规定,以更好地保证分析方法的准确性和可靠性。
其次,2024年版将分析方法验证分为全面验证和局部验证两个级别。
全面验证适用于所有分析方法,其目的是对方法的准确性和可靠性进行全面的评价。
而局部验证则是根据具体的情况对一些特殊分析方法进行验证,以确保其准确性和可靠性。
此外,2024年版还对分析方法验证的具体步骤和操作进行了规范,包括实验设计、样品处理、数据分析等方面。
同时,在验证过程中要求采用合适的参考品和对照品,以增加验证结果的可靠性。
另外,2024年版还对分析方法验证的报告内容和格式进行了统一规定。
验证报告应包括验证目的、验证方法、实验设计、数据分析、验证结果等内容,并且要求按照规定的格式进行撰写和填报。
这样可以更方便地进行结果评价和审核,并确保验证结果的可靠性和可靠性。
总之,2024年版《中国药典》通则调整中对药品质量标准分析方法验证指导原则做出了一系列的调整,旨在提高分析方法的准确性和可靠性。
这些调整将有助于加强药品质量监管,确保药品的质量和安全性。
同时,这也为我国药物研发和生产提供了更好的参考依据,推动我国药物行业的健康发展。
第七课药典方法验证要求

Accuracy
Y
1
Y
3
?
N
Precision
Y
1
Y
4
N
4
Specificity
Y
2
Y
2
Y
2
Detection Limit
N
N
N
N
Y
5
Quantification Limit N
N
Y
3
N
N
N
Range
Y
1
Y
3
?
N
专属性研究
专属性是准确度的特殊情况 考察干扰 色谱方法
类别2研究: 专属性
Category I
Category II (Quantitative)
Category II (Semiquantitative)
Analytical Performance Characteristics
<1225> <1200> <1225> <1200> <1225> <1200>
药典方法验证要求 <1200>
方法验证
分析方法验证中包含的验证项目 (<1225>)
– 准确度 – 精密度 – 专属性 – 检测限 – 定量限 – 线性范围 – 耐用性
药典方法有关的文章
近期出版的文章
– USP “Performance-Based Monographs”: PF 35(3) – USP “Acceptable, Equivalent, or Better: Approaches
通则<1200>
中国药典对于方法学验证的定义

中国药典对于方法学验证的定义我国药典对于方法学验证的定义一、引言我国药典,是指我国卫生部以及国家食品药品监督管理局编撰的、国家法定的药品标准。
它是规范我国药品生产、经营及使用的基本依据。
其中,对于药品质量控制中的方法学验证有着非常重要的定义和要求。
二、方法学验证的基本概念方法学验证,是指为了确定某个测定方法所能满足其预期用途的实验验证过程。
它是保证药品质量分析结果准确、可靠的基础,也是保证药品符合标准并且能够给患者带来预期疗效的重要环节。
三、我国药典对方法学验证的定义我国药典对方法学验证的定义是非常严格和详细的。
根据《中华人民共和国药典》的相关规定,方法学验证应包括以下内容:1. 准确性:包括精密度、准确度和线性。
2. 灵敏度:指测定方法的最小检测浓度。
3. 特异性:测定方法能否准确地区分并测定所测样品中所含的目标成分。
4. 稳定性:指测定方法在一定条件下的结果稳定性。
5. 可靠性:指在实验条件相同的情况下,测定结果是否具有重复性。
6. 实用性:指测定方法是否便于使用和操作。
7. 方法的界限:即测定方法的适用范围和限制条件。
四、方法学验证技术的重要性方法学验证技术对于药品质量控制至关重要。
只有通过严格的方法学验证,才能保证所采用的分析方法能够准确、可靠地反映出样品的真实成分,并且能够有力地支持药品的质量控制工作。
五、个人观点和理解在我看来,我国药典对于方法学验证的定义是非常严谨和全面的。
它不仅包括了方法学验证的基本要求,而且还对方法学验证的各个方面进行了详细的规定。
通过对这些规定的理解和学习,我们可以更加深入地认识药品质量控制的要求,也能更好地指导药品生产和质量控制工作的开展。
六、总结我国药典对于方法学验证的定义是确保药品质量控制的基础。
严格遵循我国药典的方法学验证要求,对于药品生产企业和药品检验机构来说是非常重要的。
只有通过深入理解和严格执行这些规定,才能够保证药品质量的可靠性和稳定性,进而保障患者的用药安全和疗效。
无菌检查方法验证
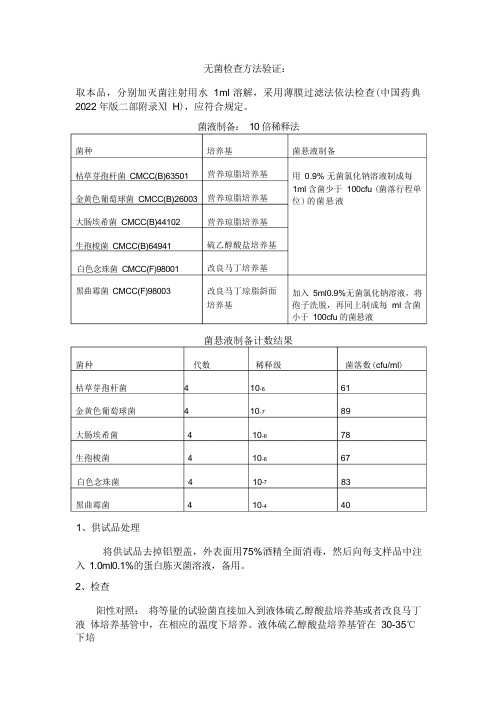
无菌检查方法验证:取本品,分别加灭菌注射用水 1ml 溶解,采用薄膜过滤法依法检查(中国药典 2022 年版二部附录Ⅺ H ),应符合规定。
菌液制备: 10 倍稀释法培养基 营养琼脂培养基营养琼脂培养基营养琼脂培养基硫乙醇酸盐培养基改良马丁培养基改良马丁琼脂斜面 培养基菌悬液制备计数结果菌种 代数 稀释级 菌落数(cfu/ml )枯草芽孢杆菌 4 10-6 61金黄色葡萄球菌 4 10-7 89大肠埃希菌 4 10-6 78生孢梭菌 4 10-6 67白色念珠菌 4 10-7 83黑曲霉菌 4 10-4 401、供试品处理将供试品去掉铝塑盖,外表面用75%酒精全面消毒,然后向每支样品中注 入 1.0ml0.1%的蛋白胨灭菌溶液,备用。
2、检查阳性对照: 将等量的试验菌直接加入到液体硫乙醇酸盐培养基或者改良马丁液 体培养基管中,在相应的温度下培养。
液体硫乙醇酸盐培养基管在 30-35℃下培菌种枯草芽孢杆菌 CMCC(B)63501 金黄色葡萄球菌 CMCC(B)26003 大肠埃希菌 CMCC(B)44102生孢梭菌 CMCC(B)64941白色念珠菌 CMCC(F)98001黑曲霉菌 CMCC(F)98003菌悬液制备用 0.9% 无菌氯化钠溶液制成每 1ml 含菌少于 100cfu (菌落行程单 位)的菌悬液加入 5ml0.9%无菌氯化钠溶液,将 孢子洗脱,再同上制成每 ml 含菌 小于 100cfu 的菌悬液养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
阴性对照:将灭菌的液体硫乙醇酸盐培养基或者改良马丁液体培养基管直接放在相应的温度下培养。
液体硫乙醇酸盐培养基管在30-35℃下培养;改良马丁液体培养基管在23-28℃下培养3-5 天。
观察记录。
样品 (薄膜过滤法):每种实验菌取10 支处理好的供试品溶液,将溶液合并后加入制备好的菌悬液1ml,用0.1%的蛋白胨灭菌溶液稀释至100ml,按薄膜过滤法过滤,取出滤膜,将其分为3 等份,分别置于含硫乙醇酸盐流体培养基及改良马丁培养基的容器中,其中一份作为阳性对照用。
- 1、下载文档前请自行甄别文档内容的完整性,平台不提供额外的编辑、内容补充、找答案等附加服务。
- 2、"仅部分预览"的文档,不可在线预览部分如存在完整性等问题,可反馈申请退款(可完整预览的文档不适用该条件!)。
- 3、如文档侵犯您的权益,请联系客服反馈,我们会尽快为您处理(人工客服工作时间:9:00-18:30)。
Prep. 1 2 3 4 5 6
Result = t(qU,df)-t(qL,df)
qU = (Upper-Mean)/(SD√(1 + 1/n)) qL = (Lower-Mean))/(SD√(1 + 1/n)) df = n-1
范围
计算值和已知浓度之间比较
准确度评估 取决于所采用的分析技术 样品: 在范围内每个浓度水平上采用不少于6个标准溶液。 评估的浓度需至少包括一个高于个论规定的上限的浓度和 一个低于个论规定的下限的浓度。以下浓度至少应被包括 在内: 80%, 90%, 100%, 110%, 和 120%.
验证参数
验证参数(续)
类别1研究: 精密度-准确度和范围
Category I Analytical Performance Characteristics Accuracy Precision Specificity Detection Limit Quantification Limit Linearity Range <1225> Y Y Y N N Y Y <1200> 1 1 2 N N 1 1 Category II (Quantitative) <1225> Y Y Y N Y Y Y <1200> 3 4 2 N 3 3 3 Category II (Semiquantitative) <1225> ? N Y Y N N ? <1200> N 4 2 5 N N N
精密度和准确度研究
精密度
– 6个独立制备的样品在100%浓度水平进行的含量测量值 之间的% RSD
准确度
– 测量值和标准物质标注量之间的差异(100%浓度水平) – 对准确度的计算需要用到精密度数据 结合验收标准,运用T-分布计算得出概率
限定: 概率不小于 0.95
精密度和准确度研究
精密度和准确度的恰当的结合产生的概率用来评估验证是
通则<1200>
适用范围
– <1200> 注重于在USP-NF决定是否收载与某项测试 相关的分析方法及其验收标准前,USP期望看到的数 据类型。 – <1200> 提供了一套系统的验证方法和标准用以评估 验证数据。能够提供满足本通则要求的验证数据的分 析方法适用于药典,也可适用于监管的考量。 – <1200> 不是为了满足公司对于应用于生产基地的分 析方法的验证的需求。
<1225> Y Y Y N N Y Y
<1200> 1 1 2 N N 1 1
精密度
样品:
– 6个待测样品,每个定量添加规定限度的指定杂质对照 品.
精密度 (重复性):
– RSD% NMT C -0.1505% (Horwitz–Massart equation)
粗放性和中间精密度: – RSD% NMT 2C -0.1505% (Horwitz–Thompson equation)
可接受的分析方法
哪些参数描述了一个可接受的分析方法?
– <1225> 规定
• 准确度– 一个已知标准物质的回收率或平均值和接受的真实 值之间差异,并给出置信区间 • 精密度 – 对一个均质样品取6-9等份检测的相对标准偏差 %RSD • 专属性 – 检测结果不受辅料或杂质的影响 • 线性 –作区间内,证实使用该方法进行检测具有适当 水平的精密度、准确度、和线性。
类别3研究: 准确度
Category I Analytical Performance Characteristics Accuracy Precision Specificity Detection Limit Quantification Limit Linearity Range <1225> Y Y Y N N Y Y <1200> 1 1 2 N N 1 1 Category II (Quantitative) <1225> Y Y Y N Y Y Y <1200> 3 4 2 N 3 3 3 Category II (Semiquantitative) <1225> ? N Y Y N N ? <1200> N 4 2 5 N N N
<1225> Y Y Y N N Y Y
<1200> 1 1 2 N N 1 1
可检测性
<1200>中的新术语 取代检测限 3个步骤
LOD
– 1: 配置一个在限度浓度的杂质标准品溶液 – 2: 配置一个添加了在限度浓度的杂质标准品的样品标准品溶液 – 3:配置一个添加了(限度100%-%RSD*浓度)的杂质标准品的样品 标准品溶液
方法性能验收标准: 在每一个浓度水平上计算得出的概 率都需不小于 0.95
类别2研究: 专属性
Category I Analytical Performance Characteristics Accuracy Precision Specificity Detection Limit Quantification Limit Linearity Range Category II (Quantitative) <1225> Y Y Y N Y Y Y <1200> 3 4 2 N 3 3 3 Category II (Semiquantitative) <1225> ? N Y Y N N ? <1200> N 4 2 5 N N N
准确度研究
准确度
– 对杂质的准确度测量是在可能的分析物的线性范围内采用 加样回收率的研究 – 评估需在一个较大的范围内进行 (如某个特定杂质限度的 50% - 150%) – 分析: 加样浓度和测量浓度之间的差异
–
验收标准:
在每个浓度水平上平行配置的样品的均值: 加样回收率 = 100% ± 2C -0.1505%
什么是Horwitz?
RSD=C−0.1505% RSD=2C−0.1505%
类别4研究: 精密度
Category I Analytical Performance Characteristics Accuracy Precision Specificity Detection Limit Quantification Limit Linearity Range Category II (Quantitative) <1225> Y Y Y N Y Y Y <1200> 3 4 2 N 3 3 3 Category II (Semiquantitative) <1225> ? N Y Y N N ? <1200> N 4 2 5 N N N
<1225> Y Y Y N N Y Y
<1200> 1 1 2 N N 1 1
专属性研究
专属性是准确度的特殊情况 考察干扰 色谱方法 – 分离度不小于1.5
专属性研究
非色谱方法比较困难 在样品中添加干扰物质 测量由干扰物质引起的误差 限度与被分析物的验收标准有关: – 使用校准曲线,对含量测试的浓度误差应不大于1% – 当应用于杂质检测,偏差水平应不大于精密度值的 1/3。 (例如, 对于一个限度为0.1%的杂质,偏差应不 大于1%)
类别5研究:可检测性
Category I Analytical Performance Characteristics Accuracy Precision Specificity Detection Limit Quantification Limit Linearity Range Category II (Quantitative) <1225> Y Y Y N Y Y Y <1200> 3 4 2 N 3 3 3 Category II (Semiquantitative) <1225> ? N Y Y N N ? <1200> N 4 2 5 N N N
药典方法验证要求 <1200>
方法验证
分析方法验证中包含的验证项目 (<1225>)
– – – – – – – 准确度 精密度 专属性 检测限 定量限 线性范围 耐用性
药典方法有关的文章
近期出版的文章
– USP “Performance-Based Monographs”: PF 35(3) – USP “Acceptable, Equivalent, or Better: Approaches for Alternatives to Official Compendial Procedures”: PF 35(3) – USP Medicines Compendium “Assessing Validation Parameters for Reference and Acceptable Procedures - Guideline for Donors - Instructions for Staff” <10>: https:/// – USP “Requirements for Compendial Validation <1200>”: PF 39(6)
*从Horwitz方程估算得出
如果1≤2 否则,
且 3<2, 则差异可被检测出
该方法不能胜任限度检测
小结
USP对现有的验证观念提出质疑 把可测量的参数和明确的标准列入方法验证 专注于精密度和准确度的结果 用专属性来帮助理解准确度 提出可检测性 淘汰检测限、定量限和线性
